HS1108·0-00盐酸大观霉素、盐酸林可霉素可溶性粉工艺规程
- 格式:doc
- 大小:165.00 KB
- 文档页数:11

制药有限公司盐酸大观霉素可溶性粉工艺规程颁发单位:GMP办公室工艺规程批准程序目录1、产品概述 (3)2、生产的工艺流程图 (5)3、操作过程及工艺条件 (6)4、工艺过程中所需SOP名称及要求 (9)5、工艺卫生及环境卫生 (9)6、工艺验证及具体要求 (10)7、设备一览表及主要设备生产能力 (10)8、物料平衡及经济技术指标计算 (10)9、技术安全及劳动保护 (11)10、岗位定员 (12)1.产品概述1.1产品名称:通用名:盐酸大观霉素可溶性粉商品名:1.2性状:本品为白色或微黄色粉末。
1.3规格:100g:50g1.4 处方:盐酸大观霉素76g,枸橼酸加至100g。
1.5 依据:2005版《中国兽药典》一部。
1.6 适应症:抗生素类药。
1.7 有效期:二年1.8 成品贮存方法及注意事项:遮光、密封,在干燥处保存。
1.9 原辅材料、半成品和成品质量标准:盐酸大观霉素质量标准见盐酸大观霉素内控质量标准。
枸橼酸质量标准见枸橼酸内控质量标准。
半成品质量标准见盐酸大观霉素可溶性粉半成品内控质量标准。
成品内控质量标准见盐酸大观霉素可溶性粉内控质量标准。
1.10原辅材料贮存注意事项:盐酸大观霉素:遮光、密封,在干燥处保存。
枸橼酸:密封保存。
1.12半成品检查方法及岗位控制:a质量控制要点:B 半成品检查方法见阿莫西林可溶性粉半成品检验操作规程。
1.12包装要求:应符合铝箔袋质量内控标准要求。
1.13用法用量:混饮每1g兑水2-4Kg,连用三日。
1.14标签:见样本。
1.15批准文号:2.生产的工艺流程图注:加粗部分为主要控制点3.操作过程及工艺条件3.1 生产前准备:3.1.1上一批次是否进行清场。
清场者、检查者是否签字,将“清场合格证”副件归入本批生产记录。
未取得清场合格证不得进行下一批次的生产。
3.1.2检查生产场所的环境、设施卫生是否符合该区域清洁卫生要求。
不得有上批生产遗留物。
3.1.3检查设备有“已清洁”标牌,并进行试运转,检查合格后,挂上“运行中”标牌后才能使用。

盐酸林可霉素、硫酸大观霉素可溶性粉生产工艺规程目录1 产品概述2 处方和依据3 工艺流程图4 制剂工艺过程及工艺条件5 原辅材料的预处理6 原辅材料质量标准和检查方法7 中间产品质量标准和检查方法8 成品质量标准和检查方法9 包装规格、包装材料质量标准10 说明书、产品文字说明和标志11 工艺要求12 设备一览表和主要设备生产能力13 技术安全与劳动保护14 劳动组织15 原辅料消耗定额16 包装材料消耗定额17 动力消耗定额18 综合利用与环境保护目的:制定本标准的目的是规范盐酸林可霉素、硫酸大观霉素可溶性粉生产过程,对一定数量的成品所需的起始原辅料和包装材料,以及工艺、加工说明、技术参数、注意事项等进一步标准化。
适用范围:适用于盐酸林可霉素、硫酸大观霉素可溶性粉生产全过程。
责任人:质量部部长、生产部部长、车间主任。
内容:1 产品概述:本品为盐酸林可霉素、硫酸大观霉素可溶性粉。
1.1 产品特点:1.1.1性状:本品为白色或类白色粉末。
1.1.6 贮藏:密闭,在干燥处保存。
1.1.7有效期:二年1.1.8批准文号:2.处方和依据2.1处方:30g盐酸林可霉素: 6.7g (林可霉素)硫酸大观霉素: 13.3g(大观霉素)无水葡萄糖:加至30g2.2处方依据:3生产工艺流程图及环境区域划分示意图4 制剂工艺过程及工艺条件4.1总述:按生产指令领取盐酸林可霉素原料药、硫酸大观霉素原料药和预处理过的无水葡萄糖,将盐酸林可霉素原料药、硫酸大观霉素原料药和预处理过的无水葡萄糖用等量递增法混合均匀,定量分装即可。
4.2分述:4.2.1投料量:为处方量的整数倍。
5 原辅材料的预处理5.1 按生产指令单领取无水葡萄糖粉的预处理按粉碎机操作规程操作,粉碎,使完全通过80目筛。
过筛结束后,检查合格将粉碎好的药粉装入洁净容器,称量、记录,挂上标签,注明品名、批号、数量、日期等,填写中间产品交接单,转入下工序。
进行物料平衡计算,收率97.0%~99.9%。

盐酸林可霉素(无菌粉)工艺规程起草人:日期:年月日审核人:日期:年月日批准人:日期:年月日有效日期:药业有限公司盐酸林可霉素(无菌粉)工艺规程目录1.主题内容 (3)2.适用范围 (3)3.职责 (3)4.产品概述 (4)5.工艺流程图 (4)6.依据 (5)7.操作过程及工艺条件 (5)8.工艺卫生................................................................................................... 错误!未定义书签。
10.原辅料、中间体、包装材料、成品以及工艺用水的质量标准和检验操作规程编码。
(10)11.物料平衡 (10)12.技术经济指标的计算及原料、辅料、包装材料消耗定额 (11)13.技术安全及劳动保护 (11)14.劳动组织与单位劳动定额、产品生产周期 (12)15.设备 (13)16.综合利用和环境保护 (13)17.附录 (14)1.主题内容本标准规定了原料药××××生产全过程的工艺技术、质量、物耗、安全、工艺卫生等内容,符合GMP规范要求。
本工艺规程具有技术法规作用。
2.适用范围本标准适用于原料药××××生产全过程,是各部门共同遵循的技术准则。
3.职责起草:原料车间主任审核:生产工程部经理、质量部经理批准:质量副总执行批准:QA主任执行:各级生产质量管理人员及操作人员监督管理:生产质量管理人员4.产品概述4.1.产品名称4.1.1.通用名:××××4.1.2.汉语拼音名:Yansuan Linkemeisu英文名:Lincomycin Hydrochloride4.1.3.产品概述4.1.4.主要成份:本品为****。
分子式:C18H34N2O6S2·HCl·H2O,分子量:461.02;分子结构式:按干燥品计算,含×××不得少于98.5%。
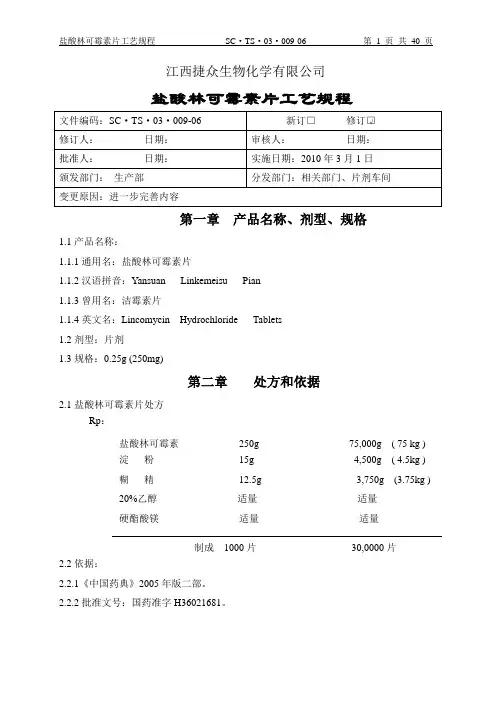
江西捷众生物化学有限公司盐酸林可霉素片工艺规程第一章产品名称、剂型、规格1.1产品名称:1.1.1通用名:盐酸林可霉素片1.1.2汉语拼音:Yansuan Linkemeisu Pian1.1.3曾用名:洁霉素片1.1.4英文名:Lincomycin Hydrochloride Tablets1.2剂型:片剂1.3规格:0.25g (250mg)第二章处方和依据2.1盐酸林可霉素片处方Rp:盐酸林可霉素250g 75,000g ( 75 kg )淀粉15g 4,500g ( 4.5kg )糊精12.5g 3,750g (3.75kg )20%乙醇适量适量硬酯酸镁适量适量制成1000片30,0000片2.2依据:2.2.1《中国药典》2005年版二部。
2.2.2批准文号:国药准字H36021681。
第三章工艺流程3.1片剂车间工艺流程图及区域图第四章操作过程与工艺条件4.1原辅料处理4.1.1操作过程4.1.1.1物料脱外包装经缓冲间,发现内包装有污物时用75%乙醇擦试,并贴上物料状态标示卡,方能进原辅料物暂存间。
4.1.1.2需粉碎的原辅料应进行粉碎、过筛。
4.1.1.3不需粉碎的原辅料用100~120目过筛。
4.1.2工艺条件4.1.2.1粉碎和过筛前核对品名、物料编号、批号、规格、重量、日期和操作者。
4.1.2.2粉碎和过筛应先开启除尘装置。
4.1.2.3料袋、筛网在每次使用前后,检查磨损和破裂情况,发现问题查明原因并及时更换。
4.1.2.4粉碎和过筛后原辅料细粉应在100~120目。
4.2称量4.2.1操作过程4.2.1.1按生产指令和要求分别核对原辅料品名、物料编号、规格、批号、生产厂家。
4.2.1.2按生产指令(配制指令)分别称取原辅料。
4.2.2工艺条件4.2.2.1处方(投料)量计算,称量及投料必须双人复核,操作者及复核者均应在记录上签名。
4.2.2.2称好的物料及时送配制间进行配制。

盐酸大观霉素盐酸林可霉素可溶性粉Y ansuan Daguanmeisu Y ansuan Linkemeisu Kerongxingfen Spectinomycin Hydrochloride and Lincomycin Hydrochloride Soluble Powder 本品含大观霉素(C14H24N2O7)、林可霉素(C18H34N2O6S)均应为标示量的90.0%~110.0%。
【性状】本品为白色或类白色粉末。
【鉴别】取本品加水溶解并稀释成每1ml中约含大观霉素10mg与林可霉素5mg的溶液,作为供试品溶液;另取大观霉素标准品与林可霉素对照品,分别加水溶解并稀释成每1ml中约含大观霉素10mg、林可霉素5mg的溶液,作为标准品溶液与对照品溶液。
吸取上述三种溶液各5μl,照盐酸大观霉素可溶性粉鉴别项试验,供试品溶液所显主斑点的位置和颜色应与大观霉素标准品溶液、林可霉素对照品溶液的主斑点相同。
【检查】水分取本品,照水分测定法(附录0832第一法A)测定,含水分不得过15.0%。
林可霉素B照林可霉素含量测定项下的方法测定,林可霉素B的峰面积不得过林可霉素与林可霉素B峰面积和的5.0%。
其他应符合可溶性粉剂项下有关的各项规定(附录0113)。
【含量测定】大观霉素精密称取本品适量,照盐酸大观霉素项下的方法测定,即得。
林可霉素精密称取本品适量,加流动相溶解并定量稀释制成每1ml中约含林可霉素2mg的溶液,照盐酸林可霉素项下的方法测定,即得。
【作用与用途】抗生素类药。
用于革兰氏阴性细菌、革兰氏阳性细菌及支原体感染。
【用法与用量】以大观霉素计。
混饮:每1L水,5~7日龄雏鸡0.2~0.32g,连用3~5日。
【注意事项】仅用于5~7日龄雏鸡。
【规格】(1)5g;大观霉素2g(200万单位)与林可霉素1g(按C18H34N2O6S 计算)(2)50g;大观霉素20g(2000万单位)与林可霉素10g(按C18H34N2O6S 计算)(3)100g;大观霉素10g(1000万单位)与林可霉素5g(按C18H34N2O6S 计算)(4)100g;大观霉素40g(4000万单位)与林可霉素20g(按C18H34N2O6S 计算)【贮藏】密闭,在干燥处保存。
![一种盐酸大观霉素盐酸林可霉素可溶性粉及其制备方法[发明专利]](https://uimg.taocdn.com/a011643db6360b4c2e3f5727a5e9856a57122656.webp)
专利名称:一种盐酸大观霉素盐酸林可霉素可溶性粉及其制备方法
专利类型:发明专利
发明人:杨宏伟,冯艺,李慧
申请号:CN202111547879.8
申请日:20211216
公开号:CN113995722A
公开日:
20220201
专利内容由知识产权出版社提供
摘要:本发明属于制药技术领域,公开了一种盐酸大观霉素盐酸林可霉素可溶性粉及其制备方法,所述盐酸大观霉素盐酸林可霉素可溶性粉的配方如下:以制成100Kg量计:盐酸大观霉素
10kg、盐酸林可霉素5kg、无水葡萄糖85kg。
本发明的主要原料为盐酸大观霉素、盐酸林可霉素、无水葡萄糖,提高盐酸大观霉素在水溶液中的稳定性,从而保证了产品的质量与疗效,从而保证了该类产品良好的质量和药效,为兽医临床治疗畜禽细菌、支原体等感染,提供了质量稳定、疗效确切的药品;同时,其制备工艺中,严格控制每道工序,利于提高其质量。
申请人:四川欧邦生物科技有限公司
地址:629000 四川省遂宁市高新区卧龙东路南侧
国籍:CN
代理机构:成都华复知识产权代理有限公司
代理人:王洪霞
更多信息请下载全文后查看。

鸡肠道疾病治疗方法
坏死性肠炎(Necrotic enteritis)又称肠毒血症,是由魏氏梭菌引起的一种急性传染病。
主要表现为病鸡排出黑色间或混有血液的粪便,病死鸡以小肠后段粘膜坏死为特征。
此病一年四季均可发生,但在炎热潮湿的夏季多发。
该病常突然发生,病鸡往往没有明显症状就突然死亡。
病程稍长可见病鸡精神沉郁,羽毛粗乱,食欲不振或废绝,排出黑色间或混有血液的粪便。
一般情况下发病鸡只较少,死亡率约2%~3%,如有并发症或管理混乱则死亡明显增加。
小包装金霉素(20%金霉素预混剂)、硫酸新霉素可溶性粉、盐酸大观霉素、盐酸林可霉素可溶性粉、硫酸安普霉素可溶性粉等,对控制肠道疾病(拉稀、腹泻、肠毒综合征、坏死性肠炎等)有明显的效果。
合理的配伍方案疗效更佳,每吨饲料的添加方案:
1、小包装金霉素2kg+32.5%硫酸新霉素可溶性粉0.3kg(或饮水);
2、小包装金霉素2kg+盐酸大观霉素、盐酸林可霉素可溶性粉
(100:40:20)0.1kg(或饮水);
3、小包装金霉素2kg +40%硫酸安普霉素可溶性粉0.25kg(或饮
水)。

盐酸林克霉素(无菌粉)原料药生产工艺规程目录1、适用范围 (2)2、引用标准 (2)3、职责 (2)4、产品名称及剂型 (2)5、产品概述 (2)6、生产工艺流程图 (3)7、工艺过程 (4)8、物料规格、质量标准 (4)9、生产工艺和质量控制检查成品质量标准 (4)10、技术安全与防火 (7)11、综合利用与“三废”治理 (8)12、操作工时与生产周期 (8)13、劳动组织与岗位定员 (8)14、设备一览表及主要设备生产能力 (9)15、原材料、动力消耗定额和技术经济指标 (9)16、物料平衡 (9)1、适用范围本规程规定了流感XXXXXXXXX生产全过程的工艺技术、质量、物耗、安全、工艺卫生、环境保护等内容,经验证合格,符合GMP规范要求。
本工艺规程具有技术法规作用。
本工艺规程适用于流感XXXXXXXXX的生产全过程,是各部门共同遵循的技术准则。
2、引用标准《中华人民共和国药典》2005年版(第三部)《中国生物制品主要原辅材料质控标准》(2000年版)《药品生产质量管理规范》(1998年修订)《XXXXXXXXXX制造和检定规程》批准件3、职责起草:生技部组织相关专业技术人员负责起草。
审批:技术总监和质量总监审核,总经理批准。
执行:各级生产质量管理人员及操作人员。
4、产品名称及剂型4.1产品通用名称:注射用盐酸林克霉素汉语拼音:Yansuan Linkemeisu商品名:XXXXXXXXX英文名称:Lincomycin Hydrochloride4.2剂型:注射用无菌粉5、产品概述5.1定义、组成与用途本品为链菌属链丝菌菌群生长时的产物,即一种林可胺类碱性抗生素。
主要通过抵制细菌的蛋白质合成而起作用。
本品适用于链球菌、肺炎球菌和金黄色葡萄球菌等敏感菌所引起的严重感染性疾病的治疗,也可用于青霉素过敏的或临床医师判定为青霉素药物不适用的感染性疾病的治疗。
本品可能导致抗生素所致的伪膜性肠炎的危险,医师在选择本药时就当考虑感染的情况是否有较低毒性药物适用的可能(如红霉素)。
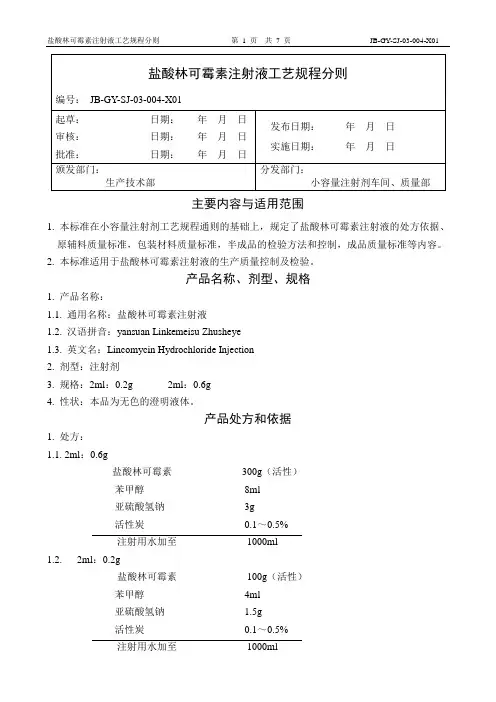
主要内容与适用范围1. 本标准在小容量注射剂工艺规程通则的基础上,规定了盐酸林可霉素注射液的处方依据、原辅料质量标准,包装材料质量标准,半成品的检验方法和控制,成品质量标准等内容。
2. 本标准适用于盐酸林可霉素注射液的生产质量控制及检验。
产品名称、剂型、规格1. 产品名称:1.1. 通用名称:盐酸林可霉素注射液1.2. 汉语拼音:yansuan Linkemeisu Zhusheye1.3. 英文名:Lincomycin Hydrochloride Injection2. 剂型:注射剂3. 规格:2ml:0.2g 2ml:0.6g4. 性状:本品为无色的澄明液体。
产品处方和依据1. 处方:1.1. 2ml:0.6g盐酸林可霉素300g(活性)苯甲醇8ml亚硫酸氢钠3g活性炭0.1~0.5%注射用水加至1000ml1.2.2ml:0.2g盐酸林可霉素100g(活性)苯甲醇4ml亚硫酸氢钠 1.5g活性炭0.1~0.5%注射用水加至1000ml2. 依据: 中国药典2005年版二部3. 批准文号:(1)2ml :0.6g 国药准字H37021474 (2)2ml :0.2g 国药准字H370214754. 安瓶质量要求:玻璃瓶应为中性安瓶外观,尺寸,折断力应符合小容量注射剂工艺规程通则.5. 安瓶精洗:注射用水终端经0.22μm 微孔滤器滤过。
6. 滤器要求:除炭过滤(5μm 钛棒),粗滤(5μm 钛棒),保证过滤(0.45μm 聚砜),精滤(0.22μm 聚砜).7. 药液配制7.1. 根据配制量,向浓配罐内注入配制总量1/2的注射用水,温度控制在90℃,打开进料口盖向上反放稳妥.7.2. 向盛有亚硫酸氢钠的桶内注入适量注射用水,以溶解亚硫酸氢钠。
7.3. 启动搅拌电源开关进行搅拌,边搅拌边将称好的苯甲醇加入浓配罐中溶解.待苯甲醇溶解后,加入溶解好的亚硫酸氢钠,再加入林可霉素,加入溶解的活性炭.注意不要把原料撒在加料口. 7.4. 投完料关闭机械搅拌,用洁净工具在投料罐之处,手工搅拌5分钟(防止浓配罐底原料堆积结块)。

1 主题内容本工艺规程规定了盐酸大观霉素、盐酸林可霉素可溶性粉生产全过程的工艺技术、质量、物耗、安全、工艺卫生等内容,经验证合格,符合GMP规范要求。
本工艺规程具有技术法规作用。
2 适用范围本工艺规程适用于盐酸大观霉素、盐酸林可霉素可溶性粉生产全过程,是各部门共同遵循的技术准则。
3 引用标准:《中国兽药典》2019年版一部4 职责生产车间工艺员:负责本工艺规程的编写。
生产部、质量部经理:负责本工艺规程的审核。
总经理:负责对本工艺规程批准。
各级生产质量管理人员及操作人员:执行本工艺规程。
QA、生产质量管理人员:负责对本工艺规程执行情况进行监督管理。
5 正文5.1 产品名称及剂型:法定名称:盐酸大观霉素、盐酸林可霉素可溶性粉汉语拼音名:Yansuan Daguangmeisu Yansuan Linkemeisu Kerongxingfen英文名:Spectinomycin Hydrochloride and Lincomycin Hydrochloride Soluble Powder剂型:本品为可溶性粉剂5.2 产品概述:5.2.1 性状:本品为白色或类白色粉末。
5.2.2 主要成分:盐酸大观霉素、盐酸林可霉素。
5.2.3 类别:抗原虫药。
5.2.4 规格:100g:大观霉素40g与林可霉素20g5.2.5 包装规格:100g/袋×10袋/桶×6桶/件5.2.6 贮藏:密闭,在干燥处保存。
5.4 处方及处方依据:5.4.1 处方:5.4.2 处方依据:《中国药兽典》2019年版一部。
5.5 工艺流程图:工艺流程图见附图15.6 工艺条件及生产过程:5.6.1 生产前准备:各岗位生产前先检查清洁、清场情况,有清场合格证,生产所用设备、容器有清洁状态标志,有该品种的批生产指令及相应配套文件,生产所需物料准备齐全。
然后检查水、电是否正常,空转设备看设备运行是否正常。
配料岗位使用的计量器具与称量范围相适应,并在检定有效期内。

克林霉素的合成工艺设计设计题目:克林霉素的合成工艺设计(十二)组员:徐文涛王严磊吕功勋峰颖盟专业班级:制药10-2班指导老师:日升、王淮老师设计时间:2012.02.23-2012.03.08克林霉素合成工艺说明书0前言0.1 克林霉素简介抗生素类药物。
为林可霉素的衍生物,自1970年在我国上市。
其用途主要用来对抗引起的各种感染性疾病。
在应用中最常见的不良反应:过敏反应,注射局部刺激和肝功能异常,最严重的是伪膜性肠炎(PMC)。
其结构式为通用名称:克林霉素英文名称:Clindamycin英文别名:Chlorodeoxylincomycin Hydrochloride、Cleocin、Clindamycin Hydrochloride汉语拼音:Kelinmeisu Linsuanzhi Zhusheye中文别名:林大霉素、氯洁霉素、氯林可霉素、氯林肯霉素、氯林霉素、盐酸克林霉素、盐酸氯洁霉素CAS NO. 18323-44-9EINECS 242-209-1分子式C18H33CLN2O5S分子量424.98适应症1.本品适用于革兰氏阳性菌引起的下列各种感染性疾病:(1)扁桃体炎、 克林霉素氯化钠注射液化脓性中耳炎、鼻窦炎等。
(2)急性支气管炎、慢性支气管炎急性发作、肺炎、肺脓肿和支气管扩合并感染等。
(3)皮肤和软组织感染:疖、痈、脓肿、蜂窝组织炎、创伤和手术后感染等。
(4)泌尿系统感染:急性尿道炎、急性肾盂肾炎、前列腺炎等。
(5)其它:骨髓炎、败血症、腹膜炎和口腔感染等。
2.本品适用于厌氧菌引起的各种感染性疾病:(1)脓胸、肺脓肿、厌氧菌引起的肺部感染。
(2)皮肤和软组织感染、败血症。
(3)腹感染:腹膜炎、腹腔脓肿。
(4)女性盆腔及生殖器感染:子宫膜炎、非淋球菌性输卵管及卵巢脓肿、盆腔蜂窝组织炎及妇科手术后感染等.1 工艺概述任务书中给定的合成路线是以林可霉素为起始原料,先后经过Vilsmeier 试剂合成和氯化/醇合成盐两步反应将林可霉素制成克林霉素,其反应方程式为: Vilsmeier 试剂合成DMF+Cl 3C O C OO CCl3N+CClH +Cl 3C O C OO COH Cl Cl氯化/醇合成盐N=CCl ++ DMF1,2-dichlorethane/BHTEt首先DMF 和三光气反应合成Vilsmeier 试剂,然后将得到的Vilsmeier 试剂与林可霉素、1,2—二氯乙烷反应生成克林霉素,产率为90%。
A盐酸林可霉素(⽆菌粉)⼯艺验证验证⽅案编号:盐酸林可霉素⼯艺验证⽅案起草⼈:⽇期:年⽉⽇审核⼈:⽇期:年⽉⽇批准⼈:⽇期:年⽉⽇海南伊顺药业有限公司1概述×××为公司申报的1类新药,在研发阶段,已对现⾏制备⼯艺进⾏了多次⼩试及中试,⼯艺稳定,各步中间体及成品质量符合规定。
为满⾜规模⽣产能⼒,制备⼩型玻璃器⽫放⼤为反应罐,中间体及粗品制备的⽣产场地由原料车间改为公司×××车间,精制、粉碎、混合包装在*****原料车间进⾏。
×××车间的⼚房设施、公⽤系统、关健设备均已进⾏了验证,原料车间空调净化系统、⼯艺⽤⽔系统已进⾏了再验证,×××酯精制层系统及其他关健设备均已进⾏了验证。
所⽤原辅材料、内包材均是由合格供应商提供的符合我公司质量标准的产品;公司的各级⼈员经过了相应规范意识和操作技能的培训。
已建⽴了系统化的⽣产质量管理⽂件体系并经过培训和试运⾏。
公司已具备⼯艺验证条件,准备进⾏⼯艺验证,证明在现有⼚房设施、⽣产设备、机构⼈员和各项管理制度和规程整体运⾏下,⼯艺稳定可靠。
本产品⽣产⼯艺及使⽤的设备见《盐酸林可霉素⼯艺规程》。
验证批⽣产按现⾏⽣产质量程序正常进⾏。
2验证⽬的通过⼯艺验证的有效实施,证实盐酸林可霉素的⼯艺过程能始终如⼀的⽣产出符合质量标准的产品。
3职责原料车间验证的组织实施;⽣产⼯程部经理负责⼯艺验证⽅案和报告的起草;QA 负责现场监控和取样;QC 负责按计划完成⼯艺验证⽅案中相关检验任务,确保检验结论正确可靠;质量部经理负责⼯艺验证⽅案及报告的审核;质量副总经理负责⼯艺验证⽅案及报告的批准。
4验证⼩组成员验证⼩组成员及分⼯:4验证⼯艺规程编码《盐酸林可霉素⼯艺规程》1108·005-00 5验证批量×××盐酸林可霉素***kg×××6⼯艺流程图(见下页)10验证执⾏的相关⽂件⽂件名称⽂件编码《溶解岗位标准操作SOP》1303·031 《精制结晶岗位标准操作SOP》1303·032 《离⼼岗位标准操作SOP》1303·033 《⼲燥粉碎岗位标准操作SOP》1303·034 《包装岗位标准操作SOP》1303·035 《***岗位SOP》1303·036《***岗位SOP》1303·037 《溶解⼯序所⽤设备及管路清洁SOP》1304·083 《精制⼯序所⽤设备及管路清洁SOP》1304·084《结晶⼯序所⽤设备及管路清洁SOP》1304·085 《离⼼⼯序所⽤设备及管路清洁SOP》1304·086 《⼲燥粉碎⼯序所⽤设备及管路清洁SOP》1304·087 《×××制备所⽤设备及管路清洁SOP》1304·088 《×××车间玻璃器清洁SOP》1304·092 《×××车间容器具清洁SOP》1304·091 《****型⼲热灭菌箱系统清洁SOP》1304·081 《****型脉动湿热灭菌柜清洁SOP》1304·077《****清洁SOP》1304·017 《HD-25型多向运动混合机清洁SOP》1304·093 《×××车间氯化氢⽓体发⽣器清洁SOP》1304·090 《×××酯中间体Ⅲ质量标准》1104·007⽂件名称⽂件编码《×××中间体Ⅳ质量标准》1104·008《×××中间体Ⅴ质量标准》1104·009《×××粗品质量标准》1104·009《×××精品质量标准》1104·206《×××质量标准》1106·205⽣产过程参数确认(记录见附表1)11验证⼯序及内容12.1 溶解⼯序主要⼯艺参数及设备参数溶解温度:50~55℃活性炭反应脱⾊时间:30min;溶解程度:通过⽬测反应罐和管道清洁验证:过滤器完整性试验:过滤器材质:孔径:1.0um 0.45um 0.22um过滤器使⽤前后:过滤器测试起泡点压⼒滤膜规定。
制药有限公司盐酸林可霉素注射液生产工艺规程颁发单位:GMP办公室工艺规程批准程目录1. 剂型、规格 (3)2. 生产工艺流程 (3)3. 操作过程及工艺条件 (4)4.质量控制要点 (7)5.设备一览表、主要设备生产能力 (8)6.工艺过程中的SOP (8)7.中间产品的控制 (9)8.验证工作要点 (9)9.工艺验证的具体要求 (10)10.工艺卫生和环境卫生 (10)11.劳动组织及岗位定员 (10)一、制剂类型:最终灭菌小容量注射液,10ml规格,安瓿瓶包装。
10ml:3g二、流程图:盐酸林可霉素注射液生产工艺流程图三、操作过程及工艺条件1 生产前的检查与确认1.1 是否还留有前批生产的产品或物料,是否已清洁并取得“清场合格证”。
1.2 检查确认生产现场的机器设备和器具是否已清洁并准备完毕挂上“合格”标示。
1.3 所使用原辅料是否准备齐全。
是否有质量检验报告单,合格品才能使用。
1.4 检查工艺用水是否新鲜制备,贮存不得超过24小时。
1.5 检查确认与生产品种相适应的批生产指令、配套文件及有关记录是否已准备齐全。
1.6 检查确认生产场所的温度是否在规定范围内(18-26℃,相对湿度在30%-65%)。
2 洗瓶、干燥灭菌2.1理瓶:根据“批生产指令”准备所需的清洁盘、领取必须的安瓶。
在理瓶室将安瓶的合格品摆满瓶盘。
2.2清洗:把安瓿瓶盘放在不锈钢传送链条上,开动洗瓶机用高压循环纯化水洗安瓿瓶内外壁。
将安瓿瓶盘对称放置,固定在甩水机上,启动甩水机,甩水处理8分钟,至安瓶甩干。
重复上述操作。
2.3 精洗:用水温50--60℃,经孔径0.45um滤膜滤过的澄明度合格的注射用水清洗安瓿瓶内外壁,重复粗洗步骤。
定时检查安瓿的清洁度:目检1000ml注射用水无可见异物,抽50支,毛、块≤2%。
2.4 干燥与灭菌:安瓿盘均匀放入烘干箱内,150℃烘干1小时,消除热原。
2.5 灭菌后的安瓿立即使用或清洁存放,贮存不得超过48小时。
盐酸大观霉素盐酸林可霉素可溶性粉说明书【兽药名称】通用名称:盐酸大观霉素盐酸林可霉素可溶性粉商品名称:英文名称:Spectinomycin Hydrochloride and Lincomycin Hydrochloride Soluble Powder汉语拼音:Yansuan Daguanmeisu Yansuan Linkemeisu Kerongxingfen【主要成分】盐酸大观霉素、盐酸林可霉素【性状】本品为白色或类白色粉末。
【药理作用】药效学大观霉素属于氨基糖苷类抗生素,对多种革兰氏阴性杆菌,如大肠杆菌、沙门氏菌、志贺氏菌、变形杆菌等有中度抑制作用。
对链球菌、肺炎球菌、表皮葡萄球菌和某些支原体(如鸡毒支原体、火鸡支原体、滑液支原体等)敏感。
对草绿色链球菌和金黄色葡萄球菌多不敏感。
对铜绿假单胞菌和密螺旋体通常耐药。
肠道菌对大观霉素耐药较广泛,但与链霉素不表现交叉耐药性。
林可霉素类对厌氧菌有良好抗菌活性,如梭杆菌属、消化球菌、消化链球菌、破伤风梭菌、产气荚膜梭菌及大多数放线菌等。
林可霉素主要作用与细菌核糖体的50S亚基,通过抑制肽链的延长而影响蛋白质的合成。
药动学大观霉素内服后仅吸收7%,但在胃肠道内保持较高浓度。
药物的组织浓度低于血清浓度。
不易进入脑脊液或眼内,与血浆蛋白结合率不高。
药物大多以原形经肾小球滤过排出。
林可霉素内服吸收差,生物利用度为30%~40%。
混饲可降低其吸收速度和吸收量。
鸡以每千克体重服用本品50mg(溶于饮用水中),连饮7天,在试验期间血浆中林可霉素达0.14µg/ml,而大观霉素的浓度极微,试验7天后,才超过0.1µg/ml。
【药物相互作用】(1)与林可霉素合用,可显著增加对支原体的抗菌活性并扩大抗菌谱。
(2)林可霉素与抗胆碱酯酶药合用可降低后者的疗效。
(3)与红霉素合用有拮抗作用。
【作用与用途】抗生素类药。
用于革兰氏阴性细菌、革兰氏阳性细菌及支原体感染。
林可霉素、大观霉素的兽医临床使用技术及配伍盐酸大观霉素是由链霉菌产生的所产生的,它是一种由中性糖和氨基环醇一苷键结合而成的氨基糖苷类快速杀菌型抗菌素,其还有个名字叫壮观霉素。
是美国人Mason等在上个世纪1961年发现的。
它在畜禽兽医治疗临床,主要用于治疗敏感细菌感染引起的大肠杆菌、沙门氏菌、巴氏杆菌和支原体等引起的疾病。
大观霉素属于碱性抗菌素,碱性越强其抗菌效力越强;但大观霉素不溶解于水,所以,目前国内最常用的商品化原药是盐酸大观霉素。
它质量保证标准下,眼观是白色或类白色结晶性粉末;它易溶于水,溶于水的水溶液显酸性检测结果,其1%水溶液的pH为3.8--5.6。
盐酸大观霉素的抗菌机制与其它氨基糖苷类抗菌素一样,也是进入细菌细胞内之后,选择性的作用于细菌细胞核蛋白体30s亚单位上,从而对细菌细胞蛋白质的合成产生强大的抑制作用,对敏感细菌产生强大杀灭作用。
盐酸大观霉素属于广谱快速杀菌剂,它对大肠杆菌、沙门氏菌、巴氏杆菌、变形杆菌、溶血性链球菌、肺炎链球菌、肺炎杆菌等作用较强;因此,它对上述敏感细菌造成的感染性疾病的治疗,具有较好的临床治疗效果。
盐酸大观霉素的毒性很低。
有研究人员用小鼠和大鼠进行了腹腔内、皮下、肌内和口服等给药途径的毒理实验,大鼠肌注大观霉素500、250、100、50mg/(kg·d)连续32d,腹腔注射大观霉素700、400、200、50/(kg·d)连续39d,观察其亚急性毒性反应。
实验结果表明,在给药期间没有观察到明显的毒性反应,大剂量组体重增长略受影响。
病理学组织切片检查,发现肌注100m g/(kg·d)以上的剂量组,动物肾小管上皮细胞肿胀,肌注局部有肌纤维变性、结缔组织增生。
腹腔注射200mg/(kg·d)以上的剂量组,动物肾小管上皮细胞肿胀、空胞变性;700/(kg·d)和400/(kg·d)剂量组,动物有肝细胞空胞变性和脂肪性变;肌注和腹腔注射50mg/(kg·d)均没有观察到病理、组织方面的改变。
目的:为检验盐酸林可霉素规定一个标准的程序,以便获得准确的实验数据。
范围:适用于盐酸林可霉素的检验。
职责:检验室主任、检验员。
规程:1.性状:本品为白色结晶性粉末;有微臭或特殊臭;味苦。
本品在水或甲醇中易溶,在乙醇水中略溶。
2.鉴别:2.1 试剂与仪器2.1.1 林可霉素对照品 2.1.2 甲醇2.1.3 0.05 mol/L硼砂溶液 2.1.4 硝酸、硫酸2.1.5 氨试液、硝酸银试液 2.1.6 碘化钾淀粉试纸2.1.7 二氧化锰 2.1.8 容量瓶(25ml)2.1.9 红外分光光度计 2.1.10 高效液相色谱仪2.1.11 电子天平(万分之一克)2.2 项目与步骤2.2.1 红外吸收光谱的鉴别:称取本品约1.5 mg,照红外分光光度法(SOP-QC-302-00)的压片法检测,本品的红外光吸收光谱应与对照的图谱(光谱集833图)一致为符合规定。
2.2.2 高效液相色谱的鉴别:精密称取本品与林可霉素对照品各约50 mg,分别置25 ml量瓶中,加流动相适量,超声振荡使溶解,并稀释至刻度,摇匀;照含量测定项下的高效液相色谱条件进行试验,样品主峰的保留时间应与对照品主峰的保留时间一致为符合规定。
2.2.3 氯化物的鉴别:2.2.3.1 取本品的水溶液,加硝酸使成酸性后,加硝酸银试液,即生成白色凝乳状沉淀;分离,沉淀加氨试液即溶解,再加硝酸,沉淀复生成。
2.2.3.2 取本品少量,置试管中,加等量的二氧化锰;混匀,加硫酸湿润,缓缓加热,即发生氯气,能使湿润的碘化钾淀粉试纸显蓝色。
3.检查3.1 试剂与仪器3.1.1 液体石蜡 3.1.2 1号浊度标准液、黄色标准比色液3.1.3 烧杯(50 ml)、量筒(5 ml、20 ml) 3.1.4电子天平(万分之一克)3.1.5 偏光显微镜 3.1.6 酸度计、马福炉3.1.7水分测定仪 3.1.8 坩埚3.2 项目与步骤3.2.1 结晶性取本品约1 mg,置载玻片上,加液体石蜡1,使悬浮,在偏光显微镜下,转动载物台按结晶性检查法(SOP-QC-345-00)检测,应呈双折射和消光位现象为符合规定。
河南华北生科动物药业有限公司第1页共11页1 主题内容本工艺规程规定了盐酸大观霉素、盐酸林可霉素可溶性粉生产全过程的工艺技术、质量、物耗、安全、工艺卫生等内容,经验证合格,符合GMP规范要求。
本工艺规程具有技术法规作用。
2 适用范围本工艺规程适用于盐酸大观霉素、盐酸林可霉素可溶性粉生产全过程,是各部门共同遵循的技术准则。
3 引用标准:《中国兽药典》2005年版一部4 职责生产车间工艺员:负责本工艺规程的编写。
生产部、质量部经理:负责本工艺规程的审核。
总经理:负责对本工艺规程批准。
各级生产质量管理人员及操作人员:执行本工艺规程。
QA、生产质量管理人员:负责对本工艺规程执行情况进行监督管理。
5 正文5.1 产品名称及剂型:法定名称:盐酸大观霉素、盐酸林可霉素可溶性粉汉语拼音名:Yansuan Daguangmeisu Yansuan Linkemeisu Kerongxingfen英文名:Spectinomycin Hydrochloride and Lincomycin Hydrochloride Soluble Powder剂型:本品为可溶性粉剂5.2 产品概述:5.2.1 性状:本品为白色或类白色粉末。
5.2.2 主要成分:盐酸大观霉素、盐酸林可霉素。
5.2.3 类别:抗原虫药。
5.2.4 规格:100g:大观霉素40g与林可霉素20g5.2.5 包装规格:100g/袋×10袋/桶×6桶/件5.2.6 贮藏:密闭,在干燥处保存。
5.4 处方及处方依据:5.4.15.4.2 处方依据:《中国药兽典》2005年版一部。
5.5 工艺流程图:工艺流程图见附图15.6 工艺条件及生产过程:5.6.1 生产前准备:各岗位生产前先检查清洁、清场情况,有清场合格证,生产所用设备、容器有清洁状态标志,有该品种的批生产指令及相应配套文件,生产所需物料准备齐全。
然后检查水、电是否正常,空转设备看设备运行是否正常。
配料岗位使用的计量器具与称量范围相适应,并在检定有效期内。
5.6.2领料:按要求领料,领入生产车间的原辅料、包材有合格检验报告书。
领料人仔细核对其品名、批号、数量与领料单相符,质量符合要求,印刷性标示材料、使用说明书除了以上检查外,还须检查文字内容、色泽、大小尺寸与标准实样一致。
操作人员在领料时,也须按上述要求仔细核对后方可领料。
并履行相关交接手续。
5.6.3干燥(水分超标时进行)。
5.6.3.1 干燥前检查:干燥岗位操作人员按规定程序进入干燥室后,检查干燥室是否有清场合格证,烘箱是否清洁并能正常运行;然后从物料暂存间领取待干燥的物料。
5.6.3.2检查完毕并符合要求后,将需要干燥的物料均匀摊布于烘盘上,每烘盘以1.5~2cm为宜,不宜过厚以免造成干燥困难或干燥不透。
5.6.3.3 物料摊布好以后将烘盘送入烘箱,自上而下排列,全部送入烘箱后关闭烘箱门,设定温度、时间进行干燥,干燥温度为65℃。
干燥时间随原辅料湿度不同而变。
5.6.3.4 烘干后待温度降至室温后开始收料,将物料装入干净、干燥的盛装容器中,并贴上盛装单,标明品名、数量、批号等相关信息,计算物料平衡。
完毕后转入下道工序。
5.6.3.4.5清场:按《清洁、清场管理程序》对设备、操作间和器具进行清洁,清场完毕后由QA检查员检查并及时填写清场记录,检查合格后QA检查员发清场合格证正副本,正本贴于本批,副本贴于下一批。
5.6.4 筛粉5.6.4.1 操作前检查:检查筛粉室是否取得清场合格证,粉碎机及振荡筛是否清洁并空转设备以查看是否能正常运行,有无异常声响;检查干燥工序或领料工序交来物料的品名、数量、批号等无误后开始准备筛粉。
5.6.4.2原辅料分别进行筛粉,具体按《30B型粉碎机操作规程》及《ZS-350型振荡筛操作规程》进行操作,筛网为五号筛。
5.6.4.3粉碎好的物料分别装入干净的容器中,计算物料平衡97.0~100.0%,贴上盛装单标明物料品名、数量、批号及所处的状态等,转入下道工序。
5.6.4.4清场:按《清洁、清场管理程序》对设备、操作间和器具进行清洁,清场完毕后由QA检查员检查并及时填写清场记录,检查合格后QA检查员发清场合格证正副本,正本贴于本批,副本贴于下一批。
5.6.5配料5.6.5.1生产前准备:按清场标准检查操作间,合格后方可生产。
5.6.5.2领料:按批生产指令和《物料领取管理程序》领取本批生产量所需原辅材料。
5.6.5.3配料:将干燥后的原辅料按投料处方分别称量,称量时有一人称量,有一人复核,称量后,将配好的物料放入物料暂存室摆放,并做好标签,标明品名、批号、规格、数量、生产日期。
5.6.5.4清场:按《清洁、清场管理程序》对设备、操作间和工器具进行清洁,清场完毕后由QA检查员检查并及时填写清场记录,检查合格后QA检查员发清场合格证正副本,正本贴于本批,副本贴于下一批。
5.6.6总混:5.6.6.1 混合前检查:检查混合间是否取得清场合格证,混合机是否清洁并能正常运行;检查上道工序交来的物料是否贴有盛装单并准确无误;检查完毕后准备混合。
5.6.6.2 混合时按等量递增法进行操作:盐酸大观霉素、盐酸林可霉素一次倒入,葡萄糖分三次加入:第一次加入葡萄糖总量的1/4,混合5分钟均匀后再加入葡萄糖原总量的1/2,混合15分钟均匀后再将剩余的葡萄糖送入混合机,再混合20分钟。
要求混合物料的总量不超过混合机容量的2/3。
5.6.6.3 混合时应严格按照混合机操作规程进行操作。
5.6.6.4计算物料平衡97.0~100.0%。
混合好的物料装入干净容器中贴上盛装单转入中转站,由中转站人员通知化验室取样进行半成品检验。
5.6.6.5清场:按《清洁、清场管理程序》对设备、操作间和工器具进行清洁,清场完毕后由QA检查员检查并及时填写清场记录,检查合格后QA检查员发清场合格证正副本,正本贴于本批,副本贴于下一批。
5.6.7 内包装5.6.7.1生产前准备:按清场标准检查操作间,合格后开机试运行,正常后停机待料。
5.6.7.2领料:领料人从中转站领取物料,领取时核对物料名称、规格、批号、重量,并重新称量,核对无误后领回,由交接双方在记录上签字。
领料人按《物料发放管理程序》在仓库领取铝塑复合包装袋,领取时核对包装袋的品名、规格、批号、数量,所用内包装材料必须有检验报告书,检验合格后方可使用,并由专人领取,专人计数发放。
核对无误后领回,由交接双方在记录上签字。
5.6.7.3内分装:事先开启多功能薄膜封口机,用铝塑复合袋按《粉/散/预混剂车间内分装岗位SOP》、《多功能薄膜封口机使用及维护保养SOP》进行操作,当生产出的成品装量,外观质量合格后,正式开始生产,随时监测装量差异,封口情况,每20分钟检查一次平均装量,注意观察,发现封口质量和装量不合格的及时停机检查,确保产品质量。
5.6.7.4将生产完毕的包装袋放入周转箱中,把在分装过程中出现的漏袋、起褶、封口不严的不合格包装袋检出,放入不合格品区,并及时处理。
5.6.7.5本批物料分装完毕后,写好标签,标明品名、规格、批号、数量,附在周转箱上,转入外包装间,由交接双方在记录上签字,计算物料平衡,并及时填写批生产记录。
5.6.7.6清场:按《清洁、清场管理程序》对设备、操作间和器具进行清洁,清场完毕后由QA检查员检查并及时填写清场记录,检查合格后QA检查员发清场合格证正副本,正本贴于本批,副本贴于下一批。
5.6.8外包装5.6.8.1生产前准备:按清场标准检查操作间,合格后方可生产。
5.6.8.2领料:按批包装指令和《物料领取管理程序》领取本批生产量所需包装材料。
所用外包装材料必须有合格检验报告书,并由专人领取,专人计数发放。
外包装岗位领料人员与内分装岗位人员进行原料交接,交接时按标签核对品名、批号、规格、数量,核对无误后领回由交接双方在记录上签字。
5.6.8.3包装:包装规格100g/袋×10袋/桶×6桶/件检查合格的包装袋方可进行包装,检查产品批号、生产日期、有效期至和操作者编号,合格后方可进行包装,每6桶装入一大箱,将合格证放入箱内,放上垫板,用封口胶封箱。
5.6.8.4入库:生产结束及时寄库,检验合格后,在纸箱内放入合格证,办理入库手续。
将装好箱的兽药转入成品库,交接双方核对品名、规格、批号、数量,核对无误后交接双方在入库单上签字。
5.6.8.5本批包装完毕,将余下的印有批号的包材销毁,其余的包材返回包材库,将不合格品在QA检查员的监督下销毁。
5.6.8.6清场:按《清洁、清场管理程序》对操作间进行清洁,清场完毕后由QA检查员检查并及时填写清场记录,检查合格后QA检查员发清场合格证正副本,正本贴于本批,副本贴于下一批。
5.7质量监控5.7.1 按生产工序设置监控点,不得遗漏。
各监控点如下:5.7.1.1配料—— 称量准确,与生产指令一致。
5.7.1.2总混—— 总混时间40分钟。
5.7.1.3半成品内控质量标准—— 粒度:应全部通过5号筛。
—— 含量:应为标示量的95.0%~105.0%。
—— 性状、溶解性应符合规定。
—— 水分应≤8.5%。
5.7.2监控内容5.7.2.1开工前及生产结束后,重点监控人、机、料、卡,要求符合工艺标准。
清洁状态达到要求;物料数量、质量、标记、贮存条件及管理符合要求;设备及计量器具须处于完好状态,并有状态标记,计量器具有检定合格证并在有效期内;相应的生产记录须齐全。
达到规定要求,方可签字允许生产或判定清场合格。
5.7.2.2生产过程重点监控工艺规程和岗位SOP 的贯彻执行情况,生产现场管理须有序规范,状态标记须齐全、正确,批生产记录须及时填写,各工序中间体的质量须达到标准。
对物料放行作出判定,为批产品审核提供依据。
5.7.4 监控执行的SOP 、管理程序及编号:《粉剂/散剂/预混剂车间工艺查证SOP 》 HS1309·009-00《粉剂/散剂/预混剂配料、粉碎过筛工序生产监控SOP 》HS1309·017-00 《粉剂/散剂/预混剂车间总混工序生产监控SOP 》 HS1309·019-00 《粉剂/散剂/预混剂内分装工序生产监控SOP 》 HS1309·020-00 《粉剂/散剂/预混剂外包装工序生产监控SOP 》 HS1309·021-00 5.8 质量标准:5.8.1 原辅料质量标准(见表1)表1 5.8.2 半成品内控质量标准(见表2)表25.8.3 成品内控质量标准(见表3)表35.8.4 包装材料质量标准(见表4)表45.9.1 300袋产品物料消耗定额(见表5)5.10 主要生产设备(见附表)5.11技术安全和劳动保护5.11.1传动设备安全保护5.11.1.1传动设备起动前先检查继电器时间设定情况、运行标志等确认无误后,再按电钮启动。