高中化学复习知识点:阿伏伽德罗定律的应用
- 格式:docx
- 大小:61.70 KB
- 文档页数:10
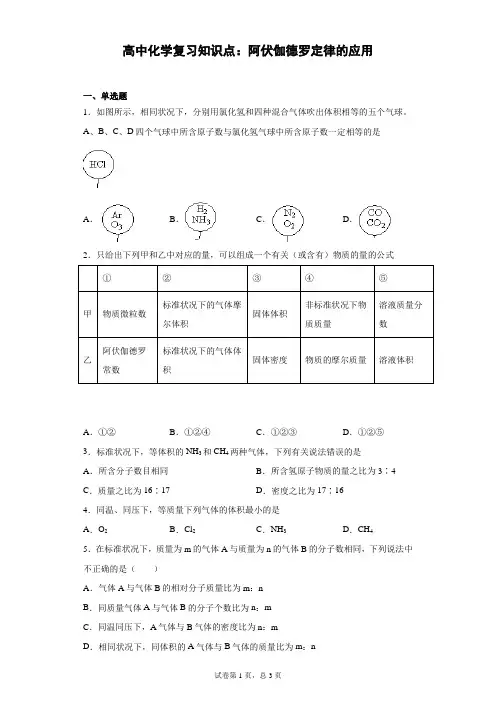

阿伏伽德罗定律及应用学案1、阿伏加德罗定律:在同温同压下,同体积的气体含有相同的分子数。
即:T 1=T 2;P 1=P 2 ;V 1=V 2 ⇒ n 1 = n 22、阿伏加德罗定律的推论:(1)三正比:同温同压下,气体的体积比等于它们的物质的量之比或微粒数之比 212121N N n n V V ==同温同体积下,气体的压强比等于它们的物质的量之比或微粒数之比 212121N N n n p p ==同温同压下,气体的密度比等于它们的相对分子质量之比. M 1/M 2=ρ1/ρ2(2)二反比:同温同压下,相同质量的任何气体的体积与它们的相对分子质量成反比 V 1/V 2=M 2/M 1 同温同体积时,相同质量的任何气体的压强与它们的摩尔质量的反比 p 1/p 2=M 2/M 1。
(3)一连比:同温同压下,同体积的任何气体的质量比等于它们的相对分子质量之比,也等于它们的密度之比 m 1/m 2=M 1/M 2=ρ1/ρ2(注:以上用到的符号:ρ为密度,p 为压强,n 为物质的量,M 为摩尔质量,m 为质量,V 为体积,T 为温度;上述定律及其推论仅适用于气体,不适用于固体或液体。
)【典型例题】例1、两个体积相同的容器,一个盛有NO ,一个盛有N 2和O 2,在同温同压下两容器内的气体一定具有相同的 ( )A .原子总数B .质子总数C .分子总数D .质量例2、在相同的温度下,相同质量的下列气体分别通入相同容积的容器中,容器内的压强最小的是 ( )A.H 2B.O 2C.SO 2D.Cl 2例3、同温同压下,等质量的SO 2和CO 2相比较,下列叙述正确的是 ( )A.体积比为1∶1B.体积比为11∶16C.密度比为16∶11D.密度比为11∶16例4、在两个密闭容器中,分别充有质量相等的甲乙两种气体。
若两容器的温度和压强均相等,且甲的密度大于乙的密度,则下列说法正确的是 ( )A.甲的分子数比乙的分子数多B.甲的物质的量比乙的物质的量少C.甲的摩尔体积比乙的摩尔体积小D.甲的相对分子质量比乙的相对分子质量小 例5、下列各组中两种气体的分子数一定相等的是 ( )A.同质量、同体积的O 2和N 2B.同质量、密度不等的N 2和C 2H 4C.同体积、同密度的CO 和C 2H 4D.同压、同体积的O 2和N 2例6、在标准状况下,ag 气体A 与bg 气体B 的分子数相同,则与此有关的以下说法中不正确的是( )A.气体A 与气体B 的摩尔质量之比为a:bB.相同状况下,同体积的气体A 与气体B 的质量之比为a:bC.质量相同的气体A 与气体B 的分子数之比为b:aD.同温同压下,气体A 与气体B 的密度之比为b:a3、气体密度和相对密度的计算(1)气体密度 ρ=V m =Vm M(2)气体相对密度 D=)B M A M ()(=)()(B A ρρ4、气体的摩尔质量或相对分子质量的计算(1)已知标准状况下气体密度 M (混)=22.4ρ(混)(2)已知两种气体的相对密度 D=)B M A M ()( → M(A)=D ×M(B)(3)混合气体的平均摩尔质量或平均相对分子质量 M (混)=混)混()(n m例7、在标准状况下,某气体密度为1.25g/L ,则该气体的相对分子质量为 ( )A .12.5B .14C .28D .30例8、(1)等质量的O 2和O 3,它们的物质的量之比为_________,所含分子数之比为________,所含原子数之比为_________,同状况下的体积之比和密度之比分别为_________、_________。


高一化学阿伏加德罗知识点阿伏加德罗常数是化学中非常重要的一个概念,它在化学计算中有着广泛的应用。
本文将介绍阿伏加德罗常数的定义、计算方法以及其在化学中的应用。
一、阿伏加德罗常数的定义阿伏加德罗常数是指在一定条件下,1摩尔气体在标准状态下的体积。
它的数值为6.02214076 x 10^23 mol^-1,通常简写为NA。
二、阿伏加德罗常数的计算方法阿伏加德罗常数可以通过实验数据与一些基本物理常数的关系计算得出。
其中,与阿伏加德罗常数相关的实验数据主要有电子电荷e、普朗克常量h和光速c等。
计算公式如下:NA = 6.02214076 x 10^23 mol^-1 = e / (h × c)三、阿伏加德罗常数在化学中的应用1. 摩尔质量计算根据阿伏加德罗常数,我们可以计算出物质的摩尔质量。
摩尔质量是指一摩尔物质的质量,单位为g/mol。
通过将物质的质量除以摩尔数,可以得到物质的摩尔质量。
2. 摩尔体积计算阿伏加德罗常数也可以用于计算气体的摩尔体积。
在标准温度和标准压力下,1摩尔气体的体积为22.4升。
由于摩尔体积与物质的摩尔数成正比,因此可以通过阿伏加德罗常数计算出气体的摩尔体积。
3. 科学计数法的使用阿伏加德罗常数是一个非常大的数值,为了方便使用,人们通常使用科学计数法表示阿伏加德罗常数。
科学计数法是一种用于表示非常大或非常小的数值的方法,可以简化计算过程,提高计算的准确性。
4. 化学方程式的平衡在一些化学方程式的平衡中,阿伏加德罗常数被用于计算摩尔比。
通过比较反应物与生成物的摩尔比,我们可以确定一个化学方程式是否平衡以及需要调整的系数。
总结:阿伏加德罗常数是化学中的重要概念,它用于计算摩尔质量、摩尔体积以及在化学方程式平衡中的应用。
通过深入理解和运用阿伏加德罗常数,我们可以更好地理解化学中的各种现象,为化学学习和实验提供准确的计算基础。

一、与“阿伏加德罗常数和阿伏加德罗定律”有关知识点归纳(一)阿伏加德罗常数有关知识归纳1. 阿伏加德罗常数旳概念及理解⑴概念:1 mol任何粒子旳粒子数叫阿伏加德罗常数, 一般用“NA”表达, 而6.02×1023是阿伏加德罗常数旳近似值。
⑵概念旳理解: ①阿伏加德罗常数旳实质是1mol任何粒子旳粒子数, 即12g12C所含旳碳原子数。
②不能说“含6. 02×1023个粒子旳物质旳量为1mol”, 只能说“含阿伏加德罗常数个粒子旳物质旳量为1mol”。
③阿伏加德罗常数与6.02×1023不能等同, 阿伏加德罗常数不是一种纯数, 它有单位, 其单位为“mol-1”, 而6.02×1023只是一种近似值, 它无单位。
2. 与阿伏加德罗常数有关旳概念及其关系①物质旳量物质旳量(n)、阿伏加德罗常数(NA)与粒子数(N)之间旳关系: n=N/NA。
②摩尔质量摩尔质量(Mr)、阿伏加德罗常数(NA)与一种分子(或原子)真实质量(mr)之间旳关系: mr=Mr/ NA。
③物质旳质量物质旳质量(m)、阿伏加德罗常数(NA)与粒子数(N)之间旳关系: m/Mr=N/ NA。
④气体体积气体体积(V)、阿伏加德罗常数(NA)与粒子数(N)之间旳关系:V/Vm=N/NA, 当气体在原则状况时, 则有:V/22.4=N/ NA。
⑤物质旳量浓度物质旳量浓度(cB)、溶液旳体积(V)与物质旳量(nB)之间旳关系: cB= nB/V,根据溶液中溶质旳构成及电离程度来判断溶液中旳粒子数。
3. 有关阿伏加德罗常数试题旳设陷方式命题者为了加强对考生旳思维能力旳考察, 往往故意设置某些陷阱, 增大试题旳辨别度。
陷阱旳设置重要有如下几种方面:⑴状态条件考察气体时常常给出非原则状况(如常温常压)下旳气体体积, 这就不能直接用“22.4L/mol”进行计算。
⑵物质旳状态考察气体摩尔体积时, 命题者常用在原则状况下某些易混淆旳液体或固体作“气体”来设问, 困惑学生。

阿伏加德罗定律及应用一、阿伏加德罗定律及应用:1、定律内容:同温同压下,相同体积的任何气体含有相同数目的分子。
注意:(1)、适应范围:任何气体。
(2)、拓展:在定律中,可以“四同”中的任意“三同”为条件,均可导出“第四同”。
(3)、与气体摩尔体积的关系:标准状况下的气体摩尔体积实际上是阿伏加德罗定律的一个特例。
2、重要推论:(1)、同温同压下,任何气体的体积之比等于物质的量(或分子数)之比。
V1:V2=n1:n2=N1:N2。
(2)、同温同体积的任何气体的压强之比等于物质的量之比。
p1:p2=n1:n2。
(3)、同温同压下,气体密度之比等于相对分子质量之比。
ρ1:ρ2=M1:M2(4)、同温同压下,同体积的气体的质量之比等于密度之比。
m1:m2=ρ1:ρ2(5)、同温同压下,同质量的气体的体积之比等于相对分子质量的反比。
V1:V2=M2:M1。
(6)、同温同体积同质量的任何气体的压强之比等于相对分子质量的反比。
p1:p2=M2:M1。
典型习题:1、同温同压下,等质量的二氧化碳和二氧化硫相比,下列叙述中正确的是()A、密度之比为16:11B、密度之比为11:16C、体积之比为11:16D、物质的量之比为16:112、在标况下,下列气体体积最大的是()A、14gCOB、32gO2C、44gCO2D、4gH23、在同温同压下,1摩尔氩气和1摩尔氟气具有相同的()A、质子数B、质量C、原子数D、体积4、在标准状况下,相同质量的下列气体中体积最大的是()A、O2B、N2C、Cl2D、CO25、相同条件下,下列气体中所含分子数最多的是()A、10g O2B、71g Cl2C、34g NH3D、1g H26、在同温同压下,同体积的下列气体,质量最大的是()A、O2B、N2C、Cl2D、CO27、同温同体积同质量的下列气体,产生压强最大的是()A、O2B、N2C、Cl2D、CO28、下列说法正确的是()A、在标准状况下,如果5.6L氧气含有n个氧气分子,则N A约为4n;B、常温常压下,1摩尔的甲烷含有的电子数为10N A;C、1摩尔Na2O2与足量的水反应,转移电子数为2N A;D、标准状况下,22.4L以任意比混合CO和CO2气体中含有的碳原子数为2N A。


阿伏加德罗定律•阿伏伽德罗定律:同温同压下,相同体积的任何气体含有相同的分子数。
••阿伏伽德罗定律的使用范围:阿伏伽德罗定律只对气体起作用,使用于任何气体,包括混合气体。
•方法与技巧:1.“三同”定“一同”(温度、压强、气体体积、气体分子数);“两同”定“比例”。
2.阿伏伽德罗定律及其推论的数学表达式可由理想气体状态方程(PV=nRT)或其变形形式(PM=ρRT)推出,不用死记硬背。
•理想气体状态方程:理想气体状态方程的表达式:PV= nRTP表示压强,V 表示体积,T表示温度,R是常数,n是气体的物质的量。
可根据此方程来推断阿伏伽德罗定律的相关推论:一、阿伏伽德罗定律及推论1、定律内容:同温同压下,相同体积的任何气体含有相同数目的分子。
注意:(1)适应范围:任何气体。
(2)拓展:在定律中,可以“四同”中的任意“三同”为条件,均可导出“第四同”。
(3)与气体摩尔体积的关系:标准状况下的气体摩尔体积实际上是阿伏加德罗定律的一个特例。
2、重要推论:根据理想气体状态方程推导:(1)、同温同压下,任何气体的体积之比等于物质的量(或分子数)之比。
V1:V2=n1:n2=N1:N2。
(2)、同温同体积的任何气体的压强之比等于物质的量之比。
p1:p2=n1:n2。
(3)、同温同压下,气体密度之比等于相对分子质量之比。
ρ1:ρ2=M1:M2(4)、同温同压下,同体积的气体的质量之比等于密度之比。
m1:m2=ρ1:ρ2(5)、同温同压下,同质量的气体的体积之比等于相对分子质量的反比。
V1:V2=M2:M1(6)、同温同体积同质量的任何气体的压强之比等于相对分子质量的反比。
p1:p2=M2:M1【练习】1.在体积相同的两个密闭容器中分别充满O2、O3气体,当这两个容器内气体的温度和密度相等时,下列说法正确的是( )A.两种气体的压强相等B.O2比O3质量小C.两种气体的分子数目相等D.两种气体的氧原子数目相等参考答案:D二、气体密度和气体相对分子质量的计算方法1、气体密度的计算:(1)密度定义法:任意情况下,ρ=m÷v(2)摩尔质量法:在标准状况下,ρ=m÷v=M•n÷Vm•n=M÷22.4L.mol-1(3)相对密度法:同温同压下,A气体对B气体的相对密度等于A气体的密度比B气体的密度,也等于A气体的相对分子质量比B 气体的相对分子质量。


阿伏加德罗定律
•阿伏伽德罗定律:
同温同压下,相同体积的任何气体含有相同的分子数。
•
•阿伏伽德罗定律的使用范围:
阿伏伽德罗定律只对气体起作用,使用于任何气体,包括混合气体。
•方法与技巧:
1.“三同”定“一同”(温度、压强、气体体积、气体分子数);“两同”定“比
例”。
2.阿伏伽德罗定律及其推论的数学表达式可由理想气体状态方程(PV=nRT)或其变
形形式(PM=ρRT)推出,不用死记硬背。
•理想气体状态方程:
理想气体状态方程的表达式:PV= nRT
P表示压强,V 表示体积,T表示温度,R是常数,n是气体的物质的量。
可根据此方程来推断阿伏伽德罗定律的相关推论:。

2010年高三化学一轮复习(阿伏加德罗定律的几个应用)一、阿伏加德罗定律在化学方程式计算中的应用例1.在一定体积的密闭容器中放入3升气体R和5升气体Q,在一定条件下发生反应:2R(气)+5Q(气)== 4X(气)+nY(气)反应完全后,容器温度不变,混和气体的压强是原来的87.5%,则化学方程式中的n值是A、2B、3C、4D、5解析:方法1:常规法。
即由反应前后压强之比列方程求解。
密闭容器中充入3升气体R和5升气体Q可认为充入3mol气体R和5mol气体Q,由反应方程式可知,R与Q完全反应后,R过量,余1mol,同时生成4molX和nmolY,根据题意:p2/p1=n2/n1有:(4+n+1)/(3+5)=87.5/100,n=2。
方法2:差量法。
由有关物质的反应量及其反应前后的相关差量结合方程式求解。
反应后气体的体积为(3+5)升×87.5%=7升2R(气)+5Q(气)== 4X(气)+nY(气)△V5升(7-4-m)升5升(8-7)升可知n=2。
方法3:特殊解法(巧解)。
因为反应完成后,压强变小,故该反应是气体分子数减小的反应,即:2+5 >4+n,n<3,在选项中只有n=2满足不等式。
二、阿伏加德罗定律与质量守恒定律的综合应用例2:在某温度时,一定量的元素A的氢化物AH3在一定体积密闭容器中可完全分解成两种气态单质,此时压强增加了75%。
则A单质的一个分子中有_______个A原子,AH3分解反应的化学方程式为__________________________________________。
解析:由阿伏加德罗定律的推论:相同温度和压强时,p1/p2=N1/N2得反应前后气体的分子数之比为1:1.75=4:7,可理解为反应式左边气体和反应式右边气体系数之和的比为4:7,再按氢原子守恒不妨先将反应式写为4AH3==A(x)+6H2,再由A原子守恒得A右下角的数字为4。
高三化学专题复习02·阿伏加德罗常数的应用考纲定位命题热点及考频考题核心素养1.了解物质的量的单位——摩尔(mol)、摩尔质量、气体摩尔体积、物质的量浓度、阿伏加德罗常数的含义。
2.根据物质的量与微粒(原子、分子、离子等)数目、气体体积(标准状况下)之间的相互关系进行有关计算。
1.阿伏加德罗常数的应用2018年Ⅰ卷T10Ⅱ卷T11Ⅲ卷T8;2017年Ⅱ卷T8;Ⅲ卷T10;2016年Ⅰ卷T8;2015年Ⅰ卷T8;2015年Ⅱ卷T10;2013年Ⅱ卷T91.微观探析——能通过物质的量、阿伏加德罗常数等建立微观粒子与宏观物质之间的联系并能解决一些实际问题。
2.模型认知——能通过物质的量、阿伏加德罗常数等物理量之间的关系形成解决宏观物质与所含微观粒子数问题的思维模型。
2.以物质的量为中心的计算2017年Ⅱ卷T28(4);2016年Ⅰ卷T27(3)、T28(4);2016年Ⅲ卷T28(2);2015年Ⅰ卷T9;2015年Ⅱ卷T28(1)一.知识再复习——剖解重点难点备考·1.四个关键问题2.阿伏加德罗常数应用的六大突破点求算N(微粒数)的基本思路:突破点1 气体摩尔体积的适用条件【突破点1】气体摩尔体积的适用条件(1)角度:从V m=22.4 L·mol-1的适用条件和物质的状态突破。
(2)突破方法:一看气体是否处在“标准状况(0 ℃、101 kPa)”;二看标准状况下,物质是否为气态(如CCl4、CHCl3、CH2Cl2、H2O、溴、SO3、己烷、HF、苯、乙醇等在标准状况下均不为气态)。
【突破点2】物质的量(或质量)与物质所处状况(1)角度:设置与计算无关的一些干扰条件,给出非标准状况下气体的物质的量或质量,干扰正确判断。
(2)突破方法:排“干扰”,明确物质的量或质量与物质所处状况无关,物质的量或质量确定时,物质所含的粒子数与温度、压强等外界条件无关。
【突破点3】物质的组成与结构(1)角度:从特殊物质的组成与结构特点突破。
阿伏加德罗定律高一知识点阿伏加德罗定律是化学中的一个重要知识点,它描述了气体的物理性质和化学性质之间的关系。
下面我们来详细了解一下阿伏加德罗定律。
一、阿伏加德罗定律的基本原理阿伏加德罗定律是指在相同温度和容积的条件下,气体的压强与气体的摩尔数成正比。
这个定律可以用以下公式表示:P = nRT/V其中,P代表气体的压强,n代表气体的摩尔数,R代表气体常数,T代表气体的温度,V代表气体的容积。
二、阿伏加德罗定律的实际应用阿伏加德罗定律在实际应用中具有广泛的用途,下面列举一些常见的应用。
1. 气球的充气当我们充气的时候,气球内部的气体会增加,而气球的体积是不变的。
根据阿伏加德罗定律,气体的压强与气体的摩尔数成正比,所以当气体增加时,气体的压强也会增加。
这就是为什么气球会变得鼓鼓的。
2. 汽车轮胎的充气汽车轮胎内部也是充满气体的,当轮胎胎压不足时,我们需要给轮胎充气。
根据阿伏加德罗定律,增加气体的摩尔数,可以增加气体的压强,这样轮胎就能恢复正常的胎压。
3. 氧气气瓶的压力计算在医院或者实验室中,我们经常会使用氧气气瓶。
根据阿伏加德罗定律,如果知道了氧气气瓶的体积、温度和氧气的摩尔数,就可以计算出氧气的压强。
这对于确定气瓶中氧气的质量和用量非常重要。
三、阿伏加德罗定律的适用条件阿伏加德罗定律适用于理想气体,也就是在低压、高温和稀薄的条件下。
这是因为在这种条件下,气体分子之间几乎没有相互作用,可以近似看作理想气体。
在高压、低温和密集的条件下,气体分子之间的相互作用会变得很显著,这时阿伏加德罗定律就不再适用了。
四、阿伏加德罗常数的数值阿伏加德罗常数(R)是一个用于计算阿伏加德罗定律的重要常数,它的数值为8.314 J/(mol·K)。
这个常数在化学计算中经常会被用到,可以用来计算气体的压强、温度和摩尔数之间的关系。
总结:阿伏加德罗定律是描述气体物理性质和化学性质之间关系的重要定律。
它的应用广泛,可以用于充气、压力计算等方面。
阿伏伽德罗定律考点总结
n/V=k
其中,n是气体的分子数,V是气体的体积,k是一个常数。
这个公
式说明了当其他两个变量保持不变时,分子数和体积之间的关系。
1.定律的表述
考生需要熟练掌握阿伏伽德罗定律的表述,即在相同的温度和压力下,体积相同的气体所含有的分子数相同,以及其数学表达式n/V=k。
2.运用定律解决实际问题
考生需要学会灵活运用阿伏伽德罗定律解决实际问题。
例如,给出两
种气体的体积和分子数,要求比较它们的摩尔质量。
根据阿伏伽德罗定律,相同体积的两种气体含有相同数目的分子,因此它们的摩尔质量之比可以
通过分子数的比值得到。
3.与其他气体定律的关系
阿伏伽德罗定律与其他气体定律(如玻意耳定律、查理定律等)之间
存在一定的关系。
考生需要理解这些定律的异同点,例如玻意耳定律指出,在恒定温度下,气体的体积与其物质的量成正比,但并不说明体积相同的
气体含有相同的分子数,而阿伏伽德罗定律则更为具体地描述了气体分子
之间的关系。
4.实验测定与验证
考生需要了解通过实验测定和验证阿伏伽德罗定律的方法。
例如,可
以通过将一定量的气体在不同条件下进行体积的测量,以验证体积与分子
数之间的关系。
考生还需要学会处理实验数据,进行数据分析和结论推断。
5.应用领域
总之,阿伏伽德罗定律是化学中的一项重要基本定律,掌握它的表述和运用方法对理解和应用化学知识都具有重要意义。
考生应该通过理论学习和实验实践,熟练掌握这一定律,并能够灵活运用于解决实际问题。
高中化学阿伏加德罗定律知识点总结高中化学阿伏加德罗定律知识点总结1.内容:在同温同压下,同体积的气体含有相等的分子数。
即“三同”定“一等”。
2.推论(1)同温同压下,V1/V2=n1/n2(2)同温同体积时,p1/p2=n1/n2=N1/N2(3)同温同压等质量时,V1/V2=M2/M1(4)同温同压同体积时,M1/M2=ρ1/ρ2注意:(1)阿伏加德罗定律也适用于混合气体。
(2)考查气体摩尔体积时,常用在标准状况下非气态的物质来迷惑考生,如H2O、SO3、已烷、辛烷、CHCl3、乙醇等。
(3)物质结构和晶体结构:考查一定物质的量的物质中含有多少微粒(分子、原子、电子、质子、中子等)时常涉及稀有气体He、Ne等单原子分子,Cl2、N2、O2、H2双原子分子。
胶体粒子及晶体结构:P4、金刚石、石墨、二氧化硅等结构。
(4)要用到22.4L·mol-1时,必须注意气体是否处于标准状况下,否则不能用此概念;(5)某些原子或原子团在水溶液中能发生水解反应,使其数目减少;点击查看:高中化学知识点总结(6)注意常见的的可逆反应:如NO2中存在着NO2与N2O4的平衡;(7)不要把原子序数当成相对原子质量,也不能把相对原子质量当相对分子质量。
(8)较复杂的化学反应中,电子转移数的求算一定要细心。
如Na2O2+H2O;Cl2+NaOH;电解AgNO3溶液等。
注:在高温高压下,许多气体都接近于理想气体),可以是单一气体,也可以是混合气体。
可以是单质气体,也可以是化合物气体。
3.阿伏加德罗定律及推论定律可导出:“一连比、三正比、三反比”的规律。
1)“一连比”:指在同温同压下,同体积的任何气体的质量比等于摩尔质量(相对分子质量)之比,等于密度比。
2)“三正比”(1)同温同压下,两气体的体积之比等于其物质的量之比,等于其分子数之比。
(2)同温同体积下,两气体的压强之比等于其物质的量之比,等于其分子数之比。
(3)同温同压下,两气体的密度之比等于其摩尔质量(又称相对分子质量)之比。