2018年讲义高考化学《物质结构与性质》专题复习
- 格式:ppt
- 大小:647.50 KB
- 文档页数:9




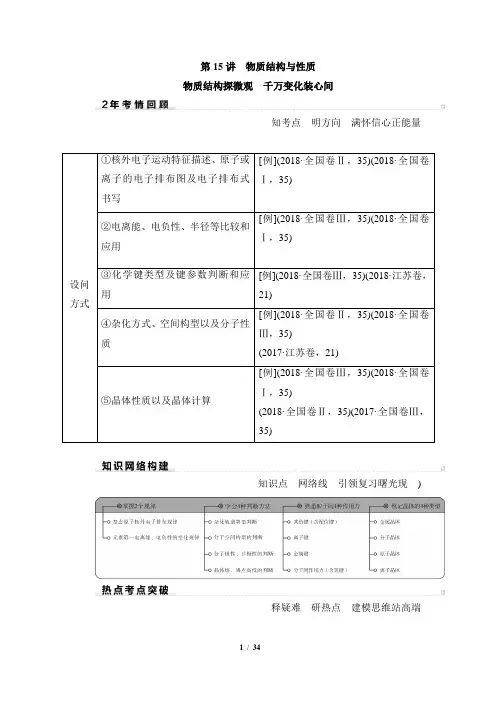
第15讲物质结构与性质物质结构探微观千万变化装心间知考点明方向满怀信心正能量设问方式①核外电子运动特征描述、原子或离子的电子排布图及电子排布式书写[例](2018·全国卷Ⅱ,35)(2018·全国卷Ⅰ,35)②电离能、电负性、半径等比较和应用[例](2018·全国卷Ⅲ,35)(2018·全国卷Ⅰ,35)③化学键类型及键参数判断和应用[例](2018·全国卷Ⅲ,35)(2018·江苏卷,21)④杂化方式、空间构型以及分子性质[例](2018·全国卷Ⅱ,35)(2018·全国卷Ⅲ,35)(2017·江苏卷,21)⑤晶体性质以及晶体计算[例](2018·全国卷Ⅲ,35)(2018·全国卷Ⅰ,35)(2018·全国卷Ⅱ,35)(2017·全国卷Ⅲ,35)知识点网络线引领复习曙光现)释疑难研热点建模思维站高端考点一原子结构与性质命题规律:1.题型:Ⅱ卷T35填空题(选做)。
2.考向:常见的命题角度有原子核外电子的排布规律及其表示方法、原子结构与元素电离能和电负性的关系及其应用。
各考查点相对独立,难度不大。
方法点拨:1.理解核外电子排布三原则及应用能量最低原理原子核外电子总是先占有能量最低的原子轨道泡利原理每个原子轨道上最多只能容纳2个自旋方向相反的电子洪特规则(铜和铬特殊) 当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,而且自旋方向相同2.基态原子核外电子排布的四种表示方法表示方法举例电子排布式Cr:1s22s22p63s23p63d54s1简化表示式Cu:[Ar]3d104s1价电子排布式Fe:3d64s2电子排布图3.从第一电离能和电负性的两种角度理解金属性和非金属性递变规律同主族(从上到下) 第一电离能增大(注意ⅡA、ⅤA的特殊性) 依次减小电负性依次增大依次减小1.(1)(2018·全国卷Ⅱ)基态Fe原子价层电子的电子排布图(轨道表达式)为,基态S原子电子占据最高能级的电子云轮廓图为__哑铃(纺锤)__形。

1.原子结构与元素的性质(1)了解原子核外电子的能级分布,能用电子排布式表示常见元素(1~36号)原子核外电子的排布。
了解原子核外电子的运动状态。
(2)了解元素电离能的含义,并能用以说明元素的某些性质。
(3)了解原子核外电子在一定条件下会发生跃迁,了解其简单应用。
(4)了解电负性的概念,知道元素的性质与电负性的关系。
2.化学键与物质的性质(1)理解离子键的形成,能根据离子化合物的结构特征解释其物理性质。
(2)了解共价键的主要类型σ键和π键,能用键能、键长、键角等说明简单分子的某些性质。
(3)了解简单配合物的成键情况。
(4)了解原子晶体的特征,能描述金刚石、二氧化硅等原子晶体的结构与性质的关系。
(5)理解金属键的含义,能用金属键理论解释金属的一些物理性质。
(6)了解杂化轨道理论及常见的杂化轨道类型(sp,sp2,sp3),能用价层电子对互斥理论或者杂化轨道理论推测常见的简单分子或者离子的空间结构。
3.分子间作用力与物质的性质(1)了解化学键和分子间作用力的区别。
(2)了解氢键的存在对物质性质的影响,能列举含有氢键的物质。
(3)了解分子晶体与原子晶体、离子晶体、金属晶体的结构粒子、粒子间作用力的区别。
一、原子结构与元素的性质1.基态原子的核外电子排布(1)排布规律①能量最低原理:基态原子核外电子先占有能量最低的原子轨道,如Ge:1s22s22p63s23p63d104s24p2。
②泡利原理:每个原子轨道上最多只容纳2个自旋状态不同的电子。
③洪特规则:原子核外电子在能量相同的各轨道上排布时,电子尽可能分占不同的原子轨道,且自旋状态相同。
注意:洪特通过分析光谱实验得出:能量相同的原子轨道在全充满(如d10)、半充满(如d5)和全空(如d0)时体系能量较低,原子较稳定。
如Cr原子的电子排布式为[Ar]3d54s1;Cu原子的电子排布式为[Ar]3d104s1。
(2)表示形式①电子排布式:用数字在能级符号右上角标明该能级上排布的电子数。


物质结构与性质考点一原子结构一、理清2个概念1.能层:原子核外电子是分层排布的,根据电子的能量差异,可将核外电子分成不同的能层。
2.能级:在多电子原子中,同一能层的电子,能量也可能不同,不同能量的电子分成不同的能级。
3.能层与能级的关系二、熟记原子轨道的形状、数目和能量关系三、掌握基态原子核外电子排布1.排布原则[注意] 当能量相同的原子轨道在全满(p6、d10、f14)、半满(p3、d5、f7)、全空(p0、d0、f0)时原子的能量最低,如24Cr的电子排布式为[Ar]3d54s1,29Cu的电子排布式为[Ar]3d104s1。
2.填充顺序——构造原理绝大多数元素的原子核外电子的排布遵循如图所示的排布顺序,人们把它称为构造原理。
它是书写基态原子核外电子排布式的依据。
3.电子排布式和电子排布图(或轨道表达式)四、明晰原子的状态和原子光谱1.原子的状态(1)基态原子:处于最低能量的原子。
(2)激发态原子:基态原子的电子吸收能量后,从低能级跃迁到较高能级状态的原子。
2.原子光谱不同元素的原子发生电子跃迁时会吸收或释放不同的光,用光谱仪记录下来便得到原子光谱。
利用原子光谱的特征谱线可以鉴定元素,称为光谱分析。
3.基态、激发态及光谱示意图[基点小练]1.判断正误(正确的打“√”,错误的打“×”)。
(1)p能级能量一定比s能级的能量高(×)(2)基态钠原子的电子排布式为1s22s22p62d1(×)(3)基态磷原子的电子排布图为(×)(4)同一原子中,2p、3p、4p能级的轨道数依次增多(×)(5)Cr的电子排布式为1s22s22p63s23p63d44s2(×)(6)2p和3p轨道形状均为哑铃形,能量也相等(×)2.请用核外电子排布的相关规则解释Fe3+较Fe2+更稳定的原因。
提示:26Fe的价电子排布式为3d64s2,Fe3+的价电子排布式为3d5,Fe2+的价电子排布式为3d6。
