有机化学 第三版 (胡宏纹 著) 高等教育出版社 课后答案
- 格式:pdf
- 大小:662.21 KB
- 文档页数:57
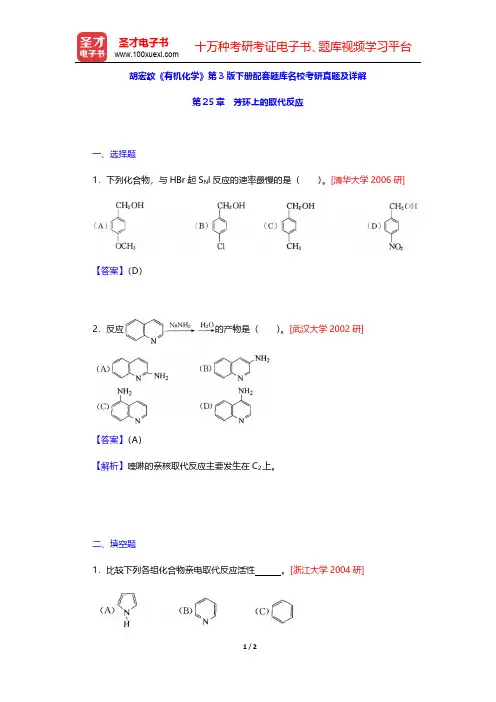
胡宏纹《有机化学》第3版下册配套题库名校考研真题及详解
第25章芳环上的取代反应
一、选择题
1.下列化合物,与HBr起S N l反应的速率最慢的是()。
[清华大学2006研]
【答案】(D)
2.反应的产物是()。
[武汉大学2002研]
【答案】(A)
【解析】喹啉的亲核取代反应主要发生在C2上。
二、填空题
1.比较下列各组化合物亲电取代反应活性。
[浙江大学2004研]
【答案】亲电取代反应活性:(A)>(C)>(B)
【解析】吡咯分子中环内每个碳原子提供1个p电子、氮原子提供2个p电子,组成大π键,氮原子的给电子共轭效应大于吸电子诱导效应,故吡咯中电子云密度比苯高;而吡啶分子中氮原子上的孤对电子没有参与大π键,氮原子的吸电子诱导效应大于给电子的共轭效应,故吡啶环内的电子云密度比苯低。
2.排出下列各化合物在亲电取代反应中的活性大小次序:。
[清华大学1999研、大连理工大学2003研]
【答案】亲电取代反应活性:(C)>(B)>(A)>D)
【解析】呋喃、噻吩电子云密度比苯高,相对而言,氧的给电子共轭效应比硫强,故呋喃的电子云密度比噻吩高,更易发生亲电取代反应,而吡啶中由于氮的电负性比碳强,故吡啶环上的电子云密度比苯低,其亲电取代反应活性不如苯。

第23章消除反应23.1复习笔记一、E1,E1cB和E2机理1.E1,单分子消除(1)单分子消除过程①第一步离去基团带着一对电子离去,底物成为碳正离子,速率较慢,是决定反应速率的步骤。
②第二步碳正离子从β位脱去一个质子给碱或溶剂,生成烯键。
(2)E1机理①第一步速率较慢,是决定反应速率的步骤。
②碳正离子也是S N反应的中间体,因此,常与E1反应竞争。
③E1机理中C-X键断裂在前,H-C(β)键断裂在后。
(3)促进E1机理的因素①α-碳上有烷基或芳基,它们使生成的碳正离子的稳定性提高。
②极性质子溶剂能使碳正离子的稳定性提高,如H2O、ROH、HCO2H等。
③β-碳上有烷基取代(不利于S N1)。
④X的离去倾向大。
2.E1cB(1)E1cB过程①第一步β-碳上的质子在碱进攻下离去,在β位生成碳负离子。
②第二步离去基团带着一对电子离去,形成烯键。
(2)化学键断裂顺序E1cB机理中C(β)-H键断裂在前,C-X键断裂在后。
(3)促进E1cB机理的因素①β-碳上有吸电子取代基,使β-H酸性增强,β-碳上形成的碳负离子稳定性提高;②离去基团的离去倾向小。
3.E2,双分子消除(1)双分子消除过程碱从β-碳上夺取质子和离去基团带着一对电子离去是协同进行的,在过渡状态中5个原子或原子团在同一平面上,随后在α-碳和β-碳上生成π键。
(2)促进E2机理的因素有利于E2和S N2的因素差别较大,可以选择适当的条件使S N2反应尽可能减少。
(3)E2反应的优势在E2反应中不发生重排,在合成工作中尽可能使消除反应在有利于E2机理的条件下进行,可以减少副产物的生成。
4.同位素效应反应体系中由于有同位素标记原子的存在而造成对反应速度的影响,如果在决定反应步骤中,涉及这个原子键的断裂,那么该原子较重同位素所参加的反应将变得较慢。
5.E1,E2和E1cB之间的关系E1cB、E2和E1只是连续的反应机理链中3种极限情况,如图23-1所示。

第16章杂环化合物16.1 复习笔记一、概念1.杂环、杂原子杂环是指由碳原子和至少一个其他原子所组成的环。
杂原子是指环内除了碳以外的原子称为,最常见的杂原子为氮、氧和硫。
2.杂环化合物杂环化合物是指含有杂环的有机化合物。
3.杂环化合物的命名对于杂环母核我国目前采取外文音译的方法命名。
例如:二、呲啶1.结构和物理性质(1)结构① 吡啶分子中所有的原子在同一平面内,测定的键长、键角为② 氮原子的孤电子对在sp2轨道上,与p轨道垂直,不参与π-电子的共轭。
③ 氮原子的存在使吡啶分子中六元环变形,并具有较大的偶极矩(7.34×10-30 C·m)。
④ 吡啶的共振结构如下:⑤ 吡啶环上碳原子带部分正电荷,是缺电子的芳环。
⑥ 用分子轨道法计算出来的吡啶环上的π-电子密度为⑦ 原子的编号从氮原子开始,2、6位,3、5位和4位原子也分别用α、β和γ表示。
(2)物理性质① 吡啶为无色液体,能与水混溶,气味与苯胺相似。
② 吡啶及其烷基取代物的沸点都比苯系化合物高。
③ 杂环上质子的化学位移与其所在碳原子周围的电子密度有关,与缺电子碳原子相连的质子的共振信号在低场出现。
2.氮原子上的亲电加成(1)吡啶环上的氮原子相当于脂肪族化合物中的亚胺,能与亲电试剂加成。
(2)吡啶的碱性在水溶液中(pK a=5.20)比脂肪胺(pK a=9~11)弱,而在气相中相近。
(3)由于甲基是给电子取代基,甲基吡啶碱性比吡啶强。
(4)一些吡啶盐是有机合成中有效的试剂:(5)吡啶是金属离子的良好配体,例如:(6)吡啶与酰氯、磺酰氯或酐生成季铵盐,后者与酰氯等相比,是更有效的酰化剂。
(7)吡啶与卤代烷或硫酸烷基酯生成季铵盐:3.碳原子上的亲电取代(1)吡啶是缺电子芳环,碳原子上的亲电取代速率非常慢,只得到3位取代产物。
如:(2)吡啶环上的给电子取代基使亲电取代较易进行,但速率仍低于苯系化合物。
如:(3)2,6-二叔丁基吡啶可以在液体SO2中用SO3磺化:(4)亲电取代生成3位取代物的原因是:亲电试剂进攻3位时,生成的中间体最稳定:进攻2位或4位时,生成的中间体中,正电荷在电负性较大的氮原子上,使其很不稳定:4.碳原子上的亲核取代(1)亲核取代是吡啶环特有的反应,苯系化合物没有类似反应。

第14章羧酸衍生物
1.推测下列化合物的结构。
提示:
答:各化合物的结构如下:
2.分离下列混合物。
(1)丁酸和丁酸丁酯
解:提纯一个化合物是要去掉其中的杂质。
分离一个混合物,则是要把其中各个组分一一分离,并使其达到一定的纯度。
例如,提纯由丁酸合成的丁酸丁酯,只要用碱洗去其中所含少量丁酸,而后蒸馏纯化,以得到丁酸丁酯。
而分离丁酸和丁酸丁酯的混合物,两种组分
都要分离提纯。
(2)苯甲醚、苯甲酸和苯酚。
(3)丁酸、苯酚、环己酮和丁醚。
(4)苯甲醇、苯甲醛和苯甲酸。
答:(1)略。
(2)分别用NaHCO3,NaOH溶液使三者分开,再各自分离提纯。
(3)分别用NaHCO3,NaOH和饱和NaHSO3溶液使四者分开,再各自分离提纯。
(4)分别用NaHCO3,饱和NaHSO3溶液使三者分开,再各自分离提纯。
3.推测下列反应的机理。
(提示:分子内的Claisen反应称为Dieckmann反应,它与Claisen反应都是可逆反应。
)
答:
(3)
4.下列化合物应如何合成?
答:(1)
(2)略。
(3)略。
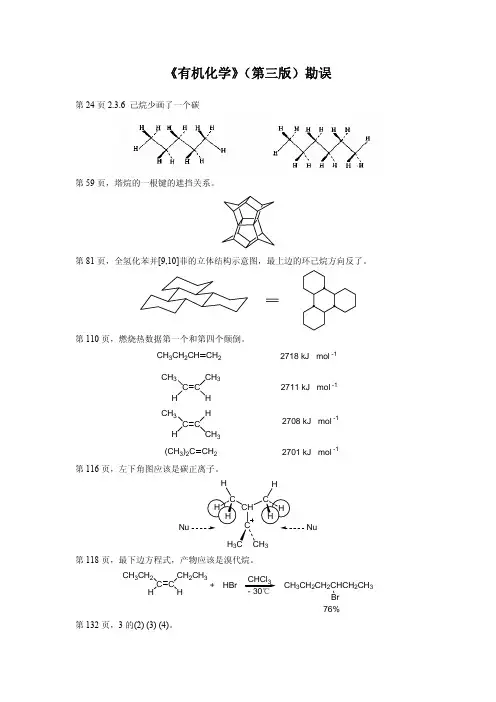
页,塔烷的一根键的遮挡关系。
第591页,“2,4,6-三甲基苯”->“1,3,5-三甲基苯”。
第593页,动力学同位素效应第一个方程式,第一个产物少了2个氘。
第594页,“2,4,6-三叔丁基苯”->“1,3,5-三叔丁基苯”。
第604页,“2,4,6-三甲苯”->“1,3,5-三甲苯”。
第607页,加成-消除机理方程式最后产物Y改为Nu。
第609页,Smiles重排中间体少一个硝基。
第614页,“NH3(I)”->“NH3(l)”。
第615页,最下边两个方程式“NH3(I)”->“NH3(l)”。
第623页,倒数第二个方程式,最后产物Et换为R。
第634页,中间三个方程式,第一、三个反应物各少了一根单键。
第646页,第二个方程式,改为和Cl2反应。
第653页,最下边方程式自由基多了一个电子。
第661页,倒数第三个方程式重氮乙酸酯碳上少一个氢;下边两个方程式氧化银应为Ag2O。
第668页,第一个方程式第二、三个共振体各少标两个H;不同方向箭头长度有待商榷。
第675页,中间产物第二个共振式少一个R2。
第677页,第一个方程式第一步Baeyer-Villiger重排产物有误。
第684页,第一个方程式产物一对苯基和甲基应调位。
第687页,第二个方程式第三个结构少一个双键。
第688页,下部一个顺旋轨道颜色反了。
第694页,最后一个结构式少两个甲基。
第711页,倒数第二个方程式中间体最后一个多一个电子。
第738页,“Polple J A”->“Pople J A”。
第744页,“Hücke”->“Hückel”。
以下是一些追求完美所需要的“错误”(不算特别严重):上册:第56页,右下角顺十氢化萘氢的遮挡关系。
第104页,制二烷基铜锂方程式产物添上一个LiI。
第133页,4.(3)改为箭头。
第219页,第一个面内弯曲的方向。
这是个不完全列举还是方向标反待讨论。




胡宏纹有机化学(第3版)(下册)知识点笔记课后答案第16章杂环化合物16.1 复习笔记⼀、概念1.杂环、杂原⼦杂环是指由碳原⼦和⾄少⼀个其他原⼦所组成的环。
杂原⼦是指环内除了碳以外的原⼦称为,最常见的杂原⼦为氮、氧和硫。
2.杂环化合物杂环化合物是指含有杂环的有机化合物。
3.杂环化合物的命名对于杂环母核我国⽬前采取外⽂⾳译的⽅法命名。
例如:⼆、呲啶1.结构和物理性质(1)结构①吡啶分⼦中所有的原⼦在同⼀平⾯内,测定的键长、键⾓为②氮原⼦的孤电⼦对在sp2轨道上,与p轨道垂直,不参与π-电⼦的共轭。
③氮原⼦的存在使吡啶分⼦中六元环变形,并具有较⼤的偶极矩(7.34×10-30 C·m)。
④吡啶的共振结构如下:⑤吡啶环上碳原⼦带部分正电荷,是缺电⼦的芳环。
⑥⽤分⼦轨道法计算出来的吡啶环上的π-电⼦密度为⑦原⼦的编号从氮原⼦开始,2、6位,3、5位和4位原⼦也分别⽤α、β和γ表⽰。
(2)物理性质①吡啶为⽆⾊液体,能与⽔混溶,⽓味与苯胺相似。
②吡啶及其烷基取代物的沸点都⽐苯系化合物⾼。
③杂环上质⼦的化学位移与其所在碳原⼦周围的电⼦密度有关,与缺电⼦碳原⼦相连的质⼦的共振信号在低场出现。
2.氮原⼦上的亲电加成(1)吡啶环上的氮原⼦相当于脂肪族化合物中的亚胺,能与亲电试剂加成。
(2)吡啶的碱性在⽔溶液中(pK a=5.20)⽐脂肪胺(pK a=9~11)弱,⽽在⽓相中相近。
(3)由于甲基是给电⼦取代基,甲基吡啶碱性⽐吡啶强。
(4)⼀些吡啶盐是有机合成中有效的试剂:(5)吡啶是⾦属离⼦的良好配体,例如:(6)吡啶与酰氯、磺酰氯或酐⽣成季铵盐,后者与酰氯等相⽐,是更有效的酰化剂。
(7)吡啶与卤代烷或硫酸烷基酯⽣成季铵盐:3.碳原⼦上的亲电取代(1)吡啶是缺电⼦芳环,碳原⼦上的亲电取代速率⾮常慢,只得到3位取代产物。
如:(2)吡啶环上的给电⼦取代基使亲电取代较易进⾏,但速率仍低于苯系化合物。
如:(3)2,6-⼆叔丁基吡啶可以在液体SO2中⽤SO3磺化:(4)亲电取代⽣成3位取代物的原因是:亲电试剂进攻3位时,⽣成的中间体最稳定:进攻2位或4位时,⽣成的中间体中,正电荷在电负性较⼤的氮原⼦上,使其很不稳定:4.碳原⼦上的亲核取代(1)亲核取代是吡啶环特有的反应,苯系化合物没有类似反应。
w w w .k h d a w .c o m
课后答案网
w w w .k h d a w .c o m
课后答案网
w w w .k h d a w .c o m
课后答案网
w w w .k h d a w .c o m
课后答案网
w w w .k h d a w .c o m
课后答案网
w w w .k h d a w .c o m
课后答案网
w w w .k h d a w .c o m
课后答案网
w w
w .k h d a w .c o m 课后答案网
w w
w .k h d a w .c o m 课后答案网
w w w .k h d a w .c o m 课后答案网
w w w .k h d a w .c o m
课后答案网
w w w .k h d a w .c o m
课后答案网
w w w .k h d a w .c o m
课后答案网
w w w .k h d a w .c o m
课后答案网
w w w .k h d a w .c o m
课后答案网
w w w .k h d a w .c o m
课后答案网
w w w .k h d a w .c o m
课后答案网
w w w .k h d a w .c o m
课后答案网
w w w .k h d a w .c o m
课后答案网
w w w .k h d a w .c o m 课后答案网
w w w .k h d a w .c o m
课后答案网
w w w .k h d a w .c o m
课后答案网
w w w .k h d a w .c o m
课后答案网
w w w .k h d a w .c o m
课后答案网
w w w .k h d a w .c o m
课后答案网
w w w .k h d a w .c o m
课后答案网
w w w .k h d a w .c o m
课后答案网
w w w .k h d a w .c o m
课后答案网
w w w .k h d a w .c o m
课后答案网
w w w .k h d a w .c o m 课后答案网
w w w .k h d a w .c o m
课后答案网
w w w .k h d a w .c o m
课后答案网
w w w .k h d a w .c o m
课后答案网
w w w .k h d a w .c o m
课后答案网
w w w .k h d a w .c o m
课后答案网
w w w .k h d a w .c o m
课后答案网
w w w .k h d a w .c o m
课后答案网
w w w .k h d a w .c o m
课后答案网
w w w .k h d a w .c o m
课后答案网
w w w .k h d a w .c o m 课后答案网
w w
w .k h d a w .c o m 课后答案网
w w w .k h d a w .c o m
课后答案网
w w w .k h d a w .c o m
课后答案网
w w w .k h d a w .c o m
课后答案网
w w w .k h d a w .c o m
课后答案网
w w w .k h d a w .c o m
课后答案网
w w w .k h d a w .c o m
课后答案网
w w w .k h d a w .c o m
课后答案网
w w w .k h d a w .c o m
课后答案网
w w w .k h d a w .c o m 课后答案网。