附表中国体外诊断网
- 格式:doc
- 大小:921.55 KB
- 文档页数:7

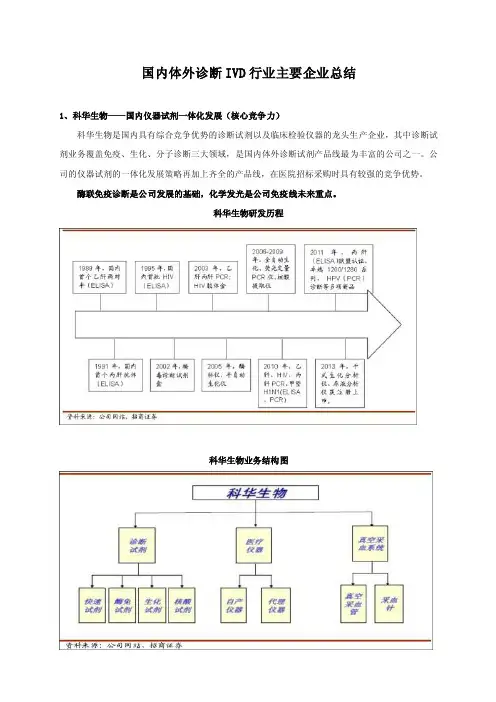
国内体外诊断IVD行业主要企业总结1、科华生物——国内仪器试剂一体化发展(核心竞争力)科华生物是国内具有综合竞争优势的诊断试剂以及临床检验仪器的龙头生产企业,其中诊断试剂业务覆盖免疫、生化、分子诊断三大领域,是国内体外诊断试剂产品线最为丰富的公司之一。
公司的仪器试剂的一体化发展策略再加上齐全的产品线,在医院招标采购时具有较强的竞争优势。
酶联免疫诊断是公司发展的基础,化学发光是公司免疫线未来重点。
科华生物研发历程科华生物业务结构图科华生物产品线总的来看,仪器+试剂一体化发展,外延并购,扩张有望提速。
科华拥有诊断试剂、诊断仪器、真空采血管三大产品线,诊断试剂涵盖生化、免疫、分子和POCT,是国内产品线最为齐备的诊断试剂公司。
仪器业务主要为代理的希森美康(Sysmex)尿液分析仪、五分类血液分析仪、血液流水线分析系统,自主研发的卓越系列生化分析仪、Fluocycle 实时荧光定量PCR仪,以及全自动核酸提取仪等产品,代表着国内同类产品的领先水平,2013年干式生化分析仪、尿液分析仪上市。
生化线(70多种)保持稳定增长,干式生化分析、尿液分析领域是新的增长点;免疫线经历近几年下滑后企稳,化学发光业务是未来看点;分子诊断保持快速增长,血筛业务还需要政策落地;代理仪器业务由于基数较高,预计每年平稳增长。
2、利德曼—立足生化、进军免疫、核心竞争力突出利德曼是是我国体外生化诊断试剂品种最齐全的生产厂商之一,能够满足医疗机构、体检中心等各种生化检测需求。
(1)生化产品线齐全。
目前公司已获得超100项生化诊断试剂产品注册证书,涵盖肝功、肾功、血脂与脂蛋白、血糖、心肌酶、离子、胰腺、特殊蛋白等九大系列,是国内生化诊断试剂品种最齐全的生产厂商之一。
产品线齐全给临床检验科室的营销工作带来极大的助力。
(2)研发实力雄厚。
预计公司每年将推出10 款以上的新产品。
(3)成熟的营销网络、优秀的市场管理能力。
截止2012 年底,公司共有骨干经销商62个,二级经销商300 至350 家,终端客户已经超过2400家,其中三级医院630 家,占全国三级医院总量的59%,已建成覆盖全国的营销网络。

体外诊断试剂研制情况核查报告表报告编号:XXXX-YYYY-ZZZZ日期:XXXX年XX月XX日一、背景随着医疗技术的不断进步,体外诊断试剂在医疗领域的应用越来越广泛。
体外诊断试剂是指用于检测人体体液或组织样本中生物化学或免疫学反应的试剂,可以帮助医生准确诊断和监测疾病。
为了满足市场需求,不断有新的体外诊断试剂研制出现。
二、目的本报告旨在对体外诊断试剂研制情况进行核查,包括研发团队、研发内容、现有成果等方面的情况,并针对存在的问题提出改进建议,以促进体外诊断试剂的研发和应用水平的提高。
三、核查内容1.研发团队:核查研发团队的组成与人员分工情况,以及团队成员的背景和专业技能。
2.研发内容:核查研发项目的具体内容,包括但不限于试剂的种类、功能、原理等。
3.研发进展:核查研发项目的进展情况,包括已经完成的研究阶段、正在进行的研发工作以及下一步计划。
4.研发成果:核查研发项目取得的成果,包括专利申请、论文发表、研发报告等。
5.问题与建议:对研发过程中出现的问题进行整理,并提出改进建议,以促进研发水平的提高。
四、核查结果1.研发团队:核查结果显示,研发团队由X位具有丰富研发经验的科研人员组成,其中包括X位博士生导师和X位博士后研究人员。
团队成员背景各异,涵盖了生物化学、医学、免疫学等多个领域。
2.研发内容:核查结果显示,研发项目主要集中在感染性疾病的体外诊断试剂研制上,包括新型冠状病毒、流感病毒等常见病原体的检测。
其中,试剂种类涵盖了免疫检测试剂、核酸检测试剂等多种类型。
3.研发进展:核查结果显示,研发项目已经完成了前期的理论研究和前期实验室验证,并且正在进行中期的临床研究。
下一步的计划是进一步完善试剂的灵敏度和特异性,争取尽快推向市场使用。
4.研发成果:核查结果显示,研发项目已经获得X项国内外专利,并在国内外重要学术期刊上发表了X篇论文。
此外,还编写了X份研发报告,以提高研发成果的传播和利用效果。
5.问题与建议:通过核查,发现研发项目面临的主要问题是研发周期较长、资金短缺等。
省博济光明医药员工健康档案编号:建档时间:年月员工培训档案职务或职称:员工培训考核记录2011年度首营企业审批表编号: 填表日期:年月日仁济医药股份首营品种审批表编号:填表日期:年月日适用围质量标准有效期试剂质量信息汇总表省博济光明医药质重上制度丸行情况自查表*省博济光明医药质量制度执行情况自查表省博济光明医药质量制度执行情况考核表省博济光明医药质量制度执行情况考核表培训签到表时间:供货方档案表企业名称地址客户资质审核表仓库温湿度记录适宜温度围:〜℃适宜相对湿度围:45%〜75%养护设备使用记录年度:_____ 生设备名称:规格/型号:设备编号:养护设备检修维护记录填表口期:养护(维修)人:设备档案编号:建档日期:建档人:名称生产企业试剂养护档案报损试剂销毁记录不合格试剂报损审批表时间:试剂运输记录表试剂运输工具:⑴冷藏车⑵试剂运输车⑶其它填写说明:本表供购进/销售试剂运输时填写;运输超过6小时需记录途中温度,每天记录2次, 间隔不少于6小时:使用无自动温度显示的冰排保冷设备时,只在启运和到达时填写冰排状态(冻结、冰水混合物、完全融化)。
产品追回记录年月口试剂质量、质量管理征询意见表调查口期: 编号:客户名称地址调查人:文件签收单收文部门:文件借(查)阅登记表文件销毁单文件修订审批单申请修订文件名称编码修订理由和容:质量领导组意见:编号:申请部门: 日期:质量负责人签名: 日期:拒收报告单产品名称供货企业拒收原因质量复检通知单编号:质量复检报告单编号:试剂停售通知单各有关部门:以下试剂因质量问题决定停售,请按规定采取有效措施停止出售,等待处理。
试剂名称:规格型号:产品批号:有效期:生产日期:生产企业:质管部年月日解除停售通知单年第号各有关部门:以下试剂经质量复查结果合格,撤销年第号“试剂停售通知单”,请恢复正常出库发货及销售,特此告知。
试剂名称:规格型号:产品批号:有效期:生产日期:生产企业:质管部年月日不合格试剂通知单年第号各有关部门:以下试剂经质量复查结果为不合格,请按《不合格试剂控制程序》处理,停止出售,特此告知。

体外诊断试剂研发及市场发展概况袁银池;赵晓勤;陈大明;张春芳【摘要】基因组学、分子生物学等基础学科的发展,促进了体外诊断试剂的开发应用和更新换代,使其在疾病诊治中发挥越来越重要的作用.2016年全球体外诊断试剂市场容量约680亿美元,未来全球增速预计达7%~8%,其中中国是全球增速最快的市场.主要就体外诊断试剂的研发及市场发展情况进行阐释.【期刊名称】《生物产业技术》【年(卷),期】2017(000)004【总页数】9页(P16-24)【关键词】体外诊断试剂;技术研发;市场发展【作者】袁银池;赵晓勤;陈大明;张春芳【作者单位】中国科学院上海生命科学信息中心,上海 200031;上海图书馆(上海科学技术情报研究所),上海 200031;中国科学院上海生命科学信息中心,上海 200031;中银消费金融有限公司,上海 200002【正文语种】中文目前,全球医疗决策中约有三分之二是依据诊断做出,其中体外诊断(in vitro diagnostics,IVD)已是预防诊断和治疗疾病过程中的重要环节。
体外诊断从人体样本中获取临床检测信息,达到诊断的目的。
体外诊断市场可以细分为体外诊断试剂和体外诊断仪器两个部分。
就国内体外诊断市场而言,体外诊断试剂占据大部分的体外诊断市场。
国家食品药品监督管理总局(CFDA)2014公布的《体外诊断试剂注册管理办法》中指出,体外诊断试剂是指按医疗器械管理的体外诊断试剂,包括可单独使用或与仪器、器具、设备或系统组合使用,在疾病的预测、预防、诊断、治疗监测、预后观察和健康状态评价的过程中,用于人体样本体外检测的试剂(盒)、校准品、质控品等产品。
CFDA 2017年通过的《体外诊断试剂注册管理办法修正案》,表明体外诊断试剂全链条动态质量管理是提升产业格局、优化产品结构的监管方向。
1.1 发展历程体外诊断试剂行业在我国开展较晚,20世纪70年代才刚刚拉开帷幕[1]。
1970年初,我国小规模引进西方国家的技术设备,诊断试剂产业的雏形初现;1980年,开始大量引入海外先进技术,出现一批体外诊断试剂的生产企业,诸如生化类诊断试剂的北京中生、深圳迈瑞等生产企业,免疫类诊断试剂的上海科华、郑州安图等生产企业;20世纪90年代初期,生化类诊断试剂已有100多家的生产企业,免疫类诊断试剂的生产企业约300家,但大多数缺少合法资质,此时诊断试剂行业竞争白热化;90年代后期,CFDA着手对血源筛查类、免疫类诊断试剂开展市场清查,取缔违规不合格生产厂家;2010年之前,我国体外诊断试剂生产企业集中于较低端的生化与免疫诊断市场,缺乏创新性;2010年之后,体外诊断技术得到快速发展,尤其是分子生物学技术在临床检验领域应用带来的新一轮医疗革命。

一、体外诊断的定义及细分1.1.体外诊断定义体外诊断(In Vitro Diagnostics,IVD)是指在人体之外,通过对人体样本(血液、体液、组织等)进行检测获取临床诊断信息,进而判断机体功能和机体疾病的诊断方法。
除了某些特殊情形需要体内诊断以外,目前临床诊断信息的80%来自体外诊断。
体外诊断包括产品和服务,其中体外诊断试剂作为国家药监系统监管产品,由《体外诊断试剂注册管理办法》做出解释:按医疗器械管理的体外诊断试剂,包括可单独使用或与仪器、器具、设备或系统组合使用,在疾病的预防、诊断、治疗监测、预后观察、健康状态评价以及遗传性疾病的预测过程中,用于对⼈体样本(各种体液、细胞、组织样本等)进⾏体外检测的试剂、试剂盒、校准品(物)、质控品(物)等。
1.2.体外诊断分类按照不同的检测原理或方法,体外诊断可分为生化诊断、免疫诊断、分子诊断、微生物诊断、尿液诊断、凝血类诊断、血液学和流式细胞诊断等,我国目前体外诊断的主要方法是生化诊断、免疫诊断和分子诊断。
下图为各分类体外诊断原料组成。
图表1:体外诊断分类简介数据来源:solarzoom、智银资本1.3.体外诊断试剂原料定义与分类体外诊断试剂原料指用于生化、免疫或分子诊断等试剂的反应体系原料,主要指核心反应体系。
上游诊断试剂原材料质量的好坏直接决定了体外诊断产品的质量,其中核心反应体系原材料如抗原、抗体、诊断酶是体外诊断质量控制最为重要的战略节点。
按照性质不同,体外诊断试剂原料可分为抗原、抗体、酶与辅酶、底物及标准品等类别。
图表2:体外诊断试剂原料的分类数据来源:IVD资讯网、头豹研究院、智银资本抗原与抗体、酶及辅酶是体外诊断试剂发挥诊断功能的重要组成成分,影响体外诊断试剂各项性能水平(如灵敏度、稳定性),是体外诊断试剂成本构成主要的部分,合计占据体外诊断原料市场75%以上的市场份额。
其他原料是除上述发生核心反应的活性物质外的原料,包括微球、磁珠、膜、引物、探针及其他化学及生物制品等。

体外诊断试剂(IVD)分析报告及建议体外诊断试剂是指按医疗器械管理的体外诊断试剂,包括可单独使用或与仪器、器具、设备或系统组合使用,在疾病的预防、诊断、治疗监测、预后观察、健康状态评价以及遗传性疾病的预测过程中,用于对人体样本(各种体液、细胞、组织样本等)进行体外检测的试剂、试剂盒、校准品(物)、质控品(物)等。
国家法定用于血源筛查的体外诊断试剂、采用放射性核素标记的体外诊断试剂不属于《体外诊断试剂注册管理办法(试行)》的管理范围。
一、体外诊断试剂(IVD)市场分析中国体外诊断(IVD)产业兴起于20世纪80年代初期,经历近30年的发展,从无到有,从弱到强,现在整个产业已经具备了规模化发展条件。
中国诊断产品用户主要包括19800 多家医院、39000多个乡镇卫生院和300多家血站,以及日新月异的体检中心和正在兴起的临床检验独立实验室。
总体来看,中国诊断行业仍处在成长初期目前,我国诊断试剂市场基本可以分成7个部分,其中免疫学诊断试剂市场规模最大,市场份额29.61%,其次是:生化诊断试剂,血糖自我监测试剂血液诊断试剂,尿液诊断试剂,生物学诊断试剂3.97%,分子及其他诊断试剂12.01%。
分子诊断试剂是20世纪80年代后期发展起来的,无论技术还是市场,都是目前所有诊断试剂产品中发展最快的。
免疫诊断试剂的市场规模已逐渐超过临床化学试剂,但由于二者的检验对象有所区别,生化诊断试剂还将保持较大份额。
据《2013-2017年中国诊断试剂行业产销需求与投资预测分析报告》[4]分析,2007-2009年中国诊断试剂行业的市场规模年复合增长率达17.93%,呈现高速增长趋势。
2009年中国诊断试剂市场规模达到96.72亿元,人均年费用为7.3元,而日本2008年人均年使用量为227.5元,差距悬殊。
总体来看,中国诊断行业仍处在成长期初期。
诊断试剂行业是生物制药行业的重要组成部分,就国内的现状来说,中国的诊断试剂仍处于弱小成长期,才处于产品研发与生产的投入初期,成长期还没有真正到来。


国内兽用诊断试剂情况汇总及注册方法向昭颖,杨佳颖/本刊诊断试剂是指采用免疫学、微生物学、分子生物学等原理或方法制备的、在体外用于对人类或动物疾病的诊断、检测及流行病学调查等的诊断试剂。
常用的检测方法有酶联免疫/酶免法(ELISA),免疫荧光法,PCR 等等。
1 注册方法为进一步加强兽医诊断制品(以下简称诊断制品)注册评审工作,满足动物疫病诊断、监测、检疫和评估等工作需要,2015年12月农业部发布中华人民共和国农业部公告第2335号,对兽医诊断制品注册要求规定如下。
1)严格执行诊断制品注册分类的规定。
凡与我国已批准上市销售、检测方法和检测标的物相同的同类诊断制品比较,在敏感性、特异性、稳定性和便捷性等方面无根本改进的诊断制品不作为新兽药审批。
2)体外诊断制品应在注册资料中提供临床检测数据和总结报告,不再要求进行临床试验审批。
3)对无国家标准的试验用动物,研制者应当制定动物质量标准和检测方法,可不提供实验动物合格证和实验动物使用许可证等证件的复印件。
4)诊断制品的中试应在GMP 车间或符合生物安全要求的实验室进行。
5)加强诊断制品生产及检验用菌(毒、虫)种和细胞等主要原材料的管理。
申请人提出兽药注册申请时,应提交菌(毒、虫)种基础种子批的制备和鉴定记录、菌(毒、虫)种的标准、鉴定报告,以及基础细胞种子批的制备和鉴定记录、细胞种子的标准、鉴定报告等资料。
6)加强诊断制品所用对照品(包括标准抗原、标准血清等质控标准物质)以及成品的敏感性、特异性和重复性检验用样品盘的制备、检验、标定管理。
必要时,标定工作由研究单位委托中国兽医药品监察所进行。
7)加强诊断制品的比对试验研究。
应在不少于3家实验室进行诊断制品的比对试验。
承担比对试验的实验室应为农业部考核合格的省级以上兽医主管部门设置的兽医实验室。
有国家兽医参考实验室或农业部指定的专业实验室的,应至少选择1家国家参考实验室或农业部指定的专业实验室实施比对试验。
