高级生化-蛋白质综述
- 格式:doc
- 大小:60.00 KB
- 文档页数:18


1. 蛋白质一级结构、二级结构、超二级结构、结构域、三级结构、四级结构,肽平面、Rossman折叠、Bohr效应的概念、分叉进化。
(1)一级结构:指蛋白质分子中氨基酸的排列顺序。
(2)二级结构:指多肽链主链上原子的局部空间排列状态。
(3)超二级结构:在蛋白质结构中有一些二级结构的组合物,充当三级结构的构件。
(4)结构域:蛋白质三维结构中存在着易于鉴别的具有重要的功能球状亚结构,1973年温特劳弗尔(Wetlaufer)将蛋白质中的这种亚结构称为结构域。
(5)三级结构:指二级结构和非二级结构在空间进一步盘曲折叠,形成包括主、侧链原子在内的专一性三维排布。
(6)四级结构:四级结构就是指蛋白质分子中亚基在空间排列状态、亚基间的相互作用以及接触部位的布局。
(7)肽平面:肽键具有部分双键的性质(约40%),不能自由旋转,所以肽键是一个刚性平面,称为肽平面(酰胺平面)。
(8)Rossman折叠:蛋白质中常常还有两组βαβ组合成的一种更为复杂的超二级结构,这种结构称为Rossman折叠,它包括两个相邻的βαβ单元,即βαβαβ,有时还有ββααββ结构,这是βXβ单元的特殊形式。
(7)Bohr效应:H+ 浓度或pH的变化可以影响血红蛋白对氧的亲合力。
在肺组织中,CO2分压低、H+ 浓度低、pH较高的情况下,血红蛋白与氧的亲合力增加,所以易与氧结合成氧合血红蛋白。
但在周围组织中,CO2分压高、H+ 浓度高、pH较低的情况下,血红蛋白与氧的亲合力降低,所以氧合血红蛋白易释放出氧成为脱氧血红蛋白。
这就是Bohr效应。
(8)分叉进化:这种从一个共同祖先蛋白质发展出另一种新蛋白质的现象称为分叉进化。
2试举两例说明蛋白质一级结构与功能的关系蛋白质的氨基酸顺序与生物功能具的密切的关系,特别是蛋白质与其它生物大分子物质之间的相互作用及其作用方式都是由氨基酸顺序决定的。
牛的催产素和抗利尿素的结构相似,都是环八肽,但有两个氨基酸不同。

生物化学课程论文…………………………………………………………………………………………………题目: 蛋白质翻译后修饰综述学院:生命科学技术学院(生化与分子)成员:祝乐清(1433121003)任课老师:李弘剑二О一五年一月七日蛋白质翻译后修饰摘要:后基因组时代的到来意味着生命科学研究重心转向功能基因组学及功能蛋白质组学等新领域(蛋白质翻译后修饰是蛋白质组学的重要组成部分(蛋白质经翻译后修饰改变自身的空间构象、活性、稳定性及其与其他分子相互作用等方面的性能,从而参与调节机体多样化的生命活动。
多数蛋白质存在翻译后修饰,目前已知的蛋白质共价修饰方式多达200余种,主要包括磷酸化、亚硝基化、硝基化、泛素化和小泛素相关修饰物化(SUMO)等。
我们就蛋白质翻译后修饰类型和生物学功能做以下综述。
关键词:蛋白质翻译后修饰;磷酸化;糖基化;硝基化;亚硝基化;泛素化;SUMO 1磷酸化磷酸化是蛋白质翻译后修饰中最广泛的共价修饰方式,三磷酸腺苷/三磷酸鸟苷的γ位磷酸基团经磷酸化激酶催化转移到蛋白质特定位点上,而其反向过程去磷酸化由蛋白磷酸酶催化去除相应磷酸基团。
发生磷酸化的蛋白质按磷酸化残基不同分为4类:O-磷酸盐蛋白质”由羟氨基酸如丝氨酸、苏氨酸或酪氨酸残基磷酸化形成:N-磷酸盐蛋白质:由天冬氨酸或谷氨酸残基磷酸化形成:酰基磷酸盐蛋白质:由精氨酸、赖氨酸或组氨酸残基磷酸化形成:S-磷酸盐蛋白质:由半胱氨酸残基磷酸化形成。
其中,丝氨酸/苏氨酸磷酸化主要是通过改变蛋白质空间结构影响酶活性。
酪氨酸磷酸化除上述作用外,更重要的是为与其他蛋白质形成多蛋白复合体提供基团,而形成的多蛋白复合体可进一步促进蛋白质磷酸化。
在多细胞生物有丝分裂中,相比非磷酸化的组蛋白H380位点苏氨酸,组蛋白H2A和H4优先与其磷酸化形式反应,增加与邻近核小体结合。
从而促进染色质的紧密贴合。
表皮生长因子受体654位的苏氨酸经蛋白激酶C催化发生磷酸化,可抑制溶酶体对其自身的降解,此外,654位苏氨酸磷酸化可以保护表皮生长因子与表皮生长因子受体的结合.共济失调毛细血管扩张症突变基因磷酸化的小鼠CGG三聚体重复结合蛋白1的164位苏氨酸是端粒的保护信号,未被磷酸化的CGG三聚体重复结合蛋白1的164位苏氨酸的过表达引起端粒缩短和融合。

生化复习资料注:本资料为知识点复习,大部分为授课老师所勾画的重点,共40个知识点。
一、蛋白质化学(1——8)1.1:pro的元素组成:主要有碳(C)、氢(H)、氧(O)、氮(N)、硫(S),有的pro还含有少量的磷、铁、铜、锌、锰、碘等。
由含氮量推算pro含量的公式:每克样品含氮量×6.25=每克样品中pro含量1.2:pro的基本单位是氨基酸。
Pr o→酸、碱/蛋白酶→完全水解→(各种)氨基酸自然界存在的氨基酸有300多种,但组成人体的pro的氨基酸仅仅20多种。
成人在不进食pro时,每日pro的最低分解量是20g。
我国营养学会推荐成人每日pro供应量为80g。
8种必须氨基酸:异亮氨酸、亮氨酸、色氨酸、苏氨酸、苯丙氨酸、赖氨酸、蛋氨酸、缬氨酸。
记忆歌诀:①一家借两本书来。
②亮亮生来苯色,结果是鸡蛋醇。
③一两色素本来淡些。
2:氨基酸的分类,4种。
①非极性疏水性氨基酸。
②极性中性氨基酸。
③酸性氨基酸。
④碱性氨基酸。
详见书P43:肽键。
在pro中,氨基酸之间通过肽键相连。
肽键(-CO-NH-)。
①由两个氨基酸缩合形成的化合物→二肽②由三个氨基酸缩合形成的化合物→三肽③由四个氨基酸缩合形成的化合物→四肽以此类推……通常将10个以内的氨基酸相连接形成的肽称为寡肽。
将10个以上的氨基酸形成的肽链称为多肽。
4:pro的基本结构。
4.1.1.一级结构:从N端到C端的氨基酸排列顺序。
4.1.2.一级结构是pro的基本结构,其主要化学键是肽键,肽键也是维持一级结构的主要化学键。
.4.1.3.胰岛素A链和B链,他们之间又—SH脱氢氧化形成的二硫键位置也属于一级结构范畴。
4.2.1.二级结构:pro中多肽主链原子的局部空间排布方式,不涉及氨基酸残基侧链基团参与形成的空间结构。
(肽链的主链借助氢键有规律地卷曲折叠成沿一维方向具有周期性结构的构象。
)4.2.2.稳定因素:氢键。
4.3..1.三级结构:由于侧链基团的相互作用,使远离的氨基酸残基彼此靠近,肽链在二级结构的基础上进一步折叠形成的特定空间结构。

蛋白质高中生物知识点蛋白质是生物体内非常重要的一类有机化合物,也是高中生物课程中的重要知识点。
它在细胞内扮演着多种不可取代的角色,起着结构支持、催化反应、调节信号传导等多种功能。
首先,蛋白质的组成单位是氨基酸。
氨基酸是一种有机化合物,由氨基基团(NH2)、羧基基团(COOH)和一个侧链基团组成。
通过连接成链状,氨基酸可以形成蛋白质的结构。
蛋白质的结构分为四个层次:一级、二级、三级和四级结构。
一级结构指的是蛋白质中氨基酸的线性排列顺序。
二级结构是指在一级结构基础上,氨基酸通过氢键形成α-螺旋和β-折叠的稳定结构。
三级结构是指蛋白质进一步通过各种相互作用形成的三维空间结构。
四级结构是指由两个或更多蛋白质亚基相互组装形成的复合物结构。
蛋白质的功能多种多样。
首先,它可以提供细胞和组织的结构支持,例如胶原蛋白是皮肤、骨骼等的主要组成物质。
其次,蛋白质还可以催化生物体内的化学反应,如酶就是一种特殊的蛋白质,能够加速生化反应的进行。
此外,蛋白质还参与信号传导和调节细胞活动,例如激素就是一类能够调节生理活动的蛋白质。
蛋白质的合成过程称为蛋白质合成。
在细胞内,蛋白质的合成是由核糖体进行的。
它包括转录和翻译两个阶段。
转录过程中,DNA的信息通过RNA的复制转录成为mRNA(信使RNA)。
翻译过程中,mRNA被核糖体识别,通过tRNA(转运RNA)带来的氨基酸依次连接成链状,形成蛋白质的一级结构。
总结起来,蛋白质是生物体内重要的有机化合物,具有多种功能,包括结构支持、催化反应和调节信号传导等。
它由氨基酸组成,通过一级、二级、三级和四级结构形成。
蛋白质的合成是由核糖体通过转录和翻译两个阶段完成的。
了解蛋白质的基本知识,对于理解生物体的结构和功能具有重要意义。


沉淀法分离纯化蛋白质综述摘要:蛋白质分离纯化是用生物工程下游技术从混合物之当中分离纯化出所需要得目的蛋白质的方法,是当代生物产业当中的核心技术。
分离纯化蛋白质的方法有沉淀法、电泳法、透析法、层析法及高速离心法。
根据蛋白质的溶解性质,利用沉淀法对其分离纯化方式进行综述。
关键词:蛋白质沉淀法盐析法有机溶剂沉淀法等电点沉淀法蛋白质是生命的物质基础,没有蛋白质就没有生命。
蛋白质具有巨大的商业价值,广泛应用于医药、食品、食品添加剂、纺织、制革、工业催化剂等领域。
从生物材料中分离制备蛋白质,研究其结构与功能,对于了解生命活动的规律,阐明生命现象的本质有重大意义。
而蛋白质分离纯化是当代生物产业当中的核心技术,该技术难度、成本均高。
根据蛋白质的酸碱性质、分子大小与形状、溶解性质及其与配体亲和性等性质可对蛋白质进行分离纯化。
沉淀法也称溶解度法。
其纯化生命大分子物质的基本原理是根据各种物质的结构差异性来改变溶液的某些性质,进而导致有效成分的溶解度发生变化。
沉淀是溶液中的溶质由液相变成固相的过程。
在生物工业、有机化工偶那个专业、无机化工工业及实验室分析中是分离与纯化最常用的方法之一。
常用的蛋白质沉淀法有盐析法、有机溶剂沉淀法及等电点沉淀法,实际工作中常联合使用这三种沉淀法以达到较高的蛋白质分离提纯的效果。
1.盐析法蛋白质在高盐浓度下发生盐溶,这是因为当向蛋白质溶液中加入中性盐到一定浓度时,蛋白质表面电荷被大量中和,即亲水基团被大量中性盐离子所包围,水分子离开蛋白质的周围,暴露出疏水区域,疏水区域间的相互作用使蛋白质分子相互聚集而沉淀。
盐析的一般操作步骤是,选择一定浓度范围的盐溶液(如0-25%饱和度的硫酸铵)使部分杂质呈“盐析”状态从溶液中沉淀出来,经离心去除。
而目的的蛋白质呈盐溶状态,而从溶液中分离出来。
盐析的影响因素包括蛋白质浓度、溶液pH值及温度。
当蛋白质浓度较低时,发生盐析需要较高的离子浓度;当pH值为蛋白质的等电点时,蛋白质分子上的净电荷数为零,溶解度最小;较高的温度有利于盐析沉淀,但较高温度易使蛋白质变性和发生共沉作用。


生物化学蛋白质章节考点总结第三章蛋白质第一节蛋白质概论蛋白质是所有生物中非常重要的结构分子和功能分子,几乎所有的生命现象和生物功能都是蛋白质作用的结果,因此,蛋白质是现代生物技术,尤其是基因工程,蛋白质工程、酶工程等研究的重点和归宿点。
一、蛋白质的化学组成与分类1、元素组成碳 50% 氢7% 氧23% 氮16% 硫 0-3% 微量的磷、铁、铜、碘、锌、钼凯氏定氮:平均含氮16%,粗蛋白质含量=蛋白氮?6.252、氨基酸组成从化学结构上看,蛋白质是由20种L-型α氨基酸组成的长链分子。
3、分类(1)、按组成:简单蛋白:完全由氨基酸组成结合蛋白:除蛋白外还有非蛋白成分(辅基)详细分类,P 75 表 3-1,表 3-2。
(注意辅基的组成)。
(2)、按分子外形的对称程度:球状蛋白质:分子对称,外形接近球状,溶解度好,能结晶,大多数蛋白质属此类。
纤维状蛋白质:对称性差,分子类似细棒或纤维状。
(3)、功能分:酶、运输蛋白、营养和贮存蛋白、激素、受体蛋白、运动蛋白、结构蛋白、防御蛋白。
4、蛋白质在生物体内的分布含量(干重) 微生物 50-80%人体 45%一般细胞 50%种类大肠杆菌 3000种人体 10万种1012 生物界 10-10,二、蛋白质分子大小与分子量蛋白质是由20种基本aa组成的多聚物,aa数目由几个到成百上千个,分子量从几千到几千万。
一般情况下,少于50个aa的低分子量aa多聚物称为肽,寡肽或生物活性肽,有时也罕称多肽。
多于50个aa的称为蛋白质。
但有时也把含有一条肽链的蛋白质不严谨地称为多肽。
此时,多肽一词着重于结构意义,而蛋白质原则强调了其功能意义。
P 76 表3-3 (注意:单体蛋白、寡聚蛋白;残基数、肽链数。
)蛋白质分子量= aa数目*110对于任一给定的蛋白质,它的所有分子在氨基酸组成、顺序、肽链长度、分子量等方面都是相同的,均一性。
三、蛋白质分子的构象与结构层次蛋白质分子是由氨基酸首尾连接而成的共价多肽链,每一种天然蛋白质都有自己特有的空间结构,这种空间结构称为蛋白质的(天然)构象。

第1章蛋白质的结构与功能1.蛋白质:是由许多氨基酸通过肽键相连形成的高分子含氮化合物。
2.谷胱甘肽:是由谷氨酸、半胱氨酸和甘氨酸组成的三肽。
3.分子伴侣:通过提供一个保护环境从而加速蛋白质折叠成天然构象或形成四级结构。
4.亚基:有些蛋白质分子含有二条或多条多肽链,每一条多肽链都有完整的三级结构,称为蛋白质的亚基5.蛋白质一级结构:指在蛋白质分子从N-端至C-端的氨基酸排列顺序。
蛋白质二级结构:蛋白质分子中某一段肽链的局部空间结构,即该段肽链主链骨架原子的相对空间位置,并不涉及氨基酸残基侧链的构象。
蛋白质三级结构:整条肽链中全部氨基酸残基的相对空间位置,即肽链中所有原子在三维空间的排布位置。
蛋白质四级结构:蛋白质分子中各亚基的空间排布及亚基接触部位的布局和相互作用。
6.蛋白质的变性:在某些物理和化学因素作用下,其特定的空间构象被破坏,也即有序的空间结构变成无序的空间结构,从而导致其理化性质改变和生物活性的丧失。
蛋白质的复性:若蛋白质变性程度较轻,去除变性因素后,蛋白质仍可恢复或部分恢复其原有的构象和功能。
7肽键的形成方式及构成肽平面的六个原子。
答:肽键是由一个氨基酸的α-羧基与另一个氨基酸的α-氨基脱水缩合而形成的化学键。
6个原子Cα1、C、O、N、H、Cα2。
8.蛋白质的一、二、三、四级结构的结构决定因素和维持空间结构稳定的价键,答:正常人血红蛋白β亚基的第6位氨基酸是谷氨酸,而镰刀形贫血患者的血红蛋白中,谷氨酸变成了缬氨酸,即酸性氨基酸被中性氨基酸替代,仅此一个氨基酸之差,原是水溶性的血红蛋白,就聚集成丝,相互黏着,导致红细胞变形成为镰刀状而极易破碎,产生贫血。
10.血红蛋白的携氧机制。
答:①正协同效应;②变构效应;血红素与氧结合后,铁原子半径变小,就能进入卟啉环的小孔中,继而引起肽链位置的变动。
11.了解蛋白质的两性、紫外吸收、显色反应,熟悉电泳的原理。
答:蛋白质的两性:当蛋白质溶液处于某一pH时,蛋白质解离成正、负离子的趋势相等,即成为兼性离子,净电荷为零,此时溶液的pH称为蛋白质的等电点。
第二章蛋白质蛋白质(Protein)是最基本的生命物质之一,是细胞中含量最丰富、功能最多的生物大分子。
它参与动物、植物、微生物的几乎所有生命结构和生命过程,它在细胞结构、生物催化、物质运输、运动、防御、调控以及记忆、识别等各个方面起着极其重要的作用。
恩格斯<<自然辨证法>>:生命是蛋白体存在的方式无论在什么地方,只要我们遇到生命,我们就会发现生命是和某种蛋白体相联系的;并且无论在什么地方,只要我们遇到不处于解体过程的蛋白体,我们也无例外地发现生命。
一、元素组成:蛋白质主要含有C、H、O、N,有的还含有S、P等,蛋白质元素组成与糖、脂不同的是含有N,而且大多数蛋白质含N量相当接近,约为15—17%,平均为16%,所以在任何生物样品中,每克N的存在大约表示该样品含有100/16=6.25g蛋白质(蛋白质指数),因此,只要测定生物样品中的含N量,就能计算出蛋白质的大致含量。
例如测定100克面粉中含有2gN,说明100克面粉里含有2×6.25=13.25g蛋白质,面粉的蛋白质含量=13.5%。
三聚氰胺(英文名:Melamine),是一种三嗪类含氮杂环有机化合物,重要的氮杂环有机化工原料。
简称三胺,俗称蜜胺、蛋白精,又叫2 ,4 ,6-三氨基-1,3,5-三嗪、1,3,5-三嗪-2,4,6-三胺、2,4,6-三氨基脲、三聚氰酰胺、氰脲三酰胺。
它是白色单斜晶体,几乎无味,微溶于水。
不溶於丙酮、醚类、对身体有害,不可用於食品加工或食品添加物。
然而,近日青海、甘肃、吉林等省再现三聚氰胺超标奶粉,超标500余倍。
很可能是对尚未完全销毁的“三鹿问题奶粉”进行加工、销售。
二、蛋白质是高分子物质结构复杂,分子量大,一般都在一万道尔顿(D)以上,蛋白质可被酸、碱和蛋白酶催化水解,使蛋白质分子断裂,分子量逐步变小,最后水解成AA。
L -和L 或 D -α-氨基酸的混合物完全水解酸或碱催化水解几种蛋白酶催化水解部分水解得到多肽片段L-α-氨基酸的混合物蛋白质酸水解:在体外加5—10倍20%Hcl水解蛋白质24hr,即可使蛋白质水解成AA(举例:猪毛制备AA,胱aa、赖aa、精aa等)碱水解:毛发蛋白6molNaOH溶液中煮沸6hr 水解成AA酶水解在生物体内,蛋白质主要是在蛋白酶的催化下分解的,在水解过程中由于水解方法和条件不同,可以得到不同程度的降解物。
蛋白质是有机体中重要的生物大分子,可以在生物体内发挥多种功能。
蛋白质是由氨基酸组成的长链分子,通常由20种不同的氨基酸按照一定顺序组成。
蛋白质的结构和功能与氨基酸的种类和顺序密切相关。
蛋白质在生物体内发挥着多种功能,包括提供组织支持、参与代谢和能量生成、调节生理过程、承担转运和信号传导等功能。
蛋白质也是人体必需的营养素之一,人体需要摄入适量的蛋白质来保证正常的生理功能。
蛋白质在生物体内经历着不断的合成和降解过程,这种过程受到多种因素的影响,包括营养状态、生长发育阶段、疾病等。
蛋白质的合成和降解平衡是人体健康的重要保障。
一、实验目的1. 了解蛋白质的组成、结构及其生物功能;2. 掌握蛋白质的提取、纯化、鉴定和定量方法;3. 掌握蛋白质变性、复性等基本性质;4. 培养实验操作技能和科学思维。
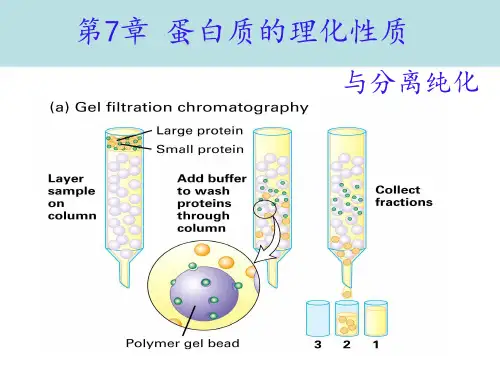
二、实验原理1. 蛋白质是由氨基酸通过肽键连接而成的生物大分子,具有多种生物功能,如催化、运输、结构支撑等;2. 蛋白质的提取方法有:酸法、碱法、盐析法等;3. 蛋白质的纯化方法有:凝胶过滤、离子交换、亲和层析等;4. 蛋白质的鉴定方法有:紫外光谱法、电泳法、质谱法等;5. 蛋白质的定量方法有:Lowry法、BCA法、 Bradford法等;6. 蛋白质变性是指蛋白质的空间结构发生改变,导致其生物功能丧失;蛋白质复性是指蛋白质在适当条件下恢复其生物功能。
三、实验材料与仪器1. 实验材料:鸡蛋清、硫酸铵、硫酸钠、SDS、Tris-HCl缓冲液、考马斯亮蓝G-250、电泳槽、电泳仪、紫外分光光度计等;2. 试剂:盐酸、氢氧化钠、氯化钠、硫酸铵、SDS、Tris-HCl缓冲液、考马斯亮蓝G-250等;3. 仪器:高速离心机、分析天平、电泳槽、电泳仪、紫外分光光度计等。
四、实验方法与步骤1. 蛋白质提取:取鸡蛋清,加入适量盐酸或氢氧化钠,搅拌,然后加入硫酸铵,使蛋白质沉淀,离心,收集沉淀;2. 蛋白质纯化:将沉淀溶解于Tris-HCl缓冲液,加入SDS,进行SDS-PAGE电泳,分离蛋白质;3. 蛋白质鉴定:将电泳后的蛋白质条带用考马斯亮蓝G-250染色,观察颜色变化;4. 蛋白质定量:将电泳后的蛋白质条带用紫外分光光度计测定其吸光度,计算蛋白质浓度;5. 蛋白质变性:将蛋白质溶液加热至100℃,观察蛋白质的沉淀现象;6. 蛋白质复性:将变性的蛋白质溶液冷却至室温,观察蛋白质的溶解现象。
五、实验结果与分析1. 蛋白质提取:成功提取了鸡蛋清中的蛋白质,沉淀量较多;2. 蛋白质纯化:SDS-PAGE电泳结果显示,蛋白质在凝胶上分离良好,纯度较高;3. 蛋白质鉴定:考马斯亮蓝G-250染色结果显示,蛋白质条带呈现蓝色,表明蛋白质存在;4. 蛋白质定量:紫外分光光度计测定结果显示,蛋白质浓度为0.5mg/mL;5. 蛋白质变性:加热至100℃后,蛋白质发生沉淀,表明蛋白质变性;6. 蛋白质复性:冷却至室温后,蛋白质溶解,表明蛋白质复性。
摘要:蛋白质组学是后基因组时代的新兴学科,是当今生命科学领域新的增长点,本文就蛋白质组学中的分离和鉴定技术包括双向凝胶电泳、色谱和质谱等技术近几年的发展状况及最新研究进展进行综述。
关键词:蛋白质组学;双向凝胶电泳;色谱;质谱;生物信息学Abstract:Proteomics which is the new discipline in the time of the post-genomics develops rapidly in the life science.The present paper has documented the current situation and new development of the techniques of separation and identification in this area,including 2·dimensional gel- electro·phoresis,chromatography an d mass spectrometry.Key words:Proteomics;2-Dimensional gel electrophoresis;Chromatography;Mass spectrometry;Bioinformatics1、概念及相关内容随着人类基因组测序计划的完成,生命科学的重心开始转移到对基因的功能性产物即蛋白质的研究,并产生了一门新的学科———蛋白质组学(proteomics) 。
“蛋白质组(proteome) ”一词是1995 年由澳大利亚科学家Marc Wilkins 和Keith Wil2liams[ 1 ] 最早提出的,是由蛋白质(protein) 和基因组(genome) 派生而来。
被定义为“一个细胞或组织所表达的所有蛋白质产物或某一特定时期内所表达的所有蛋白质产物”。
蛋白质组研究与以往的蛋白质化学研究不同,它着重于全面性和整体性,研究的对象不是单一或少数的蛋白质,而是从细胞整体水平上对蛋白质的结构和功能进行研究,包括蛋白质在细胞内的表达水平、位置、功能和调节以及翻译后的修饰、剪接等加工信息。
蛋白质组研究使人们对生命系统与活动分子机制的认识由间接的基因、核酸层次深入到生命的直接执行者———蛋白质水平。
蛋白质组研究已成为后基因组时代的主要任务[ 2,3 ]。
2、蛋白质组研究的主要技术相对于基因组的研究,蛋白质组的研究相对滞后,主要原因是缺乏像基因组研究那样成熟的技术。
当前蛋白质组研究的主要技术可分为两大类,一类是蛋白质组的分离技术,包括双向电泳、双向高效柱层析等;另一类是蛋白质组的鉴定技术,包括质谱技术、生物信息技术等。
2.1 蛋白质组的分离技术2.11 双向凝胶电泳技术(2-DE)双向凝胶电泳技术是目前应用最为广泛的研究蛋白质组学的方法之一。
这项技术是O′far2rell 、Klose 和Scheele 等[4 ,5 ]于1975发明的。
双向凝胶电泳技术利用蛋白质的等电点和分子量差别将各种蛋白质区分开来。
虽然二维凝胶电泳难以辨别低丰度蛋白,对操作要求也较高,但其通量高、分辨率和重复性好以及可与质谱联用的特点,使其成为目前最流行、可靠的蛋白质组研究手段。
双向凝胶电泳技术及质谱基础的蛋白质组学研究程序为样品制备→等电聚焦→聚丙烯酰胺凝胶电泳→凝胶染色→挖取感兴趣的蛋白质点→胶内酶切→质谱分析确定肽指纹图谱或部分氨基酸序列→利用数据库确定蛋白。
蛋白质组研究要求有高分辨率的蛋白质分离及准确、灵敏的质谱鉴定技术。
凝胶电泳中蛋白质的着色不仅影响蛋白质分离的分辨率,同时也影响后续的质谱鉴定。
蛋白质的染色可分为有机试剂染色、银染、荧光染色及同位素显色四类。
Unlu 等提出了一种荧光差异显示双向电泳(F-2D-DIGE)的定量蛋白质组学分析方法。
差异凝胶电泳(DIGE)是对2-DE 在技术上的改进,结合了多重荧光分析的方法,在同一块胶上共同分离多个分别由不同荧光标记的样品,并第一次引入了内标的概念。
两种样品中的蛋白质采用不同的荧光标记后混合,进行2-DE,用来检测蛋白质在两种样品中表达情况,极大地提高了结果的准确性、可靠性和可重复性。
在DIGE技术中,每个蛋白点都有它自己的内标,并且软件可全自动根据每个蛋白点的内标对其表达量进行校准,保证所检测到的蛋白丰度变化是真实的。
DIGE 技术已经在各种样品中得到应用。
2.12 双向高效柱层析其基本原理是先进行一次分子筛柱层析,按蛋白质分子量大小进行第一次分离,从柱上流出的蛋白峰自动进入第二向层析进一步分离,第二向层析通常是利用蛋白质表面疏水性质进行的反相柱层析。
和双向电泳相比,双向高效柱层析的优点是可以适当放大,分离得到较多的蛋白质以供鉴定;可以和质谱技术联用实现蛋白质分析技术的自动化,同时流出的蛋白峰直接进入质谱进行鉴定,可减少印迹的步骤和因此引起的缺点。
2.13 色谱分离技术近年来,色谱技术的发展为蛋白质和多肽或亚基的分离分析提供了新的手段。
色谱技术是利用各种物质在固定相和流动相之间不同的分配系数,使其在相对运动着的两相间经反复多次分配,以不同速度移动,从而获得分离的方法。
按两相状态来分类,有气相色谱法(gas chrom- atography,GC)和液相色谱法(1iquid chromatography,LC)两种,而其中的LC是蛋白质组学非凝胶蛋白分离技术中最常用的方法。
单一的液相分离技术常不能满足复杂蛋白质复合物分离的需要,多维液相分离系统则在技术上弥补了单一的液相分离技术的不足。
多维液相分离系统是两种或两种以上具有不同分离原理特性的液相分离方法的优化和组合,它有效地提高了系统对样本的分辨率和峰容量。
此外,多维液相分离系统还具有快速、高通量、自动化、重复性好等优点[6]。
常见的多维液相分离系统有二维液相(two.Dimensio-nal liquid chromatography,2D—LC)、二维毛细管(two·dimensional capillary eleetrophoresis.2D—CE)、液相色谱一毛细管电泳(LC —CE)等。
色谱技术除了直接对蛋白分离分析外,常与质谱技术联用。
如Opiteck等[7]。
首次报道多维色谱整合质谱技术(MS)分析蛋白质混合物,Washurn等[8]在多维LC—MS/MS的基础上,提出MudPIT(multidimensional protein identification technology)方法,成功分离和鉴定了酵母中1484种蛋白质,这其中还包括一些低丰度的调控性蛋白激酶。
Nielsen等[9]应用LC—MS/MS技术成功分离鉴定了海马组织中的1 685种蛋白质。
毛细管电泳(CE)作为一种最新的色谱分离技术,将经典电泳技术与现代微柱分离有机结合,目前已广泛应用于蛋白质的高效分离分析。
与经典电泳相比,CE由于其侧面截面积大,散热快,能克服由于焦耳热引起的谱带展宽,且可承受高电压,因此分离效率提高,柱效可达几百万乃至几千万理论塔板数/m以上[10]。
CE在蛋白质组分析中用于蛋白质肽图的建立与蛋白质鉴定、物化常数分析、蛋白质动力学研究、样品定性定量检测与微量制备等方面。
CE在蛋白质组分析中用于蛋白质肽图的建立与蛋白质鉴定、物化常数分析、蛋白质动力学研究、样品定性定量检测与微量制备等方面。
CE有很多灵敏的检测技术,如紫外检测、荧光检测、化学发光检测等。
应用于蛋白质组研究中的CE技术主要包括毛细管区带电泳(capilary zone electro—phoresis,CZE)、毛细管等电聚焦电泳(capilary iso.eletriefocusing,CIEF)、毛细管凝胶电泳(capilarygel eleetrophoresis,CGE)和胶束电动毛细管层析(mieelar eleetrokinetie eleetrophor- esis ehromatogra·phy,MECC)等。
2.14 同位素包被亲和标记(ICAT)ICAT是用同位素标记帮助蛋白质组定量研究的技术,基本原理是将某一状态的蛋白混合物标记后作为内标准,与另一状态的蛋白混合物混合酶解,消化后的复杂多肽混合物通过亲和标签用生物素亲和层析柱将标记的多肽分离,最后分离的样品可以用LC-MC分析或用LC-MC/MC直接由蛋白序列信息来确定蛋白。
这一技术克服了2DGE 的缺点,能全自动化,可以用于高通量蛋白质组"可以精确检测疏水的膜蛋白、PI和分子量偏大或偏小的蛋白,同时还能够测定其中蛋白质序列[11]使它的分析范围远大于2DEG。
有人用这一方法精确鉴定了体外和自然状态下分化的人HL60细胞微粒体片段中491个蛋白及其相对量,其中大部分是膜或膜相关蛋白。
ICAT在定量及差异表达检测上有巨大的优势,但也面临一些问题。
ICAT最大的挑战在于样品高度复杂,质谱分析获得数据的能力与这种复杂性相比显得不足。
但随着ICAT技术的不断进步与完善,它仍将是蛋白质组差异表达研究中的主要技术之一。
2.2蛋白质组鉴定技术2.21质谱技术其原理是对2DE所产生的上千个蛋白用传统的方法如Edman降解法等进行分析将是一个很艰巨的任务。
质谱技术的发展解决了这一难题。
它需要三个步骤,首先通过离子化装置将分子转化为气态离子,接着通过质谱分析器按照质荷比(m/z)的不同进行分离,最后转化到离子检测装置[ 12 ]。
目前,用来分析蛋白质和肽的样品离子化技术主要包括基质辅助激光解吸收离子化质谱(MALDI)和电子喷射离子化质谱(ESI)。
MALDI通常与飞行时间质谱(TOF)相结合。
TOF主要用来测量分析物飞过固定的路径所需的时间。
另一种鉴别蛋白质的方法是串联质谱(MS/MS)。
在这种情况下,经质谱分析的肽段进一步断裂并再次进行质谱分析,这样可得到肽序列的部分信息。
质谱技术能清楚地鉴定蛋白质并能准确地测量肽和蛋白质的分子量、氨基酸序列及翻译后的修饰。
目前MS/MS是唯一能够迅速测序N 末端封闭或共价修饰肽段的方法[1 ]。
质谱技术很灵活,能与多种蛋白分离、捕获技术联用,对普通的缓冲液成分相对耐受[15],能快速鉴定大量蛋白质点,而且很灵敏[14],在一些情况下,仅需10-15 fmol的蛋白[14,16,13], 这在只能得到极少量蛋白的情况下鉴别蛋白是很有用的。
在实际工作中可将几种技术结合应用,如串联质谱与Edeman微测序技术相结合[15],MALDI质谱与纳米电子喷射质谱相结合,这些技术相互互补,为分析2DE所分离的大量蛋白质提供了有效的手段。
2.22表面等离子共振技术(SPR)SPR是研究蛋白质相互作用的新技术,其原理是利用平面单色偏振光与金属膜内表面电子发生等离子共振时反射光强度最小时的入射角SPR角[17]。