6-滴定分析的计算
- 格式:doc
- 大小:57.00 KB
- 文档页数:13

六步法完成滴定分析计算
滴定分析是一种常见的化学分析方法,用于确定溶液中某种物质的浓度。
滴定分析的计算通常使用六步法,下面将详细介绍这六个步骤。
第一步:计算滴定体积
滴定体积是指溶液从初始颜色发生变化到终点颜色的体积差。
从滴定瓶中取一定体积的溶液,用滴定管逐滴加入到滴定瓶中,直到颜色发生变化。
记录下加入溶液的体积,这个体积即为滴定体积。
第二步:计算滴定剂的浓度
滴定剂通常是一种已知浓度的溶液,可以通过加权平均法来计算滴定剂的浓度。
根据滴定剂的化学方程式,确定滴定剂和待测物的化学计量关系,通过称量定量的实验进行测定。
第三步:计算滴定反应的化学计量因子
滴定反应的化学计量因子是指滴定剂与待测物的化学计量关系中被滴定剂滴定的摩尔比例。
通过计算滴定剂和待测物的化学方程式中的配比系数,可以得到化学计量因子。
第六步:计算滴定分析的结果
根据滴定分析的目的,可以根据待测物的浓度和体积来计算滴定分析的结果。
如果要计算待测物的质量,可以将待测物的浓度与滴定体积相乘;如果要计算待测物的摩尔数,可以将待测物的浓度与滴定体积相乘,再除以摩尔浓度。
总结:
滴定分析计算的六个步骤是:计算滴定体积、计算滴定剂的浓度、计算滴定反应的化学计量因子、计算滴定反应的摩尔浓度、计算待测物的浓度和计算滴定分析的结果。
通过这六个步骤,可以准确计算出滴定分析的结果,为化学分析提供重要的数据。


六步法完成滴定分析计算滴定分析是化学分析中的一种重要方法,用于确定物质的浓度或含量。
在滴定分析过程中,我们需要进行一系列的计算来确定样品的浓度。
下面将介绍滴定分析计算的六个步骤。
第一步:计算待测物质的摩尔质量。
在滴定分析中,我们通常需要知道待测物质的摩尔质量。
摩尔质量可以通过化学式中各元素的摩尔质量相加得到。
如果待测物质为NaCl,那么其摩尔质量为Na的摩尔质量加上Cl的摩尔质量。
第二步:计算滴定试剂的标准溶液浓度。
滴定试剂是用来与待测物质反应的溶液。
我们需要知道滴定试剂的浓度才能进行后续的计算。
滴定试剂的浓度可以通过滴定试剂的摩尔质量除以所用体积得到。
如果滴定试剂是NaOH,那么其摩尔质量为Na的摩尔质量加上O的摩尔质量加上H的摩尔质量。
第三步:计算待测物质的摩尔量。
根据滴定反应的化学方程式,我们可以知道滴定试剂与待测物质的反应比例。
通过滴定试剂的用量,我们可以计算出待测物质的摩尔量。
如果滴定反应式为2NaOH + H2SO4 → Na2SO4 + 2H2O,我们可以知道滴定试剂NaOH的摩尔量是待测物质H2SO4的两倍。
第四步:计算待测物质的浓度。
待测物质的浓度可以通过待测物质的摩尔量除以所用体积得到。
如果样品体积为50 mL,待测物质的摩尔量为0.02 mol,那么待测物质的浓度为0.02 mol / 0.05 L = 0.4 mol/L。
通过以上六个步骤的计算,我们可以得到滴定分析的结果,即待测物质的浓度或含量。
在进行滴定分析时,需要注意精确称量和取样,严格控制反应条件和滴定终点的判定,以获得准确可靠的结果。



六步法完成滴定分析计算
滴定分析是一种常用的化学分析方法,通过向待测溶液中滴加一种已知浓度的滴定溶液,通过滴加到相应反应终点的体现,来确定待测溶液中待测物质的浓度。
滴定分析计算的关键是通过滴定实验数据计算出待测溶液中待测物质的浓度。
滴定分析计算可采用六步法进行。
下面将详细介绍各个步骤的具体计算方法。
第一步:计算滴定溶液的浓度
滴定溶液是滴定中的溶剂,滴定溶液浓度的计算能够帮助确定待测物质的浓度。
滴定溶液的浓度C1的计算公式为:
C1 = n1/V1
n1为滴定溶液中溶质的物质量,单位为 mol;V1为滴定溶液的体积,单位为升。
第三步:计算滴定液的体积和摩尔数
滴定液是已知浓度的溶液,它与待测溶液发生反应,从而确定待测溶液中待测物质的浓度。
在滴定实验中,滴定液的体积和摩尔数需要事先确定。
滴定液体积V2的计算可以通过实验装置中已知的初始体积和最终体积来计算。
滴定液摩尔数n2的计算可以由滴定液中溶质的质量和摩尔质量来计算。
第四步:计算滴定反应的反应方程式中的物质的摩尔比
滴定反应方程式中物质的摩尔比可以由已知的反应方程式以及待测物质和滴定液中物质的摩尔数来计算。
第六步:根据滴定实验数据,计算出待测物质的浓度
在滴定实验中,通过记录滴定液滴加到达终点时的体积,可以计算出待测物质的浓度。
通过以上六个步骤的计算,可以得出待测溶液中待测物质的浓度。
滴定分析计算的过程需要结合实际实验数据进行,针对不同的滴定反应和实验条件,计算方法可能会有所差异。
不过,无论是哪种滴定分析计算方法,在计算过程中需要注意数据的精确性和计算的准确性,以保证滴定分析结果的可靠性。

滴定分析法一、溶液浓度的表示方法1、物质的量浓度指在单位体积的溶液中所含溶质的物质的量,以符号c表示。
其公式为:B为溶质的化学式;V为B溶液的体积——L;n B为溶质B的物质的量——mol;c B为B物质的物质的量浓度——mol/L;n B物质的物质的量——mol;m B为B物质的质量——g;M B为B物质的摩尔质量——g/mol;所以,C B又可这样求得2、质量分数B的质量分数=B的质量/混合物的质量质量分数表示:mg/g、μg/g、ng/g。
3、质量浓度B的质量浓度=B的质量/混合物的体积单位为g/L或mg/L、μg/L、ng/L。
4、体积分数B的体积分数=混合前B的体积/混合物的体积5、滴定度每mL标准溶液A相当于被测物质B的克数(TA/B,g或 mg)例如:THCl/NaOH = 0.004000 g/mL1mL HCl恰能与0.004000 g NaOH完全作用如果在滴定中消耗该K2Cr2O7标准溶液19.43mL,则被滴定溶液中铁的质量为多少克?解:m Fe=0.005000×19.43=0.009715g二、滴定分析基础1.基本概念:滴定剂(标准溶液):已知准确浓度的试剂溶液。
滴定:将滴定剂通过滴定管逐滴加入被测溶液中进行测定的过程。
化学计量点(sp):滴定剂与被测物按化学反应的计量关系正好完全反应的一点。
指示剂:通过颜色的改变来指示化学计量点到达的试剂。
一般有两种不同颜色的存在型体。
滴定终点(ep):指示剂改变颜色(滴定停止)的一点。
滴定误差(TE):滴定终点与化学计量点不完全一致造成的误差。
2.滴定分析法分类·酸碱滴定法·配位滴定法·氧化-还原滴定法·沉淀滴定法·非水滴定法3.滴定曲线和滴定突跃滴定曲线(titration curve):以作图的方式描述滴定过程中组分浓度的变化。
横坐标—加入滴定剂的体积(或滴定百分数)纵坐标—溶液组分浓度或浓度相关的某种参数滴定曲线的特点:1.曲线的起点决定于被滴定物质的性质和浓度。

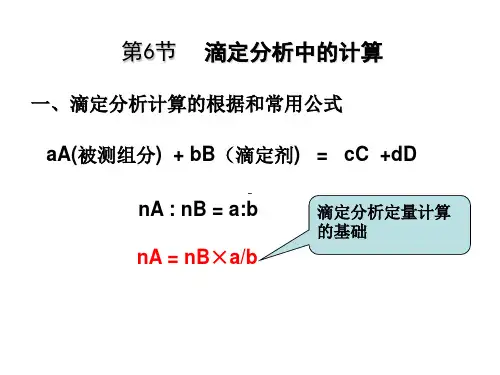

滴定分析中的计算一、滴定分析计算的依据设标准溶液(滴定剂)中的溶质B与被滴定物质(被测组分)A之间的化学反应为:aA + bB = cC + dD反应定量完成后达到计量点时,b mol的B物质恰与a mol的A物质完全作用,生成了c mol的C物质和d mol的D物质。
完全反应反应前和反应后物质的量相等。
溶液稀释前后,其中溶质的物质的量不会改变C浓V浓=C稀V稀二、滴定分析法计算实例1.标准溶液的配制(直接法)、稀释与增浓的计算基本公式:例一已知浓盐酸的密度为1.19g.mL-1,其中HCl含量约为37%。
计算:(1) 每升浓盐酸中所含HCl的物质的量和浓盐酸的浓度。
(2) 欲配制浓度为0.10mol. L-1的稀盐酸5000mL,需量取上述浓盐酸多少毫升?已知:M HCl=36.46 g.mol-1C 浓⨯V 浓=C 稀⨯V 稀12⨯ V 浓=0.10⨯5000V 浓=41,67ml例2:现有HCl 液(0.09760mol.L -1)4800mL, 欲使其浓度为0.1000mol.L -1,问应加入HCl 液(0.5000mol.L -1)多少?(C 原⨯4800)+0.5000⨯V 加=0.1000⨯(4800+V 加)V 加=28.8ml2. 标定溶液浓度的有关计算基本公式:例1:用Na2CO3标定用25mL 左右滴定液,问应称取基准Na2CO3多少克?已知: M (Na2CO3)=106.02/2=53.01g.mol-12HCl + Na2CO3 = 2 NaCl +CO2 +H2OC HCl⨯V/1000=m/M(Na2CO3)称取邻苯二甲酸氢钾(KHP)基准物质0.4925克,标定NaOH溶液,终点时用去NaOH溶液23.50mL,求NaOH溶液的浓度。
M例2:要求在标定时用去0.10 mol.L-1 NaOH溶液20~25mL,问应称取基准试剂邻苯二甲酸氢钾(KHP)多少克?,如果改用草酸(H2C2O4.2H2O)作基准物质,又应称取多少克?从计算结果能看出什么结论?已知:M(KHP)=204.22 g.mol-1,M(H2C2O4.2H2O)=126.07 /2=63.035g.mol-1解:以邻苯二甲酸氢钾(KHP)为基准物质,其滴定反应为:KHP + NaOH = KNaP + H2O即C NaOH⨯V/1000=m/M(KHP)M= C NaOH⨯V ⨯M(KHP)/1000=0.10⨯20⨯204.22=0.408 V=20 m KHP=0.10 ⨯20⨯204.22 /1000=0.40gV=25 m KHP=0.10 ⨯25⨯204.22/1000 =0.50g因此,以邻苯二甲酸氢钾(KHP)的称量范围为0.40~0.50g若改用草酸(H2C2O4.2H2O)为基准物质,此时的滴定反应为:H2C2O4 + 2NaOH = Na2C2O4 + 2H2O即V=20 m H2C2O4.2H2O =.10 ⨯20⨯126.07/2000=0.13gV=25 m H2C2O4.2H2O =0.10 ⨯25⨯126.07/21000=0.16g因此,草酸(H2C2O4.2H2O)的称量范围为0. 13~0.16g结论由于邻苯二甲酸氢钾(KHP)的摩尔质量较大,草酸(H2C2O4.2H2O)的摩尔质量较小,且又是二元酸,所以在标定同一浓度的NaOH溶液时,后者的称量范围要小得多。
药物分析含量测定结果的计算原料药 以实际百分含量表示:片剂 片剂的含量测定结果常用含量占标示量的百分比表示:标示量%═%100⨯标示量每片的实际含量═%100⨯⨯标示量平均片重取样量测得量m m注射液 注射液的含量测定结果一般用实测浓度占标示浓度的百分比表示:1. 原料药含量测定结果的计算 (1)滴定分析法① 直接滴定法: (无空白)T ——滴定度(g/mL),每毫升滴定液相当于被测组分的克数V ——滴定时,供试品消耗滴定液的体积(mL ) F ——浓度校正因子W ——供试品的质量 (g)例1:P 93 例题例2:非那西丁含量测定:精密称取本品0.3630g 加稀盐酸回流1小时后,放冷,用亚硝酸钠液(0.1010m o l/L )滴定,用去20.00mL 。
每1mL 亚硝酸钠液(0.1mol/L )相当于17.92mg 的C 10H13O 2N 。
计算非那西丁的含量为(E ) A. 95.55% B. 96.55% C. 97.55% D. 98.55% E. 99.72%%100⨯=WTVF百分含量%72.99%1003630.0101.01010.000.2092.17%3=⨯⨯⨯⨯=-非那西丁%100⨯=取样量测得量百分含量m m %100%⨯=标示实测标示量c c 标准实际c c F =② 剩余滴定法 (做空白)V 0——滴定时,空白消耗滴定液的体积(m L ) 其他符号的意义同直接滴定法含量计算公式例1:P 94 例题例2:精密称取青霉素钾供试品0.4021g ,按药典规定用剩余碱量法测定含量。
先加入氢氧化钠液(0.1mol/L)25.00mL ,回滴时消0.1015m o l/L 的盐酸液14.20mL ,空白试验消耗0.1015m o l/L 的盐酸液24.68mL 。
求供试品的含量,每1mL 氢氧化钠液(0.1mol/L)相当于37.25mg 的青霉素钾。
.6 滴定分析的计算4.6.1 原料药含量测定结果计算原料药含量一般用百分含量(g/g)来表示。
例如:对氨基水杨酸钠含量测定取样品约0.4g,精密称定,用水18ml和盐酸溶液(1→2)15ml溶解,用亚硝酸钠标准液(0.1mol/L)滴定,每1ml的亚硝酸钠标准液(0.1mol/L)相当于17.51mg 的无水对氨基水杨酸钠。
假设取样量0.4326g,亚硝酸钠标准液浓度为0.1034mol/L,终点时消耗19.80ml,计算其含量(干燥失重17.0%)。
实验测得的量含量=───────×100%供试品量已知,实验测得的量=V标准FT 供试品的量=W/N其中 V标准为终点时消耗标准液的体积(ml)W 为称样量F 为浓度因数T 为滴定度N 为稀释倍数稀释倍数的意义为:第一次取样量为最后测定用供试品量的倍数。
原料药中一般为1。
原料药含量计算公式V标准×F×T×N V标准×C实际×T×N含量=────────×100%= ──────────×100% W W×C理论一般原料药含量是以干品计算,则原料药含量计算公式为:V 标准×C实际×T×N含量=─────────────────×100%W×C理论×(1-干燥失重百分数)19.80×0.1032×0.01751×1则对氨基水杨酸钠含量=─────────────×100%=99.6%。
0.4326×0.1×(1-17.0%)4.6.2 液体制剂的含量测定结果计算液体制剂含量一般以相当于标示量的百分数表示。
标示量对固体制剂,即每一个单元制剂中所含药品的规定量;对液体制剂,最常用的表示方法为:每1ml中含有药物的规定量,或者本制剂的规定浓度。
例如:氯化钾注射液,规格为10ml:1g,它的标示量为0.1g或10%。
其含量测定方法;精密量取本品10ml,置100ml量瓶中,加水至刻度,摇匀,精密量取10ml,加水40ml,加糊精溶液(1→50)5ml,与指示剂5~8滴,用硝酸银标准液(0.1mol/L)滴定即得。
每1ml的硝酸银标准液(0.1mol/L)相当于7.455mg的氯化钾。
假设硝酸银标准液的浓度为0.09830mol/L,终点时消耗13.30ml,计算含量。
实验测得的量含量=───────────────×100%供试品按标示量计算的理论量已知:实验测得的量=V标准FT供试品按标示量计算的理论量=V样品W标示量/NV标准×F×T×N则含量=─────────────×100%V样品×W标示量V标准×C实际×T×N含量=─────────────×100%V样品×C理论×W标示量其中W标示量为供试品的标示量,其余同原料药计算公式。
则氯化钾注射液含量为:13.30×0.09830×0.007455×100/10含量=──────────────────×100%=97.5%。
10×0.1×0.14.6.3 片剂、胶囊剂等含量测定结果计算(相当于标示量的百分数)例如安乃近片含量测定:取本品10片,精密称定,研细,精密称出适量,加规定的试剂溶解后用碘标准液(0.05mol/L)滴定即得。
每1ml的碘标准液(0.05mol/L)相当于17.57mg的安乃近。
假设10片重5.3042g,精密称出细粉0.2842g,本品规格为0.5g,所用碘标准液浓度为0.05018mol/L,终点时消耗15.10ml,计算含量(以相当于标示量的百分数表示)。
实验测得的量含量=───────────────×100%供试品按标示量计算的理论量已知:实验测得的量=V标准FTW 样品 W标示量供试品按标示量计算的理论量=──×── W平均NV标准×F×T×W平均×N则含量=──────────×100%W样品×W标示量V标准×C实际×T×W平均×N含量=─────────────×100%W样品×C理论×W标示量其中 W样品:精密称出的样品量(g)W平均:被测样品每一单元制剂的平均重量(g)。
则安乃近片含量为:15.10×0.05018×0.01757×5.3042/10×1含量=───────────────────×100%=99.39%。
0.2842×0.05×0.54.7 滴定分析应用与示例4.7.1 酸碱滴定法例1 直接滴定P166阿司匹林原料含量测定:精密称定本品0.4008g,加中性乙醇(对酚酞指示液显中性)20ml溶解后,加酚酞指示液3滴,用氢氧化钠滴定液(0.1mol/L)滴定。
每1ml 氢氧化钠滴定液(0.1mol/L)相当于18.02mg的阿司匹林。
含阿司匹林不得少于99.5%。
假设氢氧化钠滴定液浓度为0.1040 mol/L,样品消耗氢氧化钠滴定液的体积为21.35ml。
测得量 V标准×C实际×T×N含量=───────×100%=───────────×100%供试量 C理论×W21.35×0.1040×0.01802×1=───────────────×100%=99.8%0.1×0.4008例2剩余滴定(用空白实验校正) P167阿司匹林片规格0.5g,含阿司匹林应为标示量的95.0%~105.0%。
含量测定:取本品10片,精密称定,重量为5.4163g,研细,精密称取细粉0.3266g,(相当于阿司匹林0.3g),置锥形瓶中,加中性乙醇(对酚酞指示液显中性)20ml,振摇使阿司匹林溶解,加酚酞指示液3滴,滴加氢氧化钠滴定液(0.1mol/L)至溶液显粉红色,再精密加氢氧化钠滴定液(0.1mol/L)40ml,置水浴上加热15分钟并时时振摇,迅速放冷至室温,用硫酸滴定液(0.05mol/L)滴定,并将滴定的结果用空白试验校正。
每1ml 氢氧化钠滴定液(0.1mol/L)相当于18.02mg的阿司匹林。
假设氢氧化钠滴定液浓度为0.1040mol/L,硫酸滴定液浓度为0.05018mol/L,空白消耗硫酸滴定液的体积为40.08ml,样品消耗硫酸滴定液的体积为23.52ml。
单位制剂测得量含量=─────────×100%单位制剂理论量(V空白-V样品)×C硫酸实际×2×T氢氧化钠×W平均×N=────────────────────×100%C氢氧化钠理论×W样品×W标示量(40.08-23.52)×0.05018×2×0.01802×5.4163/10×1=───────────────────────×100%0.1×0.3266×0.5=99.3%。
有些药物具有酸性或碱性,但难溶于水,可先加入定量且过量的酸或碱标准溶液,待反应完全后,再用碱或酸标准溶液回滴。
例3氢氧化铝凝胶的制酸力检查精密称定样品1.5036g,置250ml具塞锥形瓶中,精密加盐酸滴定液(0.1mol/L)50ml,密塞,在37℃不断振摇1小时,加溴酚蓝指示液6~8滴,用氢氧化钠滴定液(0.1mol/L)滴定至溶液显蓝色。
每1g样品消耗盐酸滴定液(0.1mol/L)应为12.5~25.0ml。
假设盐酸滴定液浓度为0.1008mol/L,氢氧化钠滴定液浓度为0.1034mol/L,样品消耗氢氧化钠滴定液体积为20.25ml,计算制酸力为:0.1008 ×50-0.1034×20.25────────────=19.6(ml)0.1×1.5036例4 非水滴定 P174中国药典2005年版中原料药“盐酸麻黄碱”的含量测定。
测定方法:精密称定本品(1)0.1516g, (2)0.1506g,加冰醋酸10ml,加热溶解后,加醋酸汞试液4ml与结晶紫指示液1滴,用高氯酸滴定液(0.1mol/L)滴定至溶液显翠绿色,并将滴定的结果用空白实验校正。
每1ml高氯酸滴定液(0.1mol/L)相当于20.17mg的盐酸麻黄碱。
规定:按干燥品计算,含盐酸麻黄碱不得少于99.0%。
测定温度为24℃,高氯酸滴定液的浓度为0.1022mol/L(标定温度为20℃),空白消耗高氯酸滴定液的体积为0.02ml,样品消耗高氯酸滴定液的体积为(1)7.32ml,(2)7.30ml,干燥失重0.2%。
高氯酸滴定液的校正浓度为:0.1022Ct=──────────=0.1018(mol/L)1+0.0011×(24-20)(V样品-V空白)×Ct×T含量=────────────────×100%C理论×W×(1-干燥失重)(7.32-0.02)×0.1018×0.02017第一份样品含量=──────────────×100%=99.07%0.1×0.1516×(1-0.2%)(7.30-0.02)×0.1018×0.02017第二份样品含量=───────────────×100%=99.45%0.1×0.1506×(1-0.2%)平均含量:99.3%, RD:0.2%。
4.7.2 沉淀滴定法例1 直接滴定 P181氯化铵片规格为0.3g,含氯化铵应为标示量的95.0%~105.0%。
取本品10片,精密称定,重量为3.8562g,研细,精密称定细粉0.1557g(约相当于氯化铵0.12g),加水50ml使氯化铵溶解,再加糊精溶液(1→50)5ml,荧光黄指示液8滴与碳酸钙0.10g,摇匀,用硝酸银滴定液(0.1mol/L)滴定。
每1ml 硝酸银滴定液(0.1mol/L)相当于5.349mg的氯化铵。
单位制剂测得量 V标准×C实际×T×W平均×N含量=────────×100%=───────────×100%单位制剂理论量 W样品×C理论×W标示量22.32×0.1018×0.005349×3.8562/10×1=────────────────────=100.3%0.1557 ×0.1×0.3例2:剩余滴定法(不用空白实验校正)P182 蓝皮书P 77胆茶碱片规格为0.1g,含胆茶碱应为标示量的94.0~106.0%。