辐射灭菌剂量设定
- 格式:ppt
- 大小:772.50 KB
- 文档页数:17

当在医疗器械上喷洒这些讨厌的细菌时,就需要找到正确的辐射剂量。
我们需要扩大设备的尺寸,找出它是由什么构成的——有些材料需要比其他材料更高的辐射剂量才能真正完成任务。
我们必须考虑如何使
用这个装置,以及涉及多大的风险。
设备靠身体组织或液体接近并且
个人化可能需要更大的辐射打击比那些只是挂在外边。
这在辐射足
够有效消毒和不把我们的医疗设备变成拥有超能力的微型超级英雄之间,是一个很好的平衡!
在知道是什么设备是什么制造的后,接下来要做的是做一些测试,看看它需要消毒多少辐射。
我们把设备的样本暴露在不同的辐射量之下然后检查它们是否干净这会帮助我们找到最低的辐射量来完成这项工作而不破坏设备。
这些试验的结果告诉我们用于消毒的辐射范围
必须进行彻底的剂量审计和核查,以确保医疗器械消毒中辐射剂量应
用的准确性和一致性。
这就需要执行严格的质量控制协议,以便始终
如一地监测和验证绝育手术期间施加的辐射剂量。
通过建立剂量审计
和核实程序,制造商可以保证绝育过程中的效能和遵守监管标准。
这
有助于维护绝育医疗器械的安全和有效性,同时增强保健提供者和病
人对绝育过程质量的信心。

ISO11137-2 医疗保健产品灭菌-辐射灭菌第二部分:灭菌剂量的确定目录: (1)引言 (3)1. 范围 (4)2. 引用标准 (4)3. 缩写、术语和定义 (4)3.1 缩写 (4)3.2 术语 (5)4 确定和保持剂量设定,剂量认证以及灭菌剂量审核中的产品族 (6)4.1 总则 (6)4.2 产品族的定义 (6)4.3 代表产品族实施验证剂量试验和灭菌剂量审核所指定的产品 (7)4.4 产品族的保持 (8)4.5 灭菌剂量的确定和灭菌剂量审核失败对产品族的影响 (8)5 确定和验证灭菌剂量的产品的选择及试验 (8)5.1 产品特性 (8)5.2 样品份额 (9)5.3 取样方式 (10)5.4 微生物试验 (10)5.5 辐照 (10)6 剂量确定方法 (10)7 方法1:利用生物负载信息进行剂量设定 (11)7.1 原理 (11)7.2 使用方法1对平均生物负载≥1.0的多个生产批次的产品的程序 (12)7.3 使用方法1对平均生物负载≥1.0的单一生产批次的产品的程序 (16)7.4 使用方法1对平均生物负载在0.1~0.9之间的单一或多个生产批次的产品的程序 (17)8 方法2:用增量剂量实验中得到的部分阳性信息确定外推因子的剂量设定 (18)8.1 原理 (18)8.2 方法2A的程序 (18)8.3 方法2B的程序 (21)9. VDmax方法——以25kGy或15kGy作为灭菌剂量的证明 (23)9.1 原理 (23)9.2 对多个生产批次使用VDmax25方法的程序 (24)9.3 对单一生产批次使用VDmax25方法的程序 (27)9.4 对多个生产批次使用VDmax15方法的程序 (29)9.5 对单一生产批次使用VDmax15方法的程序 (31)10 灭菌剂量的审核 (32)10.1 目的和频率 (32)10.2 使用方法1或方法2进行灭菌剂量设定的审核程序 (32)10.3 使用VDmax方法证明灭菌剂量的审核程序 (35)11 实例 (38)11.1 方法1举例 (38)11.2 方法2举例 (40)11.3 方法3举例 (46)11.4 使用方法1进行灭菌剂量设定的审核的实例,审核的结果有必要增加灭菌剂量 (47)11.5 使用方法2A进行灭菌剂量设定的审核的实例,审核的结果有必要增加灭菌剂量 (48)11.6 使用方法VDmax25证明灭菌剂量的审核的实例 (49)医疗卫生产品灭菌-辐射第二部分:确定灭菌剂量1.范围ISO11137本部分列出了为满足特定灭菌要求的最小剂量的确定方法以及证明使用25kGy 或15kGy作为灭菌剂量达到10-6灭菌保证水平的方法,同时指明了为确保灭菌剂量持续有效地剂量审核的方法。

XXXXX公司建立医用产品灭菌剂量验证报告送检单位:公司日期:年月日目录序言 (2)试验前准备工作 (2)方法 (4)实施内容 (4)结果 (5)结论 (6)附注 (6)参考资料 (6)初始污染菌检测规范 (6)确定灭菌剂量 (8)无菌检查 (9)序言本实验是对医用产品公司的一次性医疗用品进行了辐射灭菌剂量设定和验证.实验原理是基于ISO11137—2:2006的方法,即先对辐照前产品的初始污染菌进行测定,然后选择验证剂量.再用验证剂量对产品进行辐照,并测定辐照后存活微生物的样品件数,以此来确定所确定的验证剂量能够满足10—6的灭菌保证水平。
本实验从年月日开始至年月日结束.试验前准备工作一、样品1样品:医用产品,三个批号:生产企业:公司。
2器具及试剂2。
1器材试管容量瓶三角烧瓶酒精灯灭菌剪刀、镊子灭菌平皿(9cm)75%乙醇棉灭菌刻度吸管(1ml、5ml)紫外可见分光光度计立式压力蒸汽灭菌器电热鼓风干燥箱酸度计恒温培养箱电热恒温水浴锅生化培养箱电热恒温干燥箱2。
2培养基及试剂:a)流体硫乙醇酸盐培养基b)改良马丁培养基c)营养琼脂培养基2。
3稀释液、冲洗液及其制备方法a)质量浓度为9g/L的无菌氯化钠溶液b)0。
1%蛋白胨水溶液取蛋白胨1.0g,加水1000ml,微温溶解,滤清,调节pH值至7。
1±0.2,分装,灭菌。
c)pH7。
0氯化钠-蛋白胨缓冲液取磷酸二氢钾3.56g、磷酸氢二钠7.23g、氯化钠4。
30g、蛋白胨1。
0g,加水1000ml,微温溶解,滤清,分装,灭菌。
二、实验前准备2.1培养基要求:用于培养需(厌)气菌和真菌的培养基的制备、培养基灵敏度检查及其他各项要求应符合《中国药典(二部)》附录中《无菌检查法》的规定。
培养基使用按中国药典方生产的符合规定的脱水培养基。
制备后采用验证合格的灭菌程序灭菌。
制备好的培养基保存在2~25℃、避光的环境.2。
2器具灭菌:与供试液接触的所有器具应采用可靠方法灭菌,置压力蒸气灭菌器内121℃30min,或置电热干燥箱内160℃2h。

XXXXX公司建立医用产品灭菌剂量验证报告送检单位:公司日期:年月日目录序言 (1)试验前准备工作 (2)方法 (3)实施内容 (4)结果 (5)结论 (6)附注 (6)参考资料 (6)初始污染菌检测规范 (6)确定灭菌剂量 (8)无菌检查 (9)序言本实验是对医用产品公司的一次性医疗用品进行了辐射灭菌剂量设定和验证。
实验原理是基于ISO11137-2:2006的方法,即先对辐照前产品的初始污染菌进行测定,然后选择验证剂量。
再用验证剂量对产品进行辐照,并测定辐照后存活微生物的样品件数,以此来确定所确定的验证剂量能够满足10-6的灭菌保证水平。
本实验从年月日开始至年月日结束。
试验前准备工作一、样品1样品:医用产品,三个批号:生产企业:公司。
2器具及试剂2.1器材试管容量瓶三角烧瓶酒精灯灭菌剪刀、镊子灭菌平皿(9cm)75%乙醇棉灭菌刻度吸管(1ml、5ml)紫外可见分光光度计立式压力蒸汽灭菌器电热鼓风干燥箱酸度计恒温培养箱电热恒温水浴锅生化培养箱电热恒温干燥箱2.2培养基及试剂:a)流体硫乙醇酸盐培养基b)改良马丁培养基c)营养琼脂培养基2.3稀释液、冲洗液及其制备方法a)质量浓度为9g/L的无菌氯化钠溶液b)0.1%蛋白胨水溶液取蛋白胨1.0g,加水1000ml,微温溶解,滤清,调节pH值至7.1±0.2,分装,灭菌。
c)pH7.0氯化钠-蛋白胨缓冲液取磷酸二氢钾3.56g、磷酸氢二钠7.23g、氯化钠4.30g、蛋白胨1.0g,加水1000ml,微温溶解,滤清,分装,灭菌。
二、实验前准备2.1培养基要求:用于培养需(厌)气菌和真菌的培养基的制备、培养基灵敏度检查及其他各项要求应符合《中国药典(二部)》附录中《无菌检查法》的规定。
培养基使用按中国药典方生产的符合规定的脱水培养基。
制备后采用验证合格的灭菌程序灭菌。
制备好的培养基保存在2~25℃、避光的环境。
2.2器具灭菌:与供试液接触的所有器具应采用可靠方法灭菌,置压力蒸气灭菌器内121℃30min,或置电热干燥箱内160℃2h。

医疗保健产品辐射灭菌第二部分-灭菌剂量设定1. 概述1.1 该国际标准规定了达到无菌的特定要求所需设定最小灭菌剂量的方法以及规定了为达到10-6 SAL(无菌保证水平)证明使用25 kGy或15kGy 有效的方法。
该标准也规定了为证明灭菌剂量持续有效的剂量审核的方法。
1.2 在本国际标准中规定的剂量设定和证明的方法符合国际标准11137-1 中8.2 所规定的要求,其它符合这些要求的方法也可以使用。
基于这个理由,标准11137-2 被看作为“参考资料”。
使用的“应该”“必须”等术语,应该仅被当作这个标准的延续;亦即如果决定使用这些方法之一时, 那么这些方法应完全符合这些要求(必须)和建议(应该)作为本标准的配套推荐。
2 参考资料下列参考文件对于应用本文件是必不可少的, 对于有期限的资料, 只引用适用的版本, 对于无限期的资料, 使用最新的参考文件版本,(包括任何修订本),IEC 和ISO 的成员保持为目前有效的国际标准的注册者。
ISO 13485:2003 医疗器械-质量管理体系-规定和要求ISO 11137-1 医疗保健产品灭菌_辐射灭菌_第一部分_医疗器械灭菌过程的过程控制和确认ISO 11737-1 医疗器械灭菌_微生物学方法_第一部分_产品初始污染菌的评估ISO11737-2 医疗器械灭菌_微生物学方法_第二部分_ 灭菌过程确认中的无菌实验3 名词和定义本国际标准采用I SO11137-1 中的术语及下列定义3.1 名词3.1.1 A 中位f fp 剂量–首次阳性分数F FP 得到的校正剂量3.1.2 CD* 在方法2剂量验证过程中100 个辐照产品无菌试验的阳性个数3.1.3 d* 从给定产品批中抽取的产品单元的增量剂量实验中得到的剂量3.1.4 D* 是要求试样达到10-2 SAL 的初始估计剂量3.1.5 D** 最后得到的用于计算灭菌剂量的达到10-2 SAL 的剂量评估值3.1.6 DD*方法2中剂量验证实验中所实施的剂量3.1.7 DS 存活于DD*剂量下的产品内微生物的D10值的估测值3.1.8 D10值将同源微生物总数杀灭90%所需的辐射剂量或时间注:本标准中的D10值只有辐射剂量没有时间3.1.9 ffp (首个阳性分数的剂量)辐照剂量系列中最低的剂量,3.1.10 FFP (首个阳性分数的剂量)3.1.11 FNP(首个没有阳性的剂量)实验样本中达到10-2 SAL的剂量估值, 用于计算DS3.1.12 VDmax 给定初始污染菌的最大验证剂量,与确定的达到10-6 SAL的灭菌剂量相一致3.2 定义3.2.1 批期望在特征和质量上相同的, 并在某一确定制造周期中生产出的一定量的半成品或成品。

报告编号:辐照灭菌剂量确定报告产品名称:______________________ XXXXXXX产品型号:_______________ XXXXXXXXX ____________________产品批号:_____________ 20131030、20140224 ____________报告日期:________________ 2014年5月4日_________________目录摘要 ............................................................. (3)方法 ............................................................. (4)结果 .............................................................11资料保存................ .. (11)参考文献................ (11)摘要本报告依据ISO11137标准要求,确定医疗器械产品辐照灭菌剂量。
报告通过定义产品族及检测产品中微生物负荷数量,设定在SIP=1.0的情况下产品辐照灭菌加工过程中的验证剂量VDmax25并通过试验证实验证剂量,进一步证实|25.0 kGy 作为公司产品辐照灭菌剂量,同时,指定最大可接收的剂量值。
本次辐照灭菌确认以公司生产的XXXXX产品为确认对象。
根据ISO11137中剂量设定方法和要求,验证过程中对xxxxx产品连续3批次的产品进行初始污染菌的检验及分析,结果表明,xxxxx产品中的初始污染菌的数量分别为780 cfu/件、860 cfu/件、690 cfu/件,其中回收率为89.93%,校正因子为1.11。
同时根据ISO11137-2: 2012 VDmax25要求,确定了xxxxx产品的辐照灭菌验证剂量为8.2 ± 10%kGy并从该产品中独立批号中随机抽取10件样品,用验证剂量进行辐照灭菌,并对验证产品进行无菌检查。

药品辐射(或辐照)杀菌是利用一定剂量的波长极短的电离射线对药品进行杀菌(包括原材料),电子加速器放射出的电子射线对药品进行辐照消毒、杀菌、防霉等处理,达到延长保藏时间,稳定、提高食品质量目的的操作过程。
根据药品密度不同,辐照剂量会有差异:
1、胶囊类:辐照剂量为15KGY-30KGY。
2、片剂类:辐照剂量为15KGY-30KGY。
3、丸类:辐照剂量为:25KGY-40KGY。
辐照流程:
1、经过实验确认辐照剂量。
将剂量片分别贴于药品的上、中、下位,经过10KGY-20KGY
辐照后,分别测试上、中、下位的剂量片的吸收剂量。
2、根据剂量片的实验结果,确定辐照剂量(初期样品实验最少做3个剂量实验)。
3、客户拿样品做培菌实验,以客户培菌实验结果确定最终辐照剂量,并生成工艺文件。

拟制****** 审核****** 批准****** 版号 A 日期日期日期生效日期2022 年9 月20 日2022 年9 月20日2022 年9 月20日2022 年10 月1 日*******有限公司本文规定了灭菌的验证和日常管理。
1.1 验证组成人员2.验证的原理是基于 ISO11137 方法, 即先对辐照前产品的初始污染菌进行测定,然后选择验证剂量。
再用验证剂量对产品进行辐照,并 测定存活微生物的样品件数,以此来确定最低灭菌剂量(SAL=10-6)。
2.1 方法采集常规生产的标准包装产品,于灭菌前对三个批号进行随机抽 样。
其中取样比例(SIP)为 1。
2.1.1 初始污染菌的测定根据每一个样品的测试结果,计算出每件产品的平均带菌数。
同时 进行初始污染菌回收率的测试,以对该产品带菌数测试方法的有效性和 重复性进行确认。
初始污染菌的菌数取自三个独立批的单位产品的总平 均带菌数。
试验方法: (平板计数法) 1. 洗脱液: 2. 样品处理:。
3. 需气菌培养: 4. 霉菌培养: 5. 计数:结果:参见下表:职称/学历工作内容姓名职务阴性对照<10cfu/样品三批产品初始污染菌测试结果如下: 批 号 初始污染菌平均数(cfu/件) 2.12 验证剂量的选定根据 IOS11137:2022 方法 1 中的表 5,选择合适的验证剂量。
医疗保 健产品辐照灭菌的有效性确认和常规控制的要求( ISO11137)规定,应用 校正后的总平均带菌数确定验证剂量,除非,某一批号的平均数的平均带 菌数大于等于校正后的总平均带菌数的二倍。
在此情况下,采用平均数最 大批的数据确定验证剂量。
初始污染菌:经三批连续产品初始污染菌及回收率的检测,每批产品初始污染菌如批 号样品号1 2 3 4 5 6 7 8 9 10 平均数霉菌 (cfu 件)霉菌 (cfu 件)需气菌 (cfu 件)需气菌 (cfu 件)需气菌 (cfu 件)霉菌 (cf 件)下:三批产品初始污染菌测试结果如下: 批号 初始污染菌平均数(cfu/件) 校正后平均初始污染菌数: 75按照 ISO11137 方法 1 查得校正后总平均带菌数 75cfu/件的验证剂量 为 7.6kGy 。

辐射灭菌法综述一.定义:是采用放射性同位素放射的γ射线杀灭微生物和芽孢的方法。
辐射灭菌剂量一般为25000Gy(1Gy=1J/kg)。
该法已被《英国药典》和《日本药局方》以及《中国药典》收载。
本法适合于热敏物料和制剂的灭菌,常用于微生素、抗生素、激素、生物制品、中药材和中药方剂、医疗器械、药用包装材料以及高分子材料的灭菌。
其特点是不升高产品温度,穿透力强,灭菌效率高等。
目前辐照中使用的γ射线,是由钴-60或铯-137辐射源所放出的射线,主要是钴-60。
二机理:射线和电子射线在本质上与紫外线、红外线、无线电波和可见光等性质相同,都有是电磁波。
只不过射线波长更短,通常又称之为微微波,故它们的能量更大,其量子能量比紫外线量子大几百倍,当微生物受到辐照后,产生直接和间接两种作用共同作用的结果。
直接作用学说认为,细胞核尤其是DNA被直接击中,导致死亡;间接作用学说认为,细胞内含有大量的水分,水吸收辐射能之后,发生辐射化学反应,产生的H+、OH-等活性粒子和生命物质(蛋白质、酶)发生作用,使细胞生活所必需的结构或物质发生变化,从而引起细胞死亡。
三常用剂量:美国药典规定高剂量有效灭菌为2.5 kGy,中剂量为1 kGy,低剂量为0.2~0.4 kGy。
我国卫生部的标准规定辐照中药最高耐受剂量为:散剂、片剂3 kGy,丸剂5 kGy,中药原料粉6 kGy。
苏德模等人对中成药辐照灭菌的研究结果表明:散剂经2 kGy辐射,细菌数降低在90%以上。
蜜丸经辐射后细菌数降低:2 kGy为78%~85%,4 kGy为85%~93%,5 kGy为87%~96%,6 kGy为89%~97%。
若按照GMP,所用药材使用前按规定进行拣选、整理、洗涤等前处理加工,生产过程控制在不同洁净级别的厂房内,就能把微生物的含量控制在一定范围内,如果微生物含量超标,再辅以适宜的灭菌方法,是能保证药品卫生质量的。
比如含原生药粉的丸剂,国家规定的微生物限度为不超过3万个/g,若前处理后微生物含量为20万个,用6 kGy辐照的辐照剂量,把微生物降低89%~97%(即为0.6万~2.2万个),就能符合标准。

ISO11137-2 医疗保健产品灭菌-辐射灭菌第二部分:灭菌剂量的确定目录: (1)引言 (3)1. 范围 (4)2. 引用标准 (4)3. 缩写、术语和定义 (4)3.1 缩写 (4)3.2 术语 (5)4 确定和保持剂量设定,剂量认证以及灭菌剂量审核中的产品族 (6)4.1 总则 (6)4.2 产品族的定义 (6)4.3 代表产品族实施验证剂量试验和灭菌剂量审核所指定的产品 (7)4.4 产品族的保持 (8)4.5 灭菌剂量的确定和灭菌剂量审核失败对产品族的影响 (8)5 确定和验证灭菌剂量的产品的选择及试验 (8)5.1 产品特性………………………………………………………………………………( 8)5.2 样品份额………………………………………………………………………………( 9)5.3 取样方式………………………………………………………………………………( 10)5.4 微生物试验……………………………………………………………………………(10 )5.5 辐照 (10)6 剂量确定方法……………………………………………………………………………(10 )7 方法1:利用生物负载信息进行剂量设定 (11)7.1 原理 (11)7.2 使用方法1对平均生物负载≥1.0的多个生产批次的产品的程序 (12)7.3 使用方法1对平均生物负载≥1.0的单一生产批次的产品的程序 (16)7.4 使用方法1对平均生物负载在0.1~0.9之间的单一或多个生产批次的产品的程序 (17)8 方法2:用增量剂量实验中得到的部分阳性信息确定外推因子的剂量设定 (18)8.1 原理 (18)8.2 方法2A的程序……………………………………………………………………………(18 )8.3 方法2B的程序……………………………………………………………………………(21 )9. VDmax方法——以25kGy或15kGy作为灭菌剂量的证明 (23)9.1 原理 (23)9.2 对多个生产批次使用VDmax25方法的程序 (24)9.3 对单一生产批次使用VDmax25方法的程序 (27)9.4 对多个生产批次使用VDmax15方法的程序 (29)9.5 对单一生产批次使用VDmax15方法的程序 (31)10 灭菌剂量的审核……………………………………………………………………………(32 )10.1 目的和频率………………………………………………………………………………( 32)10.2 使用方法1或方法2进行灭菌剂量设定的审核程序 (32)10.3 使用VDmax方法证明灭菌剂量的审核程序 (35)11 实例 (38)11.1 方法1举例………………………………………………………………………………(38)11.2 方法2举例………………………………………………………………………………(40)11.3 方法3举例………………………………………………………………………………(46)11.4 使用方法1进行灭菌剂量设定的审核的实例,审核的结果有必要增加灭菌剂量 (47)11.5 使用方法2A进行灭菌剂量设定的审核的实例,审核的结果有必要增加灭菌剂量 (48)11.6 使用方法VDmax25证明灭菌剂量的审核的实例 (49)引言ISO11137本部分描述的方法可用于符合ISO11137-1:2006 第8.2款所指的两种途径之一的灭菌剂量确定, 途径中使用的方法有:a)得到产品特定的剂量的设定方法b)检验预先选定剂量为25kGy或15kGy的剂量认证ISO11137本部分所述的剂量设定方法的基本原理多数应归功于Tallentire最早提出的一些概念,随后被发展成为标准化的草案,它成为AAMI在γ辐射灭菌推荐规程中提出的剂量设定方法的基础。
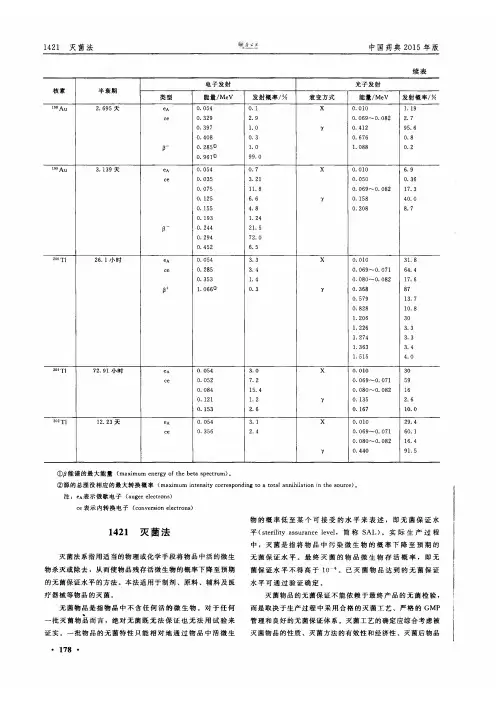
1421灭菌法中国药典2015年版续表核素半衰期电子发射光子发射类型能量/M e V发射概率/%衰变方式能量/M e V发射概率/% 198 A u 2. 695 天eA0. 0540. 1X0.010 1. 19ce0. 329 2. 90. 0690. 082 2. 70. 397 1. 070. 41295. 60. 4080. 30. 6760. 8r0. 285® 1. 0 1. 0880. 20. 961®99. 0199 A u 3.139天eA0.0540. 7X0.010 6. 9ce0. 035 3. 210. 0500. 360. 07511. 80. 0690. 08217. 30. 125 6. 6y0. 15840. 00.155 4. 80. 2088.70. 193 1. 24r0. 24421. 50. 29472. 00. 452 6. 5200 T126. 1小时eA0. 054 3. 3X0. 01031. 8ce0. 285 3. 40.0690. 07164. 40. 353 1. 40. 0800. 08217. 60+ 1.066®0. 3y0- 368870. 57913. 70. 82810. 81. 206301.226 3. 31. 274 3. 31. 363 3. 41. 515 4.0201 T|72. 91小时eA0. 054 3.0X0.01030ce0. 0527. 20.0690. 071590. 08415. 40. 0800. 082160. 121 1. 270. 135 2. 60.153 2. 60. 16710.0202 T112. 23 天eA0. 054 3. 1X0. 01029. 4ce0. 356 2. 40.0690.07160. 10‘ 0800_ 08216. 4y0. 44091. 5①卢能谱的最大能量(m a xim u m energy o f th e beta sp e ctru m)。
ISO11137-2 医疗保健产品灭菌-辐射灭菌第二部分:灭菌剂量的确定目录: (1)引言 (3)1. 范围 (4)2. 引用标准 (4)3. 缩写、术语和定义 (4)3.1 缩写 (4)3.2 术语 (5)4 确定和保持剂量设定,剂量认证以及灭菌剂量审核中的产品族 (6)4.1 总则 (6)4.2 产品族的定义 (6)4.3 代表产品族实施验证剂量试验和灭菌剂量审核所指定的产品 (7)4.4 产品族的保持 (8)4.5 灭菌剂量的确定和灭菌剂量审核失败对产品族的影响 (8)5 确定和验证灭菌剂量的产品的选择及试验 (8)5.1 产品特性 (8)5.2 样品份额 (9)5.3 取样方式 (10)5.4 微生物试验 (10)5.5 辐照 (10)6 剂量确定方法 (10)7 方法1:利用生物负载信息进行剂量设定 (11)7.1 原理 (11)7.2 使用方法1对平均生物负载≥1.0的多个生产批次的产品的程序 (12)7.3 使用方法1对平均生物负载≥1.0的单一生产批次的产品的程序 (16)7.4 使用方法1对平均生物负载在0.1~0.9之间的单一或多个生产批次的产品的程序 (17)8 方法2:用增量剂量实验中得到的部分阳性信息确定外推因子的剂量设定 (18)8.1 原理 (18)8.2 方法2A的程序 (18)8.3 方法2B的程序 (21)9. VDmax方法——以25kGy或15kGy作为灭菌剂量的证明 (23)9.1 原理 (23)9.2 对多个生产批次使用VDmax25方法的程序 (24)9.3 对单一生产批次使用VDmax25方法的程序 (27)9.4 对多个生产批次使用VDmax15方法的程序 (29)9.5 对单一生产批次使用VDmax15方法的程序 (31)10 灭菌剂量的审核 (32)10.1 目的和频率 (32)10.2 使用方法1或方法2进行灭菌剂量设定的审核程序 (32)10.3 使用VDmax方法证明灭菌剂量的审核程序 (35)11 实例 (38)11.1 方法1举例 (38)11.2 方法2举例 (40)11.3 方法3举例 (46)11.4 使用方法1进行灭菌剂量设定的审核的实例,审核的结果有必要增加灭菌剂量 (47)11.5 使用方法2A进行灭菌剂量设定的审核的实例,审核的结果有必要增加灭菌剂量 (48)11.6 使用方法VDmax25证明灭菌剂量的审核的实例 (49)引言ISO11137本部分描述的方法可用于符合ISO11137-1:2006 第8.2款所指的两种途径之一的灭菌剂量确定, 途径中使用的方法有:a)得到产品特定的剂量的设定方法b)检验预先选定剂量为25kGy或15kGy的剂量认证ISO11137本部分所述的剂量设定方法的基本原理多数应归功于Tallentire最早提出的一些概念,随后被发展成为标准化的草案,它成为AAMI在γ辐射灭菌推荐规程中提出的剂量设定方法的基础。
辐射灭菌法原理
辐射灭菌法是一种常见的灭菌方法,它的原理是利用电离辐射杀死微生物,包括细菌、病毒和真菌等。
该方法被广泛应用于医疗、食品和化工等领域。
辐射灭菌法的原理主要依赖于电离辐射的能量和剂量。
电离辐射可以分为离子辐射和非离子辐射两种,其中离子辐射包括α、β和γ射线,非离子辐射包括紫外线和X射线等。
辐射灭菌法通常使用γ射线进行灭菌,因为γ射线的穿透力强,可以穿透厚度较大的物质,如金属和塑料等。
辐射灭菌的剂量通常以灭菌剂量为单位,灭菌剂量是指在固定时间内接收到的辐射剂量。
灭菌剂量越高,杀死微生物的效果越好。
辐射灭菌的剂量通常是以千戈雷(kGy)为单位,一戈雷等于1000千戈雷。
常见的灭菌剂量为25千戈雷,这个剂量足以杀死绝大多数的微生物。
辐射灭菌法有许多优点。
首先,它可以灭杀各种微生物,包括耐热菌、芽孢和病毒等。
其次,辐射灭菌不会对物品造成污染,因为它不需要使用化学物质。
第三,辐射灭菌可以对各种物品进行灭菌,如医疗器械、食品和药品等。
最后,辐射灭菌可以在较短时间内完成,通常只需要几分钟至几小时不等。
但是,辐射灭菌法也存在一些缺点。
首先,辐射灭菌需要使用昂贵的设备,如γ射线灭菌设备,这增加了成本。
其次,辐射灭菌可能会影响物品的质量,如食品的口感和营养价值等。
此外,辐射灭菌对人体也有潜在的危害,因此需要进行安全评估。
辐射灭菌法是一种常见的灭菌方法,它利用电离辐射杀死微生物,被广泛应用于医疗、食品和化工等领域。
尽管辐射灭菌法存在一些缺点,但它的优点仍然使得它成为一种重要的灭菌方法。
如果实施剂量设定测试,对s为10-6得到的灭菌剂量≤25kGy,方法1和2也可以用于25kGy 的证明。
VDmax方法由Kowalski和Tallentire(1999)提出,这种方法的得出依据仅用于25kGy 的证明。
随后的评估包括计算技巧都证明其基本的原理是十分有依据的(Kowalski,Aoshuang 和Tallentire,2000),实施的迹象也证实用VDmax方法证明25kGy对于不同方式的生产和组装的广泛种类的医疗器械是有效的.在AAMI的灭菌技术信息报告(医疗卫生产品灭菌-辐照灭菌-证明25kGy作为灭菌剂量-VDmax方法 AAMI TIR27: 2001)中已经提到了一种使用VDmax方法来证明25kGy作为灭菌剂量的标准化的程序, 本标准中大部分是该报告中描述的方法为基础。
VDmax方法是在剂量设定的方法1的基础上诞生的,因此,它高度保留了方法1的特征。
在类似方式的剂量设定方法中,它包括了对单元产品实施无菌检验的结果得到低于灭菌剂量的辐照剂量。
这些试验的数据用来证明使用25kGy获得s为10-6可行。
为把VDmax方法用于一个预先选择的特定的灭菌剂量的证明,后者的剂量值以kGy表示,并作为VDmax符号的上标。
因而,如证明25kGy作为灭菌剂量的方法表示为VDmax25。
VDmax15方法和以上所述的VDmax25方法是以同样的原理为基础。
试验步骤和VDmax25方法相同,但是VDmax15方法局限于对平均生物负载≤1.5的产品。
这些试验的数据用来证明使用15kGy获得s为10-6可行。
ISO11137本部分也同时描述了根据ISO11137-1:2006第12条款实施灭菌剂量审核的方法,例行实施灭菌剂量的审核可以证实获得要求的s的灭菌剂量持续有效。
医疗卫生产品灭菌-辐射第二部分:确定灭菌剂量1.范围ISO11137本部分列出了为满足特定灭菌要求的最小剂量的确定方法以及证明使用25kGy 或15kGy作为灭菌剂量达到10-6灭菌保证水平的方法,同时指明了为确保灭菌剂量持续有效地剂量审核的方法。