索尔维制碱法与侯氏制碱法
- 格式:ppt
- 大小:48.00 KB
- 文档页数:9


侯氏制碱法与索尔维制碱法(也叫做氨碱法与联碱法)的比较一、氨碱法(又称索尔维法)以食盐(氯化钠)、石灰石(经煅烧生成生石灰和二氧化碳)、氨气为原料来制取纯碱。
先使氨气通入饱和食盐水中而成氨盐水,再通入二氧化碳生成溶解度较小的碳酸氢钠沉淀和氯化铵溶液。
其化学反应原理是:NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl 将经过滤、洗涤得到的NaHCO3微小晶体,再加热煅烧制得纯碱产品。
2NaHCO3=Na2CO3+H2O+CO2含有氯化铵的滤液与石灰乳[Ca(OH)2]CaO+H2O=Ca(OH)2,2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O。
氨碱法的优点是:原料(食盐和石灰石)便宜;产品纯碱的纯度高;副产品氨和二氧化碳都可以回收循环使用;制造步骤简单,适合于大规模生产。
但氨碱法也有许多缺点:首先是两种原料的成分里都只利用了一半—食盐成分里的钠离子(Na+)和石灰石成分里的碳酸根离子(CO32-)结合成了碳酸钠,可是食盐的另一成分氯离子(Cl-)和石灰石的另一成分钙离子(Ca2+)却结合成了没有多大用途的氯化钙(CaCl2),因此如何处理氯化钙成为一个很大的负担。
氨碱法的最大缺点还在于原料食盐的利用率只有72%~74%,其余的食盐都随着氯化钙溶液作为废液被抛弃了,这是一个很大的损失。
二、联合制碱法(又称侯氏制碱法)将氨碱法和合成氨法两种工艺联合起来,同时生产纯碱和氯化铵两种产品的方法。
原料是食盐、氨和二氧化碳—合成氨厂用水煤气制取氢气时的废气。
其化学反应原理是:C+H2O=CO+H2 CO+H2O=CO2+H2联合制碱法包括两个过程:第一个过程与氨碱法相同,将氨通入饱和食盐水而成氨盐水,再通入二氧化碳生成碳酸氢钠沉淀,经过滤、洗涤得NaHCO3微小晶体,再煅烧制得纯碱产品,其滤液是含有氯化铵和氯化钠的溶液。
第二个过程是从含有氯化铵和氯化钠的滤液中结晶沉淀出氯化铵晶体。

【纯碱工业】索尔维制碱法与侯氏制碱法(也叫做氨碱法与联碱法)氨碱法:先使氨气通入饱和食盐水中而成氨盐水,再通入二氧化碳生成溶解度较小的碳酸氢钠沉淀和氯化铵溶液。
其化学反应原理是:NaCl+NH3+H2O+CO2→NaHCO3↓+NH4Cl将经过滤、洗涤得到的NaHCO3微小晶体,再加热煅烧制得纯碱产品。
2NaHCO3−−−→煅烧Na2CO3+H2O+CO2↑放出的CO2气体可回收循环使用。
含有NH4Cl的滤液与石灰乳[Ca(OH)2]混合加热,所放出的NH3可回收循环使用。
CaO+H2O→Ca(OH)2,2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O氨碱法的优点是:原料(食盐和石灰石)便宜;产品纯碱的纯度高;副产品氨和二氧化碳都可以回收循环使用;制造步骤简单,适合于大规模生产。
但氨碱法也有许多缺点:首先是两种原料的成分里都只利用了一半—食盐成分里的Na+和石灰石成分里的CO32-结合成了Na2CO3,可是食盐的另一成分Cl-和石灰石的另一成分Ca2+却结合成了没有多大用途的CaCl2,因此如何处理CaCl2成为一个很大的负担。
氨碱法的最大缺点还在于原料食盐的利用率只有72%~74%,其余的食盐都随着CaCl2溶液作为废液被抛弃了,这是一个很大的损失。
联合制碱法(又称侯氏制碱法):它是我国化学工程专家侯德榜(1890~1974)于1943年创立的。
是将氨碱法和合成氨法两种工艺联合起来,同时生产纯碱和氯化铵两种产品的方法。
原料是食盐、氨和二氧化碳(合成氨厂用水煤气制取氢气时的废气,其化学反应原理是:C+H2O→CO+H2 CO+H2O→CO2+H2)联合制碱法包括两个过程:第一个过程与氨碱法相同,将氨通入饱和食盐水而成氨盐水,再通入二氧化碳生成碳酸氢钠沉淀,经过滤、洗涤得NaHCO3微小晶体,再煅烧制得纯碱产品,其滤液是含有氯化铵和氯化钠的溶液。
第二个过程是从含有氯化铵和氯化钠的滤液中结晶沉淀出氯化铵晶体。

索尔维法和侯氏制碱法的比较无水碳酸钠,俗名纯碱、苏打。
它是玻璃、造纸、肥皂、洗涤剂、纺织、制革等工业的重要原料,还常用作硬水的软化剂,也用于制造钠的化合物。
它的工业制法主要有氨碱法和联合制碱法两种。
一、氨碱法(又称索尔维法)它是比利时工程师苏尔维(1838~1922)于1892年发明的纯碱制法。
他以食盐(氯化钠)、石灰石(经煅烧生成生石灰和二氧化碳)、氨气为原料来制取纯碱。
先使氨气通入饱和食盐水中而成氨盐水,再通入二氧化碳生成溶解度较小的碳酸氢钠沉淀和氯化铵溶液。
其化学反应原理是:NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl将经过滤、洗涤得到的NaHCO3微小晶体,再加热煅烧制得纯碱产品。
2NaHCO3=Na2CO3+H2O+CO2↑放出的二氧化碳气体可回收循环使用。
含有氯化铵的滤液与石灰乳[Ca(OH)2]混合加热,所放出的氨气可回收循环使用。
CaO+H2O=Ca(OH)2,2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O其工业生产的简单流程如图所示。
氨碱法的优点是:原料(食盐和石灰石)便宜;产品纯碱的纯度高;副产品氨和二氧化碳都可以回收循环使用;制造步骤简单,适合于大规模生产。
但氨碱法也有许多缺点:首先是两种原料的成分里都只利用了一半——食盐成分里的钠离子(Na+)和石灰石成分里的碳酸根离子(CO32-)结合成了碳酸钠,可是食盐的另一成分氯离子(Cl-)和石灰石的另一成分钙离子(Ca2+)却结合成了没有多大用途的氯化钙(CaCl2),因此如何处理氯化钙成为一个很大的负担。
氨碱法的最大缺点还在于原料食盐的利用率只有72%~74%,其余的食盐都随着氯化钙溶液作为废液被抛弃了,这是一个很大的损失。
二、联合制碱法(又称侯氏制碱法)它是我国化学工程专家侯德榜(1890~1974)于1943年创立的。
是将氨碱法和合成氨法两种工艺联合起来,同时生产纯碱和氯化铵两种产品的方法。

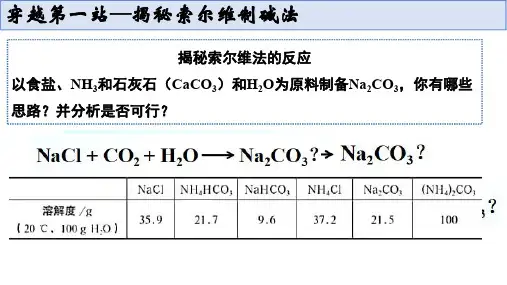
揭秘索尔维法的反应以食盐、NH3和石灰石(CaCO3)和H2O为原料制备Na2CO3,你有哪些思路?并分析是否可行?5mL滴加到盛有CO2的矿泉水瓶中,充分振荡,观察现象。
实验现象实验结论注意:①1滴管大约1mL②CO2溶解度小且溶解速度慢,必须充分用力振荡③振荡过程中不断关注溶液颜色变化及其他现象2-相互作用物质组成控制温度控制浓度沉淀生成反应反应?真实溶液的复杂问题归根结底是溶液中的物质及其相互作用的问题。
作用结果微粒种类和数量宏观现象↓索尔维制碱法工艺流程图讨论回答:1.“吸氨”和“碳酸化”过程是否可以交换?2.“灰蒸”的作用是什么?3.“废液”的主要成分是什么?历史背景:(1)我国的纯碱工业陷入新的困境。
(2)索尔维法的食盐利用率低,增加生产成本。
如何提高食盐的利用率变为亟待解决的问题!1.能否直接向母液I 中补充NaCl 、NH 3和CO 2来循环利用,以提高食盐 利用率?2. 如何降低溶液中NH 4+和Cl -的浓度?侯氏制碱法工艺流程图穿越第二站—揭秘侯氏制碱法几种物质的溶解度曲线图侯氏制碱法工艺流程图你是否可以评价侯氏制碱法的优点?侯氏制碱法保留了索尔维法的优点,消除了它的缺点,使食盐的利用率提高到98%;CO 2由合成氨厂提供,代替了索尔维法中利用CaCO 3制CO 2这一工序;NH 4Cl可作氮肥。
相互作用母液 I穿越第二站—揭秘侯氏制碱法课堂小结思维建模:分析真实溶液问题的一般思路1.根据目标确定待解决的关键问题2.分析溶液的物质组成、微粒和相互作用3.基于信息和数据综合利用溶液中的离子平衡和平衡移动进行推理迁移应用1.联合制碱法生产纯碱的工艺流程如下图所示。
下列说法正确的是( )迁移应用2.以下是在实验室模拟“侯氏制碱法”生产流程的示意图:则下列叙述错误的是( )A. A气体是NH3,B气体是CO2 B.把纯碱及第Ⅲ步所得晶体与某些固体酸性物质(如酒石酸)混合可制泡腾片 C.第Ⅲ步操作用到的主要玻璃仪器是烧杯、漏斗、玻璃棒 D.第Ⅳ步操作是将晶体溶于水后加热、蒸发、结晶课后学习过程—项目学习任务查阅资料1.历史上还有没有别的制备纯碱的方法?从化学的角度分析制备的原理。

【纯碱工业】索尔维制碱法与侯氏制碱法(也叫做氨碱法与联碱法)氨碱法:先使氨气通入饱和食盐水中而成氨盐水,再通入二氧化碳生成溶解度较小的碳酸氢钠沉淀和氯化铵溶液。
其化学反应原理是:NaCl+NH3+H2O+CO2→NaHCO3↓+NH4Cl将经过滤、洗涤得到的NaHCO3微小晶体,再加热煅烧制得纯碱产品。
2NaHCO3−−−→煅烧Na2CO3+H2O+CO2↑放出的CO2气体可回收循环使用。
含有NH4Cl的滤液与石灰乳[Ca(OH)2]混合加热,所放出的NH3可回收循环使用。
CaO+H2O→Ca(OH)2,2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O氨碱法的优点是:原料(食盐和石灰石)便宜;产品纯碱的纯度高;副产品氨和二氧化碳都可以回收循环使用;制造步骤简单,适合于大规模生产。
但氨碱法也有许多缺点:首先是两种原料的成分里都只利用了一半—食盐成分里的Na+和石灰石成分里的CO32-结合成了Na2CO3,可是食盐的另一成分Cl-和石灰石的另一成分Ca2+却结合成了没有多大用途的CaCl2,因此如何处理CaCl2成为一个很大的负担。
氨碱法的最大缺点还在于原料食盐的利用率只有72%~74%,其余的食盐都随着CaCl2溶液作为废液被抛弃了,这是一个很大的损失。
联合制碱法(又称侯氏制碱法):它是我国化学工程专家侯德榜(1890~1974)于1943年创立的。
是将氨碱法和合成氨法两种工艺联合起来,同时生产纯碱和氯化铵两种产品的方法。
原料是食盐、氨和二氧化碳(合成氨厂用水煤气制取氢气时的废气,其化学反应原理是:C+H2O→CO+H2 CO+H2O→CO2+H2)联合制碱法包括两个过程:第一个过程与氨碱法相同,将氨通入饱和食盐水而成氨盐水,再通入二氧化碳生成碳酸氢钠沉淀,经过滤、洗涤得NaHCO3微小晶体,再煅烧制得纯碱产品,其滤液是含有氯化铵和氯化钠的溶液。
第二个过程是从含有氯化铵和氯化钠的滤液中结晶沉淀出氯化铵晶体。

侯氏制碱法与索尔维制碱法(也叫做氨碱法与联碱法)的比较一、氨碱法(又称索尔维法)以食盐(氯化钠)、石灰石(经煅烧生成生石灰和二氧化碳)、氨气为原料来制取纯碱。
先使氨气通入饱和食盐水中而成氨盐水,再通入二氧化碳生成溶解度较小的碳酸氢钠沉淀和氯化铵溶液。
其化学反应原理是:NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl 将经过滤、洗涤得到的NaHCO3微小晶体,再加热煅烧制得纯碱产品。
2NaHCO3=Na2CO3+H2O+CO2↑[Ca(OH)2]混合加热,CaO+H2O=Ca(OH)2,2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O。
氨碱法的优点是:原料(食盐和石灰石)便宜;产品纯碱的纯度高;副产品氨和二氧化碳都可以回收循环使用;制造步骤简单,适合于大规模生产。
但氨碱法也有许多缺点:首先是两种原料的成分里都只利用了一半—食盐成分里的钠离子(Na+)和石灰石成分里的碳酸根离子(CO32-)结合成了碳酸钠,可是食盐的另一成分氯离子(Cl-)和石灰石的另一成分钙离子(Ca2+)却结合成了没有多大用途的氯化钙(CaCl2),因此如何处理氯化钙成为一个很大的负担。
氨碱法的最大缺点还在于原料食盐的利用率只有72%~74%,其余的食盐都随着氯化钙溶液作为废液被抛弃了,这是一个很大的损失。
二、联合制碱法(又称侯氏制碱法)将氨碱法和合成氨法两种工艺联合起来,同时生产纯碱和氯化铵两种产品的方法。
原料是食盐、氨和二氧化碳—合成氨厂用水煤气制取氢气时的废气。
其化学反应原理是:C+H2O=CO+H2 CO+H2O=CO2+H2联合制碱法包括两个过程:第一个过程与氨碱法相同,将氨通入饱和食盐水而成氨盐水,再通入二氧化碳生成碳酸氢钠沉淀,经过滤、洗涤得NaHCO3微小晶体,再煅烧制得纯碱产品,其滤液是含有氯化铵和氯化钠的溶液。
第二个过程是从含有氯化铵和氯化钠的滤液中结晶沉淀出氯化铵晶体。
由于氯化铵在常温下的溶解度比氯化钠要大,低温时的溶解度则比氯化钠小,而且氯化铵在氯化钠的浓溶液里的溶解度要比在水里的溶解度小得多。

微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用[核心素养发展目标] 1.通过认识制碱工业中复杂的多平衡体系,学会分析溶液中的微粒和平衡,理解平衡之间的相互影响,能根据实际需求选择调控平衡移动的方法。
2.通过了解工业制碱的原理,体会化学原理的巧妙应用,了解我国科学家对制碱工业作出的巨大贡献。
实验背景:无水碳酸钠,俗名纯碱、苏打。
它是玻璃、造纸、肥皂、洗涤剂、纺织、制革等工业的重要原料,还常用作硬水的软化剂,也用于制造钠的化合物。
它的工业制法主要有氨碱法和联合制碱法两种。
一、实验原理书写下列化学方程式:(1)化学反应原理是:_________________________________________。
(2)总反应为:_______________________________________________。
(3)将经过滤、洗涤得到的NaHCO 3微小晶体再加热,制得纯碱产品:________________________________________________________________________。
答案 (1)NH 3+CO 2+H 2O===NH 4HCO 3NaCl(饱和)+NH 4HCO 3===NaHCO 3↓+NH 4Cl(2)NaCl(饱和)+NH 3+CO 2+H 2O===NaHCO 3↓+NH 4Cl(3)2NaHCO 3=====△Na 2CO 3+CO 2↑+H 2O二、氨碱法(又称索尔维制碱法)1.原料:食盐(氯化钠)、石灰石(经煅烧生成生石灰和二氧化碳)、氨气。
2.步骤:(1)先把氨气通入饱和食盐水中生成氨盐水,再通入二氧化碳生成溶解度较小的碳酸氢钠沉淀和氯化铵溶液。
NH 3+CO 2+H 2O===NH 4HCO 3、NaCl(饱和)+NH 4HCO 3===NaHCO 3↓+NH 4Cl 。
(2)将经过滤、洗涤得到的NaHCO 3微小晶体,再加热煅烧制得纯碱产品。

索尔维法和侯氏制碱法的比较无水碳酸钠,俗名纯碱、苏打。
它是玻璃、造纸、肥皂、洗涤剂、纺织、制革等工业的重要原料,还常用作硬水的软化剂,也用于制造钠的化合物。
它的工业制法主要有氨碱法和联合制碱法两种。
一、氨碱法(又称索尔维法)它是比利时工程师苏尔维(1838~1922)于1892年发明的纯碱制法。
他以食盐(氯化钠)、石灰石(经煅烧生成生石灰和二氧化碳)、氨气为原料来制取纯碱。
先使氨气通入饱和食盐水中而成氨盐水,再通入二氧化碳生成溶解度较小的碳酸氢钠沉淀和氯化铵溶液。
其化学反应原理是:NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl将经过滤、洗涤得到的N aHCO3微小晶体,再加热煅烧制得纯碱产品。
2NaHCO3=Na2CO3+H2O+CO2↑放出的二氧化碳气体可回收循环使用。
含有氯化铵的滤液与石灰乳[Ca(OH)2]混合加热,所放出的氨气可回收循环使用。
CaO+H2O =Ca(OH)2,2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O其工业生产的简单流程如图所示。
氨碱法的优点是:原料(食盐和石灰石)便宜;产品纯碱的纯度高;副产品氨和二氧化碳都可以回收循环使用;制造步骤简单,适合于大规模生产。
但氨碱法也有许多缺点:首先是两种原料的成分里都只利用了一半——食盐成分里的钠离子(Na+)和石灰石成分里的碳酸根离子(CO32-)结合成了碳酸钠,可是食盐的另一成分氯离子(Cl-)和石灰石的另一成分钙离子(Ca2+)却结合成了没有多大用途的氯化钙(CaCl2),因此如何处理氯化钙成为一个很大的负担。
氨碱法的最大缺点还在于原料食盐的利用率只有72%~74%,其余的食盐都随着氯化钙溶液作为废液被抛弃了,这是一个很大的损失。
索尔维制碱法与侯氏制碱法无水碳酸钠,俗名纯碱、苏打。
它是玻璃、造纸、肥皂、洗涤剂、纺织、制革等工业的重要原料,还常用作硬水的软化剂,也用于制造钠的化合物。
它的工业制法主要有氨碱法和联合制碱法两种。
一、氨碱法(又称索尔维法)它是比利时工程师苏尔维(1838~1922)于1892年发明的纯碱制法。
他以食盐(氯化钠)、石灰石(经煅烧生成生石灰和二氧化碳)、氨气为原料来制取纯碱。
先使氨气通入饱和食盐水中而成氨盐水,再通入二氧化碳生成溶解度较小的碳酸氢钠沉淀和氯化铵溶液。
其化学反应原理是:NaCl+NH3+H2O+CO2→NaHCO3↓+NH4Cl将经过滤、洗涤得到的NaHCO3微小晶体,再加热煅烧制得纯碱产品。
2NaHCO3→Na2CO3+H2O+CO2↑放出的二氧化碳气体可回收循环使用。
含有氯化铵的滤液与石灰乳[Ca(OH)2]混合加热,所放出的氨气可回收循环使用。
CaO+H2O→Ca(OH)2,2NH4Cl+Ca(OH)2→CaCl2+2NH3↑+2H2O其工业生产的简单流程如图所示。
氨碱法的优点是:原料(食盐和石灰石)便宜;产品纯碱的纯度高;副产品氨和二氧化碳都可以回收循环使用;制造步骤简单,适合于大规模生产。
但氨碱法也有许多缺点:首先是两种原料的成分里都只利用了一半——食盐成分里的钠离子(Na+)和石灰石成分里的碳酸根离子(CO32-)结合成了碳酸钠,可是食盐的另一成分氯离子(Cl-)和石灰石的另一成分钙离子(Ca2+)却结合成了没有多大用途的氯化钙(CaCl2),因此如何处理氯化钙成为一个很大的负担。
氨碱法的最大缺点还在于原料食盐的利用率只有72%~74%,其余的食盐都随着氯化钙溶液作为废液被抛弃了,这是一个很大的损失。
二、联合制碱法(又称侯氏制碱法)它是我国化学工程专家侯德榜(1890~1974)于1943年创立的。
是将氨碱法和合成氨法两种工艺联合起来,同时生产纯碱和氯化铵两种产品的方法。
原料是食盐、氨和二氧化碳——合成氨厂用水煤气制取氢气时的废气。
1微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用1.纯碱是重要的基础化工原料,其产量和消费量通常作为衡量一个国家工业发展水平的指标。
2.纯碱的用途⎩⎨⎧制造玻璃、洗涤剂、建筑材料等用于食品工业,如生产味精、作为食品添加剂等3.纯碱制法⎩⎨⎧路布兰法索尔维法侯氏制碱法解读索尔维制碱法:1.关键反应:NaCl +CO 2+H 2O +NH 3===NaHCO 3↓+NH 4Cl 。
2.模拟实验 (1)实验步骤用如图所示装置模拟索尔维法。
锥形瓶中装有碳酸钙粉末,分液漏斗中装有稀硫酸,试管中装有氨盐水,并滴有酚酞溶液。
用冰水浴降低试管内的温度。
打开分液漏斗,观察二氧化碳通入氨盐水的现象。
模拟索尔维法的实验装置(2)实验现象随CO 2的不断通入,溶液的红色逐渐褪去后,溶液中出现白色沉淀。
(3)问题探究①NaHCO 3可溶于水,为什么能得到NaHCO 3沉淀?试用化学平衡的原理解释原因。
提示:可溶性物质的溶解是存在限度的,当相应离子浓度过大时,可溶性物质也会析出,类似于沉淀溶解平衡。
索尔维法通过增大c (Na +)、c (HCO -3),使平衡Na ++HCO -3NaHCO 3(s)的Q <K ,平衡右移,产生沉淀。
②为什么要先向饱和食盐水中通入氨气制得氨盐水,再通入二氧化碳?2提示:CO 2在水中溶解度较小,仅通入CO 2难以获得足量HCO -3;NH 3易溶于水,且能使H 2CO 3H ++HCO -3平衡右移,使HCO -3浓度增大。
③为什么酚酞完全褪色后才有沉淀逐渐析出?提示:开始时2NH 3·H 2O +CO 2===CO 2-3+2NH +4+H 2O ,随着CO 2通入,NH 3·H 2O 消耗完后生成的CO 2-3。
与CO 2、H 2O 反应:CO 2+CO 2-3+H 2O===2HCO -3,当c (HCO -3)增大至一定程度,产生NaHCO 3沉淀。
仁爱版初中化学重点知识精选化学是一门非常有意思的学科,充满了新奇的实验!仁爱版初中化学和你一起共同进步学业有成!侯氏制碱法与索尔维制碱法的比较一、索尔维制碱法(氨碱法)它是比利时工程师苏尔维(1838~1922)于1892年发明的纯碱制法。
他以食盐(氯化钠)、石灰石(经煅烧生成生石灰和二氧化碳)、氨气为原料来制取纯碱。
先使氨气通入饱和食盐水中而成氨盐水,再通入二氧化碳生成溶解度较小的碳酸氢钠沉淀和氯化铵溶液。
其化学反应原理是:NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl将经过滤、洗涤得到的NaHCO3微小晶体,再加热煅烧制得纯碱产品。
2NaHCO3=Na2CO3+H2O+CO2↑放出的二氧化碳气体可回收循环使用。
含有氯化铵的滤液与石灰乳[Ca(OH)2]混合加热,所放出的氨气可回收循环使用。
CaO+H2O=Ca(OH)2,2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O。
优点:原料(食盐和石灰石)便宜;产品纯碱的纯度高;副产品氨和二氧化碳都可以回收循环使用;制造步骤简单,适合于大规模生产。
缺点:首先是两种原料的成分里都只利用了一半——食盐成分里的钠离子(Na+)和石灰石成分里的碳酸根离子(CO32-)结合成了碳酸钠,可是食盐的另一成分氯离子(Cl-)和石灰石的另一成分钙离子(Ca2+)却结合成了没有多大用途的氯化钙(CaCl2),因此如何处理氯化钙成为一个很大的负担。
氨碱法的最大缺点还在于原料食盐的利用率只有72%~74%,其余的食盐都随着氯化钙溶液作为废液被抛弃了,这是一个很大的损失。
二、联合制碱法(又称侯氏制碱法)它是我国化学工程专家侯德榜(1890~1974)于1943年创立的。
是将氨碱法和合成氨法两种工艺联合起来,同时生产纯碱和氯化铵两种产品的方法。
原料是食盐、氨和二氧化碳——合成氨厂用水煤气制取氢气时的废气。
其化学反应原理是:C+H2O=CO+H2CO+H2O=CO2+H2联合制碱法包括两个过程:第一个过程与氨碱法相同,将氨通入饱和食盐水而成氨盐水,再通入二氧化碳生成碳酸氢钠沉淀,经过滤、洗涤得NaHCO3微小晶体,再煅烧制得纯碱产品,其滤液是含有氯化铵和氯化钠的溶液。