化学竞赛分子结构
- 格式:ppt
- 大小:1.18 MB
- 文档页数:75
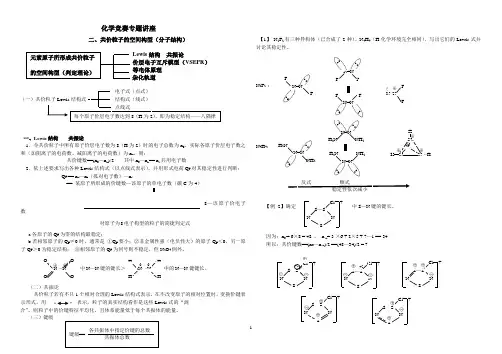
化学竞赛专题讲座二、共价粒子的空间构型(分子结构)Lewis 结构 共振论 价层电子互斥模型(VSEPR ) 等电体原理 杂化轨道一、Lewis 结构 共振论1.令共价粒子中所有原子价层电子数为8(H 为2)时的电子总数为n 0,实际各原子价层电子数之和(加阴离子的电荷数、减阳离子的电荷数)为n v ,则:共价键数==(n 0—n v )/2 其中n 0—n v == n s 共用电子数2.依上述要求写出各种Lewis 结构式(以点线式表示),并用形式电荷Q F 对其稳定性进行判断:Q F == n v —n r (孤对电子数)—n s== 某原子所形成的价键数—该原子的单电子数(碳C 为4)8—该原子价电子数a.各原子的Q F 为零的结构最稳定;b.若相邻原子的Q F ≠0时,通常是 ①Q F 要小;②非金属性强(电负性大)的原子Q F <0,另一原子Q F >0为稳定结构; ③相邻原子的Q F 为同号则不稳定,但N 2O 4例外。
(二)共振论共价粒子若有不只1个相对合理的Lewis 结构式表示,在不改变原子的相对位置时,变换价键表示形式,用 表示,粒子的真实结构看作是这些Lewis 式的“混 合”。
则粒子中的价键特征平均化,且体系能量低于每个共振体的能量。
(三)键级【1】 N 2F 2有三种异构体(已合成了2种)、N 4H 4(H 化学环境完全相同),写出它们的Lewis 式并讨论其稳定性。
N 2F 2 :N 4H 4:【例2】确定中S —N 键的键长。
因为:n 0 = 6×8 = 48 , n v = 3 ×6 + 2×5 + 7—1 == 34 所以:共价键数==(n 0—n v )/2 ==(48—34)/2 = 7(一)共价粒子Lewis 结构式每个原子价层电子数达到8(H 为2),即为稳定结构——八隅律电子式(点式)结构式(线式)点线式对原子为8电子构型的粒子的简捷判定式“ ”F N=N F N=N F F F F N=N F N=N F ⊕ 反式 顺式稳定性依次减小H 2N N=N NH 2 H 2N NH 2 N=N N=NH 2N NH 2H N N H —N N —H ⊕ ⊕ ⊕⊕ Cl +S —SN NSCl +S —S N N S⊕+2Cl +S —S N N S⊕+2Cl +S —S N N S⊕ ⊕ Cl +S —S N NS⊕⊕ O O N —N O O ⊕ ⊕ H HN—N H H0 0 中N —N 键的键长> 中的N —N 键键长。

分子结构第一题(13分)PCl5是一种白色固体,加热到160℃不经过液态阶段就变成蒸气,测得180℃下的蒸气密度(折合成标准状况)为9.3g/L, 极性为零,P—Cl键长为204pm和211pm两种。
继续加热到250℃时测得压力为计算值的两倍。
PCl5在加压下于148℃液化,形成一种能导电的熔体,测得P—Cl的键长为198pm和206pm两种。
(P、Cl相对原子质量为31.0、35.5)回答如下问题:1.180℃下PCl5蒸气中存在什么分子?为什么?写出分子式,画出立体结构。
2.在250℃下PCl5蒸气中存在什么分子?为什么?写出分子式,画出立体结构。
3.PCl5熔体为什么能导电?用最简洁的方式作出解释。
4.PBr5气态分子结构与PCl5相似,它的熔体也能导电,但经测定其中只存在一种P-Br键长。
PBr5熔体为什么导电?用最简洁的形式作出解释。
第二题(12分)NO的生物活性已引起科学家高度重视。
它与超氧离子(O2—)反应,该反应的产物本题用A为代号。
在生理pH值条件下,A的半衰期为1~2秒。
A被认为是人生病,如炎症、中风、心脏病和风湿病等引起大量细胞和组织毁坏的原因。
A在巨噬细胞里受控生成却是巨噬细胞能够杀死癌细胞和入侵的微生物的重要原因。
科学家用生物拟态法探究了A的基本性质,如它与硝酸根的异构化反应等。
他们发现,当16O标记的A在18O标记的水中异构化得到的硝酸根有11% 18O,可见该反应历程复杂。
回答如下问题:1.写出A的化学式。
写出NO跟超氧离子的反应。
这你认为A离子的可能结构是什么?试写出它的路易斯结构式(即用短横表示化学键和用小黑点表示未成键电子的结构式)。
2.A离子和水中的CO2迅速一对一地结合。
试写出这种物种可能的路易斯结构式。
3.含Cu+离子的酶的活化中心,亚硝酸根转化为一氧化氮。
写出Cu+和NO2-在水溶液中的反应。
4.在常温下把NO气体压缩到100个大气压,在一个体积固定的容器里加热到50℃,发现气体的压力迅速下降,压力降至略小于原压力的2/3就不再改变,已知其中一种产物是N2O,写出化学方程式。


分子结构3i.HCN和CS2都是直线型分子,请写出它们的对称元素。
ii.写出H3CCl分子中的对称元素。
iii.写出三重映轴S3和三重反轴I3的全部对称操作。
iv.写出四重映轴S4和四重反轴I4的全部对称操作。
v.写出σxz和通过原点并与x轴重合的C2轴的对称操作C21的表示矩阵。
vi.用对称操作的表示矩阵证明:(a)C21(x)σxy=i (b)C21(x)C21(y)=C21(x)(c)σyzσxz=C21(x)vii.写出ClHC=HCl(反式)分子的全部对称操作及其乘法表。
viii.写出下列分子所归属的点群:HCN,SO3,氯苯(C6H5Cl),苯(C6H6),素(C10H8)。
ix.判断下列结论是否正确,说明理由。
(a)凡直线型分子一定有C∞轴。
(b)甲烷分子有对称中心。
(c)分子中最高轴次(n)与点群记号中的n相同(例如C3h中最高轴次为3)。
(d)分子本身有镜面,它的镜像和它本身全同。
x.联苯C6H5-C6H5有三种不同构象,两苯环的二面角(α)分别为:(a)α=0(b)α=90o,(c)0<α<90o,试判断这三种构象的点群。
xi.SF5Cl分子的形状和SF6相似,试写出它的点群。
xii.画一立方体,在8个项角上放8个相同的球,写明编号。
若:(a)去掉2个球,(b)去掉3个球。
分别列表指出所去掉的球的号数及剩余的球构成的图形所属的点群。
xiii.判断一个分子有无永久偶极矩和有无旋光性的标准分别是什么?xiv.作图绘出Ni(en)(NH3)2Cl2可能的异构体及其旋光性。
xv.由下列分子的偶极矩数据,推测分子的立体构型及其点群。
(a)C3O2(μ=o)(b)SO2(μ=25.40³10-30C²m)(c)N≡C-C≡N(μ=0)(d)H-O-O-H(μ=6.9³10-30C²m)(e)O2N-NO2(μ=0)(f)H2N-NH2(μ=6.14³10-30C²m)(g)H2N--NH2(μ=5.34³10-30C²m)xvi.指出下列分子的点群、旋光性和偶极矩情况:(a)H3C-O-CH3(b)H3C-CH=CH2(c)IF5(d)S8(环形)(e)ClH2C-CH2Cl(交叉式)(f)xvii.下表列出4对化学式相似或相同但偶极矩不同的化合物,试阐明每一对中两个化合物在几何构型上的主要差异。



高中化学竞赛专题考试——分子结构1(路易斯结构式、共振式、VSPER 理论)1.008Zr Nb Mo T cRu Rh Pd Ag Cd In S n S b T e I Hf T a W Re OsIr Pt Au Hg T l Pb Bi Po At Ac-Lr HLi BeB C N O F Na MgAl S i P Cl S K Ca S c T i V Cr Mn Fe Co Ni Cu Zn G a G e As S e BrRb Cs Fr S r Ba RaY La Lu -6.9419.01222.9924.3139.1040.0885.4787.62132.9137.3[223][226]44.9647.8850.9452.0054.9455.8558.9363.5558.6965.3910.8126.9869.7212.0128.0972.61114.8204.4118.7207.2112.4200.6107.9197.0106.4195.1102.9192.2101.1190.298.91186.295.94183.992.91180.991.22178.588.9114.0116.0019.0030.9774.92121.8209.032.0778.96127.6[210][210][210]126.979.9035.454.00320.1839.9583.80131.3[222]He Ne Ar Kr Xe Rn 相对原子质量Rf Db Sg Bh Hs Mt一. 选择题(每题只有一个正确选项,每题2分,共50分)1. 根据鲍林近似能级图,在多电子原子中,基态时,下列电子均处于一定的能级,其中占据能级最高轨道的电子是: ( )A 2,1,1,+1/2B 3,1,1,+1/2C 3,2,1,+1/2D 4,0,0,1/2 2. 下列离子的电子构型可以用[Ar]3d 6表示的是( )A Mn 2+B Fe 3+C Co 3+D Ni 2+3.下列离子半径变小的顺序正确的是( )A F ->Na +>Mg 2+Al 3+B Na +>Mg 2+>Al 3+>F -C Al 3+>Mg 2+>Na +>F -D F ->Al 3+>Mg 2+>Na +4. 下列元素的原子中,第一电离能最大的是 ( )A BeB BC CD N5. 下列物质中,含极性键的非极性分子是()A H2OB HClC SO3D NO26. 下列分子中,没有配位键的是()A COB (BeCl2)2C CH3OBF3D N2H47. NO3—合理的共振式总数为()A 1B 2C 3D 48.下列分子中,键级等于零的是()A.O2 B. F2 C. N2 D. Ne29.原子轨道沿两核连线以“肩并肩”方式进行重叠的是()A. б键B. 氢键C. π键D. 离子键10. 下列物种中,键长最短的是( )A O2B O2+C O2—D O22—11. 下列化合物中,极性最大的是()A CS2B H2OC SO3D SnCl412. 下列物种中,既是路易斯酸,也是路易斯碱的是()ACCl4 B SOCl2 C NH2— D Hg2+13. 估计下列分子中,键角最小的是()()A NH3B PH3C AsH3D SbH314.估计下列分子或离子中,键角最小的是()A NH3B NO3—C NF3D NCl315. 几何形状是平面三角形的离子是()A SO-23 B SnCl-3C CH-3D NO-316. 下列分子或离子为平面四方构型的是()A ICl4—B ClO4—C BrF4+D SF417. 下列分子或离子中,属于三角锥构型的是()A BCl3B H3O+C BrF3D CH+318. 下列化合物中,可能含有卤桥键的是()A SnCl4B BeCl2C CCl4D NCl319. IF5是共价化合物,但液态IF5是电的良导体,原因是IF5二聚后电离,得到各带一个单位正负电荷的阴阳离子,则在该液体中存在的阳离子的几何构型是()A 三角双锥B 四方锥C 平面四方D 变形四面体20 下列哪一个分子的空间构型为折线型()A N3—B I3—C SO32—D CO32—21.下列分子中,偶极矩不为零的是()A BeCl2B BF3C NF3D CH422. 下列分子或离子中,键角最大的是()A XeF2B NCl3C CO-23 D PCl+423 通过测定AB2型分子的偶极距,能够判断:()A分子的空间构型 B 两元素的电负性之差C A—B键的极性D A—B键的键长24. 下列分子中含有两个不同键长的是()A CO2B SO3C SF4D XeF425. 下列分子中,最不容易聚合的是()A N2O5B BeCl2C AlCl3D NO2二、填空题(共50分)26.(10分)指出下列分子中有几个σ键和π键数目。




2022届高一化学竞赛习题:分子结构姓名班级学号1.在已有的原子中,当基态原子的第7电子层只有2个电子时,它的第6层电子数()A.肯定是8个电子B.18个电子C.8~18个电子D.18+2个电子2.形成HCl分子时原子轨道重叠是()A.s—s重叠B.p y—p y重叠C.s—p x重叠D.p x—p x重叠3.下列分子中键有极性,分子也有极性的是()A.CCl4B.CO C.BF3D.PCl54.下列气态卤化氢中,分子偶极矩由大到小的顺序是()A.HCl、HBr、HI、HF B.HF、HCl、HBr、HIC.HI、HBr、HCl、HF D.HCl、HBr、HF、HI5.下列分子中偶极矩不等于零的是()A.BeCl2B.BCl3C.CO2D.NH36.下列分子中几何构型为三角形的是()A.ClF3B.BF3C.NH3D.PCl37.下列哪一个化合物具有直线形分子构型()A.OF2B.O3C.ICl2-D.NO2-8.用价层电子对互斥理论判断下列分子或离子的几何形状为三角锥的是()A.SO3B.SO32-C.NO3-D.CH3+9.用价层电子对互斥理论判断下列分子或离子的几何形状为三角双锥的是()A.SeF6B.AsF5C.XeOF4D.PbCl410.下列分子中含有两个不同键长的是()A.CO2B.SO3C.SF4D.XeF411.在四个原子处在同一个平面上,C原子采用的杂化轨道是()A.sp B.sp2C.sp3D.其它杂化形式12.sp3杂化可以用于描述哪一种分子中共价键的形成()A.H2O B.NH3C.CH4D.三种分子都可以13.叠氮酸的结构式是1、2、3号氮原子采用的杂化轨道类型是()A.sp3、sp、sp B.sp2、sp、sp C.sp3、sp、sp2D.sp2、sp、sp2 14.(2010北京市赛)1998年美国科学家合成出具有极强爆炸力的“+nN”,已知它是带5电荷的呈V形构型,5个氮原子最外层都满足8电子结构,且含2个N≡N,可将其视为“+nN”,则n值为()5A.1 B.2 C.3 D.415.如果已经发现167号元素A,若已知的原子结构规律不变。