化学方程式计算专题复习
- 格式:ppt
- 大小:1.13 MB
- 文档页数:25




最新化学方程式的计算期末复习专题练习(word版 ...(word)一、中考化学方程式的计算1.高铁快速发展方便了人们的出行。
工业上可利用铝和氧化铁在高温下发生置换反应制得铁来焊接钢轨。
若用足量铝与48 kg氧化铁反应,理论上可制得铁的质量是多少?【答案】33.6kg【解析】【分析】【详解】解:理论上可制得铁的质量为x。
23232Al+Fe O=Al O+2Fe16011248kg x高温16048kg =112xx=33.6kg答:用足量铝与48 kg氧化铁反应,理论上可制得铁的质量是33.6kg。
2.酸、碱、盐是初中化学学习的重要内容。
(1)盐酸、硫酸等常见的酸都具有相似的化学性质,是因为它们在水溶液中都解离出____________(填离子符号)。
(2)“84消毒液”可有效杀死新冠病毒,某“84消毒液”瓶体部分标签如图所示:①该瓶“84消毒液”中NaClO的质量为_________g。
②工业可用氯气和氢氧化钠溶液反应来制取NaClO,同时生成食盐的主要成分和水,写出该反应的化学方程式_____________。
(3)实验室有一瓶长期露置于空气中的氢氧化钠溶液,为确定其成分,小组同学进行了如下探究。
①根据实验方案二确定该瓶溶液的溶质成分是什么_____________;②实验方案一不能准确确定溶质成分,请说明理由_______________;③实验室为防止NaOH溶液变质,可采取什么措施_______________。
BaCl、NaOH中的一种或几种。
某校课外小组同学为(4)某固体物质中可能含有NaCl、2了探究其成分,取该固体物质30g完全溶于水中,测得溶液的pH为7,然后将70g某稀硫酸加入该溶液中,充分反应,所加硫酸的量与产生沉淀的关系如图所示。
请根据图示及相关知识回答问题。
①该固体物质中一定不含有的物质是__________(化学式)。
②这种稀硫酸中溶质的质量分数是_________?【答案】H+ 447 Cl2+2NaOH=NaClO+NaCl+H2O 碳酸钠和氢氧化钠氢氧化钠喝碳酸钠溶液都显碱性,都能使无色酚酞变红密封保存 NaOH 19.6%【解析】【分析】【详解】(1)酸是解离出阳离子全是氢离子的化合物,盐酸、硫酸等常见的酸都具有相似的化学性质,是因为它们在水溶液中都解离出氢离子,故填:H+(2)NaClO的质量为1000mL×1.2g/mL×37.25%=447g故填:447;氯气和氢氧化钠溶液反应生成NaClO同时生成食盐主要成分氯化钠和水化学方程式为:Cl2+2NaOH=NaClO+NaCl+H2O,故填:Cl2+2NaOH=NaClO+NaCl+H2O(3)氢氧化钠放置在空气中容易和二氧化碳发生反应生成碳酸钠和水进而变质,故氢氧化钠溶液需要密封保存,氢氧化钠溶液变质分为三种情况;没有变质,溶质为氢氧化钠;部分变质,溶质为氢氧化钠和碳酸钠;全部变质,溶质为碳酸钠;氯化钡可以和碳酸钠产生白色沉淀,实验方案二加氯化钡产生白色沉淀说明有碳酸钠,取上层清液加无色酚酞变红说明溶液中有氢氧化钠,实验方案一氢氧化钠变质不变质加酚酞都会变红,因为碳酸钠溶液是显碱性的,也能使无色酚酞变红,滴加氯化钡产生白色沉淀说明溶液中含有碳酸钠,至于是否含有氢氧化钠无法确定,故填:碳酸钠和氢氧化钠;氢氧化钠喝碳酸钠溶液都显碱性,都能使无色酚酞变红;密封保存;(4)pH 等于7说明溶液呈中性不含NaOH,故填:NaOH解:设稀硫酸溶质质量分数为x ,由图可知当加入50g 稀硫酸时恰好完全反应 2244BaCl H SO =BaSO 2HCl9823350g x 23.3g 9850g x =23323.3gx=19.6%+↓+⨯⨯ 答:稀硫酸溶质质量分数19.6%。

专题17有关化学方程式的计算【知识网络】设未知数写出化学方程式并配平化学方程式计算基本步骤写出有关物质的相对分子质量和已知量、未知量列出比例式,求解答题【考点梳理】考点一、化学方程式计算的方法、格式和步骤1.化学方程式的一般解题步骤:(1)根据题意设未知数。
(2)根据题意正确书写有关的化学方程式。
(3)根据题意找出有关物质的相对分子质量、已知量和未知量。
(4)按正确比例关系,列出比例式,计算未知数的值。
(5)检验答案是否正确后,简明地写出答案。
2. 化学方程式计算基本格式:要制取4克氢气,需要多少克锌?解:设需要锌的质量为x。
Zn + H2SO4 ==== ZnSO4+ H2↑65 2x 4gx =130 g答:需要锌130克。
【考点诠释】根据化学方程式计算注意的问题:1.计算过程必须规范,步骤可概括为“一设、二写、三列、四解、五答”。
2.设未知数X时,不能在X后面带上单位。
3.只写出已知条件和未知量相关的物质的质量比。
4.计算过程中已知量一定要带上单位。
5.一定要将化学方程式配平后才能进行化学计算。
6.计算出的结果一定要带上单位。
7.不纯物质的质量不能代入化学方程式进行计算。
考点二、利用方程式的计算解答一些常见题型根据化学方程式计算的常见题型:1.有关纯净物的化学方程式的计算。
2.反应物或生成物含杂质的计算。
3.有关数据分析的化学方程式的计算。
4.标签型的化学方程式的计算等等。
【考点诠释】考试特点、方向:1.淡化数学计算,突出化学特点。
2.趋向于实际型、开放型、智能型。
3.标签、表格、图像中数据处理的计算是考查的热点,具有灵活性、技巧性的特点。
4.将计算融合到探究或其他题型中一并考查,不独立命题。
【典型例题】类型一、考查化学方程式的计算例1. 用不纯的锌与稀硫酸反应能加快产生氢气的速率,实验室用13g 锌粉和2g 铜粉的混合物与足量的稀硫酸反应,可生成多少克氢气?【思路点拨】锌能与硫酸反应,而铜不能与硫酸反应。


复习专题——化学方程式的计算知识点归纳一、中考化学方程式的计算1.(1)工业上若冶炼出含铁98%的生铁1000t ,至少用含氧化铁80%的赤铁矿石的质量是_________t 。
(2)取一定量该生铁样品,加入一定溶质质量分数的稀硫酸充分反应,加入稀硫酸的质量与产生氢气的质量之间的关系如图所示。
计算所用稀硫酸的溶质的质量分数______。
【答案】1750 t 9.8%【解析】【分析】【详解】解:(1)设:至少需要用含氧化铁80%的赤铁矿的质量为x 。
2323CO +Fe O =2Fe +3CO 16011280%x 1000t 98%⨯ 16011280%x 1000t 98%=⨯ x =1750t 至少需要用含氧化铁80%的赤铁矿的质量1750t 。
(2)设:所用稀硫酸的溶质质量分数为y.2442Fe +H SO =FeSO +H 982y 0.2g↑ 982y 0.2g= y=9.8g 所用稀硫酸的溶质质量分数为=9.8100%9.8%100g g⨯=。
2.实验小组同学将40g 氢氧化钠溶液和60g 硫酸镁溶液混合,恰好完全反应,反应后所得溶液质量为94.2g ,反应的化学方程式为:2NaOH+MgSO 4═Mg (OH)2↓+Na 2SO 4计算: (1)氢氧化镁的质量是______;(2)原氢氧化钠溶液溶质质量分数是多少______?【答案】5.8g 20%【解析】【分析】【详解】(1)由质量守恒定律可知:氢氧化镁的质量=40g+60g-94.2g=5.8g;(2)设:氢氧化钠溶液中溶质的质量为x42422NaOH+MgSO=Na SO+Mg(OH)8058x 5.7g↓8058x5.8g =x=8g原氢氧化钠溶液溶质质量分数是:8g40g×100%=20%。
3.将一定质量的金属锌投入到100g稀硫酸中恰好完全反应,放出气体的质量与反应时间的关系如图所示. 试求:⑴完全反应后生成H2的质量_______________。

【化学】化学方程式专题复习经典一、化学方程式选择题1.“绿色化学”的特点之一是“零排放”.在一定条件下,二氧化碳和氢气可以按照不同比例反应,生成下列有机物.其中二氧化碳和氢气反应,只生成一种产物就能实现“零排放”,该产物化学式是()A.CH4O B.CH2O2C.C2H6O D.C2H4O2【答案】B【解析】【分析】根据“二氧化碳和氢气反应,只生成一种产物”可判断所生成的有机物中C、O元素的原子个数比应与CO2中C、O元素的原子个数相同为1:2;根据所生成有机物中C、O元素的原子个数比,判断四个选项中符合此特点的化学式即该物质的化学式。
【详解】A、根据化学式CH4O,可知该物质中C、O元素的原子个数比为1:1,不符合所生成有机物的特点,不符合题意;B、根据化学式CH2O2,可知该物质中C、O元素的原子个数比为1:2,符合所生成有机物的特点,符合题意;C、根据化学式C2H5OH,可知该物质中C、O元素的原子个数比为2:1,不符合所生成有机物的特点,不符合题意;D、根据化学式C2H4O2,可知该物质中C、O元素的原子个数比为2:2=1:1,不符合所生成有机物的特点,不符合题意。
故选B。
2.在化学反应2A+B2=2AB中,A 与B2反应的质量关系如图所示,现将6g A和8g B2充分反应,则生成AB的质量是A.12g B.11g C.9g D.14g【答案】A【解析】【详解】由两者反应时的质量关系可知,两者反应的质量比是1:1,则可判断6g A和8g B2充分反应时B2会剩余2g,根据质量守恒定律可知生成的AB会是12g。
故选A。
3.食盐不仅可以做调味品,还是一种重要的化工原料。
电解饱和食盐水,不可能得到的产物是()A.H2B.Cl2C.NaOH D.Na2CO3【答案】D【解析】【分析】根据化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和,是因为化学反应前后,元素的种类不变,原子的种类、总个数不变进行分析。


复习专题——化学方程式的计算知识点归纳经典一、中考化学方程式的计算1.洁厕灵是常用的陶瓷清洗液,某同学对某品牌洁厕灵的有效成分含量进行探究。
向一锥形瓶中加入100 g 该品牌的洁厕灵,再加入足量的溶质质量分数为8%的NaHCO 3溶液120 g ,反应结束后溶液的总质量是215.6 g 。
试计算下列问题:(知识卡片)①洁厕灵有效成分是HCl ,洁厕灵中其它成分均不跟NaHCO 3反应。
②HCl 和NaHCO 3反应的化学方程式为HCl+NaHCO 3=NaCl+H 2O+CO 2↑(1) 产生的二氧化碳质量为_________克。
(2) 该品牌洁厕灵中HCl 的质量分数是多少?_____(写出计算过程)【答案】4.4 3.65%【解析】【分析】盐酸和碳酸氢钠反应生成氯化钠、水和二氧化碳,由质量守恒定律可知,反应物的总质量等于生成物的总质量,减少的是生成的气体或沉淀的质量。
【详解】(1) 由质量守恒定律可知,反应物的总质量等于生成物的总质量,减少的是生成的气体或沉淀的质量,故产生的二氧化碳质量为100g+120g-215.6g=4.4g 。
(2) 设100 g 该品牌洁厕灵中HCl 的质量为x322HCl +NaHCO =NaCl +H O +CO 36.544x4.4g↑36.544=x 4.4g x=3.65g该品牌洁厕灵中HCl 的质量分数为:3.65g 100%=3.65%100g⨯ 答:该品牌洁厕灵中HCl 的质量分数为3.65%。
【点睛】=100%⨯溶质质量溶质质量分数溶液质量2.小明想测量某氧化铜样品中氧化铜的纯度(假设其他成分不和酸反应,也不溶于水),进行如下实验:将5g 粉碎后的样品加入烧杯中再加入98g 5%的稀硫酸恰好完全反应。
该样品中氧化铜的质量分数是多少_____?【答案】80%【解析】【分析】根据氧化铜和硫酸反应其他杂质不和硫酸反应进行分析,并化学方程式进行计算。
【详解】解:设样品中氧化铜的质量为X 。
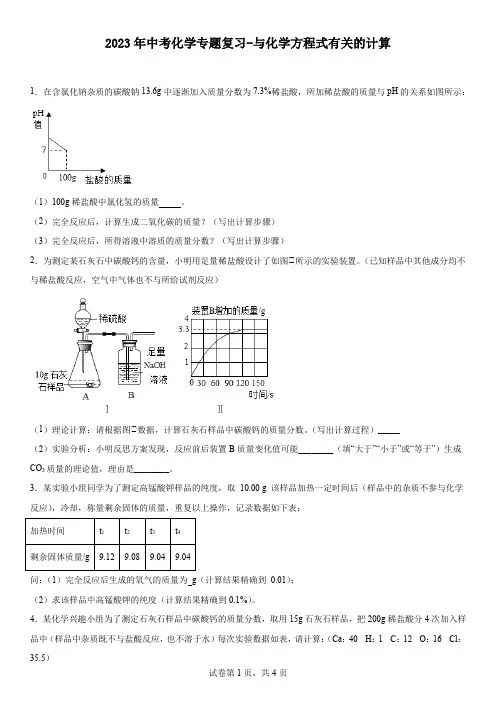
2023年中考化学专题复习-与化学方程式有关的计算1.在含氯化钠杂质的碳酸钠13.6g中逐渐加入质量分数为7.3%稀盐酸,所加稀盐酸的质量与pH的关系如图所示:(1)100g稀盐酸中氯化氢的质量。
(2)完全反应后,计算生成二氧化碳的质量?(写出计算步骤)(3)完全反应后,所得溶液中溶质的质量分数?(写出计算步骤)2.为测定某石灰石中碳酸钙的含量,小明用足量稀盐酸设计了如图Ⅰ所示的实验装置。
(已知样品中其他成分均不与稀盐酸反应,空气中气体也不与所给试剂反应)(1)理论计算:请根据图Ⅰ数据,计算石灰石样品中碳酸钙的质量分数。
(写出计算过程)_____(2)实验分析:小明反思方案发现,反应前后装置B质量变化值可能________(填“大于”“小于”或“等于”)生成CO2质量的理论值,理由是________。
3.某实验小组同学为了测定高锰酸钾样品的纯度,取10.00 g 该样品加热一定时间后(样品中的杂质不参与化学反应),冷却,称量剩余固体的质量,重复以上操作,记录数据如下表:加热时间t1t2t3t4剩余固体质量/g9.129.089.049.04问:(1)完全反应后生成的氧气的质量为g(计算结果精确到0.01);(2)求该样品中高锰酸钾的纯度(计算结果精确到0.1%)。
4.某化学兴趣小组为了测定石灰石样品中碳酸钙的质量分数,取用15g石灰石样品,把200g稀盐酸分4次加入样品中(样品中杂质既不与盐酸反应,也不溶于水)每次实验数据如表,请计算:(Ca:40H:1C:12O:16Cl:9.为测定铜锌合金中铜的质量分数,现将 10g 该合金放入烧杯中,逐渐加入稀硫酸至不再产生气泡时,恰好用去溶质质量分数为 20%的稀硫酸 49g 。
试计算该合金中铜的质量分数 _________。
10.某校化学兴趣小组在参加社会实践活动时,监测到一湿法冶铜厂排放的废水中含有硫酸和硫酸铜两种污染物,为测定该废水中各污染物的含量,给冶铜厂处理废水提供参考,该小组的同学进行了以下实验:取废水300g ,向其中加入溶质质量分数为20%的氢氧化钠溶液,测得沉淀质量与所加入氢氧化钠溶液的质量关系如图,请计算:(计算结果精确到0.1%)(1)300g 该废水中所含硫酸铜的质量。
初三化学利用化学方程式的简单计算复习题及答案一、选择题1.为测定某样品中金属元素的质量分数,样品只含氧化铜和氧化镁,取10g 该样品,向其中加入150g7.3%的稀盐酸恰好完全反应。
则该样品中金属元素的质量分数为( ) A .24%B .76%C .38%D .7.6%解析:B【解析】【分析】根据质量守恒定律,反应前后元素的质量不变。
【详解】设氧化铜质量为x ,则氧化镁质量为:10g x ﹣ 22CuO +=+80x 732HCl Cu x8Cl 0H O73 22MgO +2HCl=MgCl +H O 407310g x 73x 150g 7.3%80⨯﹣﹣ 根据题意有:73x 40( 150g 7.3%)73(10g x)80⨯⨯⨯﹣=﹣ x 8g = 样品中金属元素质量:242g =7.6g 4648g 0+80⨯⨯ 则该样品中金属元素的质量分数:7.6g 100%=76%10g ⨯ 故选B 。
【点睛】=100%⨯样品中金属元素的质量样品中金属元素的质量分数样品的质量2.Fe 2O 3、CuO 的固体混合粉末a g ,在加热条件下用足量CO 还原,得到金属混合物2.41g ,将生成的CO 2气体用足量的澄清石灰水吸收后,产生0.05mol 白色沉淀。
则a 的数值为A .3.21B .3.59C .4.01D .7.41解析:A【解析】【分析】【详解】根据CO2+Ca(OH)2=CaCO3↓+ H2O中CO2与CaCO3的物质的量的关系,可知CO2为0.05mol,即0.05mol×44g/ mol=2.2g,即碳元素的物质的量为0.05mol,则参加反应的CO物质的量为0.05mol,即0.05mol×28g/ mol=1.4g,然后根据质量守恒定律,可列等式:a+1.4g=2.41g+2.2g,a=3.21g,故选A.3.25℃时,某气态碳氢化合物与氧气混合后装入密闭容器中,经充分反应后,又恢复25℃,此时容器内气体分子是反应前的一半。
知识点一化学方程式计算1.答题模板以“求6.8 gH2O2分解可以得到氧气的质量”为例:2.计算公式(1)有关不纯物质的计算 = =100% = 100%+ =1⨯⨯⨯纯净物的质量混合物的质量纯度纯净物的质量纯净物的质量纯度混合物的质量纯净物的质量杂质的质量纯-杂质的度质量分数(2)有关溶质质量分数的计算=100%=100%+ = =+ = ⨯⨯⨯⨯溶质质量溶质质量溶质的质量分数溶液质量溶质质量溶剂质量溶质质量溶液质量 溶质质量分数(溶质质量溶剂质量-生成沉淀的质量-生成气体的 质)量溶质质量分数溶液质量-反应物中不参与化学反应前各物质反应的固体杂的质量总和质的质量类型一 题中已给出纯净物的质量【典例1】如图是某种胃药的部分标识,胃药中所含的物质能中和胃里过多的胃酸(主要是盐酸)。
某患者按标识上的服用方法服药,服药三天后病情好转。
计算患者在三天内所服的此胃药中:(1)所含Al(OH)3的质量是多少?(2)理论上可中和胃酸中HCl 的质量为多少?【典例2】科学家提出:“硅是未来的石油”,制备粗硅的化学方程式如下:SiO 2+2C Si+ nCO↑。
现以125t石英砂(SiO 2质量分数为96%)为原料,与足量的碳反应制取硅。
请计算: (1)该反应的化学方程式中n = ; (2)制取的硅的质量。
1.科学家们正在努力尝试采用“组合转化”技术,将二氧化碳转化为化工原料乙烯(化学式为C 2H 4),其反应原理为2CO 2+6H 2C 2H 4+4H 2O 。
若生产56t乙烯,则消耗掉的二氧化碳的质量是多少?类型二根据质量差计算纯净物的质量【典例1】某实验小组用氯酸钾和二氧化锰为原料制取氧气,反应过程中测量的有关数据记录如下:试计算:(1)反应完全时生成氧气的质量。
(2)原固体中二氧化锰的质量。
【典例2】某化学兴趣小组同学为回收一块质量为40g的铜锌合金中的铜,将该合金放入烧杯中,逐渐加入稀硫酸至不再产生气泡时,恰好用去稀硫酸100g,烧杯内剩余固体27g。