原花青素的生物合成途径、功能基因和代谢工程
- 格式:pdf
- 大小:789.81 KB
- 文档页数:11

原花青素
1外观
葡萄籽原花青素提取物外观一般为深玫瑰红至浅棕红色精制粉末,低聚物无色至
浅棕色,但因为葡萄籽种类、来源不同,所以在外观、色泽上都存在一定的差异。
2鞣性
原花青素能与蛋白质发生结合。
一般情况下,结合是可逆的。
原花青素一一蛋白
质结合反应是其最具特征性的反应之一。
3溶解性
低聚原花青素易溶于水、醇、酮、冰醋酸、乙酸乙酷等极性溶剂,不溶于石油醚、
氯仿、苯等弱极性溶剂中。
高聚原花青素不溶于热水但溶于醇或亚硫酸盐水溶液,
这一点相当于水不溶性单宁,习惯上称为“红粉”。
聚合度更大的聚合原花青素不
溶于中性溶剂,但溶于碱性溶液,习惯上又称为“酚酸”。
4紫外吸收特性
葡萄籽提取物原花青素水溶液的紫外最大吸收波长为278nm。
因其分子中所含的
苯环结构,在紫外光区有很强的吸收。
可起到“紫外光过滤器”的作用,在化妆品
中可开发研制防晒剂。
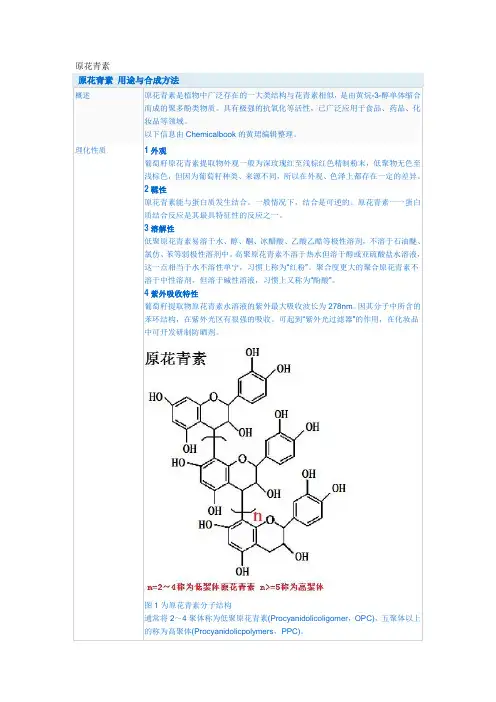
图1为原花青素分子结构
通常将2~4聚体称为低聚原花青素(Procyanidolicoligomer,OPC),五聚体以上
的称为高聚体(Procyanidolicpolymers,PPC)。
现在发现多种植物中含有原花青素,被提取的植物包括葡萄、英国山楂、花生、银杏、日本罗汉柏、北美崖柏、蓝莓和黑豆等。
葡萄籽是葡萄酿酒的主要副产品,且它在葡萄皮渣中占65%,其内多酚类物质含量可达5%~8%,在这些多酚物质中,原花青素含量最高,可达80%~85%。
花青素广泛存在于各种植物的核、皮或种籽等部
位。
图2为原花青素常见来源植物蓝莓。

花青素的研究进展及其应用一、本文概述花青素是一类广泛存在于自然界中的天然色素,因其独特的色彩和生物活性,在食品、医药、化妆品等多个领域具有广泛的应用前景。
近年来,随着科学技术的不断发展,花青素的研究逐渐深入,其在抗氧化、抗炎、抗肿瘤等方面的生物活性得到了广泛关注。
本文旨在综述花青素的研究进展,包括其提取工艺、生物活性、作用机制等方面的最新研究成果,同时探讨花青素在各个领域的应用现状及其未来发展趋势。
通过本文的阐述,旨在为花青素的研究与应用提供全面的参考,为相关领域的研究者和从业人员提供有价值的指导和帮助。
二、花青素的结构与性质花青素是一类广泛存在于自然界中的天然色素,其化学结构属于黄酮类化合物,主要存在于植物的花、果实、茎和叶等部位。
花青素的基本结构是由两个苯环通过一个吡喃环连接而成,呈现出独特的蓝色或紫色。
这些色彩不仅使植物呈现出五彩斑斓的外观,而且赋予了植物诸多生物活性。
花青素的主要性质包括其稳定性、水溶性以及抗氧化性等。
花青素在水溶液中呈现鲜艳的色泽,且其颜色随pH值的变化而变化,这一特性使其在食品工业中具有广泛的应用前景。
花青素具有较强的抗氧化性,能够有效清除体内的自由基,从而起到延缓衰老、预防疾病的作用。
在结构上,花青素具有多种类型,如黄酮醇、黄酮、黄烷酮等,不同类型的花青素在结构和性质上存在一定的差异。
这些差异使得花青素在生物活性方面表现出多样性,如抗炎、抗癌、抗心血管疾病等。
花青素的结构与性质使其成为一类具有重要研究价值的天然色素。
通过深入研究花青素的结构与性质,不仅可以揭示其在植物生长发育和逆境响应中的生物学功能,还可以为花青素在食品、医药等领域的应用提供理论依据和技术支持。
三、花青素的提取与分离花青素作为一类具有丰富生物活性的天然色素,其提取与分离技术在近年来得到了广泛的研究与发展。
花青素的提取主要依赖于其溶于有机溶剂的特性,常用的提取方法包括溶剂提取法、超声波辅助提取法、微波辅助提取法以及超临界流体萃取法等。

植物花青素合成代谢途径及其分子调控一、本文概述植物花青素是一类广泛存在于自然界中的天然色素,它们以其丰富的色彩和独特的生物活性,在植物的生长、发育以及适应环境过程中发挥着重要作用。
花青素的合成代谢途径是一个复杂而精细的网络,涉及到多个酶的催化作用和各种调控机制的协同作用。
本文将对植物花青素合成代谢途径及其分子调控进行系统的阐述,旨在深入理解花青素生物合成的分子机制,挖掘其在植物生物学中的应用潜力,为植物遗传改良和农业生产提供理论依据。
本文将详细介绍植物花青素合成代谢途径的基本框架和关键步骤,包括前体物质的合成、花色苷合成酶系的催化作用以及最终产物的形成等。
通过对这些基本过程的分析,我们可以清晰地了解花青素如何从简单的无机物质逐步转化为复杂的有机色素。
本文将深入探讨花青素合成代谢途径中的分子调控机制。
这包括转录水平、翻译水平和翻译后水平等多个层次的调控,涉及多种转录因子、miRNA、激素信号转导通路以及蛋白质相互作用等。
通过对这些调控机制的研究,我们可以揭示花青素合成代谢途径的复杂性和灵活性,了解植物如何根据环境条件的变化调整花青素的合成量和种类。
本文将总结花青素合成代谢途径及其分子调控在植物生物学中的应用前景。
随着对花青素生物合成机制的深入理解,我们可以利用基因工程、代谢工程等现代生物技术手段,对植物进行遗传改良,提高花青素的含量和品质,进而开发出更具营养价值和观赏价值的植物新品种。
花青素作为一种天然色素和生物活性物质,在食品、医药和化妆品等领域也具有广阔的应用前景。
因此,对植物花青素合成代谢途径及其分子调控的研究具有重要的理论和实践意义。
二、植物花青素合成代谢途径植物花青素(Anthocyanins)是一类重要的次生代谢产物,广泛存在于各类植物的花、果实、叶片和茎干中,赋予植物丰富多彩的色泽。
这些色素不仅影响植物的观赏价值,而且在植物应对环境胁迫(如紫外线、低温、干旱等)和防御病虫害方面发挥重要作用。

原花青素的生物学功能及开发利用前景何沙沙,文利新(湖南农业大学动物医学院,湖南长沙410128)摘要:原花青素属于生物类黄酮家族,具有抗氧化、预防心血管疾病和癌症等多种生物学功能。
综述了原花青素的抗紫外线损伤、抗氧化和清除自由基、抗病驱虫、抗癌、调节免疫功能、降血糖血脂、抗炎、抗疲劳等生物学功能,及其保健功能和应用,并对其在饲料工业中的应用进行了阐述。
关键词:原花青素;生物学功能;应用价值中图分类号:S816.79文献标识码:A文章编号:1006-060X(2011)13-0121-03原花青素(Procyanidins,PC)又称浓缩丹宁酸[1],其主要来源是南欧葡萄籽和白松,但同时也广泛存在于橡树、七叶树、榛木、山楂、苹果、浆果、大麦、豆荚、巧克力、大黄、高粱和蔷薇果等高等植物的器官组织中。
原花青素具有着色功能,在热酸处理下能产生红色花色素。
Marles研究发现,豆科植物的种子一旦成熟PC就会形成难溶性的褐色或红褐色色素。
目前,药理学研究发现,原花青素对自由基有很强的捕捉清除能力,它是一种很好的氧自由基清除剂,具有抑制红细胞膜和低密度脂蛋白脂质过氧化、防止血小板凝聚、防止心脑血管疾病、减缓癌细胞成长等功能[2-3]。
它安全低毒、高效、高生物利用率,在食品添加剂、化妆品、保健品及医药等方面有广阔的应用前景。
1原花青素的理化性质原花青素是一大类多酚化合物的总称,其成分较为复杂。
从葡萄籽提取的原花青素主要是以儿茶素或表儿茶素为单体缩合而成的聚合物,但不同植物提取出的原花青素的聚合度大小不同,其中以低聚体(二聚、三聚、四聚体)的生物活性最强,低聚体又称寡聚体(OPC)[4-5]。
聚合度在五聚体以上就称为高聚体(PPC)。
原花青素的水溶性较好[6],但稳定性较差,易受外界条件影响[7],如易氧化,对光、热、pH值敏感等[8-9],为了解决这一问题,现研究最多的是原花青素微胶囊和脂质体包埋。
2原花青素的生物学功能2.1抗紫外线损伤表皮中的类黄酮可吸收紫外辐射,保护叶和茎的内源组织。

西北植物学报,2012,32(3):0624-0632Acta Bot.Boreal.-Occident.Sin. 文章编号:1000-4025(2012)03-0624-09原花青素聚合作用机理研究进展彭清忠1,2,谢德玉2,3(1吉首大学生物资源与环境科学学院,湖南吉首416000;2植物资源保护与利用湖南省高校重点实验室,湖南吉首416000;3北卡罗莱纳州立大学植物生物系,美国北卡州罗利NC 27695)摘 要:原花青素是一类通过植物类黄酮次生代谢途径合成的聚多酚类化合物,它具有抗紫外线、抗病、抗虫,清除自由基,调节种子休眠和萌发等生理功能。
该文对近年来国内外有关原花青素的结构类型和生物合成机制、原花青素聚合作用机理(包括:原花青素的聚合作用发生在植物细胞中央大液泡、缩合过程中延伸单元前体可能为无色花青素、黄烷-3-醇和花青素等假说)、以及推测参与催化聚合反应的缩合酶(包括:植物多酚氧化酶、植物漆酶和植物过氧化酶)等方面的研究进展进行综述,为深入研究原花青素生物合成机制提供资料。
关键词:原花青素;生物合成;聚合作用;延伸单元;缩合酶中图分类号:Q946.83+6文献标志码:AProgress on the Polymerization Mechanism ofProanthocyanidins during Their BiosynthesisPENG Qing-zhong1,2,XIE De-yu2,3(1College of Biology and Environmental Sciences Jishou University,Jishou,Hunan 416000,China;2Hunan Provincial Key Labo-ratory of Plant Resources Conservation and Utilization,Jishou,Hunan 416000,China;3Department of Plant Biology,North Caro-lina State University,Raleigh NC 27695,USA)Abstract:Proanthocyanidins are oligomers or polymers of flavan-3-ol units synthesized through plant fla-vonoid biosynthetic pathway,and have a variety of functions such as ultraviolet resistance,anti-microbialpathogens,anti-insect pests,scavenging free radicals,regulating plant seed dormancy and germination,etc.Here we concisely review the structures and types of proanthocyanidins and their biosynthesis,and inten-sively summarize recent main progress achieved in the understanding of the late steps of proanthocyanidinbiosynthetic pathway,which includes these hypotheses that the polymerization of proanthocyanidin occursin the vacuole of plant cells;precursors of extension units are leucoanthocyanidins,flanvan-3-ols or antho-cyanidins,and related condensing enzymes are plant polyphenol oxidases,plant laccases or plant peroxidasesinvolved in the polymerization reaction.The review provides certain new insights about proanthocyanidinbiosynthesis.Key words:proanthocyanidins;biosynthesis;polymerization mechanism;extension units;condensing en-zymes 原花青素(proanthocyanidins)又称缩合单宁(condensed tannins),是一类通过植物类黄酮次生代谢途径合成的聚多酚类化合物。

原花青素的生物合成途径、功能基因和代谢工程
原花青素是一类广泛存在于植物中的天然色素,赋予植物花朵、果实和根茎等部位丰富的颜色。
它也被广泛应用于食品、医药和染料等领域。
原花青素的生物合成途径涵盖了多个酶催化的反应步骤。
1. 酪氨酸合成:生物合成途径的起始物质是酪氨酸,它通过多步反应由乳酸酶和其他酶催化生成。
2. 酪氨酸氨基转移:酪氨酸在酚酮类化合物的存在下,通过酪氨酸氨基转移酶催化,将酪氨酸的氨基转移到酚酮上。
3. 羟基化:酪氨酸转移后的酚酮经过多步反应,包括羟基化反应,将羟基添加到酚酮分子的特定位置。
4. 合成花青素:羟基化的酚酮通过合成酶的作用,进一步转化为花青素前体,然后通过酰基转移酶的作用进行酰化,形成具有不同花青素酰基修饰的花青素化合物。
这些反应步骤由多个相关基因编码的酶催化。
在原花青素的生物合成途径中,涉及到的功能基因包括酪氨酸合成酶、酪氨酸氨基转移酶、羟化酶等。
这些基因的表达水平和活性会影响原花青素的合成速率和组合。
针对原花青素的生物合成途径和相关基因,可以进行代谢工程的策略来调节和增加原花青素的产量和种类。
例如,通过基因工程技术调节相关基因的表达水平,可以增加酪氨酸的合成速
率和酪氨酸转移酶的活性,从而提高原花青素的产量。
此外,还可以通过转基因技术引入外源基因,增加特定酶的活性,或者通过基因敲除技术,消除一些负调控基因的功能,来进一步改善原花青素的合成。

原花青素组成原花青素是一类天然存在于植物中的化合物,具有丰富的生物活性和健康功效。
本文将从原花青素的来源、结构、生物活性和健康功效等方面进行阐述。
一、原花青素的来源原花青素存在于许多植物中,如紫葡萄、蓝莓、黑莓、红酒等。
这些植物通常富含花青素类化合物,其中原花青素是最常见的一类。
原花青素在植物的果实、花朵、叶子等部位中广泛存在,不仅赋予植物丰富的色彩,还具有抗氧化、抗炎、抗癌等生物活性。
二、原花青素的结构原花青素是一种多环芳香化合物,其结构特点是含有苯环和吲哚环,并且两个环之间通过一个碳-碳双键连接。
这种结构使得原花青素具有较强的抗氧化能力,可以中和自由基、减轻氧化应激带来的损伤。
三、原花青素的生物活性1.抗氧化作用:原花青素是一种强效的抗氧化剂,可以清除体内的自由基,减缓细胞老化和疾病发生的速度。
2.抗炎作用:原花青素可以抑制炎症反应的发生,减轻炎症引起的疼痛和不适。
3.抗癌作用:研究表明,原花青素可以抑制肿瘤细胞的生长和扩散,有望成为肿瘤治疗的新药物。
4.促进心血管健康:原花青素可以降低血压、抑制血小板凝聚和血栓形成,有助于预防心血管疾病的发生。
5.改善视力:原花青素对视网膜具有保护作用,可以减缓眼睛衰老引起的视力下降。
四、原花青素的健康功效1.抗衰老:原花青素能够中和体内的自由基,减缓细胞老化的速度,延缓衰老过程。
2.抗癌:研究发现,原花青素可以抑制肿瘤细胞的生长和扩散,具有良好的抗癌效果。
3.促进心脑血管健康:原花青素可以降低血压、改善血液循环,预防心脑血管疾病的发生。
4.增强免疫力:原花青素具有抗氧化和抗炎作用,可以提高机体的免疫力,增强抵抗力。
5.保护视力:原花青素对视网膜具有保护作用,可以减缓眼睛衰老引起的视力下降。
6.促进消化:原花青素可以促进消化液的分泌,增加食物的消化吸收效率。
7.抗糖尿病:原花青素可以降低血糖水平,改善胰岛素的分泌和利用。
原花青素作为一种天然存在于植物中的化合物,具有丰富的生物活性和健康功效。

原花青素的研究进展原花青素是一种由黄烷-3-醇单体缩合而成的天然生物类黄酮物质,是一种聚多酚类的化合物,在自然界中分布广泛,其生物活性极强。
本文主要从原花青素的化学结构、生物活性、分析方法及应用等方面的进行介绍,系统地为原花青素下一步的研究及应用提供思路和参考。
标签:原花青素;化学结构;生物活性;分析方法;应用原花青素(procyanidins),又名缩合鞣质,缩合单宁,是花青素类物质的缩合物,主要存在于蔬菜、花卉及水果的果核及果皮中。
原花青素具有极强的生物活性,目前已广泛应用于食品、药品和保健品等领域里。
本文主要从原花青素的化学结构、生物活性、分析方法及应用等方面的进行介绍,系统地为原花青素下一步的研究及应用提供思路和参考。
1.原花青素的化学结构原花青素是一种由黄烷-3-醇单体缩合而成的天然生物类黄酮物质,是一种聚多酚类的化合物。
根据原花青素的聚合程度可分为单倍体、寡聚体和多聚体。
其中单倍体是构成原花青素最基本的结构单元,常见的原花青素单倍体有:儿茶素、表儿茶素、表没食子儿茶素、表阿夫儿茶精,其化学结构见图1。
寡聚体是由2-10个单倍体聚合而成的,该成分为原花青素中研究最多的一类。
多聚体由10个以上的单倍体聚合而成,一般以混合物的形式存在。
2.原花青素的生物活性2.1抗氧化活性原花青素具有极强的抗氧化和清除自由基活性,其作用机制是原花青素的分子结构中的多个酚羟基释放出H+,竞争性地和自由基结合从而保证机体不被氧化。
其自由基清除活性远高于同等含量的维生素C和维生素E,是人类目前发现的活性最强的自由基清除剂之一。
2.2抗肿瘤活性原花青素是通过抗氧化、抗炎、调节信号分子的表达促进肿瘤细胞凋亡、阻滞细胞周期生长来达到抗肿瘤目的的。
原花青素对于多种肿瘤细胞都具有显著的杀伤作用,对于多种致癌剂在启动及促癌阶段都具有显著的抑制作用。
原花青素可有效促进癌细胞的凋亡并提高机体免疫的作用,有研究证明了原花青素可以诱导人类乳癌细胞的凋亡。

原花青素的生物学作用及其应用原花青素是一种天然的色素化合物,广泛存在于植物中,包括紫色或蓝色的水果、蔬菜和花朵中。
近年来,原花青素的生物学作用和应用引起了越来越多的关注和研究。
本文将从以下几个方面探讨原花青素的生物学作用及其应用。
一、原花青素的化学结构及来源原花青素是一种花青素类化合物,其化学结构为苯并吡喃二酮环结构,由苯丙氨酸、酪氨酸和苯丙酮等合成。
原花青素主要来源于植物中的花青素类化合物,包括花青素、花色素和类花色素等。
二、原花青素的生物学作用1. 抗氧化作用原花青素具有很强的抗氧化作用,能够清除体内自由基,减少氧化损伤,预防多种疾病的发生。
研究表明,原花青素的抗氧化作用比维生素E和维生素C还要强。
2. 抗炎作用原花青素能够抑制炎症反应,减轻炎症症状,预防炎症性疾病的发生。
研究发现,原花青素能够抑制白细胞的活化和趋化,减少炎症介质的释放,从而发挥抗炎作用。
3. 抗癌作用原花青素能够抑制肿瘤细胞的增殖和转移,预防癌症的发生和发展。
研究表明,原花青素能够抑制肿瘤细胞的DNA合成和细胞周期,促进肿瘤细胞凋亡,从而发挥抗癌作用。
4. 降血糖作用原花青素能够降低血糖水平,预防糖尿病的发生和发展。
研究表明,原花青素能够促进胰岛素的分泌和利用,降低血糖水平,改善胰岛素抵抗,从而发挥降血糖作用。
三、原花青素的应用1. 食品添加剂原花青素可以用作天然的食品色素,广泛应用于食品、饮料和化妆品等领域。
由于原花青素具有很强的抗氧化作用和安全性,因此被认为是一种理想的食品添加剂。
2. 药物开发原花青素可以用于药物开发,研究表明,原花青素具有很强的抗氧化、抗炎、抗癌和降血糖作用,因此被认为是一种潜在的药物开发对象。
3. 化妆品原料原花青素可以用作天然的化妆品原料,具有很好的保湿、抗氧化和抗皱作用。
由于原花青素是一种天然的化合物,因此被认为是一种安全、有效的化妆品原料。
4. 生物医学研究原花青素可以用于生物医学研究,研究表明,原花青素具有很强的抗氧化、抗炎、抗癌和降血糖作用,可以用于预防和治疗多种疾病。

植物花青素生物合成代谢途径及调控因子研究吴雪霞;张爱冬;朱宗文;姚静;查丁石;李贤【摘要】花青素是决定植物花色的主要色素,具有重要的营养和药用价值,是花色研究和开发的重点.本文主要概括了植物花青素合成代谢过程及其合成途径中主要结构基因和调控基因的类型、作用机制,并介绍了外部环境因素对花青素合成的影响,同时展望了植物花青素合成相关基因的应用前景和发展趋势.【期刊名称】《上海农业学报》【年(卷),期】2018(034)004【总页数】6页(P127-132)【关键词】花青素;结构基因;调控基因;调控机制【作者】吴雪霞;张爱冬;朱宗文;姚静;查丁石;李贤【作者单位】上海市农业科学院设施园艺研究所;上海市设施园艺技术重点实验室,上海201403;上海市农业科学院设施园艺研究所;上海市设施园艺技术重点实验室,上海201403;上海市农业科学院设施园艺研究所;上海市设施园艺技术重点实验室,上海201403;临沂市农业局,临沂276001;上海市农业科学院设施园艺研究所;上海市设施园艺技术重点实验室,上海201403;上海市农业科学院设施园艺研究所;上海市设施园艺技术重点实验室,上海201403【正文语种】中文【中图分类】Q943花青素(Anthocyanins)是一类水溶性天然色素,基本结构为3,5,7-羟基-2-苯基苯并吡喃,属于类黄酮化合物,在细胞质中合成,但在液泡中积累[1-2]。
花青素在植物的花瓣、果实、叶和茎等中广泛分布,使植物呈现红、蓝、紫等颜色[3-4]。
植物中常见6种花青素:天竺葵色素(Pelargonidin,Pg)、矢车菊色素(Cyanidin,Cy)、飞燕草色素(Delphinidin,Dp)、芍药花色素(Peonidin,Pn)、牵牛花色素(Petunidin,Pt)和锦葵色素(Malvidin,Mv)[2,5-7]。
研究表明,花青素与植物抗逆性相关,能提高植物抗低温、干旱和强光等逆境的能力,降低植物紫外辐射和病害的程度,保护植物,减轻损伤[7-8]。
原花青素(Procyanidins,PC)是植物王国中广泛存在的一大类多酚类化合物的总称,起初统归于缩合鞣质或黄烷醇类,随着分离鉴定技术的提高和对此类物质的深入研究与深刻认识,现已成为独树一帜的一大类物质并称之为原花青素。
原花青素主要分布在葡萄、银杏、大黄、山楂、小连翘、花旗松、日本罗汉柏、白桦树、野草莓、海岸松、甘薯等植物中,但研究发现葡萄籽提取物中原花青素的含量最高。
20世纪80年代以来,人们对数十种植物的原花青素低聚体和高聚体进行了生物、药理活性的研究,发现原花青素是一种很强的抗氧化剂,具有抗氧化、抗肿瘤、保护心血管等多种生物学活性。
1原花青素抗氧化性与结构的关系原花青素呈粉末状,易溶于水、乙酸、乙醇、丙酮等溶剂。
原花青素由不同数量的儿茶素或表儿茶素结合而成,最简单的是儿茶素、表儿茶素或儿茶素与表儿茶素形成的二聚体,此外还有三聚体、四聚体等直至十聚体。
按聚合度的大小,通常将二~四聚体称为低聚体,将五聚体以上的称为高聚体。
在各类原花青素中,二聚体分布最广,研究最多,是最重要的一类原花青素。
原花青素之所以表现很强的抗氧化作用,由于B环上具有相邻二酚羟基广泛的电子非定域化,使得相应的氧化形式另外获得稳定状态。
另外,在其高分子结构中,几个与O原子邻位的二羟酚基使得原花青素充分与金属离子(Fe(III),Cu(II),Al(III)及蛋白结合,络合作用的贡献在于阻止了催化自由基反应的金属离子的活性,这是原花青素具有营养和生物学价值的主要特征[1]。
黄烷间的连接类型(C4与C6结合,C4与C8结合)对原花青素捕获自由基抗氧化有很大影响,提示原花青素在水溶液中所采取的构象不同影响了它们的亲水特性,因而影响了它们与水相和脂质相中过氧化氢的相互作用[2]。
二聚体中,因两个单体的构象或键结合位置的不同,可有多种异构体,已分离鉴定的8种结构形式分别命名为B1~B8,其中,B1~B4是由C4→C8键合,B5~B8由C4→C6键合。
原花青素简介原花青素原花青素,简称OPC,是一种有着特殊分子结构的生物类黄酮,是目前国际上公认的清除人体内自由基最有效的天然抗氧化剂。
一般为红棕色粉末,气微、味涩,溶于水和大多有机溶剂。
最新研究表明蓝莓叶提取物原花青素可阻止丙肝病毒复制。
目录简介结构主要作用保健功能安全性能服用剂量化妆应用常见误区简介结构主要作用保健功能安全性能服用剂量化妆应用常见误区展开简介原花青素,英文名是Oligomeric Proantho Cyanidins(OPC),是一种有着特殊分子结构的生物类黄酮,是目前国际上公认的清除人体内自由基最有效的天然抗氧化剂。
一般为红棕色粉末,气微、味涩,溶于水和大多有机溶剂。
一般为葡萄籽提取物或法国海岸松树皮从蓝莓叶中提取的原花青素可以提抗丙肝病毒提取物。
原花青素(葡萄籽提取物)是一种新型高效抗氧化剂,是目前为止所发现的最强效的自由基清除剂,具有非常强的体内活性。
实验证明,OPC的抗自由基氧化能力是维生素E的50倍,维生素C 的20倍,并吸收迅速完全,口服20分钟即可达到最高血液浓度,代谢半衰期达7小时之久。
结构在结构上,原花青素是由不同数量的儿茶素(catechin)或表儿茶素(epicatechin)结合而成。
最简单的原花青素是儿茶素、或表儿茶素、或儿茶素与表儿茶素形成的二聚体,此外还有三聚体、四聚体等直至十聚体。
按聚合度的大小,通常将二~五聚体称为低聚体(简称OPC),将五聚体以上的称为高聚体(简称PPC)。
主要作用血液循环在欧洲,为了改善血液循环、治疗糖尿病性视网膜病、减轻水肿和抑制静脉曲张等,花青素己用于临床治疗几十年。
花青素可以强化毛细血管、动脉与静脉血管,因此,它有消肿化淤的功效。
毛细血管的阻力减少和渗透性改善,使细胞更容易吸收养分与排除废物。
输送养分与运出废物这是血液循环系统的功能。
心脏负责抽压血液;动脉与静脉血管输送血液;而负责运送营养给细胞,又运出废物的是毛细血管。
中国细胞生物学学报 Chinese Journal of Cell Biology2021,43⑴:219-229DOI: 10.11844/cjcb.2021.01.0027植物原花青素生物合成及调控研究进展苏全胜王爽孙玉强梅俊柯丽萍(浙江理工大学生命科学与医药学院,植物基因组与彩色纤维分子改良实验室,杭州310018)摘要 原花青素是通过类黄酮途彳圣生成的一类多酚类化合物。
原花青素具有重要的生物学功能,不仅是植物应对生物和非生物胁迫的一种重要防御手段,还能影响植物外观、风味和品质,因此原花青素合成途径一直是作物性状改良的研究热点。
该文主要在模式植物拟南芥研究的基础 上,综述了原花青素生物合成研究的最新进展,讨论了原花青素遗传工程应用前景和主要限制因 素,旨在为进一步开展原花青素的研究和应用提供参考。
关键词生物合成途径;类黄酮;原花青素;黄烷-3-醇Advances in Biosynthesis and Regulation of Plant ProanthocyanidinsS U Q u an sh en g, W A N G Shuang, S U N Y uqiang, M E I Jun, K E L ipin g(Laboratory o f P lant Genome and Colored Fiber Molecular Improvement, School o f L ife Sciences and Medicine,Zhejiang Sci-Tech University, Hangzhou 310018, China)Abstract P roan th ocyan id in s are a class o f p o ly p h en o lic com p ou n d s produced through the fla v o n o id pathw ay. P roan th ocyan id in s h ave im portant b io lo g ic a l fun ction s. T h ey act as the d efen se m eans o f b io tic and a b io tic stresses, but a lso affect the plant appearance, flavor and quality. T herefore, the b io sy n th esis o f p roan th ocyan id in s has alw ays b een the research h otsp ot in crop trait im provem ent. T h is article r e v ie w s the latest progress in the research o f p roan th ocyan idins b io sy n th esis on the b asis o f m o d el plant A r a b id o p s is th a lia n a,then d iscu sse the a p p lication p rosp ects w ith m ain lim itin g factors o f proanthocyanidins g en etic en gin eerin g, aim in g to p rovid e a referen ce for further research and ap plication o f proanthocyanidins.Keywords b io sy n th esis pathw ay; flavonoid; proanthocyanidin; flavan-3-ol原花青素(p roanthocyanidin s, P A)又名缩合单宁,是植物中重要的多酚类化合物W。
原花青素(Procyanidins,PC)是植物王国中广泛存在的一大类多酚类化合物的总称,起初统归于缩合鞣质或黄烷醇类,随着分离鉴定技术的提高和对此类物质的深入研究与深刻认识,现已成为独树一帜的一大类物质并称之为原花青素。
原花青素主要分布在葡萄、银杏、大黄、山楂、小连翘、花旗松、日本罗汉柏、白桦树、野草莓、海岸松、甘薯等植物中,但研究发现葡萄籽提取物中原花青素的含量最高。
20世纪80年代以来,人们对数十种植物的原花青素低聚体和高聚体进行了生物、药理活性的研究,发现原花青素是一种很强的抗氧化剂,具有抗氧化、抗肿瘤、保护心血管等多种生物学活性。
1原花青素抗氧化性与结构的关系原花青素呈粉末状,易溶于水、乙酸、乙醇、丙酮等溶剂。
原花青素由不同数量的儿茶素或表儿茶素结合而成,最简单的是儿茶素、表儿茶素或儿茶素与表儿茶素形成的二聚体,此外还有三聚体、四聚体等直至十聚体。
按聚合度的大小,通常将二~四聚体称为低聚体,将五聚体以上的称为高聚体。
在各类原花青素中,二聚体分布最广,研究最多,是最重要的一类原花青素。
原花青素之所以表现很强的抗氧化作用,由于B环上具有相邻二酚羟基广泛的电子非定域化,使得相应的氧化形式另外获得稳定状态。
另外,在其高分子结构中,几个与O原子邻位的二羟酚基使得原花青素充分与金属离子(Fe(III),Cu(II),Al(III)及蛋白结合,络合作用的贡献在于阻止了催化自由基反应的金属离子的活性,这是原花青素具有营养和生物学价值的主要特征[1]。
黄烷间的连接类型(C4与C6结合,C4与C8结合)对原花青素捕获自由基抗氧化有很大影响,提示原花青素在水溶液中所采取的构象不同影响了它们的亲水特性,因而影响了它们与水相和脂质相中过氧化氢的相互作用[2]。
二聚体中,因两个单体的构象或键结合位置的不同,可有多种异构体,已分离鉴定的8种结构形式分别命名为B1~B8,其中,B1~B4是由C4→C8键合,B5~B8由C4→C6键合。
微生物生产花青素的原理和方法花青素是一类广泛存在于植物、微生物和一些动物体内的天然色素,其具有丰富的生物活性和抗氧化性质。
近年来,随着人们对天然色素需求的增加,微生物生产花青素的研究逐渐受到关注。
本文将介绍微生物生产花青素的原理和方法。
一、原理:微生物生产花青素的原理是利用微生物代谢途径中的酶系统,通过合成花青素前体分子,最终形成花青素。
具体来说,微生物合成花青素的主要途径是通过苯丙氨酸途径和天门冬氨酸途径。
苯丙氨酸途径是指微生物首先利用苯丙氨酸合成肽键,形成花青素前体分子,然后通过一系列酶催化反应,将花青素前体分子转化为花青素。
天门冬氨酸途径是指微生物利用天门冬氨酸合成花青素前体分子,然后通过一系列酶催化反应,将花青素前体分子转化为花青素。
二、方法:微生物生产花青素的方法主要包括传统培养发酵和基因工程法。
1. 传统培养发酵法:传统培养发酵法是指利用已知能够生产花青素的微生物株系,通过控制培养条件,如温度、pH值、培养基成分等,使其在培养过程中产生大量的花青素。
该方法简单易行,成本较低,适用于规模较小的生产。
常用的微生物株系包括青霉、酵母菌等。
2. 基因工程法:基因工程法是指利用基因重组或基因编辑技术,将与花青素合成相关的基因导入到微生物中,使其能够合成花青素。
该方法可以通过调控基因表达,提高花青素的产量和纯度,具有较高的生产效率。
常用的微生物包括大肠杆菌、酵母菌等。
在基因工程法中,常用的基因编辑技术包括CRISPR-Cas9技术和TAL工具酶技术。
这些技术可以精确地对微生物的基因进行编辑和调控,从而实现高效、精准地生产花青素。
除了传统培养发酵法和基因工程法,还有一些新的技术被应用于微生物生产花青素,如代谢工程和发酵工程。
代谢工程是指通过改造微生物的代谢途径,增强花青素的合成能力。
发酵工程是指利用发酵工艺和反应器等设备,优化微生物生产花青素的过程。
总结:微生物生产花青素是一种新兴的生产技术,具有很大的潜力。
原花青素合成生物学微生物原花青素是一种黄酮类化合物,广泛存在于植物界中,尤其在水果、蔬菜和坚果中含量丰富。
在合成生物学领域,原花青素的合成途径及其调控机制一直是研究的热点。
关于原花青素的合成,它通常是通过苯丙氨酸途径进行的。
首先,植物通过光合作用合成苯丙氨酸,这是原花青素的前体物质。
然后,苯丙氨酸在一系列酶的催化作用下,逐步转化为花青素类化合物。
其中,关键的步骤是苯丙氨酸的氧化反应,这个反应由酚氧化酶催化,将苯丙氨酸氧化为香豆素。
接下来,香豆素经过一系列酶催化反应,逐步转化为原花青素。
在微生物中,原花青素的合成也可以通过类似的途径进行。
一些微生物,如酵母菌和细菌,被用来进行原花青素的生物合成。
通过基因工程和代谢工程的技术,可以在这些微生物中引入或优化原花青素的合成途径,从而提高原花青素的产量。
此外,合成生物学还可以用来研究原花青素的调控机制。
在原花青素的合成过程中,会出现一些“结构基因”,这些基因与合成某一个物质直接相关,如合成花青素的花青素合成酶(ANS)基因。
然而,生物体需要在特定环境下调节相应的生理生化反应,以适应环境。
因此,会出现一类“调节基因”来调节功能蛋白的表达。
这些具有调节基因转录表达功能的蛋白,也被称为转录因子。
在基因转录的过程中,转录因子通过与RNA聚合酶作用到特定的启动子序列元件上,来激活或抑制某一个基因的转录。
总的来说,原花青素的合成生物学研究涉及到了原花青素的合成途径、调控机制以及微生物在原花青素生产中的应用等多个方面。
这些研究不仅有助于我们更深入地理解原花青素的生物合成和调控机制,还有助于提高原花青素的产量,为食品、医药和化妆品等行业提供更多的原材料。
收稿2009-02-04修定 2009-03-05资助国家“863”计划(2006AA10Z110)和国家自然科学基金(30771237)。
*通讯作者(E-mail: chaiyourong1@163.com; Tel: 023-68250744)。
原花青素的生物合成途径、功能基因和代谢工程赵文军, 张迪, 马丽娟, 柴友荣*西南大学农学与生物科技学院, 重庆400716Biosynthetic Pathway, Functional Genes and Metabolic Engineering of ProanthocyanidinsZHAO Wen-Jun, ZHANG Di, MA Li-Juan, CHAI You-Rong *College of Agronomy and Biotechnology, Southwest University, Chongqing 400716, China提要: 原花青素(PA)广泛分布于高等植物中, 与农作物的多种品质性状密切相关。
虽长期受到关注, 但其生物合成途径和主要功能基因的解析则是近年来随着拟南芥等植物突变体研究的深入才取得突破的。
PA经公共苯丙烷-核心类黄酮-原花青素复合途径而合成, 先后涉及12个关键酶(PAL、C4H、4CL、CHS、CHI、F3H、F3’H 、DFR、LDOX/ANS、LAR、ANR、LAC)的催化反应和3种转运蛋白(GST、MATE、ATPase)的胞内转运, 并有6种转录因子(WIP-ZF、MYB、bHLH、WD40、WRKY、MADS)参与调控PA的合成与积累。
这些基因在拷贝数、表达特征、蛋白亚细胞定位、蛋白互作、突变体表型等方面具有显著特点。
PA的代谢工程在牧草品质改良、农产品脱涩、油菜黄籽材料创新、葡萄和葡萄酒品质改良、茶多酚分子育种、作物抗病虫性提高、新型作物拓展等方向具有重要的应用前景, 目前仅在少数方向有所启动, 更待广泛关注和深入研究。
关键词: 生物合成途径; 功能基因; 代谢工程; 原花青素原花青素(proanthocyanidin, PA)又叫缩合单宁(condensed tannin, CT), 是高等植物特有并广泛存在的聚多酚类化合物, 以PA单体、寡聚物或多聚物的形式存在。
PA对于植物具有抗紫外线、抗病、抗虫、清除自由基、调节种子休眠和萌发等生理功能, 并影响作物的适口性、可消化性、保健价值等品质性状。
PA提取物具有多方面的医疗价值, 可用于抗衰老、防治心血管疾病、防治肿瘤等(Dixon等2005)。
近年来, 随着对拟南芥等植物一系列种皮色泽突变体的分子研究的深入, PA的生物合成途径、主要功能基因、分子调控机理等已基本阐明, 为通过代谢工程进行PA相关性状的植物改良奠定了基础(Xie和Dixon 2005; Lepiniec等2006)。
1 植物原花青素的生物合成途径如图1所示, PA的生物合成是由公共苯丙烷途径、核心类黄酮-花青素途径、PA特异途径这3个连续的代谢途径构成的一个复合途径完成的。
1.1 公共苯丙烷途径 公共苯丙烷途径是指从苯丙氨酸到对羟基肉桂酸(香豆酸)的合成途径, 共有3个酶。
苯丙氨酸解氨酶(PAL)脱去苯丙氨酸的氨基,使其转化为反式肉桂酸。
肉桂酸-4-羟化酶(C4H)催化反式肉桂酸4位上的羟基化, 使其转化为反式-4-香豆酸。
4-香豆酸辅酶A连接酶(4CL)催化香豆酸与辅酶A的酯化结合, 使香豆酸得以活化, 可用于类黄酮、木质素等下游分支途径进一步合成各种次生物质(Chapple等1994)。
1.2 核心类黄酮-花青素途径 类黄酮是高等植物中普遍存在的次生代谢物质, 拟南芥中主要为花青素、黄酮醇和PA这三大类, 营养器官中积累花青素和黄酮醇, 种胚中积累黄酮醇, 种皮中积累PA(Chapple等1994)。
作为苯丙烷途径的一个重要分支途径, 植物类黄酮途径又包含黄酮醇、花青素苷、PA、异黄酮、橙酮、鞣红等多个重要的分支途径。
自查尔酮直到花青素的步骤是花青素苷分支途径和PA分支途径都必须经过的公共途径, 本文称为核心类黄酮-花青素途径。
作为所有类黄酮合成的起始步骤, 查尔酮合酶(CHS)将1分子香豆酰辅酶A与3分子丙二酰辅酶A合成为1分子四羟基查尔酮, 再由查尔酮异构酶(CHI)将其转变为柚皮素, 随后由黄烷酮3-羟化酶(F3H)和类黄酮3’-羟化酶(F3’H )分别在3和3’位进行羟化并生成黄烷酮图1 花青素苷、黄酮醇和原花青素等类黄酮物质的生物合成途径[根据Sharma和Dixon (2005)翻译和补充而成]aha10: P-type H+-ATPase, P类型H+-ATPase; ANR: anthocyanidin reductase, 花青素还原酶; ban: banyuls; C4H: cinnamate 4-hydroxylase, 肉桂酸-4-羟化酶; CHI: chalcone isomerase, 查尔酮异构酶; CHS: chalcone synthase, 查尔酮合酶; 4CL: 4-coumarate:CoAligase, 4-羟基肉桂酰辅酶A连接酶; DFR: dihydroflavonol reductase, 二氢黄酮醇-4-还原酶; F3H: flavanone 3-hydroxylase, 黄烷酮3-羟化酶; F3'H: flavonoid 3'-hydroxylase, 类黄酮3'-羟化酶; FLS: flavonol synthase, 黄酮醇合酶; GST: glutathione S-transferase, 谷胱甘肽S-转移酶; LAR: leucoanthocyanidin reductase, 无色花青素还原酶; LDOX: leucoanthocyanidin dioxygenase, 无色花青素双加氧酶; OMT: O-methyltransferase, O-甲基转移酶; PAL: phenylalanine ammonia-lyase, 苯丙氨酸解氨酶; pap1: production of antho-cyanin pigment, 产花青素苷色素突变体; RT: rhamnosyl transferase, 鼠李糖基转移酶; UFGT: uridine diphosphate glucose-flavonoidglucosyltransferase, 尿苷二磷酸葡萄糖-类黄酮葡萄糖基转移酶; tt: transparent testa, 透明种皮突变体; ttg: transparent testa glabrous,透明种皮无毛突变体。
醇, 它在二氢黄酮醇-4-还原酶(DFR)的作用下生成无色花青素, 再在无色花青素双加氧酶/花青素合成酶(LDOX/ANS)的催化下形成花青素(Lepiniec等2006)。
在花、叶、茎表等组织中, 以花青素为底物可进入花青素苷特异途径, 先后经过一系列的糖基化等修饰及向液泡的转运, 最终成为显红、紫等多种色调的花青素苷(Holton和Cornish 1995)。
在种皮等组织中, 以花青素为底物, 进入PA特异途径(图1)。
1.3 原花青素特异途径 花青素还原酶(ANR)将花青素转化成表儿茶素(2,3-顺式黄烷-3-醇), 它是一类PA单体。
在葡萄、茶叶、苜蓿、红豆草等植物中, 无色花青素还原酶(LAR)可以直接将无色花青素转化成儿茶酚(2,3-反式黄烷-3-醇), 但拟南芥缺乏该酶(Dixon等2005)。
随后是转运和聚合,虽然具体机制尚欠明了, 但综合近年来的研究进展(Pourcel等2005; Sharma和Dixon 2005), 我们推测PA单体可能先与谷胱甘肽-S-转移酶(拟南芥中为AtGST26/AtGSTF12)结合并运向液泡膜, 再由位于液泡膜上的MATE家族蛋白(拟南芥中为AtDTX41)和H+-ATPase (拟南芥中为AHA10) (二者可能联合?)将其跨膜转运到液泡中, 最后由漆酶(拟南芥中为AtLAC15)等氧化酶类将其缩合成不同聚合度的PA聚合物。
2 植物原花青素生物合成的功能基因2.1 公共苯丙烷途径的结构基因2.1.1 PAL 我们对NCBI GenBank检索和同源比对该基因后发现(后面的基因同此法), 很多种植物的PAL基因已克隆, 如拟南芥、欧芹、番茄、烟草、菜豆、豌豆、大豆、苜蓿、马铃薯、甘蓝型油菜等。
多数植物中的PAL由一个小基因家族编码, 如拟南芥中有4个成员, 甘蓝型油菜约有2 ̄5个基因与拟南芥每个成员对应(Ni等2008)。
PAL一般都有1个位置保守但长度变化较大的内含子, 唯独拟南芥的AtPAL3有2个内含子。
PAL蛋白一般为700个左右氨基酸, 组成同源四聚体, 是苯丙烷途径的第一个关键酶。
我们搜索SwissModel Repository后发现(后面的基因同此法),酵母、欧芹等PAL以及动物的HAL (组氨酸解氨酶)的晶体结构已经解析, 也有人提出了反应中心和一些活性氨基酸位点。
2.1.2 C4H 已有拟南芥、玉米、烟草、高粱、矮牵牛、金鱼草、菊花、甘蓝型油菜等50种以上植物的C4H基因被克隆, 拟南芥和豌豆只有1个,苜蓿有2个, 亚洲棉有2个以上, 绿豆、长春花等有多个(方从兵等2005)。
C4H一般有2个内含子,位置较保守。
C4H构成细胞色素P450氧化酶超家族的CYP73家族, 催化反应依赖于NADPH和O2,蛋白一般为500个左右氨基酸, 一般认为它具有1个N-端膜锚, 具有血红素结合域、氧结合位点、ERR三联体等, 有多个底物识别位点(SRS), 蛋白为球状体, 拟南芥等植物的C4H晶体结构已经解析(Chen等2007)。
2.1.3 4CL 在大多数维管植物中4CL以基因家族的形式出现, 不同的同工酶功能各异, 拟南芥有4个4CL基因和11个4CL-like基因。
拟南芥、烟草、杨树等植物4CL的研究较为深入, 红树莓、芸香、黄芩、白桦、葡萄、辣椒、丹参、欧芹、大豆等众多植物的4CL也被克隆。
4CL一般有3 ̄6个内含子, 水平同源基因间内含子的个数和位置存在差异。
4CL蛋白中存在2个保守基序, 基序I为SSGTTGLPKGV, 基序II为GEICIRG (Kajita等1997)。
目前尚无4CL蛋白晶体结构解析的报道。
2.2 核心类黄酮-花青素途径的结构基因2.2.1 CHS/TT4 已在拟南芥、玉米、矮牵牛、苜蓿、欧芹、金鱼草、蝴蝶兰、大豆等多种植物中被克隆, 许多植物存在一个CHS基因家族, 但不同物种CHS的拷贝数差异较大, 拟南芥只有1个。