电解质第一课时
- 格式:ppt
- 大小:637.00 KB
- 文档页数:35

电解质(第一课时)教学设计【课标分析】根据新课程的基本理念,化学课堂教学应立足于学生适应现代生活和未来发展的需要,从学生已有的知识和经验出发,经过各种形式的探究活动,使学生体验科学研究的过程,激发学生化学的兴趣,强化科学探究的意识,促进学习方法的转变,培养学生的创新精神、实践能力和人文精神。
教学的核心目标除了使学生真正建构起化学概念外,更重要的是培养他们的能力,如运用科学的思维方法抽象概括出概念的能力。
【教材分析】物质在水溶液中的状态和行为是一个重要的认识领域,很多化学反应都是在水溶液中进行的,因此非常有必要让学生进入这个认识领域。
电解质在人类的生产、生活中有着非常广泛的应用,它们与人类的生命活动密切相关,因此认识电解质具有重要的意义。
【学生分析】物质在水中会发生什么变化?酸、碱、盐的水溶液为什么能够导电?酸、碱、盐有阴阳离子就一定能导电吗?这些对学过初中化学的学生来说,都是有待于进一步探讨的问题;同时对这些问题的探讨可从另外一个角度对化合物进行分类,从而引导学生从不同的视角来认识化合物。
在建立电离的概念时,利用学生已经知道的酸碱盐溶液具有导电性和阴阳离子的知识。
这一节中的概念比较抽象,我们的学生基础不是很好,这就要求教师尽量使抽象的概念形象化,使用实验、视频、图片等直观教具以及实验事实,帮助学生建立和理解概念。
要注重学生的日常概念对化学概念的影响,教师要运用各种策略引发学生的已有认识,让学生有机会说出自己的想法,并让他们进行充分的讨论交流,引导学生大胆的质疑和假设,在探究体验中构建概念。
一、教学目标(一)知识与技能目标1、掌握电解质与非电解质的概念判断方法2、能从电解质溶液或熔融物导电的本质原因分析,理解电离的概念3、能从电离的角度认识酸、碱、盐并能准确书写酸、碱、盐电离方程式(二)过程与方法目标提高学生分析、类比、迁移以及概括的能力。
(三)情感态度与价值观目标1、能以“联想·质疑”激发学生的学习兴趣、能以“迁移·应用”让学生体验学习的成功感、能借助“知识点击”让学习有余力的同学感受化学学习的无穷魅力。

鲁科版化学必修1第二章第二节电解质(第一课时)一、教学目标1、知识与技能:使学生了解电解质、电离等概念的含义;使学生进一步学会用实验方法进行化学研究和学习。
2、过程与方法:通过离子反应和电解质溶液的导电实验,培养学生抽象思维能力和归纳、推理能力;通过硫酸溶液和氢氧化钡反应的实验及现象,重新认识化学反应。
3、情感态度与价值观:结合本节的有关内容和实验,使学生认识宏观现象和微观粒子的有机联系,认识有趣、丰富的微观世界。
二、教学重点、难点1、重点:电解质的电离2、难点:电解质与非电解质的区别和电离方程式的书写三、教学方法直观演示法、引导探究法、讲述法等四、教学用具导电性试验仪等五、课时安排总课时:4课时本节第1课时备课时间:8月22日六、教学过程【导入】电在我们生活中必不可少,比如电灯、电脑等,而常见的能导电的物质除了金属之外,还有我们初中常接触的氯化钠溶液、氢氧化钠溶液等。
同学们能不能想出哪些物质又是不能导电的呢?【回答】塑料、玻璃等等【实验】导电性实验,引导学生观察现象【讲解】通过物理学上根据物体能否导电分为导体和绝缘体,引出在化学上根据化合物在溶液或者熔融状态下能否导电,引出电解质和非电解质。
【板书】第2节电解质(第一课时)一、电解质和非电解质电解质:在水溶液或熔融状态下能够导电的化合物非电解质:在水溶液和熔融状态下都不能够导电的化合物注:1.对象是化合物2.单质、混合物既不是电解质也不是非电解质3.必须是自身电离出的离子导电【课堂练习】判断下列物质是不是电解质?1.氯化钠溶液2.二氧化碳通入水中能够导电3.氯气通入水中能够导电【联想】为什么上述物质在溶液中或熔融状态下具有导电性?【引导】我们知道金属能够导电是因为金属内部有自由移动的带负电的电子,在电场作用下定向迁移,那同学们联想下氯化钠溶液、氢氧化钠溶液能够导电说明溶液中也存在着什么?【学生讨论后归纳】(在教师的引导下沿着以下路径分析归纳)金属能导电→金属内部有自由移动的带负电的电子→盐酸、NaOH溶液、NaCl溶液能导电→溶液中也有自由移动的带电微粒→推论:溶液中有自由移动的分别带负电和正电的阴、阳离子。

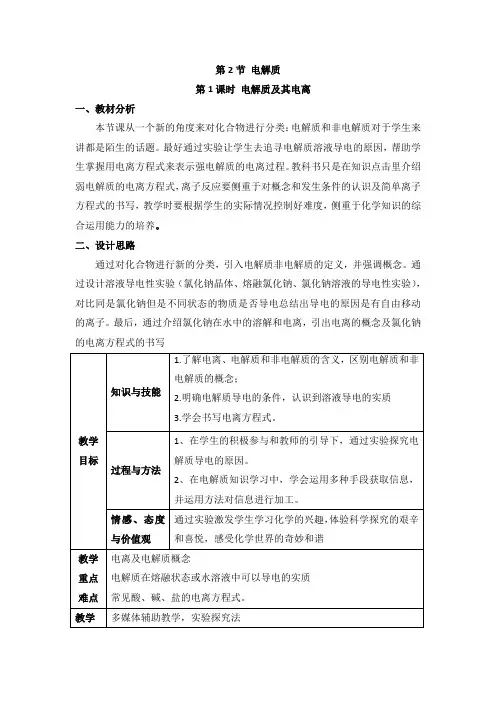
第2节电解质
第1课时电解质及其电离
一、教材分析
本节课从一个新的角度来对化合物进行分类:电解质和非电解质对于学生来讲都是陌生的话题。
最好通过实验让学生去追寻电解质溶液导电的原因,帮助学生掌握用电离方程式来表示强电解质的电离过程。
教科书只是在知识点击里介绍弱电解质的电离方程式,离子反应要侧重于对概念和发生条件的认识及简单离子方程式的书写,教学时要根据学生的实际情况控制好难度,侧重于化学知识的综合运用能力的培养。
二、设计思路
通过对化合物进行新的分类,引入电解质非电解质的定义,并强调概念。
通过设计溶液导电性实验(氯化钠晶体、熔融氯化钠、氯化钠溶液的导电性实验),对比同是氯化钠但是不同状态的物质是否导电总结出导电的原因是有自由移动的离子。
最后,通过介绍氯化钠在水中的溶解和电离,引出电离的概念及氯化钠的电离方程式的书写。
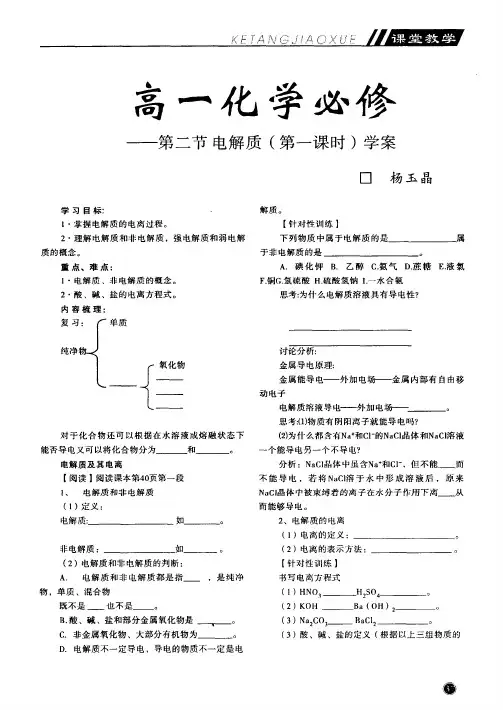




电解质第一课时电解质在水溶液中的存在状态陵县一中付光青魏新瑞课标解读知识再现知识点一:电解质定义:(1)电解质(2)非电解质(3)电离思考:电解质只有在通电条件下才电离吗?2.电离的条件(1)离子化合物(2)共价化合物3.电解质导电的条件是思考:(1) 电解质溶液导电性的强弱与什么有关?(2) 电解质溶液的导电与金属导电有何区别?知识点二、强电解质和弱电解质1、定义:(1)强电解质(2)弱电解质(3)电离平衡2、强弱电解质的比较:(1)电离过程(2)电离程度(3)溶液中存在的微粒(4)相同条件下溶液的导电性强弱思考:①判断强弱电解质的依据是什么?②如何用实验证明强弱电解质?③等物质的量浓度的盐酸、硫酸、醋酸的导电能力比较。
④氯水中存在那些微粒?3、常见强、弱电解质(1)强电解质:常见物质:(2)弱电解质:常见物质:4、电离方程式的书写(1)强电解质用“=”(2)弱电解质电离用“≒”练习:写出下列物质水溶液的电离方程式:(1)硫酸(2)硫酸氢铵(3)小苏打(4)熟石灰(5)氨水知识点三、电解质与化合物分类间关系1、离子化合物与电解质的强弱关系:2、具有极性键的共价化合物与电解质的强弱关系:典题解悟【例1】下列物质的水溶液能导电,但属于非电解质的是:A. CH3CH2COOHB. Cl2C. NH4HCO3D. SO2解析:选项中的4种物质的水溶液都能导电,但原因有所不同。
CH3CH2COOH和NH4HCO3均为电解质,水溶液理应能导电;Cl2和水SO2溶液能导电,是因为它们与水反应,Cl2+HO=HCl+HClO , SO2+ H 2O≒H 2SO 3,因生成物均为电解质,故溶液也导电。
电解质和非电解质都是化合物,Cl2是单质,因此只有SO2为非电解质,答案:D启示:该题易把非电解质的概念与不是电解质概念混淆,从而认为CH3CH2COOH和NH4HCO3均为电解质,而Cl2和SO2都不是电解质,但只有SO2是非电解质,而Cl2是单质。


第二章第一节《电解质》第一课时教学设计
教学目标:
1、能从电解质溶液或熔融物导电的本质原因分析,理解电离的概念。
2、能从电离的角度认识酸、碱、盐并能准确书写酸、碱、盐电离方程式。
3、能运用电解质的知识分析并关注身边中的化学问题。
教学重点:
1、能从电解质溶液或熔融物导电的本质原因分析,理解电离的概念。
2、能从电离的角度认识酸、碱、盐并能准确书写酸、碱、盐电离方程式。
教学难点:
能从电解质溶液或熔融物导电的本质原因分析、理解电离的概念。
教学方法:1、实验教学法
2、探究式教学法。
3、比较式教学法。
4、问题式教学法。
5、启发式教学法。