柚苷酶生产菌TC-01发酵培养条件的优化及其酶学性质的初步研究
- 格式:pdf
- 大小:444.86 KB
- 文档页数:6

产柚苷酶黑曲霉SL2K发酵条件优化伍玉春;陈显玲;苏龙【期刊名称】《中国酿造》【年(卷),期】2018(037)006【摘要】该研究以黑曲霉(Aspergillus niger) SL2K为研究对象,对其产柚苷酶的液态发酵条件进行优化.通过单因素试验对碳源、氮源、诱导物、接种量、初始pH 值和培养时间进行考查,在单因素基础上,选取麸皮粉添加量、蛋白胨添加量、接种量、初始pH值4个因素进行4水平正交试验优化.结果表明,优化后的产酶发酵条件为麸皮粉添加量3%,蛋白胨添加量5%,接种量8%,初始pH值为5.0,鼠李糖0.08%、KH2PO41 g/L,KO 0.5 g/L,MgSO4·7H2O 0.5 g/L,FeSO40.01 g/L,装液量为100 mL/250 mL,摇床转速180 r/min,培养温度28℃,培养时间96 h.在此优化条件下,柚苷酶活力为233.89 U/mL,是优化前的2.13倍.【总页数】6页(P125-130)【作者】伍玉春;陈显玲;苏龙【作者单位】燕京啤酒(玉林)有限公司,广西玉林537000;燕京啤酒(玉林)有限公司,广西玉林537000;玉林师范学院生物与制药学院,广西玉林537000;广西农产资源化学与生物技术重点实验室,广西玉林537000【正文语种】中文【中图分类】Q939.97【相关文献】1.黑曲霉TC-01产柚苷酶分离纯化及其降解内毒素研究初探 [J], 邓媛;毛勇;杨国武;李飞;李皎;张美丽;王燕2.黑曲霉固态发酵产柚苷酶培养基的优化 [J], 钱伟;黄元杰;王先锋;高乾坤;孟娜;魏胜华3.黑曲霉发酵产柚苷酶的工艺优化及热激对提高酶活的影响 [J], 李坤峰; 孙西同; 李佥; 石峰; 徐杰; 罗健; 田晶; 费旭4.黑曲霉菌发酵产柚苷酶培养基配方的优化研究 [J], 张桃桃;张萍;石彦鹏;牛春5.响应面法优化超声强化黑曲霉发酵产柚苷酶的工艺 [J], 石峰;李佥;田晶;费旭;刘向丽;罗健;张楠;陈高俊因版权原因,仅展示原文概要,查看原文内容请购买。

黑曲霉菌发酵产柚苷酶培养基配方的优化研究作者:张桃桃张萍石彦鹏牛春来源:《安徽农业科学》2021年第07期摘要 [目的]筛选出黑曲霉菌发酵产柚苷酶的最优培养基。
[方法]以沙氏琼脂培养基、马铃薯葡萄糖琼脂培养基、察氏琼脂培养基作比较;选出最适黑曲霉菌生长的固体培养基,对固体培养基进行优化,得出最佳固体培养基;通过对发酵培养基不同碳源种类、氮源种类和无机盐的筛选和优化,确定黑曲霉生长和发酵的最适培养基,再通过正交试验确定黑曲霉固态发酵产柚苷酶最优培养基。
[结果]黑曲霉固态发酵产柚苷酶最优培养基组成为0.1%磷酸二氢钾,4%鼠李糖,1%葡萄糖,0.2%无水CaCl2,0.2%七水硫酸镁,0.1%硫酸铵,02%柚皮苷,2%豆粉。
优化后的培养基(618 U/g)比优化前的基础培养基(401 U/g)的酶活提高了54.1%。
[结论]该研究为后续进行菌种遗传改造与分子育种提供了原材料,并为大规模商业化生产奠定了良好的基础。
关键词黑曲霉;发酵培养基;单因素试验;正交试验中图分类号 TS201.3 文献标识码 A文章编号 0517-6611(2021)07-0170-04Abstract [Objective] To screen out the optimal medium for producing naringinase by Aspergillus niger fermentation.[Method] Sartre’s AGAR medium,potato glucose AGAR medium and Tsar AGAR medium were compared.The best solid medium for Aspergillus niger growth was selected and optimized to obtain the best solid medium.Through selection and optimization of different types of carbon source,nitrogen source and inorganic salts in the fermentation medium,to determine the optimal culture medium for growth and fermentation of Aspergillus niger,the optimum medium for producing naringinase by solid fermentation of Aspergillus niger was determined by orthogonal experiment.[Result]The optimal culture medium was: 0.1% potassium dihydrogen phosphate,4% sugar lee,1% glucose,0.2% anhydrous CaCl2,0.2% MgSO4 7H2O,0.1% ammonium sulfate,0.2% naringin,2% soybean meal.The enzyme activity of optimized medium (618 U/g) was 54.1% higher than the optimized base medium (401 U/g).[Conclusion] It provided raw materials for genetic modification and molecular breeding,and laid a good foundation for largescale commercial production.Key words Aspergillus niger;Fermentation medium;Single factor test;Orthogonal test作者簡介张桃桃(1990—),女,宁夏银川人,助理工程师,从事生物制药研究。

微生物柚苷酶的研究进展
宋金鹏;仲秀芳;胡晓晴;田淑斌;范光森
【期刊名称】《河南工业大学学报(自然科学版)》
【年(卷),期】2024(45)2
【摘要】柚苷酶是一种具有α-L-鼠李糖苷酶和β-D-葡萄糖苷酶两种酶学活性的酶,在柑橘类产品脱苦、鼠李糖和普鲁宁制备及类固醇的生物转化等方面具有广泛的应用前景。
柚苷酶来源广泛,其主要来源为微生物。
不同来源柚苷酶的酶学性质往往会存在差异,从而影响其应用领域。
系统地从柚苷酶来源、微生物产酶、活力测定、分离纯化与性质、克隆表达、结构、固定化及应用等方面对柚苷酶进行了综述,有助于指导其更好地科学研究和工业化应用。
【总页数】12页(P19-30)
【作者】宋金鹏;仲秀芳;胡晓晴;田淑斌;范光森
【作者单位】德州市纤维检验所;北京工商大学食品与健康学院;淄博新糖源营养健康研究院;北京工商大学北京市食品添加剂工程技术研究中心
【正文语种】中文
【中图分类】TS201.2
【相关文献】
1.柚苷酶产生菌的选育及其酶特性研究进展
2.柚(皮)苷酶的研究进展
3.柚苷酶的生产及其在食品工业中的研究进展
4.微生物来源柚苷酶的研究进展及应用
5.产柚苷酶菌株改良、性质及其在柑橘酒中的应用研究进展
因版权原因,仅展示原文概要,查看原文内容请购买。

产脂肪酶真菌的分离鉴定、产酶条件优化及酶学性质研究的开题报告一、研究背景随着人们生活水平的不断提高,高脂肪食品的消费量逐渐增加。
而高脂肪食品的长期摄入容易导致人体各种代谢疾病的发生,如肥胖、高血脂、心脑血管疾病等。
因此,研究开发高效、环保的脂肪降解酶已经成为了当前生物技术领域的热点。
真菌是脂肪酶的主要产生菌种之一。
目前已经分离出多种产脂肪酶的真菌,并在饲料、乳制品、面包等食品工业中得到广泛应用。
然而,目前已知的产脂肪酶真菌种类还很有限,而且其酶学性质和产酶条件也需要进一步的研究和优化。
因此,本课题将通过对自然环境中的微生物进行筛选和鉴定,分离出一株高效产脂肪酶的真菌,并对其产酶条件和酶学性质进行研究和分析,以期为生产上的应用提供科学依据和技术支持。
二、研究内容和方法1. 真菌的分离鉴定本研究将从自然环境中采集样本,通过板培法、毛细管扩散法等方法筛选出能够产生脂肪酶的菌种,并通过形态学、生理生化、分子生物学等方法进行鉴定和分类。
2. 产酶条件的优化通过单因素试验和正交试验等方法,对影响真菌产酶的因素进行优化,如温度、pH值、培养基成分、培养时间等。
3. 酶学性质的研究将分离出的真菌进行大量培养,提取纯化脂肪酶,并进行酶学性质的分析和研究,如酶的催化效率、热稳定性、pH稳定性、底物特异性等。
三、预期结果本研究预计可以成功分离出一株高效产脂肪酶的真菌,并通过优化培养条件、提高酶的活性和稳定性等手段,进一步提高其产酶能力和应用价值。
同时,对其酶学性质和催化机理的深入研究也将为其在工业生产中的应用提供科学依据和技术支持。
四、研究意义本研究将为开发高效、环保的脂肪降解酶提供新的思路和方法,并为其在食品、医药、生物燃料等领域的应用提供技术支持和料源基础。
同时,通过研究其催化机理和特异性等酶学性质,也将为更深入地理解生物催化反应的本质提供新的思路和方向。
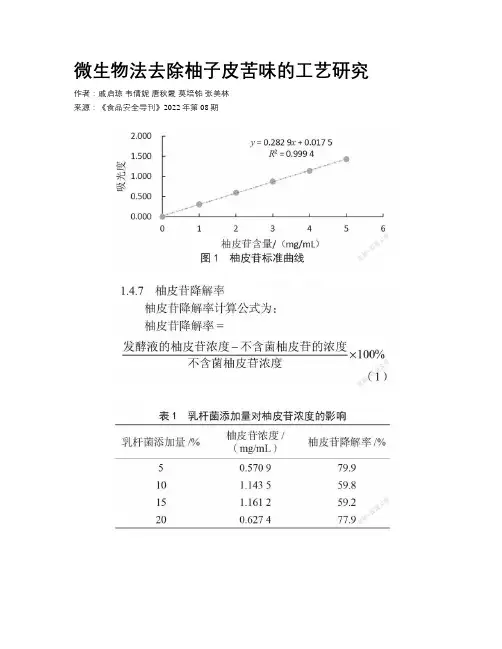
微生物法去除柚子皮苦味的工艺研究作者:戚启琼韦倩妮唐秋霞莫培铭张美林来源:《食品安全导刊》2022年第08期摘要:本研究以柚皮干為原料,用乳杆菌作为发酵菌种,以柚子皮中的主要苦味物质柚皮苷为标准物制作标准曲线,通过单因素试验得到去除柚子皮苦味的最佳条件为乳杆菌添加量5%、柚皮浆添加量40%、培养温度35 ℃以及培养时间48 h,柚皮苷苦味降低率最大。
关键词:乳杆菌;柚皮苷;柚子皮;发酵;去苦Study on Bitter Removal of Grapefruit Peel by Microbial MethodQI Qiqiong, WEI Qianni, TANG Qiuxia, MO Peiming, ZHANG Meilin (Beihai Vocational College, Beihai 536100, China)Abstract: In this study, dried grapefruit peel was used as raw material, Lactobacillus was used as fermentation strain, and naringin, the main bitter substance in grapefruit peel, was used as the standard material to make the standard curve. Through single factor test, it was found that the best conditions to remove the bitter taste of grapefruit peel were the addition of Lactobacillus 5%,the addition of grapefruit pulp 40%, the culture temperature 35 ℃ and the culture time 48 h, the bitterness reduction rate of naringin was the largest.Keywords: Lactobacillus; naringin; grapefruit peel; fermentation; go bitter柚子果肉口感好,柚子皮的活性成分多,但柚子皮味辛苦甘,其苦味在使用柚子皮制作产品时影响较大,因此在开发利用柚子皮制作果脯、果酒等产品时,需去除柚子皮的苦味物质[1-2]。

江苏农业学报(JiangsuJ.ofAgr.Sci.)ꎬ2023ꎬ39(6):1427 ̄1436http://jsnyxb.jaas.ac.cn林㊀静ꎬ罗㊀莲ꎬ杨㊀爽ꎬ等.产柚苷酶菌株改良㊁性质及其在柑橘酒中的应用研究进展[J].江苏农业学报ꎬ2023ꎬ39(6):1427 ̄1436.doi:10.3969/j.issn.1000 ̄4440.2023.06.019产柚苷酶菌株改良㊁性质及其在柑橘酒中的应用研究进展林㊀静ꎬ㊀罗㊀莲ꎬ㊀杨㊀爽ꎬ㊀李㊀萍ꎬ㊀张志清ꎬ㊀陈安均ꎬ㊀刘兴艳(四川农业大学食品学院ꎬ四川雅安611130)收稿日期:2022 ̄10 ̄10作者简介:林㊀静(1997-)ꎬ女ꎬ四川巴中人ꎬ硕士研究生ꎬ研究方向为食品微生物与发酵ꎮ(E ̄mail)1294684290@qq.com通讯作者:刘兴艳ꎬ(E ̄mail)lxy05@126.com㊀㊀摘要:㊀柚苷酶是由α ̄L ̄鼠李糖苷酶及β ̄D ̄葡萄糖苷酶组成的复合酶ꎬ不同来源的柚苷酶在酶学性质和结构特性上有一定的差异ꎬ目前柚苷酶的主要来源是真菌ꎬ真菌来源的柚苷酶最适温度为50~60ħꎬ最适pH值范围为4.0~6 0ꎬ但柚苷酶的整体结构㊁两种单组分酶的比例构成ꎬ至今尚无详尽的报道ꎮ柚苷酶作用于柑橘酒时ꎬ不仅能脱苦ꎬ还能提高柑橘酒的香气ꎬ其在提高柑橘酒的品质方面具有潜在的应用价值ꎮ本文对柚苷酶的酶学特性㊁结构特性㊁柑橘酒中的苦味物质及柚苷酶在柑橘酒中的应用等进行了综述ꎬ以期为柚苷酶的进一步研究和应用提供理论支持ꎮ关键词:㊀柚苷酶ꎻ酶学性质ꎻ柑橘酒ꎻ柚皮苷ꎻ脱苦ꎻ增香中图分类号:㊀TS255.46㊀㊀㊀文献标识码:㊀A㊀㊀㊀文章编号:㊀1000 ̄4440(2023)06 ̄1427 ̄10ResearchprogressonthestrainimprovementꎬpropertiesofnaringinaseanditsapplicationincitruswineLINJingꎬ㊀LUOLianꎬ㊀YANGShuangꎬ㊀LIPingꎬ㊀ZHANGZhi ̄qingꎬ㊀CHENAn ̄junꎬ㊀LIUXing ̄yan(CollegeofFoodScienceꎬSichuanAgriculturalUniversityꎬYaan611130ꎬChina)㊀㊀Abstract:㊀Naringinaseisacomplexenzymecomposedofα ̄L ̄rhamnosidaseandβ ̄D ̄glucosidase.Therearesomedifferencesintheenzymaticpropertiesandstructuralpropertiesofnaringinasefromdifferentsources.Atpresentꎬthemainsourceofnaringinaseisfungi.Theoptimaltemperaturerangeofnaringinasefromfungiis50-60ħ.TheoptimalpHrangeofnaringinasefromfungiis4.0-6.0.Howeverꎬthestructureofnaringinaseandtheproportionoftwosingle ̄componenten ̄zymeshavenotbeenreportedindetail.Whennaringinaseisappliedtocitruswineꎬitcannotonlyremovebitternessꎬbutalsoimprovethearomaofcitruswine.Ithaspotentialapplicationvalueinimprovingthequalityofcitruswine.Inordertoprovidetheoreticalsupportforfurtherresearchandapplicationofnaringinaseꎬtheenzymaticandstructuralpropertiesofna ̄ringinaseꎬthebittersubstancesincitruswineandtheapplicationofnaringinaseincitruswinewerereviewedinthispaper.Keywords:㊀naringinaseꎻenzymaticpropertiesꎻcitruswineꎻnaringinꎻdebitteringꎻflavorenhancement㊀㊀柚苷酶是由α ̄L ̄鼠李糖苷酶(α ̄L ̄rhamnosi ̄daseꎬEC.3.2.1.40)和β ̄D ̄葡萄糖苷酶(β ̄D ̄glucosi ̄daseꎬEC.3.2.1.21)组成的复合酶[1 ̄2]ꎮ柚苷酶是一种非常重要的工业酶ꎬ在柑橘酒的加工去苦㊁增强果酒香气等方面具有重要的应用价值[3 ̄4]ꎮ目前国内外已有许多关于柚苷酶的研究ꎬ但主要集中在菌株筛选[5 ̄6]㊁发酵条件优化[7 ̄8]及酶的分离纯化[9 ̄11]等方面ꎬ对其酶学特性和结构特性的深入研究较少ꎮ目前已有大量产柚苷酶的微生物被筛选出来ꎬ但在7241实际应用时ꎬ柚苷酶活力低下㊁生产成本高的问题仍然没有得到解决ꎮ柚苷酶来源广泛ꎬ不同来源的柚苷酶在酶学特性和分子结构方面存在一定的差异ꎬ对柚苷酶的酶学特性和结构特性进行分析将有助于阐明它们的催化反应和底物识别机制ꎬ挖掘其潜在应用价值ꎮ柑橘酒是以柑橘为主要原材料ꎬ经酒精发酵㊁脱苦㊁陈酿㊁澄清等工艺制成的低度果酒[12]ꎮ当前中国柑橘酒工业化生产还很少见ꎬ这是因为柑橘酒加工过程中会产生强烈的苦味[13]ꎬ对产品的口感造成很大的影响ꎮ研究结果表明柑橘酒的苦味主要是由柚皮苷和柠檬苦素等物质造成[14]ꎮ其中ꎬ柚皮苷不仅是典型的黄酮类苦味物质ꎬ还为柑橘酒提供了色素㊁风味物质㊁抗氧化剂ꎬ其含量高低会对酒的色泽㊁口感㊁稳定性㊁生物活性等产生重要的影响[15]ꎬ因此ꎬ它是一种不可忽略的苦味成分ꎮ柚苷酶能有效降低柚皮苷的含量ꎬ将其转化为无苦味的柚皮素ꎬ使柑橘酒苦味降低ꎬ保持其稳定性和感官特性ꎮ分子末端含有α ̄鼠李糖苷和β ̄葡萄糖苷的天然糖苷ꎬ均可作为柚苷酶的底物ꎮ因此ꎬ柚苷酶在食品工业中具有极其重要的作用ꎮ目前国内外都有商业化的柚苷酶上市ꎬ商业化的柚苷酶一般来源于黑曲霉和青霉菌ꎬ但由菌株发酵得到的柚苷酶分离纯化困难ꎬ纯化成本高ꎬ且发酵产物还含有其他水解酶ꎬ易产生副产物ꎬ这都不利于柚苷酶的纯化ꎮ本文将分别对柚苷酶的来源㊁酶学特性㊁结构特性㊁柑橘酒中苦味物质及柚苷酶在柑橘酒中的应用进行介绍ꎬ以期为柚苷酶的高值化利用提供理论支持ꎮ1㊀柚苷酶菌株筛选及菌株改良技术研究1.1㊀柚苷酶柚苷酶最早从芹菜种子中分离出来ꎬ后在柚子叶中也发现了柚苷酶ꎬ随着研究深入ꎬ陆续从许多植物㊁动物和某些微生物中分离获得了柚苷酶[16 ̄18]ꎮ然而ꎬ由于生产成本及环境因素的限制ꎬ现在市面上的柚苷酶产品几乎都来自于微生物ꎬ微生物来源的柚苷酶大多是胞外酶ꎬ且需要在培养基中添加诱导物如柚皮苷来诱导菌株产酶[19]ꎬ诱导物价格昂贵ꎬ这在一定程度上增加了柚苷酶的生产成本ꎮ已有研究结果表明ꎬ产柚苷酶的微生物菌株主要有两种ꎬ一种是曲霉ꎬ另一种是青霉ꎮ然而ꎬ由于黑曲霉菌的培养技术和在食品工业生产中的应用技术更加成熟ꎬ同时还由于其次生代谢产物的安全性相对较高ꎬ因此更适合食品工业生产的大规模应用ꎮ1.2㊀柚苷酶菌株筛选方法柚苷酶菌种可从自然环境中直接筛选得到ꎮ筛选产柚苷酶菌株常用到的方法有半固态试管法㊁定性滤纸显色法㊁透明圈法等[20 ̄21]ꎮ在菌株筛选的早期研究中ꎬ主要采用半固态试管法ꎬ菌株在试管中生长产酶ꎬ柚苷酶将柚皮苷分解形成透明层ꎮ随着培养时间的增加ꎬ柚苷酶在培养基中扩散ꎬ透明层逐渐变大ꎬ透明层的大小可判断菌株产酶能力的大小ꎮ该方法可初步获得产柚苷酶能力较强的菌株ꎮ但由于柚皮苷溶解度低ꎬ会影响对透明层的观察ꎬ从而降低实验结果的准确性ꎮ定性滤纸显色法是利用菌株产生的柚苷酶消耗掉柚皮苷后与柚皮苷显色液发生颜色反应而筛选菌株的方法ꎮ该筛选方法操作简单ꎬ但由于定性滤纸表面呈现的颜色不能作为确定该菌株产酶能力的定量依据ꎬ因此需要对产酶菌株进一步筛选ꎮ透明圈法是一种快速初步筛选菌株的方法ꎬ利用透明圈法筛选菌株时ꎬ在固体培养基中混入一些溶解性差的营养成分ꎬ使培养基浑浊㊁不透明ꎮ如果培养基上生长了目的菌株ꎬ就会利用这种营养成分ꎬ在菌落周围产生透明圈ꎮ有学者发现ꎬ与半固态试管法形成的透明层相比ꎬ透明圈法形成的透明圈不仅更容易观察ꎬ且可根据透明圈大小判断菌株产酶能力的强弱[22]ꎬ实验操作简单ꎬ透明圈法是目前筛选产柚苷酶菌株常用方法ꎮ1.3㊀柚苷酶菌株改良技术柚苷酶来源广泛ꎬ但自然筛选得到的菌株产生柚苷酶活力较低ꎬ需要对菌株进行改良以提高产酶活力ꎬ目前改良产柚苷酶菌株常用到的技术有物理诱变㊁化学诱变[23]及基因重组技术[24]等ꎮ1.3.1㊀物理诱变㊀物理诱变是目前常用的菌株改良技术之一ꎬ即使用紫外线㊁X射线㊁中子㊁微波㊁超声波等诱变源对菌株进行诱变ꎬ使菌株发生突变的技术ꎮ物理诱变所用到的设备简单㊁操作方便ꎬ利用诱变源进行诱变ꎬ可得到大量的高产菌株ꎬ在微生物的诱变育种中发挥了极其重要的作用[25]ꎮ袁文博等[26]利用常温室压等离子体技术对1株产柚苷酶菌株互隔交链孢霉(Alternariaalternate)SK.37001进行诱变ꎬ获得了1株高产柚苷酶菌株(Alternariaal ̄8241江苏农业学报㊀2023年第39卷第6期ternate)SK.37002ꎬ产酶活力比原始菌株提高了208%ꎮ黄超等[27]从腐烂柚皮中筛选到1株黑曲霉(Aspergillusniger)ꎬ并对其进行紫外诱变ꎬ选育得到了1株酶活力达933 3U/ml的突变菌株ꎬ产酶活力是原始菌株的2 25倍ꎮ1.3.2㊀化学诱变㊀化学诱变是指利用碱基类似物㊁脱氨剂㊁烷化剂等化学诱变剂使菌株发生突变的技术ꎬ目前常用的诱变剂有亚硝基胍(NTG)㊁乙烯亚胺(EI)㊁硫酸二乙酯(DES)㊁叠氮化钠(NaN3)等ꎮ化学诱变只需少量的药剂和简单的设备ꎬ具有经济方便㊁快速高效的优点[25]ꎮ陈玲等[28]采用NTG对出发菌株孢子进行诱变ꎬ得到1株突变菌株3 ̄54 ̄NTG ̄16ꎬ测定其酶活力达770 06U/mlꎬ比出发菌株提高了近100%ꎮ但在使用化学诱变剂时ꎬ一些化学诱变剂如NTG㊁DES等对人体健康有一定的危害ꎬ操作时应做好防护ꎬ减少与诱变剂接触ꎮ1.3.3㊀基因重组技术㊀基因重组技术是将生物体内控制特定性状的基因作为外源基因ꎬ按照人为意愿定向改变生物遗传形状的技术ꎬ外源基因经体外重组后可转入到受体体内并复制㊁转录㊁翻译㊁表达ꎬ从而使受体获得供体特定的性状与功能[29]ꎮ利用基因重组技术ꎬ寻找合适的微生物来源的柚苷酶基因以及合适的表达载体ꎬ从而使柚苷酶高效表达ꎬ对提高柚苷酶的酶活力及其应用具有重要意义ꎮ现已有关于柚苷酶中的α ̄L ̄鼠李糖苷酶通过酵母细胞克隆和表达的相关报道[30 ̄32]ꎬ但由于柚苷酶是一种复合酶ꎬ并不是单一的酶系ꎬ所以使得产柚苷酶微生物的基因工程育种难度较大ꎬ因此在构建产柚苷酶的基因工程菌时需对两种酶的结构性质及相互关系进行进一步的深入研究ꎮ1.3.4㊀复合诱变㊀复合诱变是指用两种或两种以上的诱变剂对生物体进行处理ꎬ从而获得突变体的方法ꎬ包括两种或多种诱变剂先后使用㊁同一种诱变剂的重复作用㊁两种或多种诱变剂的同时使用ꎮ复合诱变具有协同效应ꎬ比单一诱变效果好ꎮ朱运平等[23]采用紫外线 ̄亚硝酸钠复合诱变ꎬ选育出1株突变菌株UN2ꎬ该菌株产柚苷酶活力达147U/mlꎬ且具有较好的稳定性ꎮXia等[33]对从发霉的柚皮中分离出的柚皮苷酶生产菌株(Aspergillustubingensis)MN589840进行紫外与常压室温等离子体复合诱变ꎬ筛选出1株UA13突变体ꎬ酶活力2475.16U/mgꎬ产柚苷酶活力提高了206%ꎮ这些结果表明复合诱变是筛选高产柚皮苷酶菌株的有效策略ꎮ2㊀柚苷酶的性质2.1㊀柚苷酶的酶学性质酶的适宜温度范围㊁pH值和热稳定性是实现工业化生产必需考虑的因素ꎬ也是限制很多酶工业化生产的重要因素ꎮ反应体系的温度和pHꎬ不仅会影响底物和产物的溶解性和稳定性ꎬ而且决定着整个生产流程和对设备的要求ꎬ而酶的热稳定性也与酶的利用率㊁原料损耗和生产成本等息息相关[34]ꎮ不同来源的柚苷酶ꎬ甚至相同来源不同类型的柚苷酶在酶学性质上都存在一定差异ꎬ表1总结了部分不同来源的柚苷酶及其酶学性质ꎬ从表中可以看出ꎬ不同来源柚苷酶在分子质量㊁最适温度和最适pH值等方面都各不相同ꎬ但总体上其最适温度为50~60ħꎬ最适pH值为4.0~6 0ꎮ柚苷酶具有α ̄L ̄鼠李糖苷酶和β ̄D ̄葡萄糖苷酶两种酶的活性ꎬ在柚苷酶的作用底物上ꎬ多数柚苷酶都能够同时水解多种糖苷键ꎮα ̄L ̄鼠李糖苷酶作为柚苷酶中重要组成成分之一ꎬ可以特异性地水解聚糖或者糖苷类化合物末端的α ̄1ꎬ2㊁α ̄1ꎬ3㊁α ̄1ꎬ4㊁α ̄1ꎬ6糖苷键ꎬ释放L ̄鼠李糖[35]ꎮ柑橘汁和柑橘酒中的柚皮苷能被α ̄L ̄鼠李糖苷酶水解ꎬ生成苦味稍弱的普鲁宁和鼠李糖ꎬ而柚苷酶中的β ̄D ̄葡萄糖苷酶则进一步水解普鲁宁ꎬ生成无苦味的柚皮素和葡萄糖ꎮ柚苷酶水解柚皮苷的流程如图1所示ꎬ除柚皮苷外ꎬ分子末端含有α ̄鼠李糖苷和β ̄葡萄糖苷的天然糖苷ꎬ如芸香柚皮苷㊁橙皮苷㊁芦丁等ꎬ均可作为柚苷酶的底物[4ꎬ36]ꎮ2.2㊀柚苷酶的结构特性柚苷酶的天然来源广泛ꎬ它们的功能相似但是结构多变ꎮ对柚苷酶的功能域分析有助于对其催化机制与底物识别的理解ꎬ关于柚苷酶的结构研究ꎬ至今尚无详尽报道ꎮ国内外学者对柚苷酶进行研究分析发现其表现为单一的糖蛋白[37 ̄38]ꎬ这表明柚苷酶结构具有单体的特点ꎬ柚苷酶单体结构上具有两个催化位点ꎬ一个位点用于α ̄L ̄鼠李糖苷酶的催化ꎬ另一个位点用于β ̄D ̄葡萄糖苷酶的催化[40]ꎮ目前已有研究结果表明ꎬ酪氨酸作为一种重要的残基在α ̄L ̄鼠李糖苷酶及β ̄D ̄葡萄糖苷酶的作用过程中参与催化[40]ꎬ这似乎也证实柚苷酶是一种单体酶ꎮ但是ꎬ目前在青霉和曲霉的基因组上还没有找到能同时编码α ̄L ̄鼠李糖苷酶与β ̄D ̄葡萄糖苷酶基9241林㊀静等:产柚苷酶菌株改良㊁性质及其在柑橘酒中的应用研究进展因[41 ̄43]ꎮ相反ꎬ关于编码这两种酶的独立基因却被多次报道[44 ̄45]ꎬ同时这两种酶也被很多学者单独分离纯化[39ꎬ46 ̄48]ꎬ这些结果暗示了柚苷酶有可能是由两种酶组成的复合酶ꎬ而不是具有两个酶活性位点的单链结合蛋白质ꎮ表1㊀不同来源的柚苷酶及其酶学性质Table1㊀Naringinasefromdifferentsourcesandtheirenzymaticproperties来源㊀㊀㊀㊀㊀相对分子质量(ˑ103)最适温度(ħ)最适pH值酶活力(U/g)AspergillusnigervanTieghemMTCC2425[49]10~80505.05460.00Cryptococcusalbidus[50]50605.036.00AspergillusnigerTC ̄01[51]-604.06429.30AspergillusnigerFFCC848[52]65.12504.56932.54Penicilliumsp.1523[53]89.02/72.02504.04478.76Aspergillussojae[54]70-6.0-PediococcusacidilacticiDSM20284[54]74605.51200.00图1㊀柚苷酶水解柚皮苷的过程Fig.1㊀Hydrolysisofnaringinbynaringinase㊀㊀虽然目前尚不知道柚苷酶的整体结构ꎬ但是许多学者对柚苷酶的两种组成成分α ̄L ̄鼠李糖苷酶和β ̄D ̄葡萄糖苷酶的单独结构进行了研究ꎬ从CAZy数据库可知ꎬα ̄L ̄鼠李糖苷酶可来自GH78家族㊁GH28家族㊁GH106家族ꎮ随着研究的深入ꎬ不同来源的α ̄L ̄鼠李糖苷酶的晶体结构已被解析(表2)ꎬCui等[55]对来自芽孢杆菌Bacillussp.GL1菌株的柚苷酶进行结晶ꎬ确定了其α ̄L ̄鼠李糖苷酶有5个结构域ꎬ其中4个是β ̄三明治夹心结构ꎬCui指定为结构域N㊁D1㊁D2和Cꎻ另一个是(α/α)6 ̄桶状结构ꎬCui指定为结构域Aꎬ其三维结构如图2所示ꎬ还发现α ̄L ̄鼠李糖苷酶中的(α/α)6 ̄桶状结构提供了一个可容纳鼠李糖基的裂缝ꎬ带负电的氨基酸残基如Asp567㊁Glu572㊁Asp579㊁Glu841等在这个裂缝里可直接与鼠李糖接触发生作用ꎬ表明这些残基是酶催化的活性位点ꎮFujimoto等[56]对StreptomycesavermitilisRha(SaRha78A)及Rha与L ̄鼠李糖结合后的晶体结构进行了研究ꎬ发现其有6个结构域:N㊁D㊁E㊁F㊁A和Cꎬ同时发现Glu636㊁Glu895在酶催化过程中具有关键作用ꎬ这一结论也与Cui等[55]的研究结果类似ꎮ从表2也可以看出ꎬ不同来源的α ̄L ̄鼠李糖苷酶的晶体结构有所差异ꎬ但其结构中都含有催化结构域及β ̄夹层结构域ꎮ0341江苏农业学报㊀2023年第39卷第6期表2㊀不同来源的α ̄L ̄鼠李糖苷酶的结构Table2㊀Structureofα ̄L ̄rhamnosidasefromdifferentsourcesα ̄L ̄鼠李糖苷酶来源菌株㊀㊀α ̄L ̄鼠李糖苷酶结构㊀㊀㊀参考文献Bacillussp.GL1α ̄L ̄鼠李糖苷酶有5个结构域ꎬ其中4个是β ̄三明治夹心结构ꎬ另一个是(α/α)6 ̄桶状结构ꎬ(α/α)6 ̄桶状结构提供1个可容纳鼠李糖基的裂缝ꎬ裂缝里一些带负电的氨基酸残基为催化活性位点ꎮ[55]Treptomycesavermitilisα ̄L ̄鼠李糖苷酶与L ̄鼠李糖结合后的晶体结构有6个结构域:N㊁D㊁E㊁F㊁A和Cꎬ一些氨基酸残基(如:Glu636㊁Glu895)在酶催化过程中具有关键性作用ꎮ[56]AspergillusaculeatusJMUdb058由N端结构域㊁C端结构域㊁2个β ̄折叠结构域及(α/α)6 ̄桶状催化结构域A构成ꎮ[57]Klebsiellaoxytoca由螺旋结构的催化结构域A及β ̄夹层结构的二聚结构域B构成ꎮ[58]图2㊀α ̄L ̄鼠李糖苷酶的三维结构图[55]Fig.2㊀Three ̄dimensionalstructureoftheα ̄L ̄rhamnosi ̄dase[55]㊀㊀有学者对β ̄D ̄葡萄糖苷酶的结构进行了研究[59 ̄60]ꎬ不同来源的β ̄D ̄葡萄糖苷酶的结构有所差异(表3)ꎬPozzo等[61]对GH3家族的β ̄D ̄葡萄糖苷酶的结晶构造(GenBank登录号:2X40 ̄A)进行了报道ꎬ它由(α/β)8 ̄结构域和三明治结构域[6条(α/β)链]及C端纤连蛋白Ⅲ型结构域组成ꎮ孙月龙[57]对棘孢曲霉产生的β ̄D ̄葡萄糖苷酶的三维结构(GenBank登录号:BGL1 ̄ASPAC)进行了模拟ꎬ其三维结构模拟图如图3示ꎮ该酶由1个(α/β)8 ̄结构域和1个具有5条(α/β)链的三明治结构域组成ꎬ其C端没有纤连蛋白Ⅲ型结构域ꎬ呈不规则的卷曲状ꎮ通过比对发现该酶的活性位点是位于2个结构域表面相距较远的Asp280与Glu509ꎮMohsin等[62]对β ̄葡萄糖苷酶的结构进行研究ꎬ结果与前面两位学者的类似ꎮ对于柚苷酶的结构ꎬ虽然目前已有学者对其单组分的结构进行了研究ꎬ但柚苷酶的整体结构㊁柚苷酶两种组成成分的比例构成ꎬ目前尚无详尽的报道ꎮ表3㊀不同来源的β ̄D ̄葡萄糖苷酶的结构Table3㊀Structureofβ ̄D ̄glucosidasefromdifferentsourcesβ ̄D ̄葡萄糖苷酶来源菌株β ̄D ̄葡萄糖苷酶结构参考文献Thermotoganeapolitana由(α/β)8 ̄结构域和三明治结构域[6条(α/β)链]及C端纤连蛋白Ⅲ型结构域组成ꎮ[61]AspergillusaculeatusJMUdb058由1个(α/β)8 ̄结构域和1个具有5条(α/β)链的三明治结构域组成ꎬ其C端没有纤连蛋白Ⅲ型结构域ꎬ呈不规则的卷曲状ꎮ[57]Chaetomiumthermophilum由3个不同的结构域组成:催化磷酸三糖异构酶(TIM)桶状结构域ꎬα/β ̄三明治结构域和纤连蛋白Ⅲ型结构域ꎮ[62]3㊀柚苷酶在柑橘酒酿造中的应用3.1㊀柑橘酒的脱苦3.1.1㊀柑橘酒中的苦味物质㊀了解柑橘中的苦味物质及其降解机理ꎬ有针对性地去除其中的苦味成分对提高柑橘产品的品质至关重要ꎮ柑橘酒中的苦味主要来源于以下三个方面:(1)柑橘原料中所含的黄酮类及其衍生物质ꎬ如芸香柚皮苷㊁柚皮苷㊁新橙皮苷等ꎻ(2)发酵过程中无苦味物质转变成苦味物质ꎬ也就是在榨汁和酿制时产生的 延迟苦味 ꎬ如柠檬苦素㊁诺米林等ꎻ(3)柑橘酒发酵过程中ꎬ由于残糖㊁氨基酸和维生素等营养物质的存在ꎬ使得乳酸菌㊁产苦味杂菌等生长产生的苦味[14 ̄15]ꎮ表4㊁表5总结了柑橘果实及柑橘酒中的主要苦味物质ꎬ从1341林㊀静等:产柚苷酶菌株改良㊁性质及其在柑橘酒中的应用研究进展表中可以看出柑橘酒中柚皮苷的含量远高于柠檬苦素和诺米林ꎬ是柑橘酒中主要的苦味物质ꎮ柚苷酶的作用底物柚皮苷㊁芸香柚皮苷等是存在于柑橘类水果原料中的主要苦味物质ꎬ品种㊁采样地点㊁成熟期及栽培环境不同的柑橘ꎬ其苦味成分的组成和含量也会不同ꎮ因此在柑橘酒酿造过程中ꎬ原料的选择至关重要ꎬ柑橘类水果原料中含有大量的苦味代谢物ꎮ柑橘果肉中的柚皮苷在幼果期和果实膨胀期含量较多ꎬ到成熟阶段含量则逐步下降[63]ꎬ从表4可以看出柑橘果实中的苦味物质主要集中在囊衣㊁果皮和种子中[64]ꎬ因此在进行柑橘酒酿造时ꎬ应选择充分成熟的柑橘原料ꎬ并在榨汁时彻底去除果皮和种子ꎬ降低柑橘酒中苦味物质含量ꎮ图3㊀β ̄D ̄葡萄糖苷酶的三维结构图[60]Fig.3㊀Three ̄dimensionalstructureofβ ̄D ̄glucosidase[60]表4㊀柑橘果实中主要的苦味物质含量Table4㊀Mainbittersubstancesincitrusfruits种类㊀㊀㊀㊀部位㊀㊀㊀黄酮类物质柚皮苷柠檬苦素类物质柠檬苦素诺米林金诺果[65]果汁(mg/ml)0.2300.218果皮(mg/g)0.4224.690-种子(mg/g)0.1349.520沙田柚[66]果汁(mg/ml)0.2000.0020.004果皮(mg/g)5.2900.8460.652种子(mg/g)0.3701.1901.575囊衣(mg/g)4.9100.0230.052表5㊀柑橘饮料中主要的苦味物质含量Table5㊀Mainbittersubstancesincitruswine种类㊀㊀黄酮类物质柚皮苷(mg/L)总黄酮(mg/kg)柠檬苦素类物质柠檬苦素(mg/L)诺米林(mg/L)脐橙汁[67]-4.4300.070碰柑酒[68]566.30010.8702.200椪柑酒[69]-12.87810.023脐橙酒[67]-0.0500.080柚子酒[70]165.69017.080-蜜柚果酒[71]0.1440.048-3.1.2㊀柚苷酶对柑橘酒的脱苦应用研究㊀在柑橘汁和柑橘酒的生产中ꎬ苦味对果酒的风味及品质有一定的影响ꎬ其中以柚皮苷为主要苦味成分[72 ̄73]ꎮ研究结果表明ꎬ在柑橘汁中ꎬ柚皮苷含量大于1 5mg/ml会对果汁的品质产生一定的影响[74]ꎮ采用柚苷酶水解法ꎬ不仅可以有效降低柚皮苷含量ꎬ而且可以保持柑橘类产品原有的风味和营养ꎬ增加消费者的接受程度ꎬ是一项非常有前景的技术ꎮ柚苷酶水解法具有专一性强㊁操作简单㊁不损失风味和营养等优点ꎬ是当前最理想的脱苦方式ꎮ江飞凤等[70]采用柚苷酶对柚子酒进行脱苦ꎬ发现酶添加量2 0g/L㊁反应温度50ħ㊁反应时间60min㊁pH4 0时ꎬ柚子酒2341江苏农业学报㊀2023年第39卷第6期脱苦率为53 67%ꎮ张方艳等[75]采用柚苷酶对柑橘酒进行脱苦ꎬ发现对发酵后的柑橘酒进行加酶处理的脱苦效果比发酵前对鲜榨柑橘汁进行加酶处理的脱苦效果更好ꎬ且当柑橘酒中柚苷酶添加量为6g/L㊁pH7 0㊁反应温度50ħ㊁反应时间60min时ꎬ脱苦效果最好ꎬ柑橘酒脱苦率可达到64 05%ꎮ目前国内外已有柚苷酶上市ꎬ但其在食品工业中并没有广泛应用ꎬ主要原因是缺乏高产柚苷酶的菌株ꎬ且柚苷酶的酶活性低ꎬ柑橘汁和柑橘酒中的低pH值环境也会抑制柚苷酶的活性ꎮ除此之外ꎬ目前对柚苷酶在柑橘酒中的脱苦研究还较少ꎬ大多集中在对柑橘汁的脱苦研究上ꎬ虽已有学者对发酵前脱苦和发酵后脱苦的柑橘酒进行研究[76]ꎬ但是缺乏与原酒的对比ꎮ在用柚苷酶进行脱苦时ꎬ柚苷酶分离纯化成本大ꎬ目前的试验大多是向柑橘汁和柑橘酒中直接加入发酵粗酶液进行脱苦ꎬ这虽然能在一定程度上降低柑橘汁和柑橘酒中的苦味物质ꎬ但发酵液中的其他物质及灭酶活时的高温环境对柑橘汁和柑橘酒的品质也存在一定的不良影响ꎬ后续可针对这些问题进行研究ꎬ提高柑橘酒的品质ꎮ3.2 柑橘酒的增香果酒酿造过程中的某些单萜类物质对果酒的风味有重大贡献ꎬ这些化合物以游离形式如芳樟醇㊁橙花醇㊁香叶醇㊁α ̄松油醇㊁香茅醇㊁氧化芳樟醇或者与糖基结合的香气前体形式存在[77]ꎮ这些香气前体物质多为无味ꎬ以β ̄D ̄吡喃糖苷和二苷的形式存在ꎬ如6 ̄O ̄α ̄L ̄呋喃糖苷 ̄β ̄D ̄吡喃糖苷㊁6 ̄O ̄α ̄L ̄鼠李糖基 ̄β ̄D ̄吡喃糖苷(芦丁苷)和6 ̄O ̄β ̄D ̄吡喃糖苷 ̄β ̄D ̄吡喃糖苷等[71]ꎬ酸解或酶解时可释放出游离态香气物质ꎬ从而影响果酒风味ꎮ与酸解法相比ꎬ酶解法对果酒中的单萜类成分影响较小ꎬ因而更具优势ꎮβ ̄D ̄葡萄糖苷酶水解糖苷键配体中芳香成分和糖基间的糖苷键后ꎬ能有效实现增香ꎮ但当糖苷与双糖相连时ꎬ则需要先被酶如β ̄木糖苷酶㊁α ̄阿拉伯糖苷酶或α ̄L ̄鼠李糖苷酶等水解分子末端的双糖后ꎬβ ̄D ̄糖苷酶才能水解释放糖苷配体[3ꎬ78]ꎬ其水解释放糖苷配体过程如图4所示ꎮ因为香气和苦味物质作为影响柑橘酒品质和风味的两个重要指标ꎬ所以β ̄D ̄葡萄糖苷酶在提升柑橘酒香气和脱苦方面的应用备受关注[3]ꎮ柚苷酶中含有β ̄D ̄葡萄糖苷酶ꎬ柚苷酶作用于柑橘酒时ꎬ不仅能脱苦ꎬ同时还能提高柑橘酒的香气ꎮ有学者对未经脱苦处理的柚子酒和脱苦后的柚子酒香气成分进行分析发现ꎬ脱苦处理后生成了3种新成分ꎬ分别是顺 ̄9 ̄十六碳烯酸乙酯㊁正丙醇和正己酸乙酯ꎬ这3种香气成分之间可以互相协同ꎬ提升柚子酒风味[70]ꎮβ ̄D ̄葡萄糖苷酶能有效提高柑橘酒风味ꎬ然而目前葡萄糖苷酶主要应用于葡萄酒和蓝莓酒上ꎬ在柑橘酒上的研究和应用还比较少ꎬ且柑橘酒在加工过程中的很多因素都会影响β ̄D ̄葡萄糖苷酶的活性ꎬ从而影响产品风味ꎬ后续应进一步对β ̄D ̄葡萄糖苷酶在柑橘酒中的应用进行深入研究ꎮ4㊀总结及展望综上所述ꎬ柚苷酶是非常重要的工业酶ꎬ其在柑橘酒的脱苦及增香方面具有潜在的应用价值ꎮ近年来对柚苷酶的研究主要集中在产柚苷酶菌株的筛选ꎬ柚苷酶酶学性质及其在柑橘汁㊁柑橘酒脱苦应用等方面ꎬ但其结构㊁功能及分子生物学方面还没有被深入研究ꎬ现有研究对柚苷酶作用的分子机制也知之甚少ꎬ其晶体结构尚未确定ꎮ除此之外ꎬ柚苷酶目前在柑橘酒中的脱苦应用研究较少ꎬ柑橘酒的脱苦效果也不理想ꎬ其产品风味受到了严重影响ꎮ因此ꎬ在不影响柑橘酒本身风味物质的前提下ꎬ酶解法脱苦对有效去除柑橘酒中的苦味㊁提高柑橘酒品质具有重要的意义ꎮ鉴于目前柚苷酶及其应用存在的问题ꎬ未来可以考虑从以下几方面进行研究: (1)产柚苷酶菌一般为诱导性菌株ꎬ需要向培养基中加入诱导物诱导其产酶ꎬ诱导物价格昂贵ꎬ生产成本较高ꎬ这也是柚苷酶不能工业化生产的重要原因ꎬ后续可考虑筛选组成型的产柚苷酶菌株ꎮ(2)目前对柚苷酶的研究主要集中于菌种的筛选㊁发酵工艺优化及简单酶学性质研究ꎬ柚苷酶是由两种酶构成ꎬ其整体结构是单一蛋白还是组合蛋白及两种酶的比例构成尚不清楚ꎬ如果其是单体酶ꎬ则应对其整体结构进行研究ꎬ如果是由两种酶组成ꎬ则应对其单组分结构和组成比例进行研究ꎮ㊀㊀(3)柚苷酶分离纯化成本高ꎬ且其在柑橘酒中的应用研究还较少ꎬ柑橘酒的pH值偏低ꎬ而柚苷酶的最适pH值为4~6ꎬ柑橘酒的酸性环境会抑制柚苷酶的活性ꎮ除此之外ꎬ柑橘酒中的其他成分也会抑制柚苷酶的活性ꎬ后续可考虑筛选耐酸性的高产柚苷酶的菌株ꎬ将其与酵母菌混菌发酵ꎬ在发酵的同时去除苦味物质ꎮ3341林㊀静等:产柚苷酶菌株改良㊁性质及其在柑橘酒中的应用研究进展。

鸟苷生产菌的选育及其发酵条件优化
张蓓;马雷;武改红;张克旭;陈宁
【期刊名称】《食品与发酵工业》
【年(卷),期】2004(030)007
【摘要】以枯草芽孢杆菌T1001为出发菌株,经紫外线、硫酸二乙酯逐级诱变处理,选育出腺嘌呤缺陷型(Ade-)菌株,然后经蛋氨酸亚砜(MSO)、8-氮鸟嘌呤(8-AG)结构类似物平板定向筛选,获得鸟苷高产菌株TA208.通过模式识别法对发酵培养基的组成进行优化,同时对发酵条件如温度、pH值等进行了探索.在最优条件下,在5L自控发酵罐上发酵60h,可产鸟苷23.68g/L.
【总页数】4页(P48-51)
【作者】张蓓;马雷;武改红;张克旭;陈宁
【作者单位】天津科技大学食品科学与生物工程学院,天津,300222;天津科技大学食品科学与生物工程学院,天津,300222;天津科技大学食品科学与生物工程学院,天津,300222;天津科技大学食品科学与生物工程学院,天津,300222;天津科技大学食品科学与生物工程学院,天津,300222
【正文语种】中文
【中图分类】TS2
【相关文献】
1.利用木糖发酵生产乙醇的好食脉孢菌选育及其发酵条件优化 [J], 洪亚辉;谢伟国;程鹏;李俊
2.从一株肌苷产生菌选育出高产鸟苷菌株的研究 [J], 柏建新;朱晓宏;张一平;杜郭君;王红连;邓崇亮
3.鸟苷产生菌解淀粉芽孢杆菌的选育 [J], 吴飞;史建明;谢希贤;陈宁
4.鸟苷生产菌的诱变育种及摇瓶发酵条件优化 [J], 武改红;周昌平;王健;刘辉;陈宁
5.生产γ-氨基丁酸乳酸菌的选育及发酵条件优化 [J], 刘清;姚惠源;张晖
因版权原因,仅展示原文概要,查看原文内容请购买。

产柚苷酶高产菌株的筛选、鉴定及产酶特性研究的开题报告一、研究背景与意义柚叶素是一种来自柚子中的苄基化的二苯基丙烷类化合物,具有抗肿瘤、抗氧化、减肥、降血糖等多种药理活性。
其主要形式为柚叶素苷(naringin),是一种黄酮丙糖苷,可在体内通过酯酶水解为柚叶素。
因此,柚叶素苷是柚子中的生物前体,具有重要的发展前景。
目前,柚叶素主要从柚子中提取分离,但其收率较低且分离过程较复杂。
利用微生物发酵生产柚叶素苷是一种新的生产方式,具有生产成本低、规模化生产能力强等优点,因此备受关注。
柚叶素苷在体内通过酯酶水解为柚叶素,因此酶解柚叶素苷的酶——柚苷酶是柚叶素苷生产的关键酶。
因此,如何高效地筛选和鉴定柚苷酶高产菌株,以及对该酶的产酶特性进行研究,对柚叶素苷的生产具有重要的意义。
二、研究目的本研究旨在通过筛选、鉴定和产酶特性研究,寻找高柚苷酶产生的菌株,并对该酶的产酶特性进行探究,为柚叶素苷生产提供基础研究支持。
三、研究内容与方法1. 筛选高产柚苷酶菌株。
从自然界和土壤样品中,通过培养基筛选出菌株,利用酶促法快速鉴定柚苷酶高产菌株。
2. 鉴定柚苷酶高产菌株。
对筛选出的柚苷酶高产菌株进行16S rDNA序列分析,确定其属于的种或亚种。
3. 产酶特性研究。
利用该菌株发酵生产柚苷酶,并对该酶的反应条件、酶促性质、稳定性等多个产酶特性进行研究。
四、研究预期成果本研究预期可筛选出柚苷酶高产菌株,并对该菌株的产酶特性进行研究,从而为柚叶素苷的生产提供基础研究支持。
五、研究进度安排序号 | 内容 | 时间安排1 | 背景及意义分析、目的确定 | 前期阶段2 | 菌株筛选及鉴定 | 第1-3个月3 | 柚苷酶产酶特性研究 | 第4-10个月4 | 结果分析、论文撰写 | 第11-12个月六、研究经费预算分配经费来源 | 经费预算通用经费 | 10万元设备费 | 5万元材料费 | 5万元人员费 | 20万元合计 | 40万元。

黑曲霉液态发酵产柚苷酶的分离纯化及其性质研究王维娜1,李佥1,田晶1,费旭2,徐龙权2,廉萌1(1.大连工业大学生物工程学院,辽宁大连 116034)(2.大连工业大学现代教育技术部,辽宁大连 116034)摘要:本文针对黑曲霉液态发酵所产柚苷酶的分离纯化工艺及其酶学性质进行研究。
将黑曲霉液态发酵所产酶液,依次通过30%~70%硫酸铵盐析、膜透析和DEAE-Sepharose FF 阴离子交换层析后得到高纯度柚苷酶。
经SDS-PAGE 凝胶电泳仅得到一条清晰条带,分子量约为65.10 ku 。
纯化获得的柚苷酶比酶活可达6932.54 U/mg ,纯化倍数和酶活回收率分别为13.82倍和13.30%,并且能有效水解柚皮苷。
进一步研究发现,该酶的最适反应pH 为4.5,最适作用温度为50 ℃,在20 ~50 ℃℃及pH 3.0~6.0范围内有良好的稳定性。
在一定浓度范围内,K +、Ca 2+和Na +对柚苷酶活性有促进作用,而Fe 3+、SDS 和EDTA-Na 2对其活性有明显的抑制作用。
本研究为深入理解柚苷酶分离纯化过程,明确其酶学性质,进一步探索柚苷酶应用于天然活性产物生物转化过程的相关机制提供了基础数据,具有非常重要的科学意义和潜在的应用价值。
关键词:黑曲霉;液态发酵;柚苷酶;纯化;酶学性质文章篇号:1673-9078(2016)07-72-78 DOI: 10.13982/j.mfst.1673-9078.2016.7.012Isolation, Purification, and Properties of Naringinase Produced fromAspergillus niger FFCC 848 by Liquid FermentationW ANG Wei-na 1, LI Qian 1, TIAN Jing 1, FEI Xu 2, XU Long-quan 2, LIAN Meng 1(1.School of Biological Engineering, Dalian Polytechnic University, Dalian 116034, China) (2.Modern Education Technical Department, Dalian Polytechnic University, Dalian 116034, China)Abstract: The isolation, purification, and enzymatic properties of naringinase produced by liquid fermentation with Aspergillus niger FFCC 848 were investigated. The fermentation broth produced from liquid fermentation by A. niger FFCC 848 was purified by ammonium sulfate fractional precipitation, dialysis, and DEAE-Sepharose FF anion exchange chromatography to yield highly purified naringinase. Only one clear band was observed upon sodium dodecyl sulfate polyacrylamide gel electrophoresis, with a molecular weight of 65.10 ku. The final, purified naringinase showed 13.82-fold purification, with an enzyme activity recovery of 13.30% and specific activity of 6932.54 U/mg, and the enzyme could effectively hydrolyze naringin. Furthermore, the activity of naringinase was stable at 20–50°C and pH 3.0–6.0; optimum activity was observed at 50°C and pH 4.5. In a specific concentration range, the enzyme activity was enhanced by K +, Ca 2+, and Na +, but was strongly inhibited by Fe 3+, SDS, and EDTA-Na 2. This study provides a basis for understanding the purification of naringinase and for further studies of the related mechanism underlying the bioconversion of bioactive natural products with naringinase.Key words: Aspergillus niger ; liquid fermentation; naringinase; purification; enzymatic properties柚苷酶(EC 3.2.1.40)是由α-L-鼠李糖苷酶和β-D-葡萄糖苷酶组成,同时具有α-L-鼠李糖酶和β-D-葡萄糖苷酶的活性。

柚苷酶菌种选育方案一第一阶段:菌种的培养与选育一、培养产柚苷酶菌种培养基配方:低糖柚苷培养基(500ml)MgSO4 0.5%, ——2.5gK2HPO4 0.1% ——0.5g, KCL0.5%, ——2.5g蔗糖1%,——5.0gNaNO30.3%, ——1.5g柚苷0.5%,——2.5g琼脂1.5%。
——7.5gPH自然(来自西南农业大学柚苷酶生产菌的选育)。
实验仪器:烧杯(200ml 一个),三角瓶(1000ml 一支),量筒(100ml),玻棒,容量瓶(500ml 一支)天平(0.1 和0.0001) ,药匙,高压蒸汽灭菌锅,磁力搅拌器,精密PH计,棉花,纱布,牛皮纸,标签纸,麻绳,皮筋。
配制培养基:1、按上述配方称量药品,置于烧杯中加少许水搅拌至全溶;2、将混合液倒入500ml的容量瓶中定容;3、将定容混合液倒入1000ml烧杯中,加入1.5% 琼脂(先溶),用磁力搅拌器加热搅拌融化;4、将融液分装到1000ml的三角瓶中,加塞,用牛皮纸包扎,灭菌锅灭菌(0.1MPa,121度,灭菌30min);5、贴上标签,灭菌完后,冷却放入培养箱保存(待用)。
2,接种仪器及药品:柚苷酶,蒸馏水,无菌水,新制低糖柚苷培养基涂布器,培养皿(20个) ,称量纸,移液枪,移液枪盒,0.1和1.0的移液枪头, 1.5ml 离心管(10个),离心管盒,培养箱,超净台,电子天平(0.0001),高压灭菌锅,橡皮筋,旧报纸,。
菌种选育:1、用酒精擦拭天平外表面,之后放置在超净台过夜灭菌;2、将移液枪枪头放入移液枪枪盒,离心管放入离心管盒(离心管单独灭菌,称量纸,牛皮纸),并分别用旧报纸包好,同时也将培养皿,涂布器,烧杯,手套用旧报纸包装好,将50ml二次蒸馏水加入三角瓶中加塞包扎,分次用高压灭菌锅灭菌(0.1MPa,121度,灭菌30min),之后放入超净台灭菌半小时;3、取出柚苷酶在超净台中戴手套打开包装,用灭菌后的称量纸称量50mg酶粉末;4、取六只灭菌好的1.5ml离心管,编号(1——7),分别用移液枪加入0.9ml无菌水,(3、4步双人同时操作);5、将粉末倒入1号离心管中,震荡充分溶解,用移液枪取出0.1ml溶液加入2号离心管中,震荡混匀,在3——7号进行同样操作,依次配备出10-1(2号管),10-2,10-3,10-4,10-5,10-6。
微生物来源柚苷酶的研究进展及应用张林河;方柏山【期刊名称】《化工进展》【年(卷),期】2013(32)5【摘要】柚皮苷是影响柚子汁品味的最主要因素,柚苷酶具有将柚皮苷分解为普鲁宁、鼠李糖、葡萄糖和柚皮素等物质的功能,并且这些物质已广泛用于制药和饮料行业。
本文介绍了近年来国内外微生物来源的柚苷酶的研究、酶学特性、酶活测定、结构与功能等,表明细菌来源的柚苷酶最适温度为37~70℃,最始pH值为4.5~8.0;真菌来源的柚苷酶最适温度为30~75℃,最始pH值为4.0~11.0。
介绍了柚苷酶及其相关产物在食品、饮料和制药工业中的应用进展,发现柚苷酶不仅具有脱苦的作用,还对人类的身体健康具有重要作用。
展望了今后的研究方向,应该从柚苷酶高产菌株的选育、发酵产酶的工艺优化和酶的应用等方面开展工作,大幅度提高柚苷酶的产酶水平。
%Naringin is the principal factor which bitters the taste of grapefruit juice. Naringin could be hydrolyzed by naringinase into prunin,rhamnose,glucose,and naringenin,which have wide applications in the pharmaceutical and beverage industry. This paper provides an overview of the studies on microbial originnaringinase,purification,characterization and determination of enzyme activity as well as protein structure and function. The optimum temperature of naring inase from bacteria is from 37 ℃ to 70 ℃ while the optimal pH is in the range of 4.5 to 8.0;the optimum temperature of naringinase from fungal is from 30℃to 75 ℃ while the optimal pH is in therange of 4.0 to 11.0. The applications of naringinase and its various products in food,beverage,and pharmaceutical are also presented,showing that naringinase could not only debitter the fruit juice but also play an important role in human health. In addition,the development trends and potential applications of naringinase are also prospected. The research emphasis should be placed on screening ideal microbe strains and fermentation process optimization to enhance naringinase.【总页数】8页(P1108-1115)【作者】张林河;方柏山【作者单位】华侨大学化工学院,福建厦门 361021;华侨大学化工学院,福建厦门 361021; 厦门大学化学化工学院,福建厦门 361005【正文语种】中文【中图分类】TS201.1【相关文献】1.微生物来源蔗糖异构酶的研究进展及应用 [J], 李莎;徐虹2.微生物硫酸酯酶研究进展:来源、催化机制及应用 [J], 张丹平;何玉财3.微生物来源的L-阿拉伯糖异构酶的研究进展及应用前景 [J], 程丽芳;沐万孟;张涛;江波4.微生物来源的尿酸氧化酶的研究进展及应用前景 [J], 陈志禹;何秀萍;张博润5.海洋微生物来源木聚糖酶研究进展 [J], 田艳杰;徐佳;贾腾飞;马苗苗;张慧姗;王燕;周晨妍因版权原因,仅展示原文概要,查看原文内容请购买。
专利名称:一种制备纯化柚苷酶的方法及其酶制剂的应用专利类型:发明专利
发明人:颜廷和
申请号:CN200610068680.6
申请日:20060908
公开号:CN101092611A
公开日:
20071226
专利内容由知识产权出版社提供
摘要:本发明公开一种制备纯化柚苷酶的方法及其酶制剂的应用,其制备方法按如下步骤操作:1)采用常规微生物接种方法接种:试管斜面培养,采用察式固体培养基:接种,将上述生长的菌株移接到产孢固体培养基中,25-32℃,培养3-5天,至孢子产生;步骤1)以真菌为菌种,步骤2)将所述菌株孢子按0.5-10%接种量投加到固体培养基中,控制碳氮比例在2-5∶1-3.5范围内,保持湿度为30-70%,温度25-35℃,自然pH值,柚苷酶的产生时间为40-90小时;提取,加料重的2-5倍纯化水,过滤离心的清液;纯化:采取盐析法和有机溶剂沉淀法结合的方法,提纯柚苷酶。
盐析,硫酸铵饱和度为30-80%,有机溶剂沉淀,有机溶剂浓度为40-90%;柚苷酶产品作为柑橘类产品的脱苦剂和天然药物中黄酮类化合物的苷元转化剂,具有广泛的用途。
本发明产柚苷酶的活力高,能广泛的应用于实际生产。
申请人:颜廷和
地址:273200 山东省泗水县古城路西段
国籍:CN
更多信息请下载全文后查看。
Penicillium sp.1523产柚苷酶摇瓶发酵培养基优化黎继烈;崔培梧;鲁耀邦;王挥;郝聚喜【期刊名称】《食品科学》【年(卷),期】2011(032)009【摘要】采用单因素试验、Plackett-Burman设计和响应面分析相结合的方法,对Penicillium sp.1523产柚苷酶的摇瓶发酵培养基配方进行优化.单因素试验结果显示:发酵培养基中的最优碳源为玉米粉,最优氮源为豆饼粉;Plackett-Burman设计筛选出影响柚苷酶产量的3个重要因素为玉米粉、豆饼粉和柚苷,在此基础上运用最陡爬坡试验逼近最大响应值区域,再利用Box-Behnken试验设计及响应面分析法进行回归分析,获得最佳培养摹配方为:玉米粉31.14g/L、豆饼粉31.53g/L、柚苷1.65g/L、K<,2>HPO<,4> 1.00g/L、ZnSO<,4> 0.10g/L、MgSO<,4>·7H<,2>O 0.06g/L、CaCl<,2>0.10g/L.在优化后的条件下摇瓶发酵产柚苷酶酶活力为(891.79±6.33)U/mL,与模型预测值接近,发酵产酶量比优化前提高70.8%.【总页数】5页(P151-155)【作者】黎继烈;崔培梧;鲁耀邦;王挥;郝聚喜【作者单位】中南林业科技大学生命科学与技术学院,湖南,长沙,410004;湖南中医药大学药学院,湖南,长沙,410208;湖南中医药大学药学院,湖南,长沙,410208;中南林业科技大学生命科学与技术学院,湖南,长沙,410004;中南林业科技大学生命科学与技术学院,湖南,长沙,410004【正文语种】中文【中图分类】TQ925【相关文献】1.枯草芽孢杆菌JMUKC2产肌苷摇瓶发酵培养基的优化 [J], 杨尚彤;肖安风;倪辉;杨远帆;杨哲;蔡慧农2.南极真菌青霉(Penicillium sp.)S-3-88摇瓶发酵条件的初步优化 [J], 方莎莎;唐潮;叶科元;卢小玲;刘小宇;焦炳华3.南极青霉菌Penicillium sp.S-1-16摇瓶发酵条件的初步优化 [J], 叶科元;唐潮;卢小玲;吴文惠;刘小宇4.海洋细菌GM-1-1产芽孢发酵培养基和摇瓶发酵条件优化 [J], 吴海霞;陈茹;曹雪梅;李欢;暴增海;马桂珍;王军强;罗志会;5.海洋细菌GM-1-1产芽孢发酵培养基和摇瓶发酵条件优化 [J], 吴海霞;陈茹;曹雪梅;李欢;暴增海;马桂珍;王军强;罗志会因版权原因,仅展示原文概要,查看原文内容请购买。
利用柚皮高效发酵生产柚苷酶的研究郭小红;刘艳苓;姜泽东;李利君;朱艳冰;倪辉;蔡慧农【期刊名称】《集美大学学报(自然科学版)》【年(卷),期】2015(020)005【摘要】以棘孢曲霉为菌种, 以磷酸氢二铵为氮源固态发酵柚皮生产柚苷酶, 结果表明, 在以柚皮为碳源和磷酸氢二铵为氮源的发酵体系中, 添加疏松剂和豆饼粉对柚苷酶发酵没有显著影响, 而磷酸氢二铵添加量和水分质量分数对柚苷酶合成具有显著影响. 当无水柚皮粉中磷酸氢二铵和水分质量分数分别为324%和1700%时,有利于提高柚苷酶发酵活力. 在接种量为71%、发酵温度为30℃的情况下发酵6 d, 柚苷酶比合成速率与棘孢曲霉的生长速率符合模型Y柚苷酶 = 62677 X -0. 0381 , 其中Y代表柚苷酶的比合成速率, X代表比生长速率. 用Davis法测得柚苷酶活力为9461 IU/g, 酶发酵的培养基成本(5 × 10-5元/IU) 远远低于其他同类研究, 酶的纯度远高于用豆饼粉为氮源所获得的酶纯度.%The naringinase production from Aspergillus aculeatus was investigated using ( NH4 ) 2 HPO4 as nitrogen source in pomelo peel fermentation. The results showed that naringinase activity did not significantly increase by adding loosening agents and soybean meal powder, while the content of diammonium hydrogen phosphate and water had significant influence on naringinase production. The composition of the optimal medi-um included anhydrous citrus peel powder, the percentage rates for other ingredients in anhydrous citrus peel powder were as follow: diammonium hydrogen phosphate, 324%; water, 1700%. By using the fermen-tation condition ofinoculum size 71% and fermentation temperature 30 ℃, the naringinase fermentation was estimated to have a naringinase synthesis model Ynaringinase =62677 X-0. 0381 , where Y represented the en-zymatic specific synthetic rate and X was the specific growth rate. After fermentation for 6 days, naringinase activity attained 9461 IU/g by Davis method analysis, higher than most research before reported. In addi- tion, the medium cost was merely 5 × 10 -5 Yuan/IU naringinase, much lower than those previous studies. Furthermore, the enzyme extract revealed higher purity than that in our previous study.【总页数】9页(P356-364)【作者】郭小红;刘艳苓;姜泽东;李利君;朱艳冰;倪辉;蔡慧农【作者单位】集美大学食品与生物工程学院, 福建厦门 361021;集美大学食品与生物工程学院, 福建厦门 361021;集美大学食品与生物工程学院, 福建厦门 361021;福建省食品微生物与酶工程重点实验室,福建厦门 361021;厦门市食品与生物工程技术研究中心, 福建厦门 361021;集美大学食品与生物工程学院, 福建厦门361021;福建省食品微生物与酶工程重点实验室,福建厦门 361021;厦门市食品与生物工程技术研究中心, 福建厦门 361021;集美大学食品与生物工程学院, 福建厦门 361021;福建省食品微生物与酶工程重点实验室,福建厦门 361021;厦门市食品与生物工程技术研究中心, 福建厦门 361021;集美大学食品与生物工程学院, 福建厦门 361021;福建省食品微生物与酶工程重点实验室,福建厦门 361021;厦门市食品与生物工程技术研究中心, 福建厦门 361021;集美大学食品与生物工程学院, 福建厦门 361021;福建省食品微生物与酶工程重点实验室,福建厦门 361021;厦门市食品与生物工程技术研究中心, 福建厦门 361021【正文语种】中文【中图分类】S216.2【相关文献】1.黑曲霉TC-01产柚苷酶对柚皮苷酶解作用的研究 [J], 邓媛;毛勇;王燕;李飞;张美丽;李皎2.柚苷酶生产菌TC-01发酵培养条件的优化及其酶学性质的初步研究 [J], 邓媛;毛勇;张美丽;王燕;李飞;李皎3.柚苷酶的应用及发酵生产研究 [J], 张晨;刘志伟4.黑曲霉固态发酵生产柚苷酶的工艺研究 [J], 张楠;孙西同;李佥;田晶;费旭;詹宏磊;郑欣雨5.混菌发酵生产柚皮菌体蛋白饲料的研究 [J], 黄晓霞因版权原因,仅展示原文概要,查看原文内容请购买。
黑曲霉TC-01产柚苷酶分离纯化及其降解内毒素研究初探邓媛;毛勇;杨国武;李飞;李皎;张美丽;王燕【期刊名称】《中国食品添加剂》【年(卷),期】2018(000)001【摘要】[目的]对黑曲霉TC-01产柚苷酶进行分离纯化及酶学性质研究,并对柚苷酶降解内毒素进行初步研究.[方法]黑曲霉TC-01发酵优化后的酶液经硫酸铵分级盐析、透析浓缩、DEAE Bio-Sep FF离子交换层析等分离纯化,考察酶学性质,初步研究柚苷酶对内毒素的降解作用.[结果]柚苷酶纯化后,比活力6429.3u/mg,纯化倍数31.1倍.酶学性质研究结果表明TC-01产柚苷酶最适pH4,最适温度60℃,考察金属离子对酶活影响,1 ~ 10mMCa2+、Mg2+对柚苷酶酶活有促进作用,Zn2+、Fe2+、Fe3+、Cu2+对柚苷酶的酶活有抑制作用,Fe2+抑制作用最为强烈.柚苷酶对内毒素具有降解作用,柚苷酶与内毒素反应1h,内毒素降解率达到79.9%.[结论]研究为柚苷酶的工业化生产提供理论依据,同时拓宽了柚苷酶的应用范围,为进一步研究柚苷酶降解内毒素提供了基础数据,具有重要的科学意义和应用价值.【总页数】7页(P80-86)【作者】邓媛;毛勇;杨国武;李飞;李皎;张美丽;王燕【作者单位】陕西省微生物研究所,西安710043;陕西省微生物研究所,西安710043;陕西省微生物研究所,西安710043;陕西省微生物研究所,西安710043;陕西省微生物研究所,西安710043;陕西省微生物研究所,西安710043;陕西省微生物研究所,西安710043【正文语种】中文【中图分类】Q815【相关文献】1.不同温度、pH和无机离子对黑曲霉A66菌株产柚苷酶活力影响的初步研究 [J], 张璟晶;袁敏;管远红;涂国全2.一株产柚苷酶菌株黑曲霉的分离及菌种鉴定的初步研究 [J], 赖崇德;蔡华静;夏海林;施孝活;刘金国;涂国全3.黑曲霉TC-01产柚苷酶对柚皮苷酶解作用的研究 [J], 邓媛;毛勇;王燕;李飞;张美丽;李皎4.黑曲霉产木聚糖酶的分离纯化与鉴定研究 [J], 高月淑;许敬亮;袁振宏;蒋剑春;何敏超;张宁5.黑曲霉菌发酵产柚苷酶培养基配方的优化研究 [J], 张桃桃;张萍;石彦鹏;牛春因版权原因,仅展示原文概要,查看原文内容请购买。