极性转换及其在有机合成中的应用(俞凌翀)思维导图
- 格式:xmin
- 大小:4.81 KB
- 文档页数:1



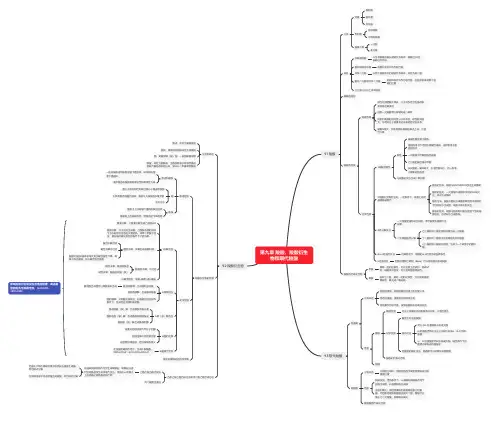
物质的相互转化和制备主要是指以氧气、氢气、碳、硫、磷等为代表的非金属单质,以铝、镁、锌、铁、铜为代表的金属单质,以一氧化碳、二氧化碳等为代表的非金属氧化物,以氧化铜、氧化铁等为代表的金属氧化物,以盐酸、硫酸、碳酸等为代表的酸,以氢氧化钠、氢氧化钙等为代表的碱,以氯化钠、碳酸钠、碳酸氢钠、碳酸钙等为代表的盐,等等物质之间的相互和制备.各类物质间的转化关系:(1)金属+金属氧化物(碱性氧化物)(2)碱性氧化物(可溶)+水碱(可溶)(3)碱(难溶)碱氧(难溶)+水(4)酸+碱盐+水;(5)非金属+非金属氧化物(酸性氧化物)(6)酸性氧化物(易溶)+水酸(易溶)(7)酸(易挥发/难溶)酸氧+水(易挥发/难溶)从纵向来看,金属碱性氧化物碱盐,其中金属元素相同。
非金属酸性氧化物酸(含氧酸)盐,其中非金属元素相同。
横向:(8)金属+非金属(无氧酸)盐(9)碱氧+酸氧(含氧酸)盐(10)含氧酸盐碱氧+酸氧(11)盐+盐两种新盐交叉:(12)酸+碱氧盐+水(13)碱+酸氧盐+水(14)酸+盐新酸+新盐;(15)碱+盐新碱+新盐(16)金属+酸盐+(17)金属+盐新盐+新金属(18)金属+盐新盐+新金属(置换反应)氢氧化钠与氢氧化钙的制备:(1)NaOH的制备方法一:Na2O+H2O==2NaOH方法二:Na2CO3+Ca(OH)2==CaCO3↓ +2NaOH (2)Ca(OH)2的制备方法:CaO+H2O==Ca(OH)2常见物质的相互转化:Na→Na2O→NaOH→Na2CO3C→CO→CO2→H2CO3Fe→Fe2O3→Fe2(SO4)3→Fe(OH)3→FeCl3S→SO2→SO3→H2SO4(单质硫不能直接转化为SO3)。

九年级化学知识点归纳思维导图化学作为一门自然科学,研究的是物质的组成、性质以及它们之间的变化。
在九年级学习化学的过程中,我们接触到了许多重要的知识点。
为了更好地理解和记忆这些知识,我们可以使用思维导图的方法整理归纳,将复杂的概念和关系以图形化的方式呈现,提升学习效果。
以下是九年级化学知识点的思维导图。
1. 物质的分类- 纯物质和混合物- 纯物质:由同一种组分构成,具有一定的固定化学组成和独特的性质。
分为元素和化合物。
- 元素:由相同类型的原子组成,不能分解为其他物质。
- 化合物:由两种以上不同类型的原子按照一定比例结合而成,可以分解为其他物质。
- 混合物:由两种或两种以上的物质按照一定比例混合而成,可以根据混合的均匀程度分为均质混合物和非均质混合物。
2. 常见物质的性质和变化- 物质的性质:可以分为物理性质和化学性质。
- 物理性质:物质在不改变化学组成的情况下表现出来的性质,如颜色、硬度、熔点、沸点等。
- 化学性质:物质在发生化学反应时表现出来的性质,如燃烧性、氧化性等。
- 物质的变化:可以分为物理变化和化学变化。
- 物理变化:物质在不改变化学组成的情况下改变外观或状态的变化,如溶解、凝固、融化等。
- 化学变化:物质在与其他物质发生反应时改变化学组成和性质的变化,如燃烧、酸碱中和等。
3. 原子和分子- 原子:是物质的基本粒子,由质子、中子和电子组成。
- 质子:带有正电荷的基本粒子,质量约为1个原子质量单位。
- 中子:不带电荷的基本粒子,质量约为1个原子质量单位。
- 电子:带有负电荷的基本粒子,质量很轻,约为1/1836个原子质量单位。
- 分子:是原子的组合形式,是能保持化学性质的最小粒子。
4. 元素周期表- 元素周期表:是按照原子序数的大小和元素性质进行排列的表格。
元素周期表按照一定的规律分为周期和族。
- 周期:是指元素周期表中横向的行,代表了元素的原子轨道。
周期越往下,电子层越多。
- 族:是指元素周期表中纵向的列,代表了元素的化学性质。


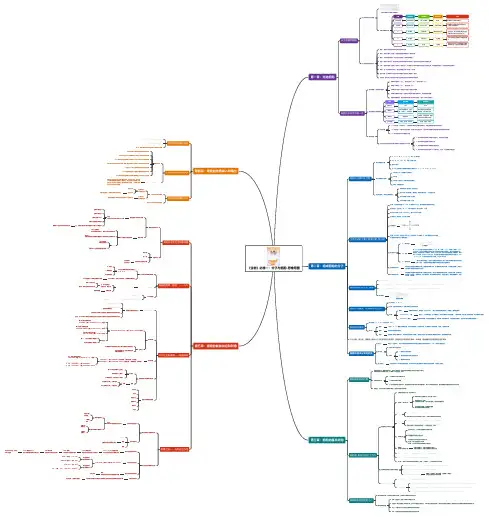


高考化学知识思维导知识关联梳理化学是一门需要理解、掌握和应用知识的科学学科,在高考中占据了重要的地位。
为了在高考中取得好成绩,我们不仅需要对化学知识点进行系统学习,还需要培养良好的思维能力和知识间的关联性。
本文将通过思维导图的方式,梳理高考化学知识的思维导知识关联,以帮助考生更好地掌握和应用化学知识。
思维导图一:物质结构与性质在化学学科中,我们首先需要了解物质的结构与性质的关系。
物质结构的不同将决定其性质的不同。
例如,原子核中质子和中子的数量决定了元素的同位素和同位素的放射性。
电子的排布决定了物质的化学性质,如原子的化学键和分子的形状等。
思维导图二:化学反应与能量变化化学反应是物质变化的基础,不同的化学反应会伴随不同的能量变化。
化学能量和化学反应热力学是高考中的重要内容。
例如,燃烧反应的放热性质和放热量的计算、电化学反应电势和电解质量的计算等。
思维导图三:化学反应与化学平衡化学反应不仅涉及能量变化,还涉及化学平衡的问题。
平衡反应可以通过化学平衡定律和反应速率等问题来描述。
了解平衡反应的条件和影响因素,以及如何通过改变温度、压力等条件来促进或抑制反应进程,是高考中需要掌握的知识。
思维导图四:离子反应与溶液化学离子反应是溶液化学的基础,涉及了酸碱中和、盐类反应、氧化还原反应等内容。
此外,了解溶液浓度、离子平衡、溶液的酸碱性质等相关知识也是高考中的重要内容。
思维导图五:有机化学基础有机化学是高考化学的重要组成部分。
了解和掌握有机化合物的命名规则、结构特点以及它们的常见反应是必不可少的。
此外,有机合成和功能有机化合物等内容也是高考考点。
思维导图六:化学分析与实验技术高考化学中也涉及了化学分析和实验技术的内容。
化学分析包括定性分析和定量分析,需要了解分析方法和仪器的使用。
实验技术则需要了解常见的实验操作、实验室安全知识和实验结果的处理方法。
通过以上的思维导图,我们可以清晰地看到高考化学知识的思维导知识关联。
第七章醇、酚、醚7.1 醇醇的分类与命名分类按所连的烃基的类型脂肪醇脂环醇芳香醇又可以分为饱和醇和不饱和醇按醇分子中所含羟基的数目一元醇按羟基所连的碳原子的类型伯醇(1° 一级醇)仲醇(2° 二级醇)叔醇(3° 三级醇)二元醇多元醇:二元以上则为多元醇命名普通命名法对于简单的醇一般使用普通命名法,以羟基所连的烃基名称来命名。
系统命名法选择含有羟基的最长碳链为主链若为不饱和醇,则主链应当包含不饱和键羟基的位次应当最小芳香醇的命名把芳香基作为取代基醇的结构由于O原子的电负性大,C-O键和O-H键都为强极性键,在化学反应中,主要断键方式为异裂。
由于羟基的-I作用,α碳和β碳上的碳氢键极性增强。
因此,这两类C-H键在一定条件下容易断裂。
醇的性质物理性质由于氢键的存在醇的沸点较高,一元醇的沸点比近似的烃高得多相对分子质量小的醇在水中有较大的溶解度。
同系列一元醇的沸点随相对分子质量的增大而增大,水溶性下降。
直链醇的沸点高于支链醇,含同一碳架的醇,伯醇的沸点最高,其次是仲醇,叔醇。
烷基的存在对缔和有阻碍作用,阻碍了氢键的形成。
常见的亲水基团有羟基、羧基、氨基、磺酸基等;常见的亲脂基有脂肪烃基、芳香烃基、酯基和醚键醇的化学性质1. 酸碱性酸性能在一般条件下和金属反应生成盐和氢气:ROH+Na=RONa+1/2 H₂酸性H₂O>R-OH>CH≡CH>NH₃>RHα-碳连的推电子基团越多,越大,H离子越难脱出,酸性也就越弱。
各种醇同金属反应的活性:甲醇>伯醇>仲醇>叔醇醇钠的碱性比氢氧化钠强,遇水分解成醇和氢氧化钠。
RONa+H₂O→ROH+NaOH碱性羟基氧上具有孤对电子,能从强酸接受质子生成质子化的醇( 盐)。
也能接受路易斯酸。
盐能溶于强酸。
利用这一性质,可将不溶于水的醇与烷烃、卤代烃区别开,或将烷烃、卤代烃中含有的少量不溶于水的醇除去。
盐的生成使醇中的C-O键变弱,因此醇的取代和消去反应通常在酸催化的条件下进行。