酶学与酶工程第三章酶的生物合成学生
- 格式:ppt
- 大小:1.39 MB
- 文档页数:66


酶工程思考题汇总第一章P251.何谓酶工程?试述其主要内容和任务.酶的生产,改性与应用的技术过程称为酶工程。
主要内容:微生物细胞发酵产酶,动植物细胞培养产酶,酶的提取与分离纯化,酶分子修饰,酶、细胞、原生质体固定化,酶非水相催化,酶定向进化,酶反应器和酶的应用等。
主要任务:经过预先设计,通过人工操作获得人们所需的酶,并通过各种方法使酶的催化特性得以改进,充分发挥其催化功能。
2.酶有哪些显著的催化特性?专一性强(绝对专一性——钥匙学说、相对专一性——诱导契合学说)、催化效率高、作用条件温和3.简述影响酶催化作用的主要因素.底物浓度、酶浓度、温度、pH、激活剂浓度、抑制剂浓度等诸多因素第二章P635.酶的生物合成有哪几种模式?生长偶联型(同步合成型、中期合成型)、部分生长偶联型(延续合成型)非生长偶联型(滞后合成型)7.提高酶产量的措施主要有哪些?a.添加诱导物(酶的作用底物、酶的催化反应物、作用底物的类似物)b.控制阻遏物的浓度c.添加表面活性剂d.添加产酶促进剂11.固定化微生物原生质体发酵产酶有何特点?1.提高产酶率2.可以反复使用或连续使用较长时间3.基因工程菌的质粒稳定,不易丢失4.发酵稳定性好5.缩短发酵周期,提高设备利用率6.产品容易分离纯化7.适用于胞外酶等细胞产物的生产第三章P843.植物细胞培养产酶有何特点?1.提高产率2.缩短周期3.易于管理,减轻劳动强度4.提高产品质量5.其他4.简述植物细胞培养产酶的工艺过程。
外植体细胞的获取细胞培养分离纯化产物6.动物细胞培养过程中要注意控制哪些工艺条件?1.培养基的组成成分2.培养基的配制3.温度的控制4.ph的控制5.渗透压的控制6.溶解氧的控制第四章P1351.细胞破碎的方法主要有哪些?各有何特点?机械破碎法:通过机械运动产生的剪切力,使组织、细胞破碎(捣碎法,研磨法,匀浆法)物理破碎法:通过物理因素的作用(温度差破碎法,压力差破碎法,超声波破碎法)化学破碎法:通过化学试剂对细胞膜的作用(添加有机溶剂,添加表面活性剂)酶促破碎法:通过细胞本身的酶系或外加酶制剂的催化作用,使细胞外层结构受到破坏(自溶法,外加酶制剂法)2.试述酶提取的主要方法。

2016-2017学年高中生物第3章酶的制备及应用第1节酶的制备及活力测定教案中图版选修1编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2016-2017学年高中生物第3章酶的制备及应用第1节酶的制备及活力测定教案中图版选修1)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2016-2017学年高中生物第3章酶的制备及应用第1节酶的制备及活力测定教案中图版选修1的全部内容。
第一节酶的制备及活力测定一、酶的存在及提取1.酶是在生物体活细胞中合成的。
其参与反应部位可以在细胞内,也可以在细胞外。
2.在酶的提取过程中,温度、酸碱性等多种环境条件都可能影响酶的空间结构,导致酶变性,甚至丧失活力。
因而提取出的酶首先需要检测酶的活力。
3.酶的活力通常以单位时间内底物的消耗量或者在单位时间内产物的生成量来表示.在测定单位时间内麦芽糖的生成量来检测淀粉酶的活力的实验中,测麦芽糖的产量可用分光光度法.二、酶活力的测定方法和原理1.提取酶液:研磨水稻种子时需加石英砂,目的是充分研磨。
制取匀浆并离心后,取上清液,其中一份要在水浴中加热,目的是使酶失活。
2.滴加酶液。
3.恒温处理。
4.钝化处理:酶促反应进行一段时间后要向反应液中加物质的量浓度为0。
4 mol/L的NaOH 溶液,目的是钝化酶的活性,使反应终止.5.测定吸光值:测定吸光值时要把反应液与2_mL3,5-二硝基水杨酸试剂混匀,并沸水浴5 min,才能产生麦芽糖产物.然后分别移入四支比色杯,用分光光度计在波长520 nm处进行比色。
6.绘制标准曲线.预习完成后,请把你认为难以解决的问题记录在下面的表格中问题1问题2问题3问题4一、植物淀粉酶活力的测定原理:淀粉酶将淀粉水解成麦芽糖。
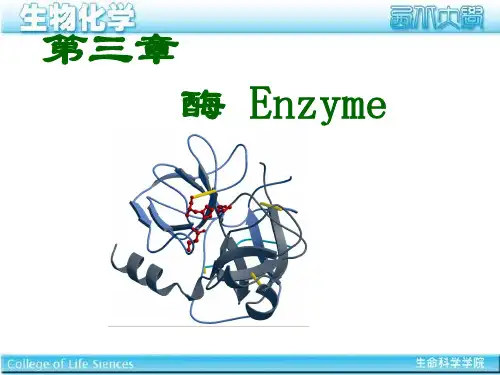

酶学与酶⼯程重点总结第⼆章酶学基础⼀、酶的活性中⼼(active center,active site)(⼀)活性中⼼和必需基团1、与酶活性显⽰有关的,具有结合和催化底物形成产物的空间区域,叫酶的活性中⼼,⼜叫活性部位。
2、活性中⼼可分为结合部位和催化部位。
3、结合部位决定酶的专⼀性,催化部位决定酶所催化反应的性质。
4、酶结构概述(1)活性中⼼是⼀个三维实体。
(2)是有⼀些⼀级结构上可能相距较远的氨基酸侧链基团组成,有的还包含辅酶或辅基的某⼀部分基团。
(3)在酶分⼦表⾯呈裂缝状。
(4)酶活性中⼼的催化位点和结合位点可以不⽌⼀个。
(5)酶活性中⼼的基团都是必需基团,但必需基团还包括活性中⼼以外的基团。
5、酶分⼦中的氨基酸残基或其侧链基团可以分为四类1.接触残基2.辅助残基3.结构残基4.⾮贡献残基(⼆)酶活性中⼼中的化学基团的鉴别1.⾮特异性共价修饰:某些化学试剂能使蛋⽩质中氨基酸残基的侧链基团反应引起共价结合、氧化或还原修饰反应,使基团结构和性质发⽣变化。
如果某基团修饰后不引起酶活⼒的变化,就可初步认为此基团可能是⾮必需基团;反之,如修饰后引起酶活⼒的降低或丧失,则此基团可能是酶的必需基团。
2.亲和标记共价修饰剂是底物的类似物,可专⼀性地引⼊酶的活性中⼼,并具有活泼的化学基团(如卤素),可与活性中⼼的基团形成稳定的共价键。
因其作⽤机制是利⽤酶对底物类似物的亲和性⽽将酶共价标记的,故称为亲和标记。
3.差别标记在过量底物或可逆抑制剂遮蔽活性中⼼的情况下,加⼊共价修饰剂,使后者只修饰活性中⼼以外的有关基团;然后去除底物或可逆抑制剂,暴露活性中⼼,再⽤同位素标记的向⼀修饰剂作⽤于活性中⼼的同类基团;将酶⽔解后分离带有同位素的氯基酸,即可确定该氨基酸参与活性中⼼。
4.蛋⽩质⼯程这是研究酶必需基闭和活性中⼼的最先进⽅法,即将酶蛋⽩相应的互补DNA(cDNA)定点突变,此突变的cDNA表达出只有⼀个或⼏个氨基酸被置换的酶蛋⽩,再测定其活性,可以知道被置换的氨基酸是否为活⼒所必需。

酶工程试题(A)一名词解释(每题3分,共计30分)1. 酶工程:又叫酶技术,是酶制剂的大规模生产和应用的技术。
2.自杀性底物:底物经过酶的催化后其潜在的反应基团暴露,再作用于酶而成为酶的不可逆抑制剂,这种底物叫自杀性底物。
3.别构酶;调节物与酶分子的调节中心结合后,引起酶分子的构象发生变化,从而改变催化中心对底物的亲和力,这种影响被称为别构效应,具有别构效应的酶叫别构酶4.诱导酶:有些酶在通常的情况下不合成或很少合成,当加入诱导物后就会大量合成,这样的酶叫诱导酶5.Mol催化活性:表示在单位时间内,酶分子中每个活性中心转换的分子数目6.离子交换层析:利用离子交换剂作为载体这些载体在一定条件下带有一定的电荷,当带相反电荷的分子通过时,由于静电引力就会被载体吸附,这种分离方法叫离子交换层析。
7.固定化酶:通过物理的或化学的方法,将酶束缚于水不溶的载体上,或将酶束缚于一定的空间内,限制酶分子的自由流动,但能使酶发挥催化作用的酶8.修饰酶:在体外用一定的化学方法将酶和一些试剂进行共价连接后而形成的酶9.非水酶学:通常酶发挥催化作用都是在水相中进行的,研究酶在有机相中的催化机理的学科即为非水酶学10模拟酶:利用有机化学合成的方法合成的比酶结构简单的具有催化作用的非蛋白质分子叫模拟酶。
二填空题(每空1分,共计30分)1.决定酶催化活性的因素有两个方面,一是酶分子结构,二是反应条件。
2.求Km最常用的方法是双倒数作图法。
3.多底物酶促反应的动力学机制可分为两大类,一类是序列机制,另一类是乒乓机制。
4.可逆抑制作用可分为竞争性,反竞争性,非竞争性,混合性;5.对生产酶的菌种来说,我们必须要考虑的条件有,一是看它是不是致病菌,二是能够利用廉价原料,发酵周期短,产酶量高,三是菌种不易退化,四是最好选用能产生胞外酶的菌种,有利于酶的分离纯化,回收率高。
6.酶活力的测定方法可用终止反应法和连续反应法。
7.酶制剂有四种类型即液体酶制剂,固体酶制剂,纯酶制剂和固定化酶制剂。


名词解释:每章的关键词(英文),就是表达本章中心内容的有实质意义的词汇。
各章重点第一章绪论一、酶工程的概念、分类及其研究内容。
生物酶工程的内容、什么是核酶二、简述酶活力测定方法的原理;酶活力单位;比活力等第二章酶的生物合成与发酵生产一、克隆酶:利用DNA重组技术而大量生产的酶。
二、什么是抗体酶?抗体酶:抗体酶是一类免疫系统产生的、具有催化活性的抗体。
三、酶生物合成的模式四、一些概念的区别:操纵子与操纵基因、诱导酶与组成酶、胞内酶与胞外酶、产酶动力学五、原核酶合成调节的类型有哪些?六、在酶制剂工业生产中为什么以微生物发酵生产为主?七、如何提高酶的产量?1选育优良的产酶细胞株系(生产组成型酶突变株的筛选,抗分解代谢阻遏突变株的选育,抗反馈阻抑突变株的筛选)2添加诱导物3控制阻遏物浓度4添加表面活性剂5添加产酶促进剂第三章酶的提取与分离纯化一、细胞破碎的目的、方法及原理。
二、酶抽提的目的及方法。
三、常用沉淀法的种类及原理。
四、常用沉淀法的种类及原理。
盐析法分离蛋白质的原理。
五、简述酶分离纯化方法及工艺程序的选择策略。
先选用非特异的、低分辨的技术,去除主要的杂质并使酶溶液浓缩;如沉淀、超滤和吸附等。
随后采用高效分离的手段;如离子交换层析、亲和层析。
将最昂贵、最费时的分离单元放在最后阶段。
如凝胶过滤层析。
六、简述影响酶提取的主要因素及影响规律。
抽提溶质的性质(酸性酶宜用碱性溶剂抽提,碱性酶宜用酸性溶液抽提,极性大的酶宜用极性溶剂抽提,含有较多非极性基团的酶宜用有机溶剂抽提。
)。
抽提溶剂的用量(增加用量可以提高酶的提取率。
但是过量的抽提溶剂,会使酶的浓度降低,对酶的进一步分离纯化不利。
用量一般为原料体积的3~5倍,最好分次抽提)温度(提取时温度对酶的提前效果有明显影响。
一般来说,适当提高温度,可以提高酶的溶解度,增大酶分子的扩散速度。
但温度过高易引起酶变性失活,所以提取温度不宜过高。
要根据被抽提酶的酶学性质选择适宜温度)pH 对酶的溶解度和稳定性有显著影响。

酶工程名词解释酶工程名词解释酶:生物体内进行新陈代谢不可缺少的受多种因素调节控制的具有催化能力的生物催化剂。
酶工程:是酶学和工程学相互渗透结合形成的一门新的技术科学。
从应用目的出发研究酶,在一定的生物反应装置中利用酶的催化性质,将相应原料转化成有用的物质。
单体酶(monomeric enzyme):由一条多肽链组成,如溶菌酶;由多条肽链组成,肽链间二硫键相连构成一整体。
寡聚酶(oligomeric enzyme):由两个或两个以上的亚基组成的酶。
多酶复合体(multienzyme complex):由几种酶非共价键彼此嵌合而成。
催化转换数:每个酶分子每分钟催化底物转化的分子数。
酶活力(酶活性):指酶催化一定化学反应的能力。
酶活力的大小:一定条件下所催化的某一化学反应的反应速度,酶反应速度:单位时间内底物的减少量或产物的增加量。
酶的活力单位(U,activity unit):酶活力的大小及酶含量的多少。
酶单位:在一定条件下,一定时间内将一定量的底物转化为产物所需要的酶量。
这样酶的含量可以用每克酶制剂或每毫升酶制剂含有多少酶单位来表示(U/g或U/ml)。
Katal(Kat)单位:一个katal单位是指在最适反应条件下,1秒钟催化1moL底物转化为产物所需要的酶量。
酶的比活力(specific activity):代表酶的纯度,比活力用每mg蛋白质所含有的酶活力单位数表示。
对同一种酶比活力愈大,纯度愈高。
酶的转换数:以一定条件下每秒钟每个酶分子转换底物的分子数来表示酶的催化效率。
酶动力学:是研究酶促反应的速度以及影响此速度的各种因素的科学。
抑制剂:任何分子直接作用于酶使他的催化速度降低即称为~。
不可逆抑制作用:抑制剂与酶的必需基团以共价键结合而引起酶活性丧失,不能用透析,超滤或凝胶过滤等物理方法去除抑制剂而使酶复活。
可逆抑制作用:抑制剂与酶以非共价键结合而引起酶活性的降低或丧失,能用物理的方法除去抑制剂而使酶复活。

《酶工程》课程教学大纲总学时数:30一、课程的地位、性质和任务酶工程(enzyme engneering)是生物技术专业的主干必修课,是酶学、微生物学的基本原理与化学工程有机结合而产生的一门新的科学技术,在生物技术人才培养中处于至关重要的地位。
它涉及细胞工程、基因工程、发酵工程、生物分离工程和化学工程等诸多学科,主要内容包括酶的发酵生产、酶的分离纯化、酶和细胞固定化以及酶的分子工程。
学生通过酶工程的学习,能够掌握酶的生产与分离纯化的基本理论、基本技术以及自然酶、化学修饰酶、固定化酶的研究和应用,了解酶在各行各业中的最新发展及研究趋势。
二、课程教学的基本要求学生通过酶工程的学习,应熟悉从应用目的出发研究酶,在一定生物反应装置中利用酶的催化性质的研究路线,掌握酶的生产与应用的基本理论、基本技术、酶的分离纯化、固定化酶以及酶的化学修饰的研究和应用,进一步了解酶在各行各业中实际应用的最新发展和发展趋势,在以后的毕业环节和工作中能够自觉地应用这些技术方法来指导自己的工作。
本课程理论课30学时,于本科三年级第二学期开设。
讲授方式:1.讲授2.利用CAI课件三、各章主要内容、学时分配及教学要求第一章绪论 2学时【单元目标】1.了解酶工程的研究意义;2.掌握酶工程的概念及研究内容。
【授课内容】一.酶与酶工程发展简史(一)酶学研究简史(二)酶工程研究简史二. 酶工程简介1.酶工程2.组成3.分类第二章微生物发酵产酶 4学时【单元目标】1.掌握酶生物合成的调节类型及调节机制2.了解产酶微生物的分离和选育方法3.了解动植物细胞与微生物细胞发酵产酶的异同【授课内容】第一节酶生物合成及调节一、酶的生物合成(一)RNA的生物合成--转录(transcription) (二)蛋白质的生物合成--翻译(translation) 1.翻译2.翻译过程即蛋白质的合成过程二、酶生物合成的调节(一)基因调控理论(二)酶合成调节的类型1.诱导 (induction)2.阻遏 (repression)(三)酶合成的调节机制三、提高酶产量的策略(一)菌种选育1.诱变育种2.基因工程育种(二)条件控制第二节酶发酵动力学一、细胞生长动力学(Monod方程)二、产酶动力学(一) 酶生物合成的模式1.生长偶联型2.部分生长偶联型3.非生长偶联型(二) 产酶动力学第三节微生物发酵产酶一、产酶微生物的分离和选育二、微生物发酵产酶方法1.固体培养2.液体培养3.固定化细胞三、微生物酶的类型1.胞外酶2.胞内酶第三章动、植物细胞培养产酶2学时一、动植物细胞与微生物细胞主要特性差异二、植物细胞培养产酶1.植物细胞培养的特点、提取法缺点2.培养基特点3.培养方法4.培养条件的影响与控制5.植物细胞培养产酶实例三、动物细胞培养产酶1.动物细胞培养的特点2.培养基3.培养方法4.培养条件的影响与控制第四章酶的提取与分离纯化 12学时【单元目标】1.掌握酶分离纯化的常用方法及其原理2.掌握几种常用的电泳方法及操作步骤2.了解酶的纯化方案的设计【授课内容】第一节酶的分离4学时一、发酵液预处理(一)发酵液的相对纯化(二)发酵液的固液分离二、细胞破碎(一)细胞壁组成(二)细胞破碎的方法(三)细胞破碎确认三、酶的提取(extraction)(一)理想提取液具备的条件、目标原则(二)提取方法四、离心分离(一)基本原理(二)离心机的种类(三)常用离心方法1.差速离心2.密度梯度离心3. 等密度梯度离心又称沉降平衡离心(四)应用五、沉淀分离(根据溶解度的不同)(一)盐析沉淀法(改变离子强度)(二)有机溶剂沉淀(降低介电常数)(三)等电点沉淀(isoelectric precipitation) (四)有机聚合物沉淀法(五)选择性变性沉淀法六、萃取(extraction)分离(一)溶剂萃取法(二)双水相萃取技术(三)超临界流体萃取(四)反胶团萃取第二节酶的精制5学时一、膜分离技术(一)扩散膜分离(二)加压膜分离(三)电场膜分离二、层析法(一)吸附层析(adsorption chromatography)1.原理2.吸附剂3.洗脱剂4.应用(二)凝胶过滤层析)(gel filtration chromatography)1.基本原理2.凝胶的种类和性质3.操作4.应用(三)离子交换层析(ion exchange chromatography,IEC)1. 原理2. 阴离子交换剂分离蛋白质的过程3. 操作4. 应用- 制备纯化生物大分子(四)疏水层析(hydrophobic interaction)1、原理2. 吸附剂3. 操作4. 应用(五)亲和层析(affinity chromatography)1. 原理2. 基质的选择3. 配体的选择4. 偶联(亲和吸附剂的制备)5. 操作及应用(六) 高效(压)液相层析(HPLC:high performance(pressure)liquid chromatography)1. 基本原理2. 分类3. 色谱仪组成第三节电泳一、电泳的基本理论1. 原理2. 电泳的分类3. 电泳常用设备二、聚丙烯酰胺凝胶电泳1.原理2.分离效应三、SDS-聚丙烯酰胺凝胶电泳1. 原理2. 操作四、等电聚焦 ( isoelectric focusing,IEF )1. 原理2. 操作3. 应用第四节酶的浓缩、干燥与结晶2学时一、酶的浓缩(一)蒸发浓缩(二)超滤浓缩(三)吸水剂(四)反复冻融浓缩(五)沉淀法二、酶的干燥三、酶的结晶(一)结晶的条件(二)结晶的方法第五节纯化方案的设计与评价1学时一、纯化方案的设计(一)纯化方法的选择依据(二)纯化方法的排序二、纯化方案的评价(一)酶活力测定(二)蛋白质浓度测定(三)提纯倍数与回收率第五章酶分子的化学修饰 2学时【单元目标】1.掌握酶活性中心的概念及共性2.了解酶化学修饰的目的及原理3.了解酶化学修饰的种类及应用【授课内容】第一节酶的活性中心一、活性中心的概念二、活性中心的共性三、研究酶活性中心的方法1.物理学方法2.化学修饰法3.蛋白质工程第二节酶化学修饰及修饰目的一、酶化学修饰1.限制酶大规模应用的原因2.改变酶特性有两种主要的方法3.酶化学修饰的概念二、酶化学修饰的目的1.研究酶的结构与功能的关系2.人为改变天然酶的某些性质,扩大酶的应用范围第三节酶化学修饰的原理一、如何增强酶天然构象的稳定性与耐热性二、如何保护酶活性部位与抗抑制剂三、如何维持酶功能结构的完整性与抗蛋白水解酶四、如何消除酶的抗原性及稳定酶的微环境第四节酶化学修饰的设计一、充分认识酶分子的特性二、修饰剂的选择三、反应条件的选择第五节酶化学修饰的种类及应用一、酶的表面化学修饰(一)大分子修饰(大分子结合修饰)1.定义2.修饰剂3.应用(二)小分子修饰(酶蛋白侧链基团修饰)1.定义2.侧链基团修饰剂3.几种重要的修饰反应(三)交联修饰(交联法)(四)固定化修饰(共价偶联法)二、酶分子内部修饰(一)蛋白主链修饰(肽链有限水解修饰)(二)氨基酸置换修饰(三)金属离子置换修饰第六章酶与细胞的固定化 2学时【单元目标】1.掌握固定化酶和固定化细胞的定义及特点2.了解固定化酶和固定化细胞的性质及应用【授课内容】第一节酶与细胞的固定化一、固定化酶和固定化细胞的定义及特点1.固定化酶 (immobilized enzyme)2.固定化细胞(immobilized cell)二、固定化方法(一)酶的固定化方法1.吸附法(adsorption)2.共价偶联法(covalent binding or covalent coupling)3.交联法(crosslinking)4.包埋法(encapsulation)(二)各种固定化方法的优缺点比较(三)细胞的固定化方法1.固定化细胞的分类2.固定化方法(四)原生质体的固定化方法第二节固定化酶和固定化细胞的性质与表征一、固定化酶的性质二、固定化细胞的性质三、固定化酶(细胞)的评价指标第三节固定化酶与固定化细胞的应用一、在工业生产上的应用1.氨基酰化酶(Aminoacylase)2.葡萄糖异构酶二、固定化酶在医学上的应用1.消血栓2. 人工肾三、在分析检测中的应用1. 酶传感器1)酶传感器的原理2)酶传感器的应用2. 酶联免疫测定第七章酶反应器 2学时【单元目标】1.了解酶反应器的几种类型2.了解酶反应器的设计原理及操作【授课内容】第一节酶反应器的特点与类型一、酶反应器的类型(一)搅拌罐型(Stirred Tank Reacter, STR)(二)固定床型(也称填充床,Packed Bed Reactor, PBR )(三)流化床型(Fludized Bed Reactor, FBR)(四)膜式反应器(Membrane Reactor)(五)鼓泡塔型反应器二、酶反应器的发展第二节酶反应器的设计与选择一、酶反应器的设计1.设计目的2.设计原理(依据)二、酶反应器的选择(一)酶的应用形式(二)底物的物理性质(三)反应操作要求(四)酶的稳定性(五)应用的可塑性及成本三、酶反应器的操作第八章酶的应用 4学时【单元目标】1.了解酶在医药方面的应用2.了解酶在食品方面的应用3.了解酶在化工方面的应用4. 了解酶在环境保护方面的应用5. 了解酶在生物技术领域的应用【授课内容】第一节酶在医药方面的应用第二节酶在食品方面的应用第三节酶在化工方面的应用第四节酶在环境保护方面的应用第五节酶在生物技术领域的应用四、使用教材与主要参考书目录1教材《酶工程》(第二版)作者:郭勇科学出版社 20042 主要参考书目郭勇现代生化技术,华南理工大学出版社, 1996郭勇酶的生产与应用,化学工业出版社个,2003罗贵民酶工程,化学工业出版社,2002张树政酶制剂工业,科学出版社,1984邹国林酶学,武汉大学出版社, 1997五、考核方法和成绩构成本课程为考试考核,包括两部分:期中及平时为30%,期末70%。
《酶工程》教案安排:本课总学时为48,其中理论课40,实验课8,周学时为3学时。
要求:要求同学们课前预习教材,带着问题听课,这样学习效果好;学生上课作笔记,动动脑;学生课后复习和整理笔记,教师作课后小结和布置作业,达到教学相长的目的。
绪论1教学目标:使学生掌握酶、酶工程的概念,酶的化学性质与催化特性,了解酶的分类与命、酶活力测定、酶的生产方法。
2教学内容:主要讲酶和酶工程的基本概念与发展史、影响酶催化作用的因素、酶的分类与命名、酶的化学性质与催化特性、酶活力测定、酶的生产方法。
3重点和难点:酶、酶工程、酶活力有关的概念;酶的化学性质与催化特性、酶活力测定。
4教学方法:采用讲授式、启发式、图示法、问答式相结合的教学方法。
5板书设计:从上至下,从左至右;大标题始终留在黑板的左边;书写规范。
6学时分配:理论3学时,实验2学时。
7教学进程:第一节酶和酶工程的基本概念与发展史1酶的基本概念酶是生物体内进行新陈代谢不可缺少的受多种因素调节控制的具有催化能力的生物催化剂。
按化学组成分:蛋白类酶(Enzyme proteins)和核酸类酶(Ribozyme RNAs)。
a蛋白类酶(Enzyme proteins)酶是由生物体产生的具有催化活性的蛋白质。
b核酸类酶(Ribozyme RNAs)本身就是一段RNA,不需要额外的蛋白酶就可以对自身进行剪切。
提问:酶一定是蛋白质吗?2酶的发展史1.2.1酶在中国的发展史人们对酶的认识起源于生产与生活实践。
夏禹时代,人们掌握了酿酒技术。
公元前12世纪周朝,人们酿酒,制作饴糖和酱。
春秋战国时期已知用麴(曲)治疗消化不良的疾病。
酶者,酒母也。
1.2.2酶在西方的发展史1878年, 给酶一个统一的名词,叫Enzyme,这个字来自希腊文,其意思“在酵母中”。
1896年,日本的高峰让吉首先从米曲霉中制得高峰淀粉酶,用作消化剂,开创了有目的的进行酶生产和应用的先例。
西方国家19世纪对酿酒发酵过程进行了大量研究。
酶工程各章试题酶工程第一章测试试题卷一填空 (每空1分,共20分)1.1878年,____首次将酵母中酒精发酵的物质称为酶.2.1913年,Michaelis 和Menten根据中间产物学说,推导出酶催化反应的基本动力学方程----米氏方程,可用公式表示为_______.3.1982年Thomas Cech等人发现四膜虫的rRNA可以在没有蛋白质存在的情况下自身催化切除内含子,完成加工过程.这一具有催化活性的RNA的发现改变了传统的酶的化学本质是____________的概念。
4.对同一种酶可同时采用系统命名和_____命名两种方法.5.乳酸脱氢酶可标识为[EC.2],其中EC代表_________.6.催化L-谷氨酸 D—谷氨酸的酶属于________酶.7.核酸类酶的基本组成单位是_________.8.酶的有机辅助因子在催化过程中起_______________的作用.9.在酶的二级结构β—片状折叠中,________式结构更稳定.10.酶的绝对专一性又称为___________专一性.11.PH对酶的影响主要是影响到了氨基酸的________状态.12.在测酶活力时,为了使酶反应速度不受底物浓度底限制,反应系统应使用足够高的底物浓度,一般要求:__________.13.酶分离纯化整个工作包括三个基本环节:抽取纯化和________.14.工业应用的三大酶制剂是蛋白酶 ________和脂肪酶.15 核酸类酶催化反应的类型,可以将R-酶分为三类:剪切酶,剪接酶和________酶.16、具有不同分子形式但却催化相同反应的酶称为__________.17、每毫克蛋白或RNA中所具有的酶活力数称为酶的_______.用u/mg表示.18、酶制剂可分为液体酶制剂,固体酶制剂,纯酶制剂和_______酶制剂.二. 选择题 (每题2分,共10分)1.谷氨酸脱氢酶可有以下四种底物,由Km推断它的最适底物是( ).A. 谷氨酸Km= 0.12B. α-酮戊二酸Km=2.0C. NAD氧化形 Km=0.025D. NAD 还原形 Km=0.0182. D EA B CF G图示抑制模式属于:()A累积反馈抑制B无分支途径中酶活性反馈抑制C 顺序反馈抑制D 协调反馈抑制3.有A.B两种蛋白酶样品,A样品32mg,酶活力单位数为180U.B样品52mg ,酶活力单位数为190U,则两样品纯度为:A A >B B. A < B C. A = B D. 不能断定.4.某酶四种底物的Km 如下,与酶亲和力最大的底物是: ( )A 2.5 ×10-2B 4.4× 10-1C 8.8×10-2D 5.0×10-65.从世界范围看,酶制剂在哪一行业中的应用占比例最高?( )A 淀粉业B 乳制品C 洗涤剂业D 制酒业三. 名词解释 (每题3分,共12分)1.调节酶2.别构效应3.固定化酶四. 判断题(每题1分,共7分)2.1/Km越大,酶与底物亲和力越大.3.酶的最适温度是一个固定不变的常数,其数值不受底物的种类.作用时间而改变.4.盐析法分离蛋白质时,应将溶液PH调至蛋白质等电点附近.5.酶浓度越高,酶结晶越大.6.调节酶就是别构酶.7.大肠杆菌丙酮酸脱氢酶是多酶复合体.五. 说明题(共6分)1.图示并说明竞争性抑制和非竞争性抑制的区别.(6分)六. 简答题 (共21分)1.简介酶分子中氨基酸残基种类及作用.(8分)2请比较说明吸附层析、离子交换层析、凝胶层析、亲和层析的原理.(8分) 3、固定化酶的制备原则是什么?(5分)酶工程第一章测试参考答案一填空 (每空1分,共18分)1.库尼2.v=vmax[S]/Km+[S]3.酶是具有生物催化功能的蛋白质.4.习惯5.国际酶学委员会6.异构酶二. 选择题 (每题3分,共15分)1.D2.D3.A. 4D 5.C三. 名词解释 (每题5分,共15分)1.调节酶: 在代谢途径和物质转化体系中起调节作用的关键酶.2.别构效应:一种化合物与酶的活性中心以外的部位结合,引起酶的构象发生变化的现象.3.固定化酶:在一定空间内呈闭锁状态存在的酶,能连续地进行反应,反应后酶可以回收重复使用.四. 判断题(每题2分,共14分)1.正确2.错误3. 正确4. 错误5. 错误6. 正确7. 正确五、图示说明题(共12分)2.图示并说明竞争性抑制和非竞争性抑制的区别.(6分)不论底物分子是否与酶结合, 非竞争性抑制剂都能与酶分子结合产生死端复合物. 非竞争性抑制剂与活性中心以外的基团结合,其结构肯与底物分子毫无相关之处,两者没有竞争作用,但ESI不能进一步分解成产物. (图4分,解释2分) 七. 简答题 (共26分)1.请比较说明吸附层析、离子交换层析、凝胶层析、亲和层析分离酶的原2.固定化酶的制备原则是什么?(10分)(1)维持酶的催化活性和专一性.(2)应有利于生产自动化.连续化.(3)与载体牢固结合(4)载体不与底物.产物和反应物发生化学反应.(5)成本要低,利于工业使用.第二、三章酶的生物合成法生产测试题填空题1、SOD是_________酶,具有____________________的功效。