常见的酸和碱2
- 格式:doc
- 大小:42.50 KB
- 文档页数:1

第五单元初识酸和碱第一节生活中的酸和碱一、常见的酸和碱酸:H2SO4、HNO3、HCL(胃酸)、H2CO3、H2S(氢硫酸)、H3PO4、CH3COOH(HAc,乙酸、醋酸)工业三大强酸:H2SO4、HNO3、HCL碱:Ca(OH)2、NaOH、KOH、NH3.H2O(易分解,易挥发)二、酸的组成和分类组成:由氢元素和酸根组成的化合物分类:1. 物质类别:无机酸、有机酸2.是否具有氧元素:含氧酸(某酸)、无氧酸(某化氢/氢某酸)3.氧原子个数:一元酸(HCL)、二元酸(H2S)、三元酸(H3PO4)4.可结合(如:HCL一元无氧无机酸)三、碱的组成和分类组成:金属元素(或铵根)与氢氧根组成的化合物分类:1、可溶:KOH、NaOH、Ba(OH)2、NH3.H2O2、微溶:Ca(OH)23、难溶:其余 Fe(OH)3红褐色,Cu(OH)2 蓝色,Mg(OH)2白色四、实验室常见的酸和碱:酸(碱)的溶液才有酸(碱)性。
工业三大强酸: H2SO4、HNO3、HCl :四大强碱: Ca(OH)2、NaOH、KOH、Ba(OH)2。
H2SiO3硅酸难溶(1)盐酸性质:①为混合物:HCl气体+水,所以氯化氢≠盐酸。
②纯净的盐酸为无色液体,工业盐酸不纯净,黄色,含铁的化合物③有很强挥发性,浓盐酸(36%--37%),有刺激性气味,打开浓盐酸瓶盖,瓶口产生白雾-------挥发出的HCl(2)硫酸纯净H2SO4是无色、粘稠状液体,难挥发(纯H3PO4是无色晶体)①吸水性(物理性质):用于干燥剂,干燥O2、H2、CO2(碱性气体除外,如:NH3)②敞口放置:M质不变,M液增长,(但不是变质)溶质质量分数减小③脱水性(化学性质):使物质碳化④腐蚀性:用作金属除锈浓盐酸、浓硫酸分别滴在蓝色石蕊试纸上,前者变红,后者变黑。
(3)氢氧化钠(NaOH)俗名:火碱、烧碱、苛性钠(具有强腐蚀性)固体(白色)极易溶于水(溶解放热),能吸水而潮解,又能与空气中的CO2反映而变质,所以NaOH必须密封保存。


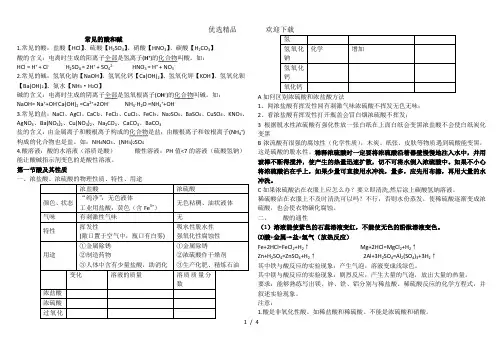
常见的酸和碱1.常见的酸:盐酸【HCl】、硫酸【H2SO4】、硝酸【HNO3】、碳酸【H2CO3】酸的含义:电离时生成的阳离子全部是氢离子(H+)的化合物叫酸。
如:HCl = H+ + Cl- H2SO4 = 2H+ + SO42- HNO3 = H+ + NO3-2.常见的碱:氢氧化钠【NaOH】、氢氧化钙【Ca(OH)2】、氢氧化钾【KOH】、氢氧化钡【Ba(OH)2】、氨水【NH3·H2O】碱的含义:电离时生成的阴离子全部是氢氧根离子(O H-)的化合物叫碱。
如:NaOH= Na++OH-Ca(OH)2 =Ca2++2OH-NH3·H2O =NH4++OH-3.常见的盐:NaCl、AgCl、CaCl2、FeCl2、CuCl2、FeCl3、Na2SO4、BaSO4、CuSO4、KNO3、AgNO3、Ba(NO3)2、Cu(NO3)2、Na2CO3、CaCO3、BaCO3盐的含义:由金属离子和酸根离子构成的化合物是盐;由酸根离子和铵根离子(NH4+)构成的化合物也是盐。
如:NH4NO3、(NH4)2SO44.酸溶液:酸的水溶液(溶质是酸)酸性溶液:PH值<7的溶液(硫酸氢钠)能让酸碱指示剂变色的是酸性溶液。
第一节酸及其性质一、浓盐酸、浓硫酸的物理性质、特性、用途1.4.8.A如何区别浓硫酸和浓盐酸方法1、闻浓盐酸有挥发性闻有刺激气味浓硫酸不挥发无色无味;2、看浓盐酸有挥发性打开瓶盖会冒白烟浓硫酸不挥发;3 根据脱水性浓硫酸有强化性放一张白纸在上面白纸会变黑浓盐酸不会使白纸炭化变黑B浓流酸有很强的腐蚀性(化学性质),木炭、纸张、皮肤等物质遇到硫酸能变黑,这是硫酸的脱水性。
稀释浓硫酸时一定要将浓硫酸沿着器壁慢慢地注入水中,并用玻棒不断得搅拌,使产生的热量迅速扩散,切不可将水倒入浓硫酸中。
如果不小心将浓硫酸沾在手上,如果少量可直接用水冲洗,量多,应先用布擦,再用大量的水冲洗。

课题10.1 常见的酸和碱(第二课时)(练习)【基础篇】1.下列物质放在空气中易潮解的是()A.碳酸钙B.纯碱C.烧碱D.生石灰【答案】C【解答】解:A.碳酸钙没有吸水性,在空气中不会潮解,不合题意;B.纯碱没有吸水性,在空气中不会潮解,不合题意;C.烧碱易吸收空气中的水蒸气而发生潮解,符合题意;D.生石灰能与空气中的水蒸气反应生成氢氧化钙而发生变质,不合题意。
故选:C。
2.下列几种物质的名称中,表示同一种物质的是()A.盐酸、胃酸、氯化氢B.冰、干冰、水C.氢氧化钠、烧碱、苛性钠D.氢氧化钙、消石灰、生石灰【答案】C【解答】解:A、盐酸是胃酸的主要成分,是氯化氢气体的水溶液,不是氯化氢,错误;B、干冰是固体二氧化碳,冰和水是同一种物质,错误;C、氢氧化钠俗称烧碱、苛性钠,正确;D、消石灰是氢氧化钙,生石灰是氧化钙,错误;故选:C。
3.氢氧化钠、氢氧化钙的溶液都具有相似化学性质,其原因是()A.都能解离出金属离子B.都含有氢元素和氧元素C.都能使无色酚酞试液变成红色D.溶液中都含有OH﹣【答案】D【解答】解:碱是指电离时生成的阴离子全部是氢氧根离子的化合物,碱溶液中的阴离子都是氢氧根离子,即电离时都能电离出OH﹣,氢氧化钠、氢氧化钙的溶液都具有相似化学性质,是因为液中都含有OH﹣。
故选:D。
4.某同学为了区别氢氧化钠溶液和澄清石灰水,设计了如图所示的四组实验方案,其中能达到目的是()A.B.C.D.【答案】D【解答】解:区别两种碱,需要借助差异,而不是共性,所以要从钠离子和钙离子上入手。
A、盐酸虽然都可以与氢氧化钠和澄清石灰水反应,但是没有反应现象,没法鉴别,故A错误,B、酚酞与遇碱变红色,氢氧化钠和澄清石灰水都是碱,没法鉴别,故B错误,C、石蕊遇碱变蓝色,氢氧化钠和澄清石灰水都是碱,不能鉴别,故C错误,D、二氧化碳与澄清石灰水反应出现沉淀,与氢氧化钠反应没现象,可以鉴别,故D正确。
故选:D。
5.下列有关氢氧化钠的描述中,正确的是()A.氢氧化钠在空气中放置会潮解B.氢氧化钠溶液能使紫色石蕊溶液变红C.氢氧化钠溶于水吸热D.氢氧化钠俗称烧碱、火碱、纯碱【答案】A【解答】解:A、氢氧化钠能够吸收水蒸气,在空气中放置会潮解,该选项说法正确;B、氢氧化钠溶液显碱性,能使紫色石蕊溶液变蓝色,该选项说法不正确;C、氢氧化钠溶于水放热,该选项说法不正确;D、氢氧化钠俗称烧碱、火碱、苛性钠,该选项说法不正确。

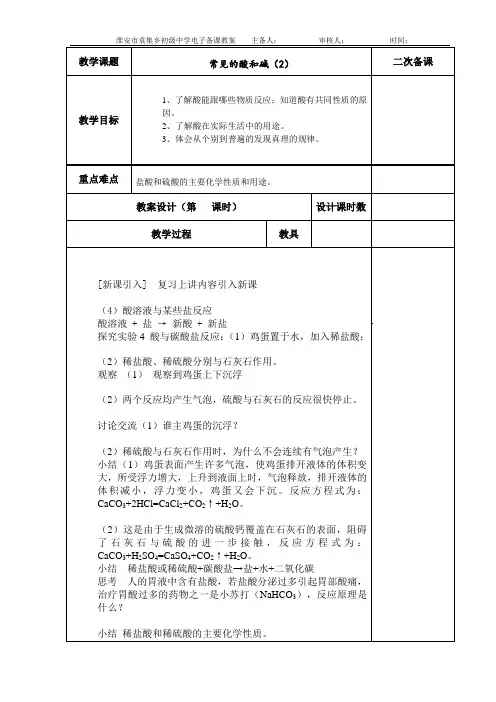



常见的酸和碱2【学习目标】1、知道盐酸的物理性质和用途。
2、通过活动与探究掌握盐酸的化学性质,能描述典型反应的实验现象并会书写相应的化学方程式。
4、树立科学的物质观,学会用辩证的观点看待事物,能透过表面现象挖掘事物具有共性的本质原因。
【学习重点】酸的化学性质【课前预习】1、盐酸可以使紫色石蕊变色;使无色酚酞变色。
这是因为溶液中都有。
、实验室用和制取二氧化碳,反应原理是:。
浓盐酸物理性质归纳总结:1、浓盐酸是无色(工业盐酸因为有杂质所以显黄色)具有刺激性气味的液体,具有性,需密封保存,长时间敞口放置,溶质质量分数会变。
盐酸的作用、、酸的化学性质1、与指示剂作用在稀盐酸中滴加紫色石蕊和无色酚酞溶液观察现象。
练习:自来水厂为了消毒经常向自来水中充入氯气(Cl2)反应的化学方程式为:Cl2+H2O===HCl+HClO,不法商贩经常用自来水冒充纯净水出售。
根据所学知识,设计一个实验鉴别真假纯净水。
2、与金属反应(1)从反应的基本类型看:它们都属于(2)能与酸反应的金属都是在金属活动顺序中的金属。
(3)从反应的速率看:______>_______>_______>,这是由它们的决定的。
(4)铁与盐酸、稀硫酸反应时,生成物中铁元素的化合价为______价。
溶液为________色。
(含有亚铁离子的溶液一般都显色)练习:黄铜(铜锌合金)和黄金在外观上非常相似,运用所学知识设计实验鉴别黄铜和黄金。
3、酸和金属氧化物反应分别在盛有稀盐酸、稀硫酸试管中放入一个生锈的铁钉,向盛有稀硫酸的试管中加入少量氧化铜。
(1)、反应的生成物有什么共同之处?(2)、利用上面的反应可以清除金属表面的锈,除锈时能否将金属制品长时间浸在酸中?为什么?(注意):(1)铁锈的主要成分是____________(填名称)而Fe2O3中,铁元素的化合价为______价,与盐酸、稀硫酸反应时,生成物中铁元素的化合价不变,所得溶液为_______色。

1
第 1 页 第 2 页
初 三 年级 化学 学案 主备: 时间 : 月 日
学习内容:十单元 课题1 常见的酸和碱(2) 自学收获
一.展示浓盐酸、浓硫酸以及浓硫酸与木材、纸张、布的反应,观察现象,分 析原因。
(在课本记录现象)
二.展示稀盐酸、稀硫酸与生锈的铁钉、氧化铜反应,观察现象,分析原因。
(在课本中进行记录) 小组学习:(积极参与,合作共赢!)
一.怎样区分浓盐酸和浓硫酸两种无色液体?
二.以小组总结酸的化学性质
展示反馈:(大胆展示,亮出自己!)
一.浓硫酸常用作干燥剂,是因为它有 性;浓盐酸暴露在空气中溶质质量 分数变 ,是因为 ,硫酸和盐酸对人体皮肤 及衣服都具有 性。
二.将一铜丝在空气中加热,可观察到 色的铜丝表面变成 色,然后将它 浸入稀硫酸里并微热,铜丝表面变成 色,反应后溶液呈 色,写出有 关反应的化学方程式: 、 三.用盐酸除去铁制品表面的铁锈,开始一段时间看到的现象是: ,发生反应的化学方程式: ,如果盐酸过量,过一会儿,又会看到 ,有关反应的化学方程式: 拓展延伸:(自主思维,拓宽视野!)
下列物质长期暴露在空气中,溶质成分不变,但溶质质量分数减小且溶液质量 增加的是( )
A.浓硫酸
B.浓盐酸
C.石灰水 请分析原因:
学习目标:1.知道几种常见酸的主要性质和用途 2.酸的腐蚀性和使用注意事项
重点:常见酸的主要性质和用途 自主学习:(细心研读,定有收获!)
一.请用15分钟时间仔细阅读P 51-P 54,认识几种常见的酸: 1.浓硫酸具有哪些特性?请划出来。
2.盐酸和硫酸的用途有哪些?在表中勾出来。
3.回忆八单元所学的几种金属分别与稀盐酸或稀硫酸反应的现象以及 反应的化学方程式。
二.自学检测:
1.试写出初中化学常见酸的化学式:
盐酸 、硫酸 、碳酸 、硝酸 、醋酸 2.浓硫酸具有强烈的腐蚀性,如果不慎将浓硫酸沾到皮肤或衣服上, 应先 ,然后 。
3.稀释浓硫酸时,一定要 ,切 不可 。
4.回忆第八单元所学的几种金属分别与稀盐酸或稀硫酸的反应,写出 化学方程式:
与稀盐酸反应 与稀硫酸反应 镁 锌 铁 5.铁锈的主要成分为 ,它呈 色。
试写出你新认识的反应: 铁锈+稀盐酸 铁锈+稀硫酸 6.列举你从自学中了解到的盐酸,硫酸的用途:
盐酸 ; 硫酸 。
活动探究:
自学疑问。