分析化学教案 课程目的和要求: 教学课时:36
- 格式:pdf
- 大小:84.09 KB
- 文档页数:10


《分析化学教案》PPT课件一、教案概述本教案旨在帮助学生掌握分析化学的基本概念、原理和方法,提高他们运用化学知识分析和解决实际问题的能力。
通过本章的学习,学生将了解分析化学的发展历程、任务和分类,掌握溶液的浓度表示方法、配制及稀释,了解常见分离和富集方法。
二、教学目标1. 知识与技能:(1)了解分析化学的发展历程、任务和分类;(2)掌握溶液的浓度表示方法、配制及稀释;(3)了解常见分离和富集方法。
2. 过程与方法:(1)通过实例分析,培养学生的分析能力;(2)通过实验操作,提高学生的动手能力。
3. 情感态度与价值观:(1)培养学生对分析化学的兴趣和热情;三、教学重点与难点1. 教学重点:(1)分析化学的发展历程、任务和分类;(2)溶液的浓度表示方法、配制及稀释;(3)常见分离和富集方法。
2. 教学难点:(1)溶液的浓度计算;(2)实验操作技巧。
四、教学方法与手段1. 教学方法:(1)讲授法:讲解分析化学的基本概念、原理和方法;(2)案例分析法:分析实际问题,培养学生的分析能力;(3)实验操作法:演示实验操作,提高学生的动手能力。
2. 教学手段:(1)PPT课件:展示分析化学的基本概念、原理和方法;(2)实验器材:进行实验操作,巩固所学知识。
五、教学过程1. 导入:通过展示分析化学在日常生活和科学研究中的应用,引发学生对分析化学的兴趣,激发学习热情。
2. 新课内容:(1)分析化学的发展历程、任务和分类;(2)溶液的浓度表示方法、配制及稀释;(3)常见分离和富集方法。
3. 案例分析:分析实际问题,引导学生运用分析化学的知识进行解决问题,培养学生的分析能力。
4. 实验操作:演示实验操作,讲解实验原理和方法,提高学生的动手能力。
5. 课堂小结:6. 作业布置:布置课后作业,巩固所学知识。
7. 课后反思:六、教学评估1. 课堂问答:通过提问,了解学生对分析化学基本概念的理解程度。
2. 实验报告:评估学生在实验操作中的动手能力和对实验原理的理解。


《无机及分析化学实验》教学大纲【课程编号】【学时学分】120 学时;【开课模式】必修【实验学时】36 学时【上机学时】【课程类型】专业课【考核方式】考试【先修课程】【开课单位】石油化工学院【授课对象】石油化工生产技术、精细化学品生产技术、有机化学品分析、煤化工一、教学目的与任务无机化学和分析化学是一门实验科学为主的基础课程。
实验是无机化学不可缺少的一个重要组成部分,是培养学生独立操作、观察记录、分析归纳、撰写报告等多方面能力的重要环节。
学生通过无机及分析实验课的学习,不仅加深对分析化学基础理论的理解,而且学习和掌握分析化学实验的基本知识、基本操作和基本技能,树立严格的“量”的概念。
培养学生实事求是的科学态度和严谨的科学作风、良好的实验室工作习惯,使其初步具备作为高级工程技术应用型人才的要求。
掌握常量组分定量分析的基础知识和基本操作。
1、掌握常用仪器分析的基本知识和基本操作技术。
2、掌握实验数据的误差分析和统计处理方法。
实验是化学与材料科学学院各专业本科生的一门必修的、独立的基础实验课。
课程的安排服从“一体化、渐定式、多层次、开放式”的教学体系和模式。
着力于培养学生具有宽广的基础知识和熟练的基本技能、能够适应未来社会发展需要的专业人才。
教学内容着眼于为学生今后的发展奠定基础。
学生在学习无机化学专业理论知识的同时,通过实验研究活动,学习和掌握无机化学专业的基本实验技术,研究元素的单质及其化合物的重要性质,熟悉重要无机化合物的制备方法;加深理解和掌握无机化学基本理论和基础知识;比较牢固地掌握化学实验的基本知识和操作技能;培养学生严谨的科学态度;培养学生准确观察化学反应现象,处理实验数据的能力,达到训练学生基本理论知识的综合应用能力。
课程的任务包括:(一)实验室一般知识介绍1.在全部教学过程中,应始终坚持对学生进行实验室安全和爱护公物的教育。
2.简介有效数字和误差理论。
3.介绍正确书写实验记录和实验报告的方法。

《分析化学》课程教学大纲(适用于化学专业)课程编码:B100013030总学时:64 总学分:4开课学期:第三学期课程类型:专业必修课先修课程:无机化学、无机化学实验一、课程教学目的《分析化学》课程是化学类本科专业学生的主干基础课之一,其理论和方法是其它一切与化学有关的课程以及专业的基础。
分析化学课在教给学生基本的分析化学原理和方法的同时,使学生建立起严格的“量”的概念,培养从事理论研究和实际工作的能力以及严谨的科学作风。
让学生能够运用化学平衡的理论和知识,处理和解决各种滴定分析法的基本问题。
《分析化学》课程的具体教学目的可以归纳为以下几点:1.掌握常量组分定量分析的基本知识、基本理论和基本分析方法;2.掌握分析测定中的误差来源、误差的表征,以及实验数据的统计处理方法与表达;3.初步了解分析化学在化工、医药、生物、信息、能源等领域中的应用,以及其它学科的新技术、新成就对分析化学的促进与发展。
二、课程基本内容第一章绪论(6学时)教学目标:1、了解分析化学的任务、作用和发展概况2、了解定量分析的方法与过程3、掌握基准物质和标准溶液的概念、定量分析的基本计算方法教学内容:1、分析化学定义、分析方法分类、分析化学的发展2、定量分析过程和方法3、滴定分析法概论教学重点:分析的基本过程、基准物质和标准溶液的概念教学难点:基准物质和标准溶液的概念第二章分析试样的采集与制备(4学时)教学目标:1、了解如何采集试样2、理解试样的制备方法3、掌握样品的分解方法教学内容:1、样品的采集2、试样的制备与分解教学重点:试样的制备与分解教学难点:试样的分解方法第三章分析化学中的误差与分析数据处理(10学时)教学目标:1、了解偶然误差的分布特征(正态分布),有限次测量中随机误差的t分布2、误差产生的原因及提高分析结果准确度的方法3、理解有效数字概念并掌握其计算法则4、掌握系统误差、偶然误差、准确度与精密度、误差与偏差等概念5、掌握计算分析结果的绝对误差、相对误差、标准偏差的方法6、掌握用数理统计方法处理分析数据的方法7、掌握置信度和显著性水准概念的含义教学内容:1、分析化学中的误差2、有效数字及其运算规则3、分析化学中的数据处理4、显著性检验5、可疑值取舍6、回归分析法7、提高分析结果准确度的方法教学重点:有效数字的运算规则、置信度、置信区间、误差产生的原因及提高分析结果准确度的方法教学难点:置信度、置信区间的概念;随机误差的分布特征——正态分布,有限次测量中随机误差的t分布第四章酸碱滴定法(10学时)教学目标:1、掌握酸碱质子理论,酸碱存在形式,及分布曲线2、掌握质子条件方程,简单溶液pH的计算3、理解酸碱指示剂变色原理及范围4、理解一元强、弱酸碱的滴定曲线、滴定突跃范围及指示剂的选择5、掌握强酸、强碱、一元弱酸、一元弱碱滴定终点误差的计算6、掌握酸碱滴定法的应用教学内容:1、酸碱反应与平衡2、酸碱体系中各型体的分布分数3、溶液中H+浓度的计算4、缓冲溶液5、酸碱指示剂6、酸碱滴定原理7、滴定误差8、酸碱滴定的应用教学重点:共轭酸碱对的Ka 与Kb的关系、质子条件式的书写、H+浓度的计算、滴定误差的计算教学难点:质子条件式的书写;缓冲溶液H+浓度计算第五章络合滴定法(10学时)教学目标:1、了解EDTA的性质及其与金属离子的配位能力和特点2、掌握EDTA滴定反应中副反应系数、酸效应系数定义式和计算式。



《分析化学》课程教案《分析化学》课程教案作为一无名无私奉献的教育工作者,可能需要进行教案编写工作,教案有利于教学水平的提高,有助于教研活动的开展。
写教案需要注意哪些格式呢?下面是店铺收集整理的《分析化学》课程教案,欢迎大家借鉴与参考,希望对大家有所帮助。
目的要求:了解分析化学的主要任务和作用、分类方法和发展以及主要参考资料。
教学内容:一、分析化学的任务和作用1.基本概念:分析化学:研究物质化学组成的分析方法及有关理论的一门科学,是化学的一个重要分支。
2.分析化学的任务可归纳为三大方面的主要任务:鉴定物质的化学组成(或成分)——定性分析(qualitative analysis)测定各组分的相对含量——定量分析(quantitative analysis)确定物质的化学结构——结构分析(structural analysis)3.分析化学的作用不但对化学学科的本身的.发展起着重大的作用,而且在各个领域都起着很重要的作用,比如:在国民经济、科学研究、医药卫生与环境保护等领域都起着重要的作用。
二、分析方法的分类三、分析化学的发展与趋势分析化学的发展经历了三次巨大变革,成为化学的一个重要分支。
第一次变革:20世纪初。
溶液平衡四大理论的建立,为分析化学提供了理论基础,使分析化学由一门技术发展成为一门科学。
第二次变革:20世纪50年代。
由于物理学和电子学的发展,使仪器分析方法得到发展,使原来以化学分析为主的经典分,发展成为以仪器分析为主的现代分析化学。
第三次变革:20世纪70年代,以计算机应用主要标志的信息时代的到来,为分析化学建立高灵敏度、高选择性、高准确性、自动化、智能化的新方法创立了条件。
总之,分析化学的发展趋势是以提高分析方法的准确度、灵敏度和分析速度,发展自动分析和遥测分析为目标。
思考题:做好下一章的预习目的要求:通过本章教学,使学生了解固体试样、液体试样、气体试样及生物试样的采集方法;掌握试样的制备方法;掌握常用的试样分解方法:溶解法、熔融法,了解试样分解的其它方法;了解并理解分析测定前的预处理。

《分析化学》课程教案篇一:分析化学教案一.分析化学的任务1.确定物质的化学组分——定性分析(由那些元素、离子、官能团或化合物组成)成分分析2.测定有关成分的含量——定量分析3.确定物质中原子间结合方式——结构分析(化学结构、晶体结构、空间分布等)分析化学是获取物质化学组成和结构信息的科学(本课程将以与卫生检验专业关系密切的“成分分析”为基本内容主要讨论成分分析的定量分析中的各种基本方法)二.分析方法的分类(根据分析化学任务、分析对象、分析原理、操作方法等分为多种分类)1.定性、定量、结构分析——根据分析化学任务元素、离子、化合物、相等2官能团、空间结构等3.化学分析与仪器分析——根据分析原理*化学分析:以物质的化学反应为基础的分析方法(历史悠久是分析化学的基础故又称经典分析方法)化学定性分析:根据反应现象、特征鉴定物质的化学组成化学定量分析:根据反应中反应物与生成物之间的计量关系测定各组分的相对含量使用仪器、设备简单常量组分分析结果准确度高但对于微量和痕量(<0.01%)组分分析灵敏度低、准确度不高*仪器分析:以物质的物理或物理化学性质为基础的分析方法(光化学、电化学、热、磁、声等)需要精密仪器;①电化学分析法:电位法、电导法、库仑法、伏安法等;②光学分析法:紫外及可见分光光度法、原子吸收分光光度法、分子荧光法、红外分光光度法等;③色谱分析法:液相色谱法、气相色谱法、高效液相色谱法等;④电感耦合等离子体原子发射光谱法;⑤质谱法;⑥核磁共振波谱法;⑦流动注射分析法;等特点:快速、灵敏所需试样量少适于微量、痕量成分分析(但对常量组分准确度低)4.常量、半微量、微量分析、超微量分析——根据操作方法及用量各种分析方法的试样用量方法试样质量(mg)试样体积(ml)常量分析>100>10半微量分析10100110微量分析0.10.01超微量分析<0.1<0.01化学定量分析:主要采用常量分析方法;仪器分析:主要用于进行微量、超微量分析常量组分分析、微量组分分析、痕量组分分析——待测组分含量常量组分微量组分痕量组分>1%0.01%1%<0.01%以上两种概念不能混淆如痕量组分分析不一定是微量分析:自来水中痕量污染物分析是常量分析5.常规分析和仲裁分析——根据分析目的(例行分析和裁判分析)三.定量分析结果的表示通常以单位质量或单位体积(mS、Vs)中被测物质的量来表示固体样品:用组分的质量分数(?)表示计算公式为mB?B?mSmB——被测组分质量mS——样品的质量若被测组分为常量组分mB的数值仍可用百分率(%)表示如ωB=0.3567则可计为35.67%;若被测组分为微量组分mB可用指数形式表示:如ωB=3.2×105 液体样品:用物质的量浓度c::mol/L,mmol/L,?mol/L物质的质量浓度:?:g/L,mg/L,?g/L气体样品:用质量浓度mg/m3,体积分数(?)ml/m3四.分析化学中的法定计量单位我国国务院于1984年2月27日发布了《关于在我国统一实行法定计量单位的命令》要求自1991起我国的计量单位一律采用《中华人民共和国法定计量单位》(一)中华人民共和国法定计量单位我国的法定计量单位(简称法定单位)由国际单位制(standardinternationalunitSI)计量单位和国家选定的其他计量单位构成包括以下几个部分:(基础单位辅助单位导出单位非国际单位制单位组合形式的单位十进倍数和分数单位)*国际单位制的基本单位(教材附录二表1)基础单位*国际单位制的辅助单位(教材附录二表2)辅助单位*国际单位制中具有专门名称的导出单位(教材附录二表3)由SI基本单位和辅助单位借助于乘、除等数学符号通过代数式表示的单位*国家选定的非国际单位制单位(教材附录二表4)在我国使用广泛的重要单位*由以上单位构成的组合形式的单位如:mol/Lm3 *由词头和以上单位所构成的十进倍数和分数单位(教材附录二表5)词头+主单篇二:大学分析化学教案目的要求:了解分析化学的主要任务和作用、分类方法和发展以及主要参考资料教学内容:一、分析化学的任务和作用1.基本概念:分析化学:研究物质化学组成的分析方法及有关理论的一门科学是化学的一个重要分支2.分析化学的任务可归纳为三大方面的主要任务:鉴定物质的化学组成(或成分)——定性分析(qualitativeanalysis)测定各组分的相对含量——定量分析(quantitativeanalysis)确定物质的化学结构——结构分析(structuralanalysis)3.分析化学的作用不但对化学学科的本身的发展起着重大的作用而且在各个领域都起着很重要的作用比如:在国民经济、科学研究、医药卫生与环境保护等领域都起着重要的作用二、分析方法的分类三、分析化学的发展与趋势分析化学的发展经历了三次巨大变革成为化学的一个重要分支第一次变革:20世纪初溶液平衡四大理论的建立为分析化学提供了理论基础使分析化学由一门技术发展成为一门科学第二次变革:20世纪50年代由于物理学和电子学的发展使仪器分析方法得到发展使原来以化学分析为主的经典分发展成为以仪器分析为主的现代分析化学第三次变革:20世纪70年代以计算机应用主要标志的信息时代的到来为分析化学建立高灵敏度、高选择性、高准确性、自动化、智能化的新方法创立了条件总之分析化学的发展趋势是以提高分析方法的准确度、灵敏度和分析速度发展自动分析和遥测分析为目标思考题:做好下一章的预习目的要求:通过本章教学使学生了解固体试样、液体试样、气体试样及生物试样的采集方法;掌握试样的制备方法;掌握常用的试样分解方法:溶解法、熔融法了解试样分解的其它方法;了解并理解分析测定前的预处理教学重点:试样的分解;教学难点:根据试样特点确定试样分解方法教学内容:21试样的采集在分析实践中常需测定大量物料中某些组分的平均含量.?取样的基本要求:代表性对比较均匀的物料如气体、液体和固体试剂等可直接取少量分析试样不需再进行制备通常遇到的分析对象从形态来分不外气体、液体和固体三类对于不同的形态和不同的物料应采取不同的取样方法2.1.1固体试样的采集固体物料种类繁多性质和均匀程度差别较大组成不均匀的物料:矿石,煤炭,废渣和土壤等;组成相对均匀的物料:谷物、金属材料、化肥、水泥等对不均匀试样应按照一定方式选取不同点进行采样以保证所采试样的代表性采样点的选择方法:随即采样法;判断采样法;系统采样法等取样份数越多越有代表性但所耗人力、物力将大大增加应以满足要求为原则平均试样采取量与试样的均匀程度、颗粒大小等因素有关通常试样量可按下面经验公式(切桥特公式)计算:m≥Kd2式中:m为采取平均试样的最低重量(kg);d为试样的最大颗粒直径(mm);K为经验常数可由实验求得通常K值在0.051之间例:采集矿石样品若试样的最大直径为10mmk=0.2kg/mm2,则应采集多少试样解:m≥kd2=0.2?102=20(kg)金属(合金)样品采取一般金属经过高温熔炼组成比较均匀因此于片状或丝状试样剪取一部分即可进行分析钢锭和铸铁由于表面和内部的凝固时间不同铁和杂质的凝固温度也不一样因此表面和内部的组成不很均匀取样时应先将表面清理然后用钢钻在不同部位、不同深度钻取碎屑混合均匀作为分析试样对于那些极硬的样品如白口铁、硅钢等无法钻取可用铜锤砸碎之再放入钢钵内捣碎然后再取其一部分作为分析试样2.1.2液体试样的采取常见液体试样包括:水饮料体液工业溶剂等一般比较均匀采样单元数可以较少对于体积较小的物料可在搅拌下直接用瓶子或取样管取样;装在大容器里的物料在贮槽的不同位置和深度取样后混合均匀即可作为分析试样;对于分装在小容器里的液体物料应从每个容器里取样然后混匀作为分析试样对于水样应根据具体情况采取不同的方法采样采取水管中或有泵水井中的水样时取样前需将水龙头或泵打开先放水1015分钟然后再用干净瓶子收集水样采取池、江、河、湖中的水样时首先根据分析目的及水系具体情况选择好采样地点用采样器在不同深度各取一份水样混合均匀后作为分析试样2.1.3气体试样的采取常见气体试样有:汽车尾气、工业废气、大气、压缩气体以及气溶物等亦需按具体情况采用相应的方法最简单的气体试样采集方法为用泵将气体充入取样容器中一定时间后将其封好即可但由于气体储存困难大多数气体试样采用装有固体吸附剂或过滤器的装置收集固体吸附剂用于挥发性气体和半挥发性气体采样;?过滤法用于收集气溶胶中的非挥发性组分?大气样品的采取通常选择距地面50180厘米的高度采样、使与人的呼吸空气相同大气污染物的测定是使空气通过适当吸收剂由吸收剂吸收浓缩之后再进行分析对储存在大容器内的气体因不同部位的密度和均匀性不同应在上、中、下篇三:分析化学教案目的要求:了解分析化学的主要任务和作用、分类方法和发展以及主要参考资料基本内容:一、分析化学的任务和作用1.基本概念:分析化学:研究物质化学组成的分析方法及有关理论的一门科学是化学的一个重要分支2.分析化学的任务可归纳为三大方面的主要任务:鉴定物质的化学组成(或成分)——定性分析(qualitativeanalysis)测定各组分的相对含量——定量分析(quantitativeanalysis) 确定物质的化学结构——结构分析(structuralanalysis)3.分析化学的作用不但对化学学科的本身的发展起着重大的作用而且在各个领域都起着很重要的作用比如:在国民经济、科学研究、医药卫生与环境保护等领域都起着重要的作用二、分析方法的分类三、分析化学的发展与趋势分析化学的发展经历了三次巨大变革成为化学的一个重要分支第一次变革:20世纪初溶液平衡四大理论的建立为分析化学提供了理论基础使分析化学由一门技术发展成为一门科学第二次变革:20世纪50年代由于物理学和电子学的发展使仪器分析方法得到发展使原来以化学分析为主的经典分发展成为以仪器分析为主的现代分析化学第三次变革;20世纪70年代以计算机应用主要标志的信息时代的到来为分析化学建立高灵敏度、高选择性、高准确性、自动化、智能化的新方法创立了条件分析化学无机分析有机分析化学分析仪器分析分析对象测定原理例行分析仲裁分析具体要求总之分析化学的发展趋势是以提高分析方法的准确度、灵敏度和分析速度发展自动分析和遥测分析为目标四、分析化学的最新进展1.毛细管电泳2.芯片实验室3.联用技术4.超导核磁共振波谱法5.流动注射分析法6.激光7.计算机的应用8.化学计量学9.仿生化和信息智能化第二章误差和分析数据处理目的要求:掌握误差产生的原因及减免方法准确度和精密度的表示方法;测量误差对计算结果的影响;熟悉逸出值舍弃原则了解统计检验的方法重点与难点:1.掌握基本概念:误差、绝对误差和相对误差、准确度和精密度、系统误差和偶然误差、误差和偏差2.掌握准确度和精密度的表示方法和有关计算基本公式3.掌握误差的来源(或产生原因)和减免方法4.掌握有效数字的修约规则及运算法则5.掌握显著性检验的目的和方法:F检验和t检验6.掌握可疑数据的取舍方法:Q检验法和G检验法7.掌握置信区间的含义和表示方法基本内容:一、测量误差及其表示方法1.基本概念和公式准确度(accuracy):表示分析结果与真值的接近程度准确度的高低用误差来表示误差有两种表示方法绝对误差和相对误差绝对误差(absoluteerror):测量值与真值之差称为绝对误差-测量值-值绝对误差可以为正值表示测量值大于真值;也可以为负值表示测量值小于真值测量值越接近真值越小反之越大相对误差(relativeerror):绝对误差与真值的比值称为相对误差通常以%或表示反映测量误差在值中所占的比例在分析工作中常用相对误差来衡量分析结果例题:测定纯NaCl中Cl的百分含量为60.52%而其含量(理论值)应为60.66%求测定的绝对误差和相对误差解:绝对误差=60.52%60.66%=0.14%相对误差=[(60.52%60.66%)/60.66%]×1000?=2.3例题:用分析天平称两个重量一是0.0021g另一是0.5432g两个重量的绝对误差都是0.0001g(0.0001/0.0021)×1000=47.62(0.0001÷0.5432)×1000=0.1841系统误差(systematicerror):由某种确定的原因造成的一般有固定的方向和大小重复测定时重复出现也称为可定误差(determinateerror)根据系统误差产生的原因可以把它分为方法误差、仪器(或试剂)误差、操作误差三种偶然误差(accidentalerror):由一些偶然的、不可避免的原因造成的误差特点:大小和方向(正负)都不固定;服从统计规律(正态分布);不能用加校正值的方法消除可以通过增加平行测定次数减免精密度(precision):平行测量的各测量值(实验值)之间相互接近的程度各测量值之间越接近精密度就越高;反之精密度越低精密度用偏差、相对平均偏差、标准偏差和相对标准偏差来表示实际工作中多用相对标准偏差偏差(deviationd):测量值与平均值之差称为偏差平均偏差(averagedeviation)::各单个偏差绝对值的平均值称为平均偏差相对平均偏差(relativeaveragedeviation):标准偏差(standarddeviationS):有限次测量各测量值对平均值的偏离程度相对标准偏差(relativestandarddeviationRSD):标准偏差在平均值中占的百分数RSD例题:四次标定某溶液的浓度结果为0.2041、0.2049、0.2039和0.2043mol/L计算测定结果的平均值平均偏差相对平均偏差标准偏差及相对标准偏差平均值=(0.2041+0.2049+0.2039+0.2043)/4=0.2043(mol/L)平均偏差=(0.0002+0.0006+0.0004+0.0000)/4=0.0003(mol/L) 相对平均偏差=(0.0003/0.2043)×1000?=1.5?相对标准偏差RSD=(0.0004/0.2043)×100%=0.2%2.准确度和精密度的关系测量结果的好坏应从准确度和精密度两个方面衡量:(1)精密度是保证准确度的先决条件(2)精密度好不一定准确度高只有在消除了系统误差的前提下精密度好准确度才会高3.提高分析准确度的方法(如何减免分析过程中的误差)(1)选择恰当的分析方法(2)减小测量误差(3)增加平行测定次数减小偶然误差(4)消除测量中的系统误差系统误差是造成平均值偏离真值的主要原因根据来源不同可以采用校准仪器、做对照试验、做回收试验、做空白试验的方法消除系统误差(0004.0140000.00004.00006.00002.02222LmolS标准偏差)1.基本概念有效数字:实际上能测量到的数字反映测定的准确程度记录原则:在记录测量数据时只允许保留一位可疑数末位数欠准注意问题:(1)数据中的“0”位于数字中间的0是有效数字在数字前面的“0”是定位用的不是有效数字很小的数字或很大的数字常用10的幂次表示(2)变换单位时有效数字的位数必须保持不变(3)pH、pM、pK等的有效数字仅取决于小数部分数字的位数因为正数代表原值的幂次(4)首位数8的数字其有效数字的位数可以多记一位2.有效数字的修约规则(1)“四舍六入五成双(或尾留双)”注意:尾数为5而后面是0时5前面是偶数则舍为奇数则入;尾数为5而后面不是0时都入(2)只允许对原测量值一次修约至所需位数不能分次修约(3)在大量数据运算时为防止误差迅速累加对参加运算的数据可先多保留一位有效数字运算后再将结果修约成与最大误差数据相当的位数3.有效数字的运算法则加减法几个数据相加减时以绝对误差最大的数据为准修约其它数据使各数据的绝对误差一致后再进行加减运算一般以小数点后位数最少的数据为准例题:0.53629.00534.25980.0011.97244.25958+0.25+0.00030.7910.97800.0003乘除法几个数据相乘除时以参加运算的数据中相对误差最大的那个数据为准进行修约后再运算例题:0.12×9.6782=1.161384修约为1.20.12×9.7=1.164修约为1.2三、有限量实验数据的统计处理1.正态分布和t分布正态分布:无限次测量的偶然误差分布服从正态分布(高斯分布)用平均值μ来表示一组数据群分布的位置用标准偏差来描述数据分布的离散性用正态分布概率密度函数表达:正态分布说明:(1)数据既向某个中心值集中的趋势又有偏离开这个中心值的倾向(2)大多数测量值集中在算术平均值的附近;(3)正负误差出现的概率相等;(4)小误差出现的概率大大误差出现的概率小;(5)所有测量出现在这个区间的概率总和为1有限次测量值的偶然误差分布服从t分布用样本的标准偏差S 代替总体标准偏差ζ来估计测量数据的分散程度t(xμ/S)图:t分布曲线t分布曲线:纵坐标仍然是概率密度y横坐标是统计量t得到的曲线称为t分布曲线统计量(t):是以标准偏差S为单位的(xμ)值t=xμ/St分布曲线是随自由度f(n1)而改变当f趋近于无限时t 分布就趋近于正态分布2.基本概念置信水平P(或置信度):表示在某一t值时测定值落在()的概率显著性水平?:测定值落在(tS=1P(置信水平P或显著性水平?表示人们作出判断的可靠把握程度由于t值和和f相关故引用时要加脚注用tαf表示)平均值的精密度:反映测量次数对平均值可靠性的影响程度平均值的精密度可用平均值的标准偏差表示置信区间:在一定的置信水平时以测定结果为中心包括总体平均值在内的可信范围称为置信区间(置信界限)具体表示:为置信区间为置信限(1)用多次测量的样本平均值x估计?值的范围:)称为平均值的置信区间(2)用少量测定值的平均值x估计值的范围:ntSx?(置信区间分为双侧和单侧两种双侧指同时存在大于和小于总体平均值的置信范围单侧指在一定置信水平时总体平均值大于或小于总体平均值的范围)3.显著性检验t检验:也叫准确度显著性检验主要用于检验两个分析结果是否存在显著的系统误差即判断少量实验数据的平均值x与标准试样标准值?之间是否存在显著性差异具体做法:先将数据代入公式nSxt???求出t值在一定置信度下从表中查得相应ft,?临界值计算值和查表值比较若计算的ftt说明与x间存在显著性差异;若计算的ftt,说明?与x间不存在显著性差异例题:某药厂生产的维生素丸剂要求含铁量为4.800%今从该厂的某一批号的产品抽样进行五次化验测得含铁量为4.744%、4.790%、 4.790%、4.798%及4.822%试问这批产品是否合格F检验:又称精密度显著性检验通过比较两组数据的方差S2以确定它们的精密度是否存在显著性差异具体方法:先计算出两个样本的方差比F然后与方差比的单侧临界值(21,,ffF)进行比较若21,,ffFF则说明两组数据的精密度不存在显著性差异;若21,,ffFF,则说明两组数据的精密度存在显著性差异例题:用两种方法测定同一样品中某组分第1法共测6次S1=0.055;第2法共测4次S2=0.022试问这两种方法的精密度有无显著性差别解:f1=61=5;f2=41=3由表24查得F0.05,5,3=9.01F=0.0552/0.0222=6.2<9.01因此S1与S2无显著性差别即两种方法的精密度相当使用显著性检验的几点注意事项:(1)两组数据的显著性检验顺序是先进行F检验然后进行t检验(2)单侧与双侧检验:检测两个(两组)分析结果是否存在显著性差异时用双侧检验;若检验某分析结果是否明显高于(或低于)某值则用单侧检验(3)置信水平P或显著性水平α的选择在分析化学中通常以α=0.05或P=95%作为判断差别是否显著的标准4.可疑数据的取舍当一组数据中出现个别不能判断的异常值时常用Q检验法和G检验法(Grubbs检验法)进行检验判断取舍例题:标定一个标准溶液测得4个数据:0.1014、0.1012、0.1019 0.1012和0.1016mol/L试用Q检验法确定数据0.1019是否应舍弃解:Q=(0.10190.1016)/(0.10190.1012)=0.43N=4时Q90%,4=0.76因为Q<Q90%,4所以数据0.1019不能舍弃思考题:1.恒定误差和比例误差有什么共同点和不同点点2.为什么统计检验的正确顺序是:先进行可疑数据的取舍再进行F检验最后进行t检验小结:系统误差和偶然误差的区分是本章的一个难点只要把握它们各自的特点就不难区分本章的另一个难点是应用统计学原理对有限数据进行统计处理判断其准确性和可靠程度第三章滴定分析概论目的要求:掌握滴定分析的特点滴定分析对反应的要求标准溶液的配制和标定基准物质的条件标准溶液浓度的表示方法和有关计算重点与难点:滴定分析法是目前完成化学分析任务最常用的一类分析方法包括酸碱滴定法、络合滴定法、氧化还原滴定法和沉淀滴定法等而化学平衡是分析化学中大多数基本分析方法(包括滴定分析)的理论基础1.在了解滴定分析法的特点和分类方法的基础上明确作为滴定分析的化学反应所必须具备的条件(1)反应必须定量完成;(2)反应必须迅速完成;(3)必须有合适的指示剂或其他简单可靠的方法确定终点2.掌握滴定分析中常用的滴定方式:(1)直接滴定法;(2)返滴定法;(3)置换滴定法;(4)间接滴定法3.掌握标准溶液的配制、标定及其浓度的表示方法(1)标准溶液的配制方法:直接法和间接法(2)基准物质应符合的条件:试剂组成和化学式完全相符试剂的纯度要足够高一般在99.9%以上;性质稳定参加滴定反应时无副反应;试剂最好有较大的摩尔质量可减小称量的相对误差。

《分析化学》教学大纲陈兴国(兰州大学化学化工学院,兰州730000)一教学目的和要求《分析化学》是化学专业学生的主干基础课之一,它的理论和方法不仅是分析化学的基础,也是从事化学教育、化学、生物、地质、环境等学科工作的基础。
《分析化学》在教给学生基本的分析化学原理和方法的同时,使学生建立起严格的“量”的概念,培养学生从事理论研究和实际工作的能力和严谨的科学作风。
为基地班开设的《分析化学》课程,除上述要求外,还应特别注意培养学生的创造性。
《分析化学》的目的和要求可以归纳为以下几点:1.掌握常量组分定量分析的基本知识、基本理论和基本分析方法。
2.掌握分析测定中的误差来源、误差的表征及初步学会实验数据的统计处理方法。
3.了解定量分析中常用分离方法的原理及应用。
4.了解分光光度法的原理及应用。
5.了解分析化学学科的最新科研成果。
在本课程教学中,不仅要讲清分析化学的基本要领和基本理论,而且要让学生懂得建立这些概念和理论的化学处理方法和思维方法,加强素质教育,注重能力培养,提倡创新精神。
二课程内容和学时分配本课程共分十一章,总授课学时为54学时。
表1 《分析化学》课程学时分配内容学时内容学时绪论2沉淀滴定法2误差与数据处理6重量分析法4滴定分析概述2吸光光度法6酸碱平衡及酸碱滴定11分离方法6络合滴定法7试样准备及分析示例2氧化还原滴定法6(合计)(54)考试(2次)(4)1.绪论(2学时)分析化学的定义、分类、任务和作用。
分析化学的发展、现状和展望。
定量分析过程定量分析方法。
2.误差及分析数据的处理(6学时)测量误差的表征––—准确度和精密度。
误差的表示方法––—误差和偏差。
误差的来源和分类––—系统误差和随机误差。
随机误差的分布规律:频率分布、正态分布、随机误差的区间概率。
测量精密度的表征:极差、平均偏差、标准偏差(s 和σ);平均值的标准偏差(-xS 和-xσ)。
平均值的置信区间:从σ求μ的置信区间(U 分布表);从s 求μ的置信区间(t 分布表)。
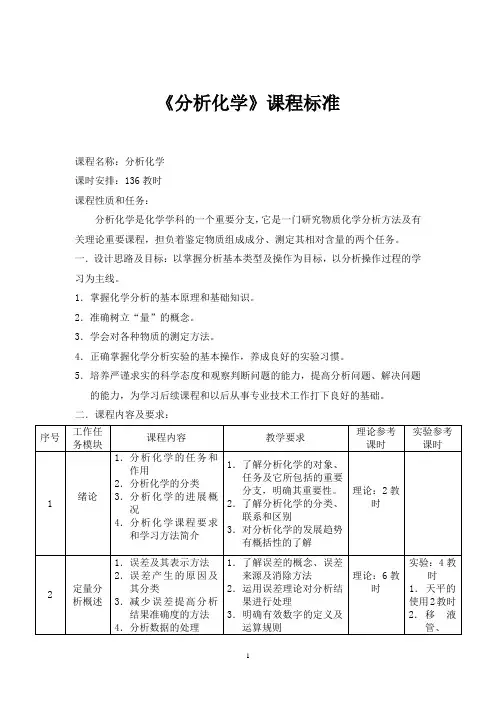
《分析化学》课程标准课程名称:分析化学课时安排:136教时课程性质和任务:分析化学是化学学科的一个重要分支,它是一门研究物质化学分析方法及有关理论重要课程,担负着鉴定物质组成成分、测定其相对含量的两个任务。
一.设计思路及目标:以掌握分析基本类型及操作为目标,以分析操作过程的学习为主线。
1.掌握化学分析的基本原理和基础知识。
2.准确树立“量”的概念。
3.学会对各种物质的测定方法。
4.正确掌握化学分析实验的基本操作,养成良好的实验习惯。
5.培养严谨求实的科学态度和观察判断问题的能力,提高分析问题、解决问题的能力,为学习后续课程和以后从事专业技术工作打下良好的基础。
二.课程内容及要求:序号工作任务模块课程内容教学要求理论参考课时实验参考课时1 绪论1.分析化学的任务和作用2.分析化学的分类3.分析化学的进展概况4.分析化学课程要求和学习方法简介1.了解分析化学的对象、任务及它所包括的重要分支,明确其重要性。
2.了解分析化学的分类、联系和区别3.对分析化学的发展趋势有概括性的了解理论:2教时2 定量分析概述1.误差及其表示方法2.误差产生的原因及其分类3.减少误差提高分析结果准确度的方法4.分析数据的处理1.了解误差的概念、误差来源及消除方法2.运用误差理论对分析结果进行处理3.明确有效数字的定义及运算规则理论:6教时实验:4教时1.天平的使用2教时2.移液管、5.有效数字及其运算规则4.掌握天平的使用滴定管校正。
2学时3 滴定分析概述1.滴定分析的过程2.滴定分析方法的分类3.标准溶液的配制及标定4.标准溶液浓度的表示方法5.滴定分析计算1.了解滴定分析法的过程、分类2.掌握标准溶液的配制和浓度标定的各种方法及有关计算3.掌握滴定分析结果的计算方法理论:8教时实验:6学时标淮溶液的配制1.直接法22.间接法23.标定24 水溶液中的酸碱平衡1.温度和湿度系数的概念2.酸碱质子理论3.酸碱平衡有关浓度的计算4.缓冲溶液1.理解酸碱质子理论的概念2.掌握酸碱平衡体系中PH值的计算方法3.通过实验掌握缓冲溶液的作用原理、配制方法及其应用理论:8教时实验:6学时1.缓冲液配制。
一、课程基本信息1. 课程名称:分析化学2. 授课对象:化学、环境科学、材料科学等相关专业本科生3. 学时安排:32学时4. 教学目标:- 知识目标:掌握分析化学的基本原理、方法和应用,了解化学分析在各个领域的应用。
- 能力目标:培养学生分析问题和解决问题的能力,提高实验技能和数据处理能力。
- 素质目标:培养严谨的科学态度、良好的实验习惯和团队合作精神。
二、教学内容1. 分析化学的基本概念和原理2. 定量分析和定性分析3. 常用分析方法:滴定分析、重量分析、光谱分析、色谱分析等4. 分析误差及数据处理5. 分析化学在各领域的应用三、教学方法和手段1. 讲授法:系统讲解分析化学的基本原理和常用分析方法。
2. 案例分析法:通过典型实例,分析化学分析方法在实际问题中的应用。
3. 实验教学法:引导学生进行实验操作,培养学生的实验技能。
4. 讨论法:组织学生进行课堂讨论,激发学生的思考能力。
5. 多媒体教学:利用PPT、视频等多媒体手段,丰富教学内容。
四、教学进度安排1. 第一周:分析化学的基本概念和原理2. 第二周:定量分析和定性分析3. 第三周:滴定分析4. 第四周:重量分析5. 第五周:光谱分析6. 第六周:色谱分析7. 第七周:分析误差及数据处理8. 第八周:分析化学在各领域的应用五、教学活动设计1. 课堂讲授:教师系统讲解分析化学的基本原理和常用分析方法。
2. 案例分析:教师选取典型实例,分析化学分析方法在实际问题中的应用。
3. 实验操作:引导学生进行实验操作,培养学生的实验技能。
4. 讨论交流:组织学生进行课堂讨论,激发学生的思考能力。
5. 实验报告:学生完成实验操作后,撰写实验报告,提高数据处理能力。
六、教学评价1. 课堂表现:观察学生在课堂上的学习态度、参与程度和回答问题的情况。
2. 实验报告:评估学生的实验操作、数据处理和撰写报告的能力。
3. 期末考试:通过笔试,检验学生对分析化学知识的掌握程度。
《分析化学》课程标准
一、课程目标
1.了解分析化学的任务、作用和化学分析的分类、步骤。
2.了解误差的来源、特点,掌握定量分析中的误差及数据处理方面的基础知识。
3.了解滴定分析法的原理,掌握标准滴定溶液的配制和标定方法。
4.理解定量分析中的基本概念,掌握酸碱滴定法、配位滴定法、氧化还原滴定法、沉淀滴定法等滴定分析和称量分析的方法及基本原理。
5.了解各种滴定法常见的应用实例。
6.培养学生牢固树立“量”的概念,掌握定量分析中的有关计算。
二、课程内容
3.教学实施建议
(1)教学场地与设备
授课教室按容纳50名学生配置,并配有黑板、讲台、计算机、投影仪等多媒体教学设备。
(2)师资要求
任课老师应具备相关专业大学本科及以上学历;具备高级工以上的职业资格,具有中等职业学校教师资格,经过职业教育学理论、教学方法等方面的培训,具有基本的教学设计能力。
(3)教学方法建议
①提倡教学方法和教学手段多样化。
②理论联系实际,结合实物、演示实验教学,激发学生的兴趣和求知欲。
③引导学生找出知识的规律性,抓住重点、突破难点。
④加强分析基本计算的训练。
分析化学课程教学大纲一、课程概述分析化学是化学专业的一门基础课程,旨在培养学生分析和解决实际问题的能力。
本课程教学大纲旨在明确课程目标、教学内容和评估方式,以帮助学生全面理解和掌握分析化学的基本理论和实验技术。
二、课程目标1.认识和理解分析化学的基本概念、原理和方法;2.熟悉常用的分析仪器设备、实验操作和数据处理技术;3.培养学生的实验设计和数据分析能力;4.掌握分析化学在科学研究和实际应用中的重要性和作用。
三、教学内容1.分析化学的基本概念和原理(1)分析化学的定义和分类(2)样品的制备和处理技术(3)分析方法的选择和评价2.常用的分析仪器设备和实验技术(1)光谱分析法(紫外-可见光谱、红外光谱等)(2)电化学分析法(电位滴定法、电化学方法等)(3)色谱分析法(气相色谱、液相色谱等)(4)质谱分析法(质量光谱、质谱法等)3.分析化学实验技术(1)标准曲线的建立和应用(2)样品测定和数据处理(3)实验安全与仪器操作规范4.分析化学在科学研究和实际应用中的应用(1)环境监测与分析(2)生物医药分析(3)食品安全与质量监测四、教学方法1.理论授课:通过课堂讲解和案例分析,向学生介绍分析化学的基本原理和方法;2.实验教学:通过实验操作,让学生亲自体验和掌握分析化学的实验技术;3.讨论和互动式学习:鼓励学生积极参与讨论,分享实验经验和思考问题;4.案例分析和实践报告:要求学生根据所学知识分析实际问题,并撰写实践报告。
五、评估方式1.平时成绩:包括参与度、实验报告和课堂作业等;2.期中考试:对学生的理论知识和实验能力进行考核;3.期末考试:综合考察学生对分析化学知识的掌握和应用能力。
六、学时安排本课程总学时为36学时,其中理论教学占24学时,实验教学占12学时。
七、教材和参考书目主教材:《分析化学教程》参考书目:1. 《分析化学基础》2. 《分析化学导论》3. 《现代分析化学》总结:此份分析化学课程教学大纲明确了课程目标、教学内容、教学方法和评估方式等重要要素。
分析化学教案课程目的和要求:通过这门课程的学习使学生掌握其定量分析的原理和测定方法,建立起严格的“量”的概念。
让学生能够运用化学平衡的理论和知识,处理和解决各种滴定分析法的基本问题,包括滴定曲线、滴定误差、滴定突跃和滴定可行性判据,掌握重量分析法及吸光光度法的基本原理和应用、分析化学中的数据处理。
了解常见的分离与富集方法。
培养学生科学的思维方法和严谨的科学作风,正确掌握有关的科学实验技能,提高分析问题和解决问题的能力。
教学课时:36学时所用教材:武汉大学主编,分析化学,第五版,上册,高等教育出版社, 2006 主要教学参考书及材料1.武汉大学等,分析化学,第四版,北京:高等教育出版社, 2000.2.华中师范大学,东北师范大学,陕西师范大学等,分析化学,第三版,北京:高等教育出版社, 2002.3.林树昌,胡乃非.分析化学(化学分析部分).4.彭崇慧,冯建章,张锡瑜,李克安,赵凤林.定量化学分析简明教程.第2版.北京:北京大学出版社,19975.R. Kellner, J.-M. Mermet, M. Otto and H. M. Widmer, Ed., AnalyticalChemistry,WILEY-VCH, Weinheim, 1998。
中译本,分析化学,李克安,金钦汉等人,北京大学出版社,2001。
6.李俊义,张渔夫,徐书绅等编.分析化学学习指导. 北京: 高等教育出版社,1991.67.武汉大学《定量分析习题精解》编写组编著.定量分析习题精解. 北京:科学出版社.1999.8.8.淅江大学分析化学教研组.分析化学选择填充题选集(第一册). 北京: 高等教育出版社,1988.8.9.淅江大学分析化学教研组.分析化学选择填充题选集(第二册). 北京: 高等教育出版社,1988.8.第1章绪论(2学时)教学要求:会用不同的分类标准 , 将分析化学分成许多不同的类别;了解分析化学的定义、任务和作用和分类。
分析化学教案课程目的和要求:通过这门课程的学习使学生掌握其定量分析的原理和测定方法,建立起严格的“量”的概念。
让学生能够运用化学平衡的理论和知识,处理和解决各种滴定分析法的基本问题,包括滴定曲线、滴定误差、滴定突跃和滴定可行性判据,掌握重量分析法及吸光光度法的基本原理和应用、分析化学中的数据处理。
了解常见的分离与富集方法。
培养学生科学的思维方法和严谨的科学作风,正确掌握有关的科学实验技能,提高分析问题和解决问题的能力。
教学课时:36学时所用教材:武汉大学主编,分析化学,第五版,上册,高等教育出版社, 2006 主要教学参考书及材料1.武汉大学等,分析化学,第四版,北京:高等教育出版社, 2000.2.华中师范大学,东北师范大学,陕西师范大学等,分析化学,第三版,北京:高等教育出版社, 2002.3.林树昌,胡乃非.分析化学(化学分析部分).4.彭崇慧,冯建章,张锡瑜,李克安,赵凤林.定量化学分析简明教程.第2版.北京:北京大学出版社,19975.R. Kellner, J.-M. Mermet, M. Otto and H. M. Widmer, Ed., AnalyticalChemistry,WILEY-VCH, Weinheim, 1998。
中译本,分析化学,李克安,金钦汉等人,北京大学出版社,2001。
6.李俊义,张渔夫,徐书绅等编.分析化学学习指导. 北京: 高等教育出版社,1991.67.武汉大学《定量分析习题精解》编写组编著.定量分析习题精解. 北京:科学出版社.1999.8.8.淅江大学分析化学教研组.分析化学选择填充题选集(第一册). 北京: 高等教育出版社,1988.8.9.淅江大学分析化学教研组.分析化学选择填充题选集(第二册). 北京: 高等教育出版社,1988.8.第1章绪论(2学时)教学要求:会用不同的分类标准 , 将分析化学分成许多不同的类别;了解分析化学的定义、任务和作用和分类。
掌握化学计量点、滴定终点、滴定误差等基本概念。
掌握滴定分析对化学反应的要求和基准物质应具备的条件。
了解常用的滴定方式。
掌握标准溶液的配制和标定方法。
通过习题计算牢固掌握物质的量浓度和滴定度的应用及换算。
教学重点:分析方法的分类。
定量分析的一般程序。
有关滴定分析的基本概念 , 对化学反应的要求,标准溶液的配制、标定和浓度表示及计算。
1.1分析化学的定义、任务和作用定义:分析化学是发展和应用各种理论、方法、仪器和策略以获得有关物质在相对时空的组成和性质的信息的一门科学。
分析化学(分析学)是一门自然科学。
它致力于建立和应用各种方法,仪器和战略以获得有关物质在一定时间或空间内的组成、结构和能态的信息(周南:现代分析化学的内涵和新定义。
理化检验-化学分册。
37卷1期,47-48)。
对新定义的几点说明:⑴指有关分析化学发展,带有方向性的设想和规划等,如分析仪器的微型化,分析技术的联用等。
这是建立新方法和开发新分析仪器的基础。
⑵组成也包括某一元素各种形态的组成。
例如有机硒和无机硒。
形态也包括某一元素的各种氧化态或价态,如Re(Ⅳ)和Se(Ⅵ)等。
⑶一定时间指各种瞬时扫描测定和过程分析而言。
⑷一定空间指各种表面分析、微区分析等试样某一指定部位而言。
⑸信息”强调分析化学是用分析思维和方法获得物质化学信息的科学它是一门“应用信息科学。
⑹自然科学”表明分析化学是一门独立的自然科学,不从属于化学或物理学或其“他学科,但由于它提供的是化学信息,故仍可称作“分析化学”。
⑺物质”指分析化学仅适用于物质世界这一范畴之内。
“分析化学是研究物质化学组成的表征和测量的科学。
测量:物质的组成的含量;表征:物质的组成结构。
任务:确定物质化学组成,测量含量,表征物质化学结构。
化学组成-定性分析(化学分析,仪器分析)组份含量-定量分析(化学分析,仪器分析)化学结构-结构分析(仪器分析)作用:科学研究的基础,生产实践必不可少。
生命科学、材料科学、环境科学、能源科学提供重要信息。
工业-原料选择、流程控制、产品检验;农业-土壤分析、化肥、农药分析、农作物生长过程研究;国防-武器研制和生产;资源开发等。
1.2 分析化学方法分类与选择1.2.1 方法分类分类标准:任务,分析对象,测定原理,试样用量,组分含量,具体要求。
任务——定性分析、定量分析、结构分析。
分析对象——无机分析:物质组成和成分含量;有机分析:官能团和结构分析。
测定原理——化学分析法:以化学反应为基础。
仪器分析法:以物理和物理化学性质为基础。
进一步分:光、电化学、热、色谱、声等。
试样用量——常量分析(>0.1克)、半微量分析(0.1-0.01克)、微量分析(0.01-0.0001克)、超微量分析(<0.0001克)。
组分含量——常量成分分析(>0.1%)、微量成分分析(0.01%-1%)、痕量成分分析(<0.01%)。
具体要求-例行分析(常规分析)、仲裁分析。
按分析材料名称—水分析、岩石分析、食品分析、钢铁分析、临床分析、药物分析按化学组成—全分析、元素分析、化合物分析1.2.2 方法选择根据测定要求,组分的特点、共存组分情况、现有条件、测定成本、时间要求等。
1.3 分析化学的发展简史与展望。
三次变革:20世纪初二次大战前后(20世纪中叶)20世纪初70年代1.4 分析化学过程及分析结果的表示1.4.1 定量分析的过程一般步骤:取(采)样-制样-分离-选择方法-测定-结果计算及评价。
取(采)样-制样(第二章的内容)分离的意义:在分析化学中分离是非常重要的,所测对象通常都是很复杂的,许多共存物质有可能干挠,除一些采用掩蔽消除外,多采用分离的方法,分离是分析化学中非常重要的一个研究领域。
分离:是消除干扰的一种方法。
常用的分离方法:沉淀分离法;挥发和蒸馏分离法;液– 液萃取分离法;离子交换分离法;色谱分离法;测定:选择合适的分析方法。
熟悉各种分析方法的特点做出正确选择。
对于高含量组分的测定,一般采用滴定分析法和重量分析法;对于低含量组分的测定,一般采用灵敏度较高的仪器分析法。
分析结果的计算与评价(第三、第四章)1.4.2分析结果的表示一、表示形式:待测组分实际存在形式;如试样中氮的实际存在形式, 可用NH3、NO3-,N2O5等表示元素的氧化物形式;如矿石分析中常以K2O,CaO,MgO,SiO2等表示。
元素形式;在金属材料和有机分析中,用Fe,Cu, Mo 和C、H、O、S 等表示。
离子形式。
如电解质溶液中,常以K+,Na+, SO42-,Cl-等表示。
二、含量表示方法固体--质量分数;可用小数表示,也可用%表示。
液体--物质的量浓度;mol·L-1质量摩尔浓度;mol·Kg-1质量分数;体积分数;摩尔分数;质量浓度g·L-1气体--体积分数;质量浓度。
1.5 滴定分析法概述1.5.1滴定法常用术语及方法特点一、滴定分析法原理:将一种已知准确浓度的试剂溶液,逐滴加入到被测物质的溶液中,直到反应完全。
然后根据所用的试剂溶液的体积和浓度,求出待测物质的含量。
1、滴定剂:已知准确浓度的试剂溶液(一般为标准溶液)2、滴定:把滴定剂从滴定管滴加到被测物质溶液中的过程。
3、化学计量点:滴入的标准溶液与被测物质定量反应完全时,称反应到达了化学计量点,简称计量点并用sp表示,即stoichiometric point 的缩写。
4、滴定终点(end point ):一般依照指示剂的变色来确定化学计量点,滴定中指示剂改变颜色的那一点,称为滴定终点并用ep 表示,5、终点误差Et (titration error) :滴定终点与化学计量点不一定恰好相符, 由此造成的分析误差称为终点误差。
理论上,滴定剂与被测物质的量符合化学计量关系时。
-计量点。
实际上,用指示剂判断,使滴定停止时。
-滴定终点。
问:两者有何区别?二、滴定分析法的特点①两者成化学计量关系;②常量分析(取样量?含量?)③快速、简单、简便、广泛;④准确(标准方法)相对误差<0.1%1.5.2滴定分析法对化学反应的要求滴定反应:能用于滴定分析的化学反应。
①反应必须按一定的化学反应方程式进行②反应要定量进行(符合化学计量,反应完全99.9%);③反应速度要快;④能用简单的方法确定终点。
1.5.3滴定方式一、直接滴定法:用标准溶液直接滴定待测物质,是滴定分析中常用和最基本的方法。
二、返滴定法:待测物质和过量标准溶液反应,再用另一种标准溶液滴定剩余的标准溶液。
三、置换滴定法:用一种试剂与待测组分待测组分定量地置换为另一种物质,再用标准溶液滴定这种物质。
四、间接滴定法待测物质不能与滴定剂直接反应时,通过另外的化学反应生成能和标准溶液反应的物质,根据各反应物的计量关系计算待测组分的量。
1.6 基准物质和标准溶液1.6.1 基准物质试剂的级别:保证试剂(优级纯);分析试剂(分析纯);化学纯(纯);实验试剂。
滴定待测物质的具有准确浓度的溶液为标准溶液。
可以直接配制标准溶液的物质为基准物质。
基准物质应符合的条件:①在空气中稳定;②纯度在99.9%以上;③实际组成与化学式相符④摩尔质量较大;⑤滴定反应符合滴定分析要求。
常用的基准物质有纯金属和纯化合物。
如Ag , Cu , Zn , Cd , Si , Ge , Al ,Co , Ni , Fe 和NaCl , K2Cr2O7 ,Na2CO3 , As2O3 , CaCO3,邻苯二甲酸氢钾,硼砂等。
它们的质量分数一般在99.9%以上1.6.2 标准溶液的配制方法一、直接法配制--在分析天平上,直接称取一定质量的物质(基准物),溶解后,定量转移到一定容量的容量瓶中。
如重铬酸钾标准溶液的配制。
二、标定法间接配制法--先配制接近所需浓度的溶液,然后用基准物质滴定(称为标定),或用已标定过的标准溶液滴定。
如氢氧化钠标准溶液的配制。
1.7 滴定分析法的计算。
1.7.1 标准溶液浓度的表示方法一、物质的量浓度C B :溶液中所含溶质的物质的量nB 除以溶液的体积V 。
(物质的量的数值与基本单元有关)二、滴定度:每毫升滴定剂相当于被测物质的质量或质量分数。
(生产单位的例行分析常用)TB /A (g/mL ) B :被测物的化学式 A :滴定剂的化学式三、滴定度与物质的量浓度的换算:100010001000/B A A B A A B A A B B A B A B M C a b V M n a b V M n a b V M n V m T dD cC bB aA ×=×××=××=×==+=+1.7.2①滴定分析计算依据 t T + A == P或②标准溶液的直接配制: ③基准物标定(估算基准物质量;计算标准溶液浓度):④1000/T T T T M V C m ⋅⋅=A A T T V C at V C ⋅⋅=⋅⑤1.7.3 滴定分析计算示例例1:现有0.1200 mol/L 的NaOH 标准溶液200 mL ,欲使其浓度稀释到0.1000mol/L ,问要加水多少mL ?解:设应加水的体积为 V mL ,根据溶液稀释前后物质的量相等 的原则,)200(1000.02001200.0V +=×∵)(401000.0200)1000.01200.0(mL V =×−=∴ 例2:将0.2500 g Na2CO 3基准物溶于适量水中后,用0.2 mol/L 的HCl 滴定至终点(甲基橙),问大约消耗此HCl 溶液多少毫升?232=CO Na HCl n n ∵ 323232100022CO Na CO Na CO Na HCl HCl M m n V C ××=×=× )(240.1062.010002500.02ml V HCl ≈×××=∴232=CO Na HCl n n ∵ 例3:若TNa 2CO 3/HCl = 0.005300 g/mL ,试计算HCl 标准溶液物质量的浓度。