无机及分析化学实验教学大纲
- 格式:docx
- 大小:15.30 KB
- 文档页数:5
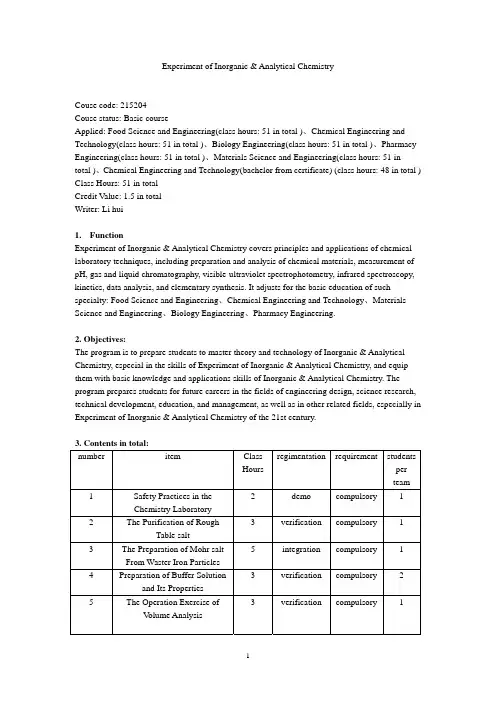
Experiment of Inorganic & Analytical ChemistryCouse code: 215204Couse status: Basic courseApplied: Food Science and Engineering(class hours: 51 in total )、Chemical Engineering and Technology(class hours: 51 in total )、Biology Engineering(class hours: 51 in total )、Pharmacy Engineering(class hours: 51 in total )、Materials Science and Engineering(class hours: 51 intotal )、Chemical Engineering and Technology(bachelor from certificate) (class hours: 48 in total ) Class Hours: 51 in total Credit Value: 1.5 in total Writer: Li hui1. FunctionExperiment of Inorganic & Analytical Chemistry covers principles and applications of chemical laboratory techniques, including preparation and analysis of chemical materials, measurement of pH, gas and liquid chromatography, visible-ultraviolet spectrophotometry, infrared spectroscopy, kinetics, data analysis, and elementary synthesis. It adjusts for the basic education of such specialty: Food Science and Engineering 、Chemical Engineering and Technology 、Materials Science and Engineering 、Biology Engineering 、Pharmacy Engineering.2. Objectives:The program is to prepare students to master theory and technology of Inorganic & Analytical Chemistry, especial in the skills of Experiment of Inorganic & Analytical Chemistry, and equip them with basic knowledge and applications skills of Inorganic & Analytical Chemistry. The program prepares students for future careers in the fields of engineering design, science research, technical development, education, and management, as well as in other related fields, especially in Experiment of Inorganic & Analytical Chemistry of the 21st century.3. Contents in total:number item Class Hours regimentationrequirement studentsper team1 Safety Practices in the Chemistry Laboratory2 demo compulsory 1 2 The Purification of RoughTable salt 3 verification compulsory 1 3 The Preparation of Mohr salt From Waster Iron Particles 5 integration compulsory 1 4 Preparation of Buffer Solutionand Its Properties 3 verification compulsory 2 5The Operation Exercise ofV olume Analysis3 verification compulsory 16 The Measurement ofConcentrations of Hcl(aq) andNaOH(aq) by Neutral Titration 3 verificationcompulsory 17 The Measurement of theConcentrations of the NaOHand Na2CO3 in the mixedalkaline liquid 3 verificationcompulsory 18 The preparation andstandardization of the standardsolution of EDTA 3 verificationcompulsory 19 The Measurement of theDegree of hardness of water 3 verificationcompulsory 110 The preparation andstandardization of the standardsolution of Na2S2O33 verificationcompulsory 111 The Measurement of theCopper concentration of CuSO43 verificationcompulsory 112 The Measurement of Iron inIron(Ⅱ) Phenanthroline ion bySpectrophotometric Method 5 verificationcompulsory 313 The preparation andstandardization of the standardsolution of Silver nitrate 3 verificationcompulsory 114 The preparation andComponent Analysis of[Co(NH3)6]Cl39 integrationcompulsory 24. Assessment:Assessments(70%): including preparation、practical and papers of experiments;Final test(30%).5. Essential Reading:Li,juqing、Yu,yuanzhi、zhang,liqing、zhang,peizhi. Experiment of Inorganic & Analytical Chemistry、zhejiang University Of Science and Technology Press,Jul.2003;6. References:1) Chen,huapu、Experiment of Inorganic & Analytical Chemistry、Chemistry Technology Press,1998;2) Ni,jing’an、Inorganic & Analytical Chemistry、Chemistry Technology Press,1999;3) Cui,xuegui、zhang,xiaoli. Experiments of Basic chemistry- Experiment of Inorganic & Analytical Chemistry、Chemistry Technology Press,Jul.2003;。

《无机及分析化学2》教学大纲课程编号:11202044 (原)英文名称:Inorganic and Analytical Chemistry 2学分:2.5学时:48 (其中理论32学时,实验16学时)课程类别:必修课授课对象:科学教育专业学生教学单位:化学化工学院无机材料学科修读学期:第2学期—、教学任务“无机与分析化学”是化学、化工、生物类专业的基础课程,是化学学科的重要分支。
元素化学主要掌握主族元素中典型的金属和非金属的单质及其重要的化合物的制备、性质和用途,以及第一过渡系的金属及其重要化合物的制备、性质和用途等丰富的化学知识。
“无机与分析化学2”主要为微观结构知识和元素化学的知识学习,了解元素的性质、化合物的结构和制备方法等等相关内容。
解释一些实验现象,从理论上阐明各种元素及其化合物性质的变化规律。
有了丰富的化学知识,才能深化对理论的认识,因此,在学习时,必须注意理论联系实际,理论在实际中的应用。
二、教学目标1.专业知识方面:微观结构、元素的性质、化合物的结构和制备方法等等2.专业能力方面:掌握元素的性质与原子结构、元素周期系的关系和内在的联系3.综合能力方面:理论与实验相结合,将实验现象用理论知识加以解释和阐述三、教学内容(%1)化学动力学基础1.教学内容(1)化学反应速率的定义及其表示方法(2)影响化学反应速率的因素浓度、温度和催化剂的影响;速率方程(3)反应历程基元反应、反应分子数等2.教学要求(1)了解反应速率的表示方法、相关的基本概念(2)重点:质量作用定律与应用、温度对反应速率的定量影响关系与应用;(%1)原了结构与元素周期系1.教学内容(1)道尔顿原子论*(2)相对原子质量(原子量)*:元素、原子序数和元素符号、核素、同位素和同位素丰度等(3)原子的起源和演化*(4)原子结构的波尔行星模型*:氢原子光谱、玻尔理论(5)氢原子结构(核外电子运动)的量子力学模型*微观粒子的波粒二象性、测不准原则、氢原子量子力学模型等(6)核外电子运动状态:波函数、电子云、四个量子数以及相互关系和应用(7)基态原了电了组态(电了排布)多电子能级、屏蔽效应、钻穿效应、核外电子排布原则、核外电子层结构与元素周期系(8)元素周期系:构造原理、基态原子电子组态(9)元素周期性:原子半径、电离能、电负性2.教学要求(1)了解原子半径等等概念(2)重点:四个量子数、核外电子排布与周期系的关系等,熟练掌握(3)难点:波函数与量子数和电子的排布等关系、电子在核外出现的概率和概率密度等概念(%1)化学键与分子结构1.教学内容(1)路易斯结构式*(2)共价键理论价键理论、共价键本质和特点、共价键的种类等、(3)杂化轨道理论杂化轨道理论要点及应用,主要介绍sp. sp\ sp3杂化(4)共价分子的性质共价半径、键能、键的极性与分子极性(5)分子间力三种分子间力及举例,氢键2.教学要求(1)了解化学键的生成与原子结构的关系(2)重点:共价键形成,分子间力(3)难点:杂化轨道的形成、杂化轨道理论解释化学键的形成等(%1)卤素1.教学内容(1)卤素的通性卤素的成键特性、卤素的元素电势图及应用(2)卤素在自然界中的分布和发现简介(3)卤素单质的物理化学性质及制备(4)卤素化合物(不含氧的化合物)卤化氢的性质和制备、卤化物和卤素互化物(5)卤素的氧化物卤素氧化物和含氧酸盐的性质:氧化还原性、稳定性、酸性以及影响因素2.教学要求(1)了解卤素单质的组成和性质(2)重点:卤素的性质变化规律、重要化合物的性质和应用(%1)氧族元素1.教学内容(1)氧族元素的通性通性、分布、氧族元素发现简介(2)氧及其化合物氧气单质、氧化物、臭氧、过氧化氢等(3)硫和它的化合物单质、硫形成化合物时的价键特征、硫的制备、性质和用途;硫化物、硫的氧化物、硫属的含氧酸;硫的其他化合物(4)硒和硫2.教学要求(1)了解氧和化合物的性质(2)重点在硫和化合物组成、性质、应用(%1)氮族元素1.教学内容(1)氮族元素的通性通性、分布、氮族元素发现简介(2)氮和它的化合物氮的成键特性和价键结构、氮的氢化物、含氧化合物、卤化物(3)磷和它的化合物磷的成键特性和价键结构、磷的氢化物、含氧化合物、卤化物、硫化物(4)碑、镣、锡单质和重要化合物化合物2.教学要求(1)了解该族元素的通行(2)重点是氮和磷的化合物性质和应用(%1)碳、硼族元素1.教学内容(1)碳族元素的通性通性、分布、碳族元素发现简介(2)碳单质、氧化物、氢化物、卤化物、硫化物;碳含氧酸及其盐(3)硅单质硅的性质、制备和用途,硅烷、硅的卤化物和氟硅酸盐、硅的含氧化合物(4)硼硼原子的成键特征、单质硼、硼的氢化物和硼氢配合物、硼的卤化物和含氧化物等(5)碳化物、硅化物和硼化物离了型化合物、共价性化合物、间隙型(金属型)化合物(6)铝、镣分族铝及其化合物、周期表中的对角线关系,铉分族(7)错分族错、锡、铅的存在和冶炼、信、锡、铅的单质和化合物2.教学要求(1)了解单质的性质,碳硅硼的缺电子性对形成物质的结构和性质上的影响(2)重点是铝和化合物的性质和应用(%1)非金属元素小结1.教学内容(1)非金属单质的结构和性质非金属单质的结构和物理性质、非金属单质的化学反应(2)分子型氢化物热稳定性、还原性、水溶液酸碱性和无氧酸的强弱(3)含氧酸最高氧化态氢氧化物的酸碱性、含氧酸及其酸根的结构、含氧酸的强度(4)非金属含氧酸盐的某些性质溶解性、水解性、热稳定性、含氧酸及其盐的氧化还原性(5)p区元素的次级周期性第二周期P区元素的特殊性、第四周期,区元素的不规则性2.教学要求(1)了解性质的变化与元素在周期表中的位置和结构的关系(2)掌握非金属单质和化合物的性质变化规律一酸碱性、氧化还原性、热稳定性等。

《无机及分析化学》教学大纲课程编号:学时:40 学分:2.5一、课程性质及任务本课程是生物和化学类很多专业的基础课,课程融合了无机化学及分析化学的基本理论知识,主要涵盖了无机及分析化学的基本理论、基本规律及物质分析的基本原理及分析方法,通过本课程学习,使学生逐步学会运用基本理论分析和掌握无机化合物和无机反应的一般规律,了解近代物质结构理论的基本知识,掌握无机化学中的一些基本原理和分析化学中的一些基本方法,初步培养学生运用化学知识分析生物专业实际问题,使学生分析问题和解决问题的能力得到一定的提高,为学习后续课程及从事专业实践打下必要的基础。
二、教学目的和要求。
1.理论教学(40学时)掌握稀溶液的4个依数性,溶液的性质和胶团结构,熟悉溶液各种浓度之间的换算, 3h掌握核外电子排布的3个规律,元素基本性质的周期性,离子键的性质,共价键的价键理论要点及共价键的特征和类型,能熟练书写核外电子排布式,了解波函数的意义,杂化轨道理论及分子间力和氢键的形成,了解3种晶体的物理特性。
8h掌握化学反应的质量作用定律,活化能和催化剂的概念,了解反应级数,温度对反应速率影响,反应速率理论和催化剂的特点。
4h掌握标准平衡常数的表示,熟悉有关化学平衡的计算以及浓度、压力、温度对化学平衡移动的影响,了解生物化学标准平衡常数。
6h 掌握定量分析的程序,定量分析中误差的产生及表示法,有效数字表示及计算规则,掌握标准溶液的配制及浓度标定,熟悉滴定分析中的有关计算,了解滴定分析的分类及滴定方式。
3h掌握酸碱质子理论的内容,稀释定律,同离子效应,缓冲溶液的选择与配制,能熟练计算溶液的pH值。
3h掌握酸碱滴定的基本原理,熟悉常用的酸碱指示剂的变色范围,了解酸碱滴定法的某些具体应用。
3h掌握溶度积的定义及溶度积规则,熟悉利用溶度积规则判断沉淀的生成和溶解,了解沉淀滴定法中莫尔法、佛尔哈得法的基本原理及滴定条件。
4h掌握氧化数、氧化和还原、标准电极电势的概念,原电池的原理,电极电势的应用,熟悉氧化还原反应方程式的配平,了解影响电极电势的因素,元素电势图及其应用。

《无机及分析化学》教学大纲开课单位(系、教研室、实验室):生物工程学院化学教研室学分:3学分总学时:48H (理论教学48学时)课程类别:必修考核方式:考试基本血向:化学工程与T艺专业、制药T程专业一、木课程的目的、性质和任务该课程综合了以往的无机化学、分析化学两门基础化学课程的内容,无机及分析化学是阐述化学变化和分析测试基木原理的基础学科。
木课稈是高分了材料科学与工稈专业木科生的必修基础课。
通过对木课稈的学习与实践,使学生掌握物质结构基础理论、化学反应基木原理、元素化学知识、分析测试的基木原理与方法,培养学生的科学态度和创新能力,为学生进一步学习后续课程打下基础。
二、木课程的基本要求1掌握溶液与胶体、化学热力学、化学平衡、化学动力学的基木理论,理解化学反应的基本原理。
2掌握原子结构、分子结构基本理论,理解物质结构与物质性质的关系。
3 了解s区元素、p区元素、d区元素、f区元素屮一些重要生命元素。
4掌握溶液屮的四大平衡规律,掌握以四大平衡为基础的化学分析的基木原理和方法。
5 了解配位化学、电化学、生命元素化学的基础知识。
6 了解木课稈内容在生物学、制药•和化工屮的应用,培养学生科学的思维方法。
三、木课稈与其它课程的关系木课稈是材料类各专业学习克它专业基础课和专业课的基础。
与木课稈平行开设的是《无机及分析化学实验》课稈。
四、木课程的教学内容绪论化学发展简介;化学的地位和作用;无机及分析化学的主要内容;化学的发展趋势和前沿领域;木课程的学习方法第1章溶液与胶体分散系;溶液的浓度;稀溶液的依数性。
第2章化学反应的能量和方向系统和环境;状态与状态函数;广度性质和强度性质;过稈与途径;热和功;热力学能;热力学第一定律;定容热效应;定压热效应;焙和焙变;热化学方稈式;Hess定律;白发过程;混乱度;爛及其统计意义;热力学第三定律;标准炳;H由能;热力学第二定律;标准生成自由能:Gibhs-Helmholtz方稈; 标准生成自由能。

《无机及分析化学》教学大纲篇一:《无机及分析化学》教学大纲《无机及分析化学》教学大纲课程名称:无机及分析化学课程编号:课程类别:专业基础课/必修课学时/学分:48/3开设学期:第一学期开设单位:化学与化工学院说明一、课程性质与说明1.课程性质专业基础课/必修课2.课程说明《无机及分析化学》是全国高等农业院校“十五”规划教材,也是农学、园艺、生物等专业的必修基础课,是上述专业学生学习的第一门基础化学课程。
本课程在元素周期律、原子和分子结构理论及四大平衡(酸碱平衡、沉淀平衡、氧化还原平衡和配位平衡)原理的基础上,讨论重要元素及其化合物的结构、组成、性质、变化规律及其含量测定的理论和方法。
上述内容与相关专业对化学基础的要求相结合,为学生学习后继课程、写作毕业论文及从事专业实践打下必要的基础。
二、教学目标1.理解分散系、物质结构、化学反应速率和化学平衡等无机化学的基本概念、基础理论。
2.理解酸碱滴定法、沉淀滴定法、配位滴定法、氧化还原滴定法和吸光光度法等分析化学的基本原理,初步掌握定量分析的常用测定方法。
3.掌握定量分析基本计算方法,能正确表示定量分析结果。
4.培养学生具有初步解决化学问题的能力并且养成严谨细致、实事求是的科学作风。
三、学时分配表章序章题讲授学时实验学时辅导学时自学学时小计1溶液和胶体42化学反应速率23化学热力学基础及化学平衡74物质结构基础55酸碱平衡与沉淀溶解平衡56配位化合物47氧化还原反应68重要的生命元素自学9分析化学概论610滴定分析法611重量分析法自学12吸光光度法413电势分析法自学合计48 四、教学教法建议本课程教学应在充分了解中学化学教学内容的基础上展开,既要注意与中学教学内容的衔接,又要注意避免不必要的重复。
对于已习惯中学教学的新生一时难以适应大学化学学习的情况,教师在本课程教学开始就应注意学习方法的指导和教学内容的精炼,以使学生尽快适应。
每章讲完之后应及时小结重点,以助学生理清思路,及时消化。
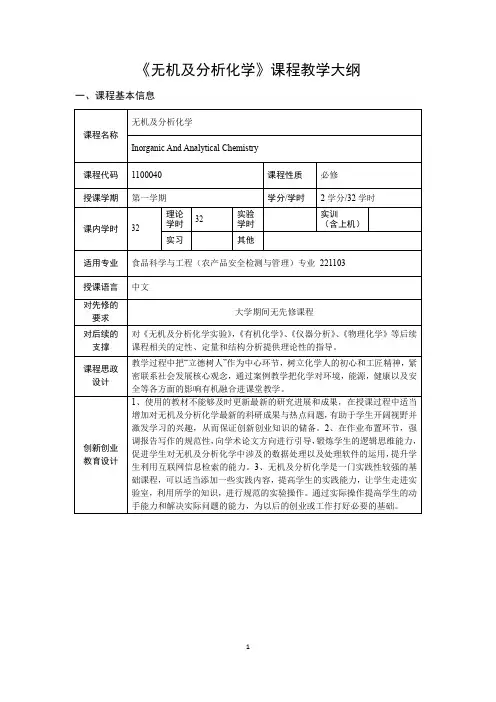
《无机及分析化学》课程教学大纲一、课程基本信息
二、课程目标及对毕业要求指标点的支撑
三、教学内容及进度安排
四、课程考核
注:各类考核评价的具体评分标准见《附录:各类考核评分标准表》
五、教材及参考资料
1.教材
《无机与分析化学》,商少明,化学工业出版社,2017第三版,978-7-122-29016-8。
2.主要参考书
1、《无机与分析化学》,陈若愚、朱建飞,大连:大连理工大学出版社,2007,第978-7-56-113764-2。
2、《无机与分析化学》,侯振雨、李英、郝海玲,北京:化学工业出版社,2016,第978-7-12-227545-5。
3、《无机与分析化学》,陈虹锦,北京科学出版社,2008,第二版,978-7-03-021961-9。
4、《分析化学》,武汉大学,北京:高等教育出版社,2006,第四版,978-7-04-007952-4。
5、《无机与分析化学学习指导》,谢少艾,陈虹锦,梁竹栖等,北京:科学出版社,2006, 第一版,7-03-017262-0。
6、《仪器分析原理及技术》,魏福祥,北京:中国石化出版社,2011,第一版,978-7-51-141066-5。
六、教学条件
多媒体教室。
附录:各类考核评分标准表
小测验评分标准
平时作业评分标准
课程考试评分标准。

矿产资源开发利用方案编写内容要求及审查大纲
矿产资源开发利用方案编写内容要求及《矿产资源开发利用方案》审查大纲一、概述
㈠矿区位置、隶属关系和企业性质。
如为改扩建矿山, 应说明矿山现状、
特点及存在的主要问题。
㈡编制依据
(1简述项目前期工作进展情况及与有关方面对项目的意向性协议情况。
(2 列出开发利用方案编制所依据的主要基础性资料的名称。
如经储量管理部门认定的矿区地质勘探报告、选矿试验报告、加工利用试验报告、工程地质初评资料、矿区水文资料和供水资料等。
对改、扩建矿山应有生产实际资料, 如矿山总平面现状图、矿床开拓系统图、采场现状图和主要采选设备清单等。
二、矿产品需求现状和预测
㈠该矿产在国内需求情况和市场供应情况
1、矿产品现状及加工利用趋向。
2、国内近、远期的需求量及主要销向预测。
㈡产品价格分析
1、国内矿产品价格现状。
2、矿产品价格稳定性及变化趋势。
三、矿产资源概况
㈠矿区总体概况
1、矿区总体规划情况。
2、矿区矿产资源概况。
3、该设计与矿区总体开发的关系。
㈡该设计项目的资源概况
1、矿床地质及构造特征。
2、矿床开采技术条件及水文地质条件。

实验教学大纲:无机及分析化学实验教学大纲大纲制定(修订)时间:2017年10月课程名称:无机及分析化学课程编码:050431001课程类别:专业基础课程课程性质:必修适用专业:无机非金属材料工程,粉体工程课程总学时:56实验(上机)计划学时:16开课单位:材料学院一、大纲编写依据1.无机非金属材料工程专业2017版教学计划;2.无机非金属材料工程专业《无机及分析化学》理论教学大纲对实验环节的要求。
二、实验课程地位及相关课程的联系1.《无机及分析化学》是无机非金属材料工程专业重要的专业基础课程;2.本实验项目是《无机及分析化学》课程相关知识的实践检验;3.本实验项目是对学生基本化学实验技能的培养;4.本实验为后续的《无机材料科学基础实验》、《粉体工程实验》和毕业设计等奠定了基础。
三、本课程实验目的和任务1.理解无机及分析化学的基本理论,训练化学实验的基本技能,掌握科学的实验方法;2.通过实验使学生能够具备基本化学实验的常识,并巩固所学的无机化学元素部分的知识;3.熟悉常规化学实验仪器的使用方法;4.通过设计性实验训练,增强学生对所学知识的运用能力;5.培养学生观察问题、分析问题和独立解决问题的能力;6.培养正确记录实验数据和现象,正确处理实验数据和分析实验结果的能力以及正确书写实验报告的能力。
四、实验基本要求1.实验项目的选定依据教学计划对学生实践能力培养的要求;2.巩固和加深学生对无机及分析化学基础知识的理解,提高学生综合运用所学知识的能力;3.实验项目要求学生综合掌握无机及分析化学的基本知识,并运用相关知识自行设计实验方案。
通过实验,要求学生做到:能够预习实验,自行设计实验方案并撰写实验报告;学会分析化学实验现象,能够独立分析实验结果;掌握基本的化学实验方法。
五、实验内容和学时分配备注:实验序号2和3选做1个六、教材(讲义、指导书):《无机及分析化学》实验讲义自编七、考核方法和评分标准:1.按照实验指导书的具体要求,根据每个学生实验前的预习准备,实验过程的考查,实验操作情况及实验报告的质量,综合给出实验成绩。

无机及分析化学第二版教学大纲一、课程简介无机及分析化学是化学类本科生的基础课程,其目的是使学生能够系统学习无机及分析化学基础知识和技能,为后续专业课程提供扎实的基础。
本课程分为两个部分:无机化学和分析化学。
无机化学部分主要介绍无机化合物的基本概念、性质、反应和应用;分析化学部分主要介绍分析化学基本理论和分析方法。
二、教学目标1.掌握无机化合物基本概念、性质和反应;2.掌握分析化学基本理论和分析方法;3.培养学生系统的分析和解决问题的能力;4.提高学生实验操作和数据分析的能力。
三、教学内容(一)无机化学1. 无机化学基础1.1 无机化学基本概念和分类;1.2 价电子理论及应用;1.3 金属元素的性质和应用;1.4 非金属元素的性质和应用。
2. 无机离子和离子反应2.1 无机离子的特性和描述;2.2 离子反应的基本原理;2.3 离子反应的定性和定量分析。
3. 无机化合物结构和性质3.1 无机化合物结构和性质的基本概念;3.2 金属-配合物的结构和性质;3.3 无机非金属化合物的结构和性质。
(二)分析化学1. 分析化学基础1.1 分析化学基本概念和分类;1.2 分析化学定量和定性分析的基本原理;1.3 分析化学中的误差和精度分析。
2. 量的表示和物质测定2.1 量的表示和测定单位;2.2 物质测定的一般原则和方法;2.3 标准溶液的制备和应用。
3. 分析方法及应用3.1 分光光度法分析;3.2 比色法分析;3.3 电化学分析;3.4 火焰原子吸收分析。
(三)实验教学1.无机化学实验操作;2.分析化学实验操作;3.数据分析和实验报告撰写。
四、教学方法本课程采用多种教学方法,包括:1.前期讲授理论知识,后期进行例题及应用实例的分析与讨论;2.课堂练习和作业辅导,梳理知识点和强化应用;3.实验教学,培养实际应用技能和实验操作能力;4.互动式教学,鼓励学生主动思考和提问,促进知识的自主学习和掌握。
五、教材及参考书目(一)教材《无机化学》(第二版)严立新编著,高等教育出版社;《分析化学》(第二版)韩东编著,高等教育出版社。
《无机及分析化学实验》教学大纲
【课程编号】
【学时学分】120 学时; 【开课模式】必修
【实验学时】36 学时 【上机学时】
【课程类型】 专业课 【考核方式】考试
【先修课程】 【开课单位】石油化工学院
【授课对象】石油化工生产技术、精细化学品生产技术、有机化学品分析、煤化
工
一、教学目的与任务
无机化学和分析化学是一门实验科学为主的基础课程。实验是无机化学不可
缺少的一个重要组成部分,是培养学生独立操作、观察记录、分析归纳、撰写报
告等多方面能力的重要环节。
学生通过无机及分析实验课的学习,不仅加深对分析化学基础理论的理解,
而且学习和掌握分析化学实验的基本知识、基本操作和基本技能,树立严格的
“量”的概念。培养学生实事求是的科学态度和严谨的科学作风、良好的实验室
工作习惯,使其初步具备作为高级工程技术应用型人才的要求。
掌握常量组分定量分析的基础知识和基本操作。
1、 掌握常用仪器分析的基本知识和基本操作技术。
2、 掌握实验数据的误差分析和统计处理方法。
实验是化学与材料科学学院各专业本科生的一门必修的、独立的基础实验
课。课程的安排服从 “一体化、渐定式、多层次、开放式”的教学体系和模式。
着力于培养学生具有宽广的基础知识和熟练的基本技能、能够适应未来社会发展
需要的专业人才。教学内容着眼于为学生今后的发展奠定基础。学生在学习无机
化学专业理论知识的同时,通过实验研究活动,学习和掌握无机化学专业的基本
实验技术,研究元素的单质及其化合物的重要性质,熟悉重要无机化合物的制备
方法;加深理解和掌握无机化学基本理论和基础知识;比较牢固地掌握化学实验
的基本知识和操作技能;培养学生严谨的科学态度;培养学生准确观察化学反应
现象,处理实验数据的能力,达到训练学生基本理论知识的综合应用能力。
课程的任务包括:
(一)实验室一般知识介绍
1.在全部教学过程中,应始终坚持对学生进行实验室安全和爱护公物的教
育。
2.简介有效数字和误差理论。
3.介绍正确书写实验记录和实验报告的方法。
(二)基本操作和仪器使用
1.初步训练的内容包括:掌握重结晶,离心分离,滴定操作和常用溶液的
配制方法;掌握半自动电光天平、pH计、电导仪、温度计、比重计、气压计、
干燥箱、直流电源和分光光度计的使用方法;掌握选择干燥剂和冷冻剂的原则。
2.掌握无机化学实验常用仪器的洗涤和干燥方法;掌握玻璃的切割和弯曲,
塞子打孔,仪器的安装和拆御方法;掌握固体和液体试剂的取用,直接加热和水
浴加热的技能;掌握气体发生器的组装,气体的净化、干燥和收集方法;掌握台
秤、洒精灯、洒精喷灯、量筒、容量瓶和移液管的使用方法。
(三)介绍实验基础知识和基本技能
使学生系统地掌握常用仪器的名称、规格和性能,化学试剂,温度的测量
和温度计的校准以及无机物分离和提纯的基础知识和基本技能。
(四)实验和专题讲授的内容
二 、 实验内容与时间安排表
(一)实验室基本安全知识及基本操作
1、熟知实验室的基本安全知识
2、掌握滴定分析仪器的基本使用及操作。
(二)分析天平的使用
实验目的
1、了解分析天平的构造及性能
2、掌握分析天平正确的使用方法。
主要仪器设备:TG-328G型半机械加码电光天平,台秤,称量瓶,锥形瓶
实验内容:NaCl的称量
(三)醋酸电离常数的测定
实验目的:
1、掌握用酸度计测定醋酸电离常数的原理和方法。
2、进一步练习移液管的使用。
3、练习并掌握酸度计的使用方法。
实验内容:
1、醋酸溶液浓度的测定。
2、配制不同浓度的醋酸溶液。
3、测定醋酸溶液的pH值,并计算醋酸的电离度和电离常数。
主要仪器设备:
pH计、碱式滴定管、吸管(10ml带刻度,25ml)、锥形瓶、烧杯(50ml)、
容量瓶(50ml)
(四)电导率法测定硫酸钡溶度积
实验目的:
1、掌握用电导率法测定硫酸钡溶度积常数的原理和方法。
2、进一步练习固液分离和洗涤沉淀的基本操作。
3、练习并掌握电导率仪的使用方法。
实验内容:
1、BaSO4饱和溶液的制备。
2、用电导率仪测定。
3、数据处理。
主要仪器设备:
电导率仪、烧杯
(五)氯化钠的提纯
实验目的:
1、掌握用化学方法提纯氯化钠得原理和方法。
2、初步学会无及制备得某些基本操作。
3、了解中间控制检验和氯化钠纯度检验的方法。
实验内容:
1、粗食盐得提纯。
2、产品纯度的检验。
3、铅得难溶盐。
主要仪器设备:
布氏漏斗、真空泵
(六)分析化学基本操作(3学时)
1、掌握滴定管、容量瓶、移液管的使用方法和滴定操作技术。
2、通过甲基橙和酚酞指示剂的使用,熟悉判断滴定终点的方法。
(七)混合碱中NaOH、Na2CO3含量的测定(3学时)
3、掌握酸式滴定管的准备和使用方法。
4、熟练分析天平、移液管的使用方法。
5、掌握HCL标准溶液的配制和标定方法。
6、掌握用双指示剂法测定混合碱的方法原理。
(八)工业用水总硬度的测定(3学时)
a) 掌握EDTA标准溶液的配制和标定方法。
b) 掌握配位滴定法测定水的硬度的方法原理。
c) 掌握铬黑T指示剂、钙指示剂的使用条件。
d) 了解水的硬度的表示方法。
e) 熟练滴定分析基本操作。
(九)过氧化氢含量的测定(3学时)
f) 掌握高锰酸钾溶液的配制、保存和标定方法。
g) 掌握自动催化反应、自身指示剂的作用原理。
h) 掌握高锰酸钾法测过氧化氢含量的方法原理。
i) 熟练滴定分析操作。
(十)碘量法测定铜合金中铜的含量(3学时)
j) 掌握Na2S2O3标准溶液的配制和标定方法。
k) 掌握K2Cr2O7的标准溶液的配制方法。
l) 学会酸分解铜合金试样的方法。
m) 掌握用间接碘量法测铜的方法原理。
n) 熟练滴定分析基本操作。
(十一)邻二氮菲分光光度法测定微量铁(3学时)
o) 掌握邻二氮菲分光光度法测定铁的方法原理。
p) 掌握721、722型分光光度计的构造和使用方法。
q) 学会绘制吸收曲线和工作曲线。
(十二)实验考试
四、实验学时安排
序 号 内 容 学 时 备 注
1 实验室基本安全知识及基本操作 3
2 分析天平的使用 3
3 醋酸电离常数的测定 3
4 电导率法测定硫酸钡溶度积 3
5 氯化钠的提纯 3
6 酸碱滴定基本练习 3
7 混合碱含量的测定 3
8 工业用水总硬度的测定 3
9 双氧水含量的测定 3
10 碘量法测铜合金中铜的含量 3
11 邻二氮菲分光光度法测定微量铁(或天然水中溶解氧的测定) 3
12 实验考试 3
合 计
36
五、教学参考书
主要参考书:分析化学实验(第三版) 武汉大学主编
高等教育出版社