物理化学第五章、第六章电化学习题
- 格式:doc
- 大小:93.00 KB
- 文档页数:4

《物理化学》期末复习第一章热力学第一定律及其应用第二章热力学第二定律第三章多组分系统热力学第四章相平衡第五章化学平衡第六章电化学第七章表面现象第八章胶体分散系统第一章热力学第一定律及其应用(一)有关状态函数的概念第一章中提到的状态函数有:第二章中提到的状态函数有:1、若物系为1 mol 的物质,则下列各组哪一组所包含的量皆属状态函数?()A、U、Q p、C p、CB、Q V、H、C V、SC、△U、△H、Q p、Q VD、U、H、C p、G2、若物系为1 mol 的物质,则下列各组哪一组所包含的量皆属状态函数?()A、U、Q p、C p、CB、Q V、H、C V、CC、U、H、C p、C VD、△U、△H、Q p、Q V3、下列各量中,()是为零。
A、Δf Hθm(C,金刚石,298.15K,pθ)B、Δf Hθm(H2O,l,298.15K,pθ)C、Δf Hθm(N2,g,298.15K,pθ)D、Δf Hθm(N2,g,350K,pθ)4、下列各量中,()是为零。
A、Δf Hθm(C,石墨,298.15K,pθ)B、Δf Hθm(H2O,l,298.15K,pθ)C、Δf Hθm(I2,g,298.15K,pθ)D、Δf Hθm(N2,g,273.15K,pθ)5、热力学第一定律△U=Q+W的形式表达式时,其条件是( )A.任意系统工程B.隔离系统C.封闭系统D.敞开系统6..下列反应中,反应的标准摩尔焓变等于生成物的标准摩尔生成焓的是()。
A、CO2(g) + CaO(s) → CaCO3 (s)B、21H2(g) + 21I2(g) → HI(g)C、H2(g) + Cl2(g) →2HCl(g)D、H2(g) + 21O2(g) →H2O(g)7.、下列反应中,反应的Δr Hθm等于生成物的Δf Hθm的是()。
A、N2(g) + 3H2(g) 2NH3(g)B、Ag(s) + 21Cl2 (g) AgCl(s)C、21H2(g) + 21Br2 (g) →HBr(g)D、NH3(g) + 21Cl2(g) →NH4Cl (s)8、对状态函数的描述,()是不确切的?A、它是状态的单值函数,状态一定它就是具有唯一确定的值。

浙江大学远程教育学院 《物理化学》课程作业(必做)姓名:学 号:年级:2014春药学学习中心:杭州学习中心—————————————————————————————第一章 热力学第一定律一、填空题1. △U=Q+W 适用于 宏观上静止且无外力场存在的封闭 系统。
2. △H=Q P 的适用条件是 封闭系统在非体积功为0且等压 。
3. 系统的性质分为广度性质和 强度性质 。
4. 水(101325Pa ,273.15K )在等温等压下凝结成冰(101325Pa ,273.15K )过程 的W 小于 零(填“小于”、“大于”或“等于” )。
二、简答题1. 什么是系统?什么是环境?答:将一部分物质从其他部分中划分出来,作为研究的对象,这一部分物质就称为系统; 系统之外与系统密切相关的部分称为环境。
2. 什么是热力学第一定律?答:将能量守恒与转化定律应用于宏观的热力学系统即为热力学第一定律。
三、计算题1. 1 mol 单原子理想气体在298K 时,分别按下列三种方式从15.00dm 3膨胀到40.00 dm 3: (1)自由膨胀; (2)等温可逆膨胀;(3)在恒定外压为终态压力下等温膨胀。
分别求上述三种过程的Q 、W 、ΔU 和ΔH 。
答:(1)自由膨胀;0)(0)(1212e ===V V V V p W -⨯--因为理想气体的热力学能和焓都只是温度的函数,而理想气体自由膨胀过程温度不变,所以:ΔU =ΔH =f (T )=0 (2)等温可逆膨胀;因为理想气体的热力学能和焓都只是温度的函数,所以等温过程ΔU=ΔH=0W=-nRTln(v2/v1)=-1x8.314x298ln(40/15)=-2430J Q=-w=2430J(3)在恒定外压为终态压力下等温膨胀。
ΔU=ΔH=0P=nRT/V=(1×8.314×298)/(40/1000)=61.94KPa W=-61.94 × (40-15) =-1548.5J Q=-w=1548.5J2. 已知298.2K 时,NaCl(s)、H 2SO 4(l)、Na 2SO 4 (s)和HCl(g)的标准摩尔生成焓分别为-411、-811.3、-1383和-92.3 kJ·mol -1,求下列反应2NaCl(s) + H 2SO 4(l) = Na 2SO 4(s) + 2HCl(g)在298.2K 时的△r H m ө。

电化学B一、选择题1. p∃和298 K下,把Pb和Cu(Ac)2溶液发生的反应安排为电池,当获得可逆电功为91.84 kJ时,电池同时吸热213.6 kJ,因此该过程有:()(A) ∆r U>0, ∆r S>0 (B) ∆r U<0, ∆r S>0(C) ∆r U>0, ∆r S<0 (D) ∆r U<0, ∆r S<02. 在应用电位计测定电动势的实验中,通常必须用到:()(A) 标准电池(B) 标准氢电极(C) 甘汞电极(D) 活度为1的电解质溶液3. 下列电池中液接电势不能被忽略的是:( )(A) Pt, H2(p1)│HCl(m1)│H2(p2), Pt(B) Pt, H2(p)│HCl(m1)‖HCl(m2)│H2(p), Pt(C) Pt, H2(p)│HCl(m1)┆HCl(m2)│H2(p), Pt(D) Pt, H2(p)│HCl(m1)│AgCl,Ag-Ag,AgCl│HCl(m1)│H2(p), Pt4. 某电池反应为:Hg2Cl2(s)+H2(p∃)─→2 Hg(l)+2 H+(a=1)+2 Cl-(a=1)已知:E∃=0.268 V, (∂E/∂T)p=-3.2×10-4 V·K-1, 则∆r S m为:( )(A) -61.76 J·K-1·mol-1(B) -30.88 J·K-1·mol-1(C) 62.028 J·K-1·mol-1(D) -0.268 J·K-1·mol-15. 电池中使用盐桥的作用是:()(A) 使电池变成无液体接界的可逆电池(B) 基本消除电池中的液体接界电势(C) 消除电池中存在的扩散现象(D) 使液体接界电势为零6. 用对消法测定电池电动势,若实验中发现检流计始终偏向一边,则可能原因是:()(A) 被测定电池温度不均匀(B) 被测定电池的两极接反了(C) 搅拌不充分使浓度不均匀(D) 检流计灵敏度差7. 将一铂丝两端分别浸入含0.1 mol·dm-3 Sn2+和0.01 mol·dm-3 Sn4+的溶液中,这时的电位差为:()(A) E(Sn4+|Sn2+)+0.059/2 (B) E(Sn4+|Sn2+)+0.059(C) E(Sn4+|Sn2+) - 0.059 (D) E(Sn4+|Sn2+) - 0.059/28. 测定电池电动势时,标准电池的作用是:()(A) 提供标准电极电势(B) 提供标准电流(C) 提供标准电位差(D) 提供稳定的电压9. 当电池的电动势E=0时,表示:()(A) 电池反应中,反应物的活度与产物活度相等(B) 电池中各物质都处于标准态(C) 正极与负极的电极电势相等(D) 电池反应的平衡常数K a=110. 下列电池中,电动势与氯离子活度无关的电池是:(A) Zn│ZnCl2(aq)‖KCl(aq)│AgCl│Ag(B) Pt│H2│HCl(aq)│Cl2│Pt(C) Ag│AgCl(s)│KCl(aq)│Cl2│Pt(D) Hg│Hg2Cl2(s)│KCl(aq)‖AgNO3(aq)│Ag二、填空题11. 电池Hg│Hg2Cl2│HCl(a)│Cl2(p∃)│(Pt)在25℃, a = 0.1 时, E = 1.135 Va = 0.01 时, E = ______12. 将反应H2(g) + PbSO4(s) → Pb(s) + H2SO4(aq)设计成电池的表示式为:_______________________________________________________。

物理化学肖衍繁答案【篇一:物理化学复习题】程名称:物理化学教材:《物理化学》,肖衍繁李文斌主编,天津大学出版社辅导教师:史春辉联系电话:4153173第一章气体一、填空题1、物质的量为5mol的理想气体混合物,其中组分b的物质的量为2mol,已知在30℃下该混合气体的体积为10dm3,则组分b的分压力pb=_________kpa,分体积vb=________dm3。
(填入具体数值) 3、在任何温度、压力条件下,压缩因子恒为1的气体为________________。
若某条件下的真实气体的z1,则说明该气体的vm___________同样条件下的理想气体的vm,也就是该真实气体比同条件下的理想气体___________压缩。
4、一物质处在临界状态时,其表现为____________________________。
5、已知a、b两种气体临界温度关系为tc(a)tc(b),则两种气体相对易液化的气体为_________。
6、已知耐压容器中某物质的温度为30℃,而且它的对比温度tr=9.12,则该容器中的物质为_________体,而该物质的临界温度tc=__________k。
二、选择题1、如左图所示,被隔板分隔成体积相等的两容器中,在温度t下,分别放有物质的量各为1mol的理想气体a和b,它们的压力皆为p。
若将隔板抽掉后,两气体则进行混合,平衡后气体b的分压力pb=_________。
a、2pb、4pc、p/2d、p2、在温度为t、体积恒定为v的容器中,内含a、b两组分的理想气体混合物,它们的分压力与分体积分别为pa、pb、va、vb。
若又往容器中再加入物质的量为nc的理想气体c,则组分a的分压力pa___________,组分b的分体积vb____________。
a、变大b、变小c、不变d、无法判断3、已知co2的临界参数tc=30.98℃,pc=7.375mpa。
有一钢瓶中贮存着29℃的co2,则该co2_________状态。


《物理化学》部分章节补充习题——选择题及参考答案第一章热力学第一定律1.对于任何循环过程,系统经历了i步变化,则据热力学第一定律应该是:(A)∑Q i=0, (B)∑W i=0, (C)(∑Q i-∑W i)>0, (D) (∑Q i+∑W i)=02.1mol373K、pφ下的水经下列两个不同过程到373K、pφ的水汽: (1)等温可逆蒸发,(2)真空蒸发.这两个过程中功的关系为:(A)W1>W2, (B) W1<W2(C)W1=W2(D) W1=W2=03.下列宏观过程(1)101.325kPa、273K下冰融化为水;(2)气缸中活塞往复运动;(3)NaCl溶解在水中;(4)水在101.325kPa、373K下蒸发.可看作可逆过程的是:(A)(1)和(4) (B) (2)和(3)(C) (1)和(3) (D) (2)和(4)4.1mol水银蒸气在正常沸点630K时压缩成液体,已知其蒸发热为54566J·mol-1,设水银蒸气为理想气体,则此过程的∆U和∆H为(A) ∆U=∆H=54566J (B) ∆U=-49328J,∆H=-54566J(C)由于定温,故∆U=0,∆H=0 (D) ∆U=-59804J,∆H=-54566J5.已知250C时H2O(g)的标准摩尔生成热∆f H mφ(H2O,g)=-241.82kJ·mol-1, H2(g)的标准摩尔燃烧热∆c H mφ(H2,g)=-285.83kJ·mol-1,在同温度下H2O(l)→H2O(g)的标准摩尔相变热为(单位为kJ·mol-1): (A)-44.01 (B)44.01(C)241.82 (D)285.83第二章热力学第二定律1.理想气体与温度为T 的大热源接触作定温膨胀吸热Q ,所作的功是变到相同终态的最大功的20%,则系统的熵变为:(A)Q/T (B)0 (C)5Q/T (D)-Q/T 2.系统经历一个不可逆循环后(A)系统的熵增加 (B)系统吸热大于对外作功 (C)环境的熵一定增加 (D)环境内能减少3.理想气体从状态I 经自由膨胀到达状态II ,可用哪个热力学判据来判断该过程的自发性: (A)∆A (B) ∆G (C) ∆S (D) ∆U4.可逆热机的效率最高,在其它条件相同的情况下,假设由可逆热机牵引火车,其速度将 (A)最快 (B)最慢 (C)中等 (D)不能确定5.液态水在373K 及101325Pa 下汽化为水蒸汽,则该过程的 (A)∆H =0 (B) ∆S =0 (C)∆A =0 (D) ∆G=06. 在298K 和p φ下,KNO 3溶解在水中将吸收热量,此时系统的熵变为: (A)∆S<0 (B) ∆S>0 (C) ∆S=0 (D) ∆S=∆H/2987.在298K 时已知气相反应2CO 2=2CO+O 2的∆G φ为514.2kJ·mol -1,则此反应的∆A φ( kJ·mol -1)为: (A) ∆A φ=514.2 (B) ∆A φ=0 (C) ∆A φ>514.2 (D) ∆A φ<514.28.当100J 的热量从300K 的大热源传向290K 的另一大热源时,整个过程所引起的熵变是: (A)(290100300100+ )J·K -1 (B) (290100300100-)J·K -1 (C) (290100300100+-)J·K -1 (D) (290100300100-- )J·K -1第三章多组分系统的热力学1.理想溶液的通性是:(A)∆V mix=0, ∆H mix=0,∆S mix>0,∆G mix<0(B)∆V mix=0, ∆H mix=0,∆S mix>0,∆G mix=0(C)∆V mix=0, ∆H mix>0,∆S mix>0,∆G mix<0(D)∆V mix=0, ∆H mix=0,∆S mix=0,∆G mix=02.298K时A和B两种气体在某一溶剂中溶解的享利常数分别为k A和k B,且k A>k B,则当A和B压力相同时,在该溶剂中溶解的量是:(A)A的量大于B的量(B) A的量小于B的量(C) A的量等于B的量(D)A的量和B的量无法比较3.苯和甲苯能形成理想溶液,在293K时当1mol苯和1mol甲苯混合时,这过程所对应的∆G(J)是(A)-3377 (B)3377 (C)0 (D)-34344.A和B能形成理想溶液,已知在373K时纯液体A的蒸汽压力为133.32kPa,纯液体B的蒸汽压为66.66kPa,当A和B的二元溶液中A的摩尔分数为0.5时,与溶液平衡的蒸汽中A的摩尔分数是:(A)1 (B)3/4 (C)2/3 (D)1/25.313K时纯液体A的饱和蒸汽压是纯液体B的21倍,A和B能形成理想溶液,若气相中A和B的摩尔分数相等,则液相中A和B的摩尔分数之比X A:X B应为:(A)1:21 (B)21:1 (C)22:21 (D)1:226.在一完全密闭的透明壁的恒温箱中,置有两杯液体,A杯为纯水,B杯为蔗糖水溶液。


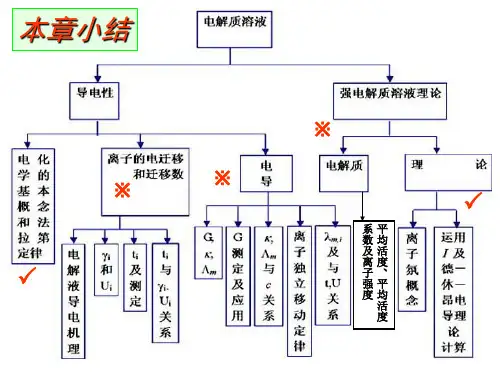
<<物理化学>>第六章 电化学单元测试练习题(6A 卷)一、判断题(说法正确否):(本题11分, 每小题1分)1.电解质溶液中各离子的迁移数之和为1。
2.电解池通过1F 电量时,可以使1mol 物质电解。
3.无限稀的电解质溶液的摩尔电导率可以看成是正负离子无限稀摩尔电导率之和,这一规律只适用于强电解质。
4.对于氯化钡溶液,以下等式成立:)))a a b b a a a c g g g g +-?-== = 323)))4d b b b e b b f b b ?-+-北= = =5.将锌和铜插入硫酸溶液中构成的电池是可逆电池。
6.恒温恒压下△G >0的反应不能自发进行。
7.21(1)2,n n r m z e z E G q q++瓺,22(2)11,,22nn rm z e z E G q q ++瓺12(1)(2)r m r m E E G G q q q q =\D =D Q8.2122,,H e H E q ++ 222222,,H O e H OH E q -+?因为它们都是氢电极,故12E E q q =。
9.对于电极Pt ∣2()Cl p ∣Cl -其还原电极电势为2222/(/)(/)ln 2Cl Cl p p R TE Cl Cl E Cl ClF a q q---=-。
10.对于电池Zn ︱ZnSO 4(aq)‖AgNO 3(aq)︱Ag,其中的盐桥可用饱和氯化钾溶液。
11.实际电解时,在阴极上首先发生还原作用的是按能斯特方程计算的还原电势最大者。
二、单选题:(本题30分,每小题2分)1.在298.2K 的无限稀释水溶液中,下列离子中离子迁率最大的是:A.Be 2+B. Mg 2+C. Na +D.H +2.根据Debye-Huckel 极限公式,比较298.2 k 时0.0011mol kg - 的32()Cu NO 水溶液的1()γ±与0.0011mol kg -的4ZnSO 水溶液的2()γ±,其关系为: A. 12()()γγ±±> B. 12()()γγ±±< C. 12()()γγ±±= D. 12()2()γγ±±= 3.将难溶盐AgCl 溶于下面电解质溶液中,在电解质溶液中溶解度最大的是:A. 330.1mol dm NaNO -B. 30.1mol dm NaCl -C. 3240.1mol dm K SO -D. 3320.1()mol dm Ca NO -4.反应221()()()()2Na s H O l NaOH aq H g +=+可设计成如下电池: A. 2()|()|()|()Na s NaOH aq H p Pt s θB. 22()|()|()|()|()|()t Na s NaI EtNH Na Hg NaOH aq H p p s θC. 2()|()|()|()t Na Hg NaOH aq H p p s θD. 以上都不对5.反应2222()2()24Hg l O H O l Hg OH +-++=+设计成电池,电池反应达平衡时, 电池电动势为:A. E E θ=B.E=0C.E<0D.E>06. 电池3322()|(0.01||(0.01|()H p HI mol dm Ag AgI Ag HI mol dm H p θθ--++,其电池电动势约为:A.0.1184VB.-0.0592VC.0.0592VD.0.0296V 7.已知2/ 1.360Cl ClEV θ-=, 2/ 1.065Br Br E V θ-=, 298.2K 时将反应22()22()Cl g Br Cl Br l --+=+设计成电池,其反应的平衡常数是:A.6 8210⨯ B. 4410⨯ C. 41210⨯ D. 99.5510⨯ 8. 298.2K 时,某电池电动势E=1.000V , 4() 4.0010/,P EV k T-∂=⨯∂此电池可逆地提供1F 电量的热效应为:A.-96500JB.96500JC.-84977JD.11503J9.室温下,用铂作电极,电解31mol dm NaOH - 溶液,阴极上发生的电极反应为:A. Na e Na +-+→ B. 2222H O O e OH --++→C. 222H e H +-+→D. 2221/22H O H O e +-→++ 10.通电于含有2222,,,Fe Ca Zn Cu++++电解质溶液中,已知22(/)0.44,(/) 2.76,E Fe Fe V E Ca Ca V θθ++=-=-22(/)0.763,(/)0.337,E Zn Zn V E Cu Cu V θθ++=-=若不考虑超电势,在惰性电极上金属析出的次序为:A. Cu Fe Zn Ca →→→B. Cu Zn Fe Ca →→→C. Ca Fe Zn Cu →→→D. Ca Zn Fe Cu →→→11. 298 K 、0.1 mol ·dm -3的 HCl 溶液中,氢电极的热力学电势为 -0.06 V ,电解此溶液 时,氢在铜电极上的析出电势 E 为: ( )A.大于-0.06 VB. 等于 -0.06 VC 小于 -0.06 V D. 不能判定12.25℃时, H 2在锌上的超电势为 0.7 V ,E θ (Zn 2+/Zn) = -0.763 V ,电解一含有Zn 2+(a=0.01) 的溶液,为了不使 H 2析出,溶液的 pH 值至少应控制在 ( )A. pH > 2.06B. pH > 2.72C. pH > 7.10D. pH > 8.02 13.常用的甘汞电极的电极反应 Hg 2Cl 2(s) + 2e -2Hg(l) + 2Cl -(aq)设饱和甘汞电极、摩尔甘汞电极和 0.1 mol ·dm -3甘汞电极的电极电势相应地为 E 1、E 2、E 3,则 298 K 时,三者之相对大小是: ( )A. E 1> E 2> E 3B.E 1< E 2< E 3C. E 2> E 1> E 3D. E 3> E 1=E 2 14. 有下列两个浓差电池 (a 1<a 2):(1) Cu(s)│Cu 2+(a 1)‖Cu 2+(a 2)│Cu(s) (2) Pt │Cu 2+(a 1),Cu +(a ')‖Cu 2+(a 2),Cu +(a ')│Pt 它们的电池反应与电动势 E 1和E 2之间的关系为 : ( )A. 电池反应相同, E 1= E 2B. 电池反应不同, E 1= E 2C. 电池反应相同, E 1= 2E 2D.电池反应相同, E 2= 2E 1 15. 1-1型电解质溶液的摩尔电导率可以看作是正负离子的摩尔电导率之和,这一规律只适用于:( )A. 强电解质B. 弱电解质C. 无限稀释电解质溶液D. 摩尔浓度为1的溶液 三、填空(本题14分, 每空2分)1.CaCl 2摩尔电导率与其离子的摩尔电导率的关系是:_____________________________。


第六章可逆电池电动势6.1 本章学习要求1.掌握可逆电池、可逆电极的类型、电极电势标准态、电动势、Nernst公式及其应用;2.掌握可逆电池热力学,可逆电池电动势的测定方法及其在化学、生命体系及土壤体系等领域中的应用;3.了解pe、pH−电势图和生化标准电极电势。
6.2 内容概要6.2.1 可逆电池1.可逆电池(reversible cell)的条件:电池在充、放电时发生的反应必须为可逆反应;电池充、放电时的能量转换必须可逆,即通过电池的电流无限小,无热功转化。
2.可逆电极的类型(1)金属电极由金属浸在含有该金属离子的溶液中构成,包括汞齐电极。
如Zn电极Zn (s)│ZnSO4(aq) 电极电势(electrode potential )φZn/ Zn = φ−ln(2)气体电极由惰性金属(通常用Pt或Au为导电体)插入某气体及其离子溶液中构成的电极,如氢电极,Pt,H2 ( p)│H(a H) 电极电势φ= φ− ln(3)金属难溶盐电极将金属表面覆盖一薄层该金属的难溶盐,浸入含有该难溶盐的负离子的溶液中构成。
如银−氯化银电极,Ag (s),AgCl (s)│Cl(a Cl) 电极电势φAgCl,Ag,Cl = φ− ln a Cl(4)氧化还原电极由惰性金属(如Pt片)插入某种元素两种不同氧化态的离子溶液中构成电极,如Sn、Sn电极,Pt (s)│Sn(a),Sn(a) 电极电势φ= φ− ln3.电池表示法电池的书面表示所采用的规则:负极写在左方,进行氧化反应(是阳极),正极写在右方,进行还原反应(是阴极);组成电池的物质用化学式表示,并注明电极的状态;气体要注明分压和依附的不活泼金属,温度,所用的电解质溶液的活度等,如不写明,则指298K,p,a=1;用单垂线“│”表示接触界面,用双垂线“║”表示盐桥(salt bridge);在书写电极和电池反应时必须遵守物料平衡和电荷平衡。
6.2.2 电极电势1.标准氢电极(standard hydrogen electrode)用镀铂黑的铂片插入氢离子活度为1的溶液中,用标准压力的干燥氢气不断冲击到铂电极上所构成的电极,规定其电极电势为零。
物理化学电化学练习题及答案一、选择题1. 以下哪一项不是电化学电池的基本组成部分?A. 电极B. 电解质C. 外电路D. 磁场答案:D2. 在电化学电池中,电子从哪个电极流向另一个电极?A. 阳极到阴极B. 阴极到阳极C. 阳极到阳极D. 阴极到阴极答案:A3. 以下哪种电池属于原电池?A. 铅酸电池B. 锂离子电池C. 燃料电池D. 镍氢电池答案:A4. 在电解过程中,电解质溶液中的离子是如何移动的?A. 阳离子向阴极移动B. 阴离子向阳极移动C. 阳离子向阳极移动D. 阴离子向阴极移动答案:A、B二、填空题1. 电化学电池的电动势(EMF)等于正极电极电势与负极电极电势的差值,即EMF = ___________。
答案:E+ - E-2. 在标准状态下,1摩尔电子通过外电路所做的功称为法拉第常数,其值为_________。
答案:96500 C/mol3. 电解质溶液中的离子在电场作用下发生迁移,这种现象称为_________。
答案:电解4. 在电化学反应中,氧化反应发生在_________,还原反应发生在_________。
答案:阳极;阴极三、判断题1. 电化学电池中的电极反应分为氧化反应和还原反应。
()答案:√2. 在电化学电池中,电子从负极流向正极。
()答案:×(应为从阳极流向阴极)3. 电解质溶液中的离子在电场作用下发生迁移,产生电流。
()答案:√4. 在原电池中,正极发生氧化反应,负极发生还原反应。
()答案:×(应为正极发生还原反应,负极发生氧化反应)四、计算题1. 已知某电化学电池的电动势为1.5V,电池中通过的电流为2A,求电池在1小时内所做的功。
答案:W = E × I × t = 1.5V × 2A × 3600s= 10800J2. 计算下列电化学反应的平衡常数K:Fe3+ + e- → Fe2+ (E° = 0.77V)Cu2+ + 2e- → Cu (E° = 0.34V)答案:K = exp[(nFE°)/RT] = exp[(2 ×96500C/mol × 0.43V)/(8.31J/(mol·K) × 298K)]≈ 1.3 × 10^353. 在某电解池中,电解质溶液的浓度为0.1mol/L,电解过程中,电流为5A,电解时间为30分钟,求电解过程中消耗的电量。
物理化学测验题(五)一、选择题。
在题后括号内,填上正确答案代号。
1、 无限稀释的KCl 溶液中,Cl -离子的迁移数为0.505,该溶液中K +离子的迁移数为:( )。
(1) 0.505 ; (2) 0.495; (3) 67.5; (4) 64.3 。
2、 电解质分为强电解质和弱电解质,在于:( )。
(1) 电解质为离子晶体和非离子晶体; (2) 全解离和非全解离; (3) 溶剂为水和非水; (4) 离子间作用强和弱。
3、质量摩尔浓度为b 的H 3PO 4溶液,离子平均活度因子(系数)为,则电解质的活度是a B :( )。
(1)a B =4( b / b )44 ; (2)a B =4( b / b )4 ;(3)a B =27( b / b )4 ; (4)a B =27( b / b )44 。
4、 实验室里为测定由电极Ag | AgNO 3(aq)及Ag | AgCl(s) | KCl(aq) 组成的电池的电动势,下列哪一项是不能采用的?( )(1)电位差计; (2)标准电池;(3)直流检流计; (4)饱和的KCl 盐桥。
5、原电池在等温等压可逆的条件下放电时,其在过程中与环境交换的热量为:( )。
(1)∆H ; (2)零; (3)T ∆S ; (4)∆G 。
6、在等温等压的电池反应中,当反应达到平衡时,电池的电动势等于:( )。
(1)零; (2)E ;(3)不一定; (4)随温度、压力的数值而变。
7、25℃时,电池Pt|H 2(10 kPa)|HCl(b )| H 2(100 kPa)|Pt 的电动势E 为:( )。
(1)2×0.059 V ; (2)-0.059 V ; (3)0.0295 V ; (4)-0.0295。
8、正离子的迁移数与负离子的迁移数之和是:( )。
(1) 大于1; (2) 等于1; (3) 小于1 。
9、 浓度为b 的Al 2(SO 4)3溶液中,正、负离子的活度因子(系数)分别为和,则离子的平均活度系数等于:( )。
第六章电化学原理及其应用一、选择题1.下列电极反应中,溶液中的pH值升高,其氧化态的氧化性减小的是(C)A. Br2+2e = 2Br-B. Cl2+2e=2Cl—C. MnO4—+5e+8H+=2Mn2++4H2OD. Zn2++2e=Zn2.已知H2O2在酸性介质中的电势图为O2 0.67V H2O2 1.77V H2O,在碱性介质中的电势图为O2-0.08V H2O2 0.87V H2O,说明H2O2的歧化反应(C)A.只在酸性介质中发生B.只在碱性介质中发生C.无论在酸、碱性介质中都发生D.与反应方程式的书写有关3.与下列原电池电动势无关的因素是Zn |Zn2+‖H+,H2 | Pt (B)A. Zn2+的浓度B. Zn电极板的面积C.H+的浓度D.温度4.298K时,已知Eθ(Fe3+/Fe)=0.771V,Eθ(Sn4+/Sn2+)=0.150V,则反应2Fe2++Sn4+=2Fe3++Sn2+的△r G mθ为(D)kJ/mol。
A. -268.7B. -177.8C. -119.9D. 119.95.判断在酸性溶液中下列等浓度的离子哪些能共存(D)A Sn2+和Hg2+ B. SO32—和MnO4—C. Sn4+和FeD. Fe2+和Sn4+已知Eθ(Hg2+/Hg)=0.851V,Eθ(Sn4+/Sn2+)=0.15V ,Eθ(MnO4—/Mn2+)=1.49VEθ(SO42—/H2SO3)=1.29V ,Eθ(Fe2+/Fe)= —0.44V6.已知下列反应在标准状态下逆向自发进行Sn4++Cu = Sn2++Cu2+Eθ(Cu2+/Cu)=(1) , Eθ(Sn4+/Sn2+)=(2) 则有(C)A. (1) = (2)B. (1)<(2)C. (1)>(2)D. 都不对二、填空题1.将下列方程式配平3PbO2 + 2 Cr3+ + ____H2O___ =1Cr2O72—+ 3Pb2+ + __2H+___ (酸性介质)2MnO2 + 3 H2O2 +__2OH-___ =2MnO4—+ ___4H2O______ (碱性介质)2.现有三种氧化剂Cr2O72—,H2O2,Fe3+,若要使Cl—、Br—、I—混合溶液中的I—氧化为I2,而Br-和Cl-都不发生变化,选用Fe3+最合适。
一.填空题
1. 0.1mol·kg -1的MgCl 2溶液的γ±=0.70,则其平均摩尔浓度b ±= ;平均活度a ±= 。
2. 氢氧电池的电池反应可写成以下两种形式:
1)O(l)2H (g)O (g)2H 222→+;2)O(l)H (g)O 2/1(g)H 222→+, 则E 1 E 2,1G ∆ 2G ∆。
3.反应)HCl(Ag(s)AgCl(s))(H 2H 2a p +=+可设计成电池:
________________ 。
4.在双液电池中不同电解质溶液间或不同浓度的同种电解质溶液的接界处存在 电势,通
常采用加 的方法来减少或消除。
5. 当有电流通过电极时,阳极的电极电势比可逆时增
大,阴极电极电势比可逆时 ,原电池的电动势比可逆时 。
二.选择题
1.某电池电动势E 与温度T (K)的关系为)298(1049174.15-⨯+=-T E (伏),在298K 工作时,则( )
(A) 0=∆S (B) 0<∆S (C) 0>∆S (D) 不能确定
2.电解质溶液的摩尔电导率随溶液浓度的增大而()
(A)减小(B)增大
(C)先减小后增大(D)先增大后减小
3. 甘汞电极属于()
(A)第一类电极;(B)第二类电极;(C)氧化还原电极;
4.电池
1)Cu (s)│Cu (a Cu+)║Cu (a Cu+),Cu (a Cu2+)│Pt (s) ;2)Cu (s)│Cu (a Cu2+)║Cu (a Cu+),Cu (a Cu2+)│Pt (s)
的反应均可写成Cu (s) + Cu (a Cu2+) → 2Cu (a Cu+),此两电池标准电池电动势E 及电池反应的标准Gibbs
自由能变化ΔrG 的关系为()。
(A)ΔrG ,E 均相同 (B)ΔrG 相同,E 不同(C) ΔrG 不同,E 相同 ( D) ΔrG , E 均不同5.原电池在定温、定压可逆的条件下放电时,其在过程中与环境交换的热量为()
(A)ΔrHm (B)零(C)TΔrSm (D)ΔrGm 6.在下列电池中液接电势不能被忽略的是()。
(A)Pt,H2 ( p )│HCl (a)│H2 ( p ),Pt
(B)Pt,H2 ( p )│HCl (a )‖HCl (a )│H2 ( p ),Pt
(C )Pt ,H 2 ( p )│HCl (a )┆HCl (a )│H 2 ( p ),Pt
7.已知298K 时,
Hg 2Cl 2 (s) +2e → 2Hg (l) +2 Cl - (a Cl -
) φ = 0.27 V , AgCl (s) + e → Ag (s) + Cl - (a Cl - ) φ = 0.22 V , 当电池反应为Hg 2Cl 2 (s) +2Ag (s) →2AgCl (s) +2Hg (l)时,其标准电池电动势为( )
(A )0.050V (B )-0.170V
(C )−0.085V (D )0.025V
三.计算题:
写出下列电池的电极反应、电池反应。
t a Cl Cd P Kp g Cl a Cl a Cd s Cd ),325.101,(|)5.0(||)01.0(|)(222==-+-+计算25℃,101.325Kp a 时此电池的标准电动势θE ,电动势E ,电池反应的标准平衡常数θK 及Δr G m ,已知=-θϕCl Cl /2 1.3580V ,=+θϕCd
Cd /2-0.4028V 。
解:
负极反应:Cd(s) - 2e - ∙ Cd 2+()01.02=+C d a
正极反应:Cl 2(p=100Kp a )+ 2e - ∙ 2Cl -(5.0=-
Cl a ) 电池反应:Cd(s)+Cl 2(p=100Kp a ∙Cd 2+()01.02=+
Cd a +2Cl -5.0=-Cl a ) 25℃, V E 7608.1)4028
.0(3580.1=--=-=-+θθθϕϕ
V a a F RT E E Cl Cd 8378.1)5.001.0ln(96485
215.298314.87608.1)ln(2222=⨯⨯⨯-=⋅-=-+θ
59
10392.3)298
314.87608.1964852exp()exp()exp(⨯=⨯⨯⨯==∆-=RT ZFE RT G K m r θθθ
1
64.3548378.1964852-⋅-=⨯⨯-=-=∆mol KJ ZFE G m r。