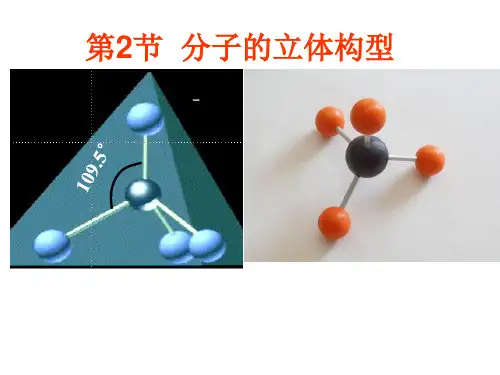
用杂化轨道理论解释甲烷分子的形成
CH4分子(sp3杂化)
2s
2 p 激发 2s 2 p
sp 3杂化
sp3
三、杂化轨道理论简介
1、sp3杂化 由1个S轨道和3个P轨道组合而成, 杂化轨道间的夹角为109°28′,呈 四面体形。如CH4。
要点:
基态 原子
激发态 原子
1个S轨 道和3个 P轨道
混杂
4个相同的 SP3杂化轨道
7 、自卑的人,总是在自卑里埋没的自己,记住,你是这个世界上唯一的。 3 、相信就是强大,怀疑只会抑制能力,而信仰就是力量。那些尝试去做某事却失败的人,比那些什么也不尝试做却成功的人不知要好上多少 。
5 、生命的路上,耐心使你获得力量,耐心使你认清方向;耐心使你坦途疾进,耐心使你少遭波浪。寻着古往今来的路,在耐心的帮助下看生 活。
杂化轨道间 夹角
VSEPR模 型名称
180°
直线形
实 例 BeCl2 , C2H2
sp2
sp3
1个s + 2个p 1个s + 3个p
3个sp2杂化轨 4个sp3杂化轨
道
道
120° 109°28′
平面三角形 四面体形
BF3 , C2H4 CH4 , CCl4
杂化轨道理论解释微粒的立体构型 杂化轨道数= 中心原子孤对电子对数+中心原子结合的原子数
课堂练习
例1:下列分子中的中心原子杂化轨道的类
型相同的是 ( B )
A.CO2与SO2 B.CH4与NH3 C.BeCl2与BF3 D.C2H2与C2H4
例2:对SO2与CO2说法正确的是( D )
A.都是直线形结构 B.中心原子都采取sp杂化轨道 C. S原子和C原子上都没有孤对电子 D. SO2为V形结构, CO2为直线形结确定杂化轨道类型的方法