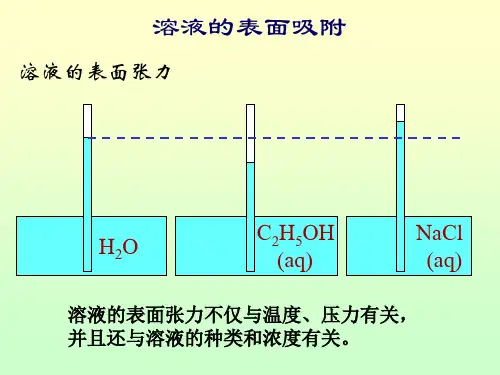
溶液表面吸附
- 格式:doc
- 大小:200.50 KB
- 文档页数:5

溶液表面吸附量的测定(3学时)一、目的要求1、了解溶液表面吸附量的物理意义及其测定原理。
2、了解最大气泡法测定溶液表面张力的基本原理和方法。
3、了解弯曲液面的附加压力与液面弯曲度、溶液表面张力之间的关系。
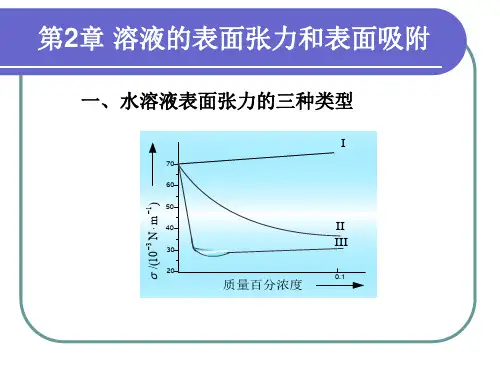
二、实验原理当一种溶质溶于水形成溶液时,溶质在溶液表面的浓度与其在溶液本体中的浓度存在着差别,这种现象称为溶液的表面吸附。
理论上,可用“表面吸附量”(或称表面超量)表示溶液的表面吸附程度大小,表面吸附量的物理化学意义是指溶质在溶液表面处的浓度与其在溶液本体中浓度的差值,通常用符号表示,其SI 单位为mol.m -2。
Γ在恒温、恒压条件下,表面吸附量(mol m -2)、溶液中溶质的活度和溶液表面张力Γa 三者之间的关系可用式(8.1)中的Gibbs 等温式进行描述:()1N m γ−(8.1)a d RT da γΓ=−在浓度不太大时,可以采用浓度代替活度,因此Gibbs 等温式可写成:()1mol L c −a (8.2)c d RT dc γΓ=−可见,只要通过实验测得溶液的表面张力与溶质浓度的关系曲线,即可利用公式γc (8.2)计算得到某一个浓度条件下的表面吸附量。
c Γ例如,图8.1为溶液表面张力随溶质浓度的变化曲线,若要求溶质浓度为时溶液的表1c 面吸附量,可在浓度轴上点作浓度轴的垂线,该垂线与关系曲线相交于A 点,1Γ1c ~c γ则曲线在A 点处切线AB 的斜率即为,由图8.1可知,AD 为纵轴的垂线,则有d dc γ。
又因为,则得到,代入到式(8.2)中即可DB AD d dc γ=1AD c =()1DB c d dc γ=求出浓度为时溶液的表面吸附量。
1c对于溶液表面吸附,可以采用Langmuir 理想吸附模型描述表面吸附量与溶液浓度Γc 之间的关系,即:(8.3)1kc kc θ∞Γ==Γ+γBD 1图8.1表面张力随浓度的变化关系曲线式(8.3)中,为溶质分子对溶液表面的覆盖百分率;为溶液的最大吸附量,对于θ∞Γ给定的体系,一定条件下是常数;为吸附常数∞Γk 可以将式(8.3)重排为直线形式:(8.4)1c c k ∞∞=+ΓΓΓ以对作图可得到一条直线,根据直线的截距和斜率可以求得最大吸c Γc 1k ∞Γ1∞Γ附量和吸附常数。

溶液表面吸附的测定实验报告实验报告:溶液表面吸附的测定实验目的:1. 了解溶液表面张力的测定方法;2. 理解溶液中表面吸附现象的产生和作用;3. 掌握X方法测定特定物质的表面吸附现象。
实验原理:当溶液与固体表面接触时,由于表面活性剂的存在,表面物质会吸附在固体表面上,形成薄膜。
表面吸附现象与溶液温度、浓度、pH值等因素密切相关,其大小与固体表面性质、溶质分子结构、外界环境温度、压力、湿度等因素有关。
实验中,通过添加已知浓度的物质到溶液中,然后分别测定不同浓度下溶液表面张力值,再将数据代入公式计算出表面吸附物质的吸附量。
实验仪器和试剂:1. 表面张力计;2. 磁力搅拌器;3. 鱼油酸钠试剂(0.1mol/L);4. 标准盐酸(0.5mol/L);5. 微量滴定管。
实验步骤:1. 准备工作:清洁实验仪器和试剂瓶口,定量取出所需试剂。
2. 将100mL二甲苯溶液倒入清洁的烧杯中,加入脱氧鱼油酸钠浸泡1小时,搅拌均匀。
3. 用干净针头涂取适量已浸泡好的鱼油酸钠溶液滴到表面张力计的平衡槽中;4. 将磁力搅拌器调整至适当转速,使溶液中的表面张力尽量平衡;5. 记录稳定状态下的表面张力值;6. 依次加入不同浓度的标准盐酸,重复第4-5步操作,测定不同浓度下的表面张力值;7. 计算出不同浓度下的表面吸附物质的吸附量。
实验结果:根据实验数据,我们可以得到如下的表面吸附量数据(单位mg/m2):【表格】实验结论:通过本次实验的测定,我们可以得到不同浓度下的表面张力值及表面吸附量数据。
从实验数据中可以看出,表面吸附量会随着浓度的增加而增加,这与表面吸附物质分子与溶剂分子接触几率增加的结论相符。
通过本实验可进一步认识表面吸附现象,有助于我们深入了解该现象在工业生产和实际应用中的作用。
实验注意事项:1. 实验仪器需保证干净,以免影响实验结果;2. 实验试剂需定量取用,并注意浓度值,以保证实验数据的准确性;3. 操作过程中需严格按照实验流程进行,确认数据和记录结果时应谨慎。
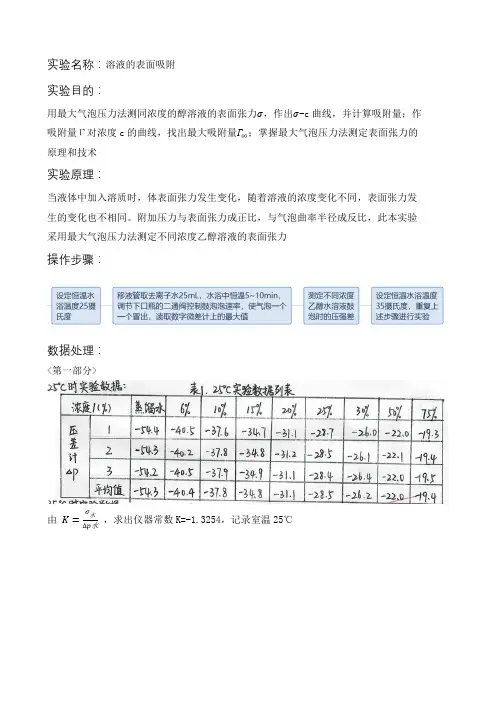
实验名称:溶液的表面吸附
实验目的:
用最大气泡压力法测同浓度的醇溶液的表面张力σ,作出σ-c曲线,并计算吸附量;作吸附量Γ对浓度c的曲线,找出最大吸附量Γ∞;掌握最大气泡压力法测定表面张力的原理和技术
实验原理:
当液体中加入溶质时,体表面张力发生变化,随着溶液的浓度变化不同,表面张力发生的变化也不相同。
附加压力与表面张力成正比,与气泡曲率半径成反比,此本实验采用最大气泡压力法测定不同浓度乙醇溶液的表面张力
操作步骤:
数据处理:
<第一部分>
由K=
σ
水
∆p水
,求出仪器常数K=-1.3254,记录室温25℃
根据上图可知该温度下最大吸附量Γ∞为60.5×10−11mol∙cm−2 <第二部分>
由K=
σ
水
∆p水
,求出仪器常数K=-1.3304,记录室温35℃
根据上图可知该温度下最大吸附量Γ∞为55.7×10−11mol∙cm−2
分析与讨论:
1.实验时,确保粗细两毛细管插入液面下的位置一致,且橡胶塞密封完好
2.鼓泡速率不能太快也不能太慢,适宜的速率为5-6秒产生一个气泡。

溶液表面吸附的测定1. 实验目的① 掌握最大气泡压力法测定溶液表面张力的原理和方法② 根据吉布斯吸附方程,计算溶液表面吸附量和乙醇分子的横截面积2. 实验原理① 表面自由能:从热力学观点看,液体表面缩小是一个自发过程,这是使体系总的自由能减小的过程。
如欲使液体产生新的表面ΔA ,则需要对其作功。
功的大小应与ΔA 成正比:-W=σΔA ,式中σ为液体的表面自由能,亦称表面张力(单位为J ·m-2)。
它表示了液体表面自动缩小趋势的大小,其量值于液体的成分、、溶质的浓度、温度及表面气氛等因素有关。
② 溶液的表面吸附:纯物质液体的表面层与本体(内部)组成相同。
根据能量最低原理,为降低其表面吉布斯自由能,必须尽可能地收缩液体表面。
对溶液则不同,加入溶质后,溶剂表面张力发生变化,根据能量最低原理,若加入的溶质能降低溶剂表面张力时,则溶剂在表面层的浓度比在溶液本体中的浓度大;反之,若溶质使溶剂表面张力升高,溶质在表面层的浓度小于在溶液本体中的浓度。
溶质在溶液表面层与在溶液本体中浓度不同的现象称为溶液的表面吸附,即溶液借助于表面吸附来降低表面吉布斯自由能。
③ 溶液表面吸附溶质的量Γ与表面张力σ、浓度c 有关。
其关系符合吉布斯吸附方程:Γ=-C RT(∂σ∂c)T 。
(∂σ∂c)T ,表示在一定温度下,表面张力随浓度的变化率。
如果溶液表面张力随浓度增加而减小,即(∂σ∂c)T <0,则T>0,此时溶液中溶质在表面层中的浓度大于在溶液本体中的浓度,称为正吸附。
如果(∂σ∂c )T >0,则T<0,称为负吸附。
④ 以表面张力对浓度作图,得到σ-C 曲线,在σ-C 曲线上任选一点作切线,即可得到该点所对应浓度c i 的斜率 ∂σ∂c iT 。
其中MN =-c i ∂σ∂c iT ,则Γ=MNRT,根据此式可求得不同浓度下各个溶液的Γ。
对于溶液表面吸附,可以采用朗格缪尔(Langmuir)吸附等温式描述表面吸附量Γ与溶液浓度c 之间的关系,即θ=ΓΓ∞=kc1+kc 。

溶液的表面吸附实验报告溶液的表面吸附实验报告引言:表面吸附是溶液中溶质分子或离子在溶剂表面附着的现象。
它在化学、生物学和材料科学等领域中具有重要的应用价值。
本实验旨在通过测定铜离子在水溶液中的表面吸附量,探究不同条件下表面吸附的影响因素。
实验材料与方法:1. 实验材料:铜离子溶液、去离子水、试管、比色皿、分光光度计等。
2. 实验方法:a. 准备一系列浓度不同的铜离子溶液。
b. 取一定量的去离子水,加入不同浓度的铜离子溶液,得到一系列不同浓度的溶液。
c. 将每个溶液分别倒入比色皿中。
d. 使用分光光度计测量每个溶液的吸光度。
e. 根据吸光度与溶液浓度之间的关系,计算出表面吸附量。
结果与讨论:通过实验测得的吸光度数据,我们可以得到不同浓度下的表面吸附量。
进一步分析数据发现,表面吸附量随着溶液浓度的增加而增加。
这说明溶液浓度是影响表面吸附的重要因素之一。
当溶液浓度较低时,表面吸附量较小,随着浓度的增加,表面吸附量逐渐增大。
这可能是因为溶质分子或离子在溶液中的浓度增加,导致更多的分子或离子能够接触到溶剂表面并发生吸附。
此外,我们还进行了不同温度下的表面吸附实验。
实验结果表明,随着温度的升高,表面吸附量呈下降趋势。
这可能是因为高温下分子或离子的热运动增强,使其更容易脱离溶液表面,减少了表面吸附的数量。
因此,温度也是影响表面吸附的重要因素之一。
此外,我们还观察到pH值对表面吸附的影响。
实验结果显示,在酸性条件下,表面吸附量较大,而在碱性条件下,表面吸附量较小。
这可能是因为酸性条件下,溶液中存在更多的H+离子,它们与铜离子形成络合物,增加了表面吸附的数量。
而在碱性条件下,溶液中的OH-离子与铜离子形成沉淀,降低了表面吸附的数量。
结论:通过本实验,我们得出了以下结论:1. 溶液浓度是影响表面吸附量的重要因素,浓度越高,表面吸附量越大。
2. 温度的升高会降低表面吸附量,因为高温下分子或离子更容易脱离溶液表面。
3. pH值对表面吸附也有影响,酸性条件下表面吸附量较大,碱性条件下较小。


溶液表面吸附的测定一、实验目的1、采用最大泡压法测定不同浓度的乙醇水溶液的表面张力2、根据吉布斯吸附公式计算溶液表面的吸附量和乙醇分子的横截面积二、实验原理1、表面自由能 从热力学观点看,液体表面缩小是一个自发过程,这是使体系总的自由能减小的过程。
如欲使液体产生新的表面△A ,则需要对其作功。
功的大小应与△A 成正比:A W ∆=σ-式中σ为液体的表面自由能,亦称表面张力。
它表示了液体表面自动缩小趋势的大小,其量值与液体的成分、溶质的浓度、温度及表面气氛等因素有关。
2、溶液的表面吸附 纯物质表面层的组成与内部的组成相同,因此纯液体降低表面自由能的唯一途径是尽可能缩小其表面积。
对于溶液,由于溶质能使溶剂表面张力发生变化,因此可以调节溶质在表面层的浓度来降低表面自由能。
根据能量最低原则,溶质能降低溶剂的表面张力时,表面层溶质的浓度比溶液内部大;反之,溶质使溶剂的表面张力升高时,表面层中的浓度比内部的浓度低。
这种表面浓度与溶液内部浓度不同的现象叫做溶液的表面吸附。
显然,在指定的温度和压力下,溶质的吸附量与溶液的表面张力及溶液的浓度有关,从热力学方法可知它们之间的关系遵守吉布斯(Gibbs)吸附方程:Tdc dσRTc-Γ⎪⎪⎭⎫ ⎝⎛= 式中:Γ为表面吸附量(单位:mol·m -2);T 为热力学温度(单位:K);c 为稀溶液浓度(单位:mol·dm -3);R 为气体常数。
T dc dσ⎪⎪⎭⎫ ⎝⎛<0,则Γ>0,称为正吸附;Tdc dσ⎪⎪⎭⎫⎝⎛>0,则Γ<0,称为负吸附。
以表面张力对浓度作图,即得到c -σ曲线,在c -σ曲线上任选一点作切线,如图12.1所示,即可得该点所对应浓度c i 的斜率:()T i c d /d σ,图12.1 表面张力与浓度的关系其中: ()T i i c c MN d /d σ-= 则: RT MN /=Γ,根据此式可求得不同浓度下各个溶液的Γ值。


姓名: 肖池池 序号: 31 周次: 第四周 指导老师: 张老师
溶液表面的吸附
——最大气泡压力法测溶液表面张力
一、实验目的:
1、掌握气泡最大压力法测定液体表面张力的原理与方法,并测定不同浓度正丁醇水溶液的表面张力;
2、了解溶液表面的吸附作用,应用Gibbs 吸附等温式和Langmuir 吸附等温式求出正丁醇的饱和吸附量,并计算正丁醇分子的截面积。
二、 实验原理:
在一定温度下,溶液的表面吸附量Γ与表面张力γ及溶液本体浓度c 之间的关系符合吉布斯吸附等温式:
dc d RT c γ⋅-
=Γ (1) 式中:Γ为表面吸附量(mol ·m -2);T 为热力学温度(K );c 为稀溶液浓度(单位:mol ·L -1);
γ为表面张力(单位:N ·m -1)
;R 为气体常数。
用吉布斯吸附等温式计算某溶质的吸附量时,可
通过实验测定不同浓度的溶液的表面张力γ
,并以γ
对c 作图,如图左所示。
在
c γ-曲线上任
取一点a ,通过a 点作曲线的切线和平行于横坐
标的直线,分别与纵坐标交于'
,b b 。
令'b
b Z =,则
d Z c
dc γ=-,代入式(1),得:
Z
RT Γ=
;从c γ-曲线上取不同的点,就可求得不同浓度时
溶质在表面层的吸附量Γ。
对可形成单分子层吸附的表面活性物质,溶液的表面吸附量Γ与溶液内部浓度c 之间的关系符合Langmuir 吸附等温式:
1kc
kc ∞Γ=Γ⋅
+ (2)
b’
b
γ
式中:
∞Γ为 饱和吸附量;k 为常数。
将式(6-1-2)两边取倒数,并同乘以c ,可得
11c c k ∞∞=+ΓΓΓ (3) 根据式(3),以c
Γ对c 作图应为一直线,直线的斜率的倒数即为∞Γ。
如果以N 代表饱和
吸附时单位面积表面层中的分子数,则N=Γ∞N A ,N A 为阿伏加德罗常数。
而在饱和吸附时,每个被吸附的溶质分子在表面上所占的面积,即溶质分子的截面积m a 为:
(4)
本实验选用气泡最大压力法测定溶液的表面张力。
由Laplace 方程可知,此压力差p ∆与溶液的表面张力γ
成正比,与气泡的曲率半径r 成反比:
r p γ
2=
∆ (5)
毛r r p γγ22min max =
=
∆ (6)
max max /2r p k p γ=∆=⋅∆毛 (7)
式中:k 为仪器常数,通常用已知表面张力的物质确定,本实验用蒸馏水确定k 。
若用同一根毛细管,对表面张力分别为1γ和2γ的液体而言,则有下列关系:
11max k p γ=⋅∆, 2m a x k p γ=⋅∆2,
1max
12
max p p γγ∆=∆,2, (8) 由此可见,只要测出最大压力差,即可由已知表面张力的标准物质求出待测物质的表面张力。
三、 仪器与药品:
表面张力测定装置1套;不同浓度的正丁醇(AR )溶液。
四、 实验步骤:
(1)仪器准备与检漏
1.将表面张力测定管与毛细管洗净,连接装置。
插上电源插头,打开电源开关,LED 显示即亮,预热五分钟后按下置零按钮显示为0000,表示此时系统大气压差为零。
2.在洗净的表面张力测定管中装入适量的蒸馏水,打开放水阀使毛细管管端与液面恰好相
切,关闭放水阀。
3.在滴液漏斗中装入适量水,打开滴液漏斗的活塞,滴液漏斗的水流到磨口烧杯中,使系统
的压力增加,压力计上即显示一压力差。
关闭滴液漏斗的活塞,若2-3分钟内压力计的读数
不变,则表明系统不漏气,然后进行后续试验。
(2以水作为待测液测定仪器常数
打开滴液漏斗,控制滴液速度,使气泡由毛细管管口成单泡逸出,且每个气泡的形成时间约
为5~10秒,记录最大的压差△p max,连续读数三次,取其平均值。
(3)待测正丁醇溶液表面张力的测定
用同样方法测定不同浓度的正丁醇水溶液,注意由稀至浓依次测定,每次更换溶液时,应用
待测液洗涤毛细管内壁及表面张力管2~3次。
测定已知浓度的待测样品的最大压力差△
p max ,连续读数三次,取其平均值。
五、数据记录与处理:
(1)实验数据记录:
t/ ℃= 25
c / (mol / L) 0 0.02 0.04 0.06 0.08 0.10 0.12 0.16 0.24
△p / Pa 1 717 673 642 613 579 558 538 516 464 △p / Pa 2 716 673 643 611 579 557 536 515 464 △p / Pa 3 717 673 641 610 579 557 536 517 463
△p / Pa(平均值) 716.7
71.97 673.0
67.585
642.0
64.472
611.3
61.392
579.0
58.145
557.3
55.969
536.7
53.894
516.0
51.818
463.7
46.563
γ×103/(N·m-1)
Z×1030.000 3.267 6.021 8.261 9.989 11.203 11.905 11.769 5.340 ×106(mol·m-2)0.000 1.323 2.438 3.347 4.049 4.544 4.832 4.787 2.212(2)实验数据处理:
表面张力与浓度关系图
γx 103
/(N /m )
c/(mol/L)
图一
Γ∞/c
与c 关系图
c /Γx 10
-6
c /(mol/L)
图二
由图二可以得到曲线的斜率k= 0.12602×106, Γ∞ = 1/(0.12602×106) = 7.935×10-6 而
=1/(7.935×10-6×6.022×1023)= 2.09×10-19m 2 = 0.209nm 2
六、注意事项:
(1)测定用毛细管一定要清洗干净,测定时毛细管要保持垂直,管端与液面相切;
(2)实验用毛细管的管端一定要光滑、平整、力求程圆形。
七、思考题:
1、做好本实验的关键是什么?
答:做好本实验主要是控制气泡的溢出数率,不能太快也不能太慢,每个气泡的形成时间约5~10s.,且每次测量的数率尽量一样。
2、毛细管不干净,对实验数据有何影响?
答:如果毛细管不干净可能会堵住毛细管,使测量的值偏大,而且毛细管上的残留物会影响测量溶液的浓度,对实验造成影响。
3、为什么毛细管端口必须和液面相切?
答:毛细管尖端若不与液面相切插入一定深度,会引起表面张力测定值偏小。
4、若气泡不成单泡逸出,或逸出速度太快,将会给实验带来什么影响?为什么?
答:气泡逸出速率会影响气泡的大小,近而影响压力差值的大小,因而要保证测定过程中气泡逸出速率恒定。
5、温度变化对表面张力有何影响?
需要恒温,因为表面张力的大小受温度的影响。