影响盐的水解的因素、盐类水解的应用
- 格式:ppt
- 大小:278.00 KB
- 文档页数:17
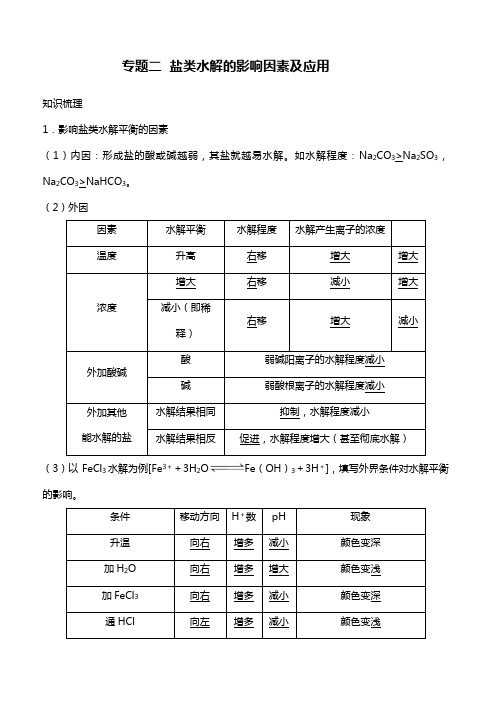
专题二盐类水解的影响因素及应用知识梳理1.影响盐类水解平衡的因素(1)内因:形成盐的酸或碱越弱,其盐就越易水解。
如水解程度:Na2CO3>Na2SO3,Na2CO3>NaHCO3。
(2)外因因素水解平衡水解程度水解产生离子的浓度温度升高右移增大增大浓度增大右移减小增大减小(即稀释)右移增大减小外加酸碱酸弱碱阳离子的水解程度减小碱弱酸根离子的水解程度减小外加其他能水解的盐水解结果相同抑制,水解程度减小水解结果相反促进,水解程度增大(甚至彻底水解)(3)以FeCl3水解为例[Fe3++3H2O Fe(OH)3+3H+],填写外界条件对水解平衡的影响。
条件移动方向H+数pH现象升温向右增多减小颜色变深加H2O向右增多增大颜色变浅加FeCl3向右增多减小颜色变深通HCl向左增多减小颜色变浅加NaHCO3向右减小增大生成红褐色沉淀,放出气体加AlCl3向左增多减小颜色变浅2.盐类水解的应用应用举例判断溶液的酸碱性FeCl3溶液显酸性,原因是(用离子方程式表示)Fe3++3H2O Fe(OH)3+3H+判断酸性强弱NaX、NaY、NaZ三种盐溶液的pH分别为8、9、10,则酸性由强到弱的顺序为HX>HY>HZ配制或贮存易水解的盐溶液配制FeCl3溶液,加入少量盐酸,贮存Na2CO3溶液、Na2SiO3溶液不能用磨口玻璃塞胶体的制取制取Fe(OH)3胶体的离子方程式:Fe3++3H2O错误!Fe(OH)3(胶体)+3H+泡沫灭火器原理成分为NaHCO3溶液与Al2(SO4)3溶液,发生反应Al3++3HCO错误!===Al(OH)3↓+3CO2↑作净水剂明矾可作净水剂,原理为Al3++3H2O Al(OH)3(胶体)+3H+化肥的使用铵态氮肥与草木灰不得混用除锈剂NH4Cl与ZnCl2溶液可作焊接时的除锈剂判断盐溶液蒸干时的产物盐水解生成挥发性酸,蒸干灼烧后一般得氧化物。
如AlCl3→Al2O3盐水解生成难挥发性酸,蒸干后得原物质。





化学教案盐类的水解4篇化学教案盐类的水解1目标:1.影响盐类水解的因素,与水解平衡移动。
2.盐类水解的应用。
教学设计:1.师生共同复习稳固第一课时相关学问。
〔1〕依据盐类水解规律分析醋酸钾溶液呈性,缘由;氯化铝溶液呈性,缘由;〔2〕以下盐溶于水高于浓度增大的是2.应用试验手段,启发思维试验1.在溶液中滴加几滴酚酞试液,观看现象,分析为什么?将溶液分成二等份装入二支洁净试管中,一支加热,另一支保持室温,进行比较。
现象;缘由分析;试验2.将新制备的胶体中,分装于二支试管中,一支试管加入一滴盐酸,与另一支试管对比比较。
现象;缘由分析。
教学过程:影响盐类水解的因素1.主要因素是盐本身的性质。
组成盐的酸根对应的酸越弱,水解程度也越大,碱性就越强,越高。
组成盐的阳离子对应的碱越弱,水解程度也越大,酸性就越强,越低。
2.影响盐类水解的外界因素主要有温度、浓度及外加酸碱等因素。
〔1〕温度:盐的水解是吸热反应,因此上升温度水解程度增大。
〔2〕浓度:盐浓度越小,水解程度越大;盐浓度越大,水解程度越小。
〔3〕外加酸碱能促进或抑制盐的水解。
例如水解呈酸性的盐溶液加入碱,就会中和溶液中的,使平衡向水解方向移动而促使水解,若加酸则抑制水解。
盐类水解学问的应用1.盐溶液的酸碱性推断依据盐的组成及水解规律分析。
“谁弱谁水解,谁强显谁性”作为常规推断根据。
例题:分析:溶液是显酸性?还是显碱性?为什么?分析:溶液是显酸性?还是显碱性?为什么?3.溶液中离子浓度大小的比较电解质水溶液K存在着离子和分子,它们之间存在着一些定量关系。
也存在量的大小关系。
〔1〕大小比较:①多元弱酸溶液,依据多元酸分步电离,且越来越难电离分析。
如:在溶液中,;②多元弱酸正盐溶液,依据弱酸根分步水解分析。
如:在溶液中,;③不同溶液中同一离子浓度的比较要看溶液中其他离子对其影响因素。
④混合溶液中各离子浓度比较,要进行综合分析,要考虑电离、水解等因素。
〔2〕定量关系〔恒等式关系〕①应用“电荷守恒”分析:电解质溶液呈电中性,即溶液中阳离子所带正电荷总数与阴离子所带负电荷总数相等。
第19讲影响盐类水解的主要因素及盐类水解的应用1.了解影响盐类水解平衡的因素,分析外界条件对盐类水解平衡的影响。
2.了解盐类水解在生产生活、化学实验、科学研究中的应用。
学会设计探究方案,进行实验探究。
一、影响盐类水解的主要因素1.反应物的性质盐类水解程度的大小主要由盐的性质决定,生成盐的弱酸酸性越弱(或弱碱碱性越弱),即越难电离(电离常数越小),该盐的水解程度越大,即越弱越水解。
2.实验探究反应条件对水解程度的影响已知FeCl 3发生水解反应的离子方程式:Fe 3++3H 2OFe(OH)3+3H +,根据实验操作填写下表:影响因素实验步骤实验现象解释盐的浓度加入FeCl 3固体,再测溶液的pH 溶液颜色变深,pH 变小加入FeCl 3固体,c (Fe 3+)增大,水解平衡向正反应方向移动溶液的酸碱度加盐酸后,测溶液的pH 溶液颜色变浅,pH 变小加入盐酸,c (H +)增大,水解平衡向逆反应方向移动,但c (H +)仍比原平衡中c (H +)大加入少量NaOH产生红褐色沉淀加入氢氧化钠后,OH -消耗H +,c (H +)减小,水解平溶液衡向正反应方向移动温度升高温度溶液颜色变深,pH变小升高温度,水解平衡向正反应方向移动二、盐类水解的应用1.在化学实验中的应用大多数盐溶液蒸干灼烧后可以得到相应的盐,以下常见的三类盐溶液蒸干得不到相应的盐(1)盐溶液水解生成易挥发性酸时,蒸干后一般得到对应的弱碱,如AlCl3、FeCl3溶液蒸干后一般得到Al(OH)3、Fe(OH)3,若灼烧则会生成Al2O3、Fe2O3。
(2)考虑盐受热时是否分解。
因为Ca(HCO3)2、NaHCO3、NH4Cl固体受热易分解,因此蒸干灼烧后分别为Ca(HCO3)2→CaO;NaHCO3→Na2CO3;NH4Cl→NH3+HCl。
(3)还原性盐在蒸干时会被O 2氧化,如Na 2SO 3溶液蒸干得到Na 2SO 4;FeSO 4溶液蒸干得到Fe 2(SO 4)3。
第十七讲 盐类水解的影响因素及应用一、水解平衡常数1.定义:盐类水解反应的平衡常数(或水解常数),用K h 表示。
2.表达式对于水解方程式:A+H 2O ⇌HA+OH ,其平衡常数可表示为:K h =c (HA )·c(OH -)c(A -)3.意义:K h 表示水解反应趋势的大小,K h 数值越大,水解趋势越大。
4.影响因素:对于确定的离子,其水解常数只受温度影响。
温度越高,水解常数越大。
5.与电离常数的关系K h =K w K a(K a 为弱酸的电离平衡常数)或K h =Kw K b(K b 为弱碱的电离平衡常数)二、影响盐类水解的因素 1.内因——盐本身的性质弱酸阴离子、弱碱阳离子对应的酸、碱越弱,就越易发生水解。
相同温度下,等物质的量浓度的NaX 、NaY 、NaZ 三种正盐溶液,测得溶液的pH 分别是7、9、10。
则相对应的酸HX 、HY 、HZ 的酸性强弱顺序为:HX >HY >HZ 。
2.外因①温度:温度越高水解程度越大(水解吸热,越热越水解)①浓度:符合勒夏特列原理。
浓度越小,水解程度越大(越稀越水解)。
要点集结知识精讲①酸碱:促进或抑制盐的水解(H+促进阴离子水解而抑制阳离子水解;OH促进阳离子水解而抑制阴离子水解)水解平衡和其他化学平衡一样也是动态平衡,外界条件改变,平衡就会发生移动,以CH3COONa的水解为例(CH3COO-+H2O①CH3COOH+OH-)填写下表三、盐类水解的应用热的纯碱溶液去污能力强:CO2-3+H2O HCO-3+OH-,升高温度,水解平衡右移,c(OH-)增大成分为NaHCO与Al(SO),发生反应为Al3++3HCO-===Al(OH)↓+3CO↑除锈剂NH4Cl 与ZnCl2溶液可作焊接时的除锈剂比较离子浓度大小如NHCl溶液:NH4++H2O⇌NH3·H2O+H+,c(Cl)>c(NH4+)>c(H+)>c(OH)4四、判断盐溶液蒸干时所得的产物1.水解生成难挥发性酸的强碱盐,蒸干后一般得原物质。