食药监械管〔2014〕13号——创新医疗器械特别审批程序(试行)
- 格式:pdf
- 大小:227.38 KB
- 文档页数:8

附件1创新医疗器械特别审批程序(试行)(征求意见稿)第一条为鼓励医疗器械的研究与创新,促进自主创新医疗器械产业发展,根据《医疗器械监督管理条例》、《医疗器械注册管理办法》等法规和规章,制定本程序。
第二条食品药品监督管理部门对同时符合下列情形的医疗器械按本程序实施审评审批:(一)申请人具有产品核心技术的自主知识产权,权益状况明确。
申请人具有自主知识产权是指,申请人经过其主导的技术创新活动,在我国依法拥有发明专利的所有权,或依法通过受让取得在我国发明专利的所有权或使用权。
(二)产品主要工作原理/作用机理为国内首创,产品性能或安全性与同类产品比较有根本性改进,技术上处于国际领先水平,并且具有显著的临床应用价值。
(三)申请人已完成产品的前期研究并具有基本定型产品,研究过程真实和受控,研究数据完整和可溯源。
(四)申请人为中国境内的企业法人,产品在中国境内生产,并具有医疗器械生产企业许可证。
第三条各级食品药品监督管理部门及相关技术机构,根据各自职责和本程序规定,按照早期介入、专人负责、科学审批的原则,在标准不降低、程序不减少的前提下,对创新医疗器械予以优先办理,并加强与申请人的沟通交流。
第四条申请人申请创新医疗器械特别审批,应当填写《创新医疗器械特别审批申请表》(见附件1),并提交支持拟申请产品符合本程序第二条要求的资料。
资料应当包括:(一)申请人企业法人资格证明文件。
(二)医疗器械生产企业许可证。
(三)产品知识产权情况及证明文件。
(四)产品研发过程及结果的综述。
(五)产品技术文件,至少应包括:1. 产品的预期用途;2. 产品工作原理/作用机理;3. 产品主要技术指标及确定依据,主要原材料、关键元器件的指标要求,主要生产工艺过程及流程图,主要技术指标的检验方法。
(六)产品创新的证明性文件,至少应包括:1. 国家级信息或专利检索机构出具的查新报告;2. 核心刊物公开发表的能够充分说明产品临床应用价值的学术论文、专著及文件综述;3. 与产品主要技术相关的发明专利说明书;4. 国内外已上市同类产品应用情况的分析;5. 产品的创新内容及在临床应用的显著价值。

医疗器械从研发到上市需要花费的时间费用(附详细流程)对于初创企业而言,产品从研发设计阶段到走向消费市场,至少应经历设计开发、注册检测、临床试验、注册申报、生产许可申请等漫长的无盈利过程。
那么,如何评估产品安全性风险、申报注册周期、投入资金与成本?都是初创企业创始人最关心的问题。
基于上述问题,笔者整理此文,希望对正踏步进军医疗行业的初创企业有所帮助。
本文将按照工商注册、产品设计开发、体系建立、创新产品申报(若涉及)、注册检测、临床试验、注册申报、生产许可申请、产品上市等必要阶段进行简单介绍。
01基本流程(一)工商注册现如今,公司实行注册资本认缴制和三证合一登记制度,注册流程大为简化,注册费用大为节约,注册周期也大为缩减。
但在公司注册前,需认真思考经营范围,前置考虑未来产品生产范围,避免后续再做变更。
(二)产品开发设计1、产品设计开发流程产品设计开发可分7个阶段:策划阶段、设计输入阶段、设计输出阶段、小试阶段、中试阶段、定型阶段、注册资料准备阶段。
2、产品设计开发要点一般而言,创始人创立公司是基于科研成果与产品布局基础上,并已初步具备研发团队、合作伙伴等。
但无论如何,对于初创公司而言,因涉及大量资金注入与技术攻坚,产品设计开发阶段十分艰难,时间也是难以预估的,短则数月,长则数年。
那么,如何在产品设计开发阶段降低成本,满足需求,增加创新?首先,产品技术层面,专业高效的研发团队是前提和基础;其次,法规层面,建议寻找专业CRO公司或引进法规团队对产品开发进行严格的风险评估,明确产品申报类型等。
但我们常常发现,很多新办企业在产品已定型、开模后,才开始引进法规人员或寻找咨询机构。
此时的建议和措施往往基于补救,严重的可能涉及改模、重新设计等。
所以对于新办企业而言,法规前置慎重考量。
最后,还应关注产品专利布局。
公司应重点布局核心技术的知识产权保护,同时还应考虑核心技术转让、购买等问题,而产品的专利申报可以委托相应机构,后期若涉及专利较多,亦可引入兼职或专职人员。


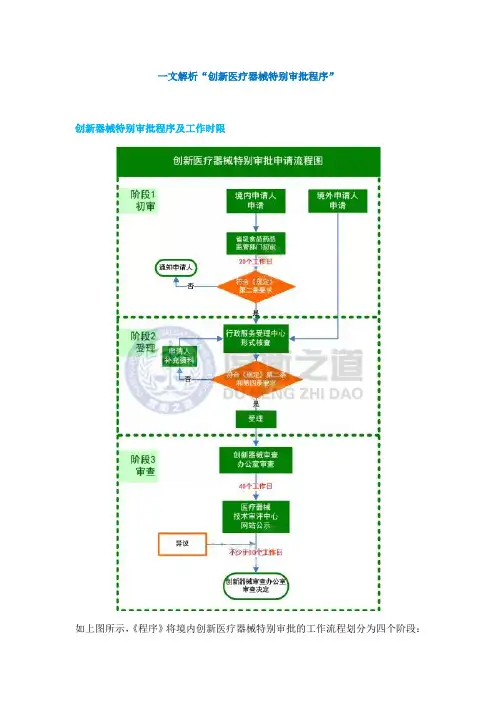
一文解析“创新医疗器械特别审批程序”创新器械特别审批程序及工作时限如上图所示,《程序》将境内创新医疗器械特别审批的工作流程划分为四个阶段:初审、受理、审查、公示;境外创新医疗器械特别审批的工作流程仅包含三个阶段:受理、审查、公示。
《程序》限定初审应于20个工作日内完成,审查应于40个工作日内完成,公示应≥10个工作日。
据此是否可以估算境内创新器械特别审批申请应在≤70个工作日内获得审查结果;境外创新医疗器械特别审批申请应在≤50个工作日内获得结论呢?可能还需考虑申请人提供信息有欠缺或进行补充资料的情况。
依据法规事务经验,在初审、受理、审查这三个环节,企业均面临补正资料或补充资料的可能。
但《程序》并未明确提及资料的补充、期限和复审期限。
其中,补充资料时间企业必须根据材料的缺失程度和补正所需周期估算。
此外,在《程序》中并未对受理以及资料流转给予时间限定。
依据现有要求,受理与流转时限为8个工作日。
但是由于这部分时间涉及到多个部门之间的交接问题,在同类情形中也出现过超出时限、难以推进的情况。
提请各位注意,对于境内创新医疗器械还需估算企业所在地省级食品药品监督管理部门的受理及结转的时限。
具体可参照当地的相关配套文件。
“创新特别审批”将给与企业哪些优待?我们将创新产品的上市划分为两个阶段:创新医疗器械特别审批申请阶段和创新医疗器械注册申请阶段。
第二阶段是建立在第一阶段基础上的。
这两个阶段《创新医疗器械特别审批程序(试行)》(食药监械管〔2014〕13号)(以下简称《程序》)究竟为企业创造了哪些便捷和优待?请参见下图(以境内创新产品为例)。
此处要提请广大会员注意的是:在第一阶段中,《程序》给予企业最大的优待政策是在产品注册申请受理前以及技术审评过程中,指定专人,应申请人的要求及时沟通、提供指导,共同讨论相关技术问题。
沟通交流应形成记录,供该产品的后续研究及审评工作参考。
沟通内容至少涉及两个方面:一方面是审查产品的创新性;另一方面,也是创新企业的沟通重点,是在指定专人的条件下,就重大技术、安全、临床方案问题与技术审评中心在产品最终定型注册申请前进行充分的沟通和分步确认。

医疗器械注册员必备法规《医疗器械监督管理条例》(国务院令第650号)自2014年6月1日正式实施,条例配套的规章及规范性文件陆续密集出台。
新法规的出台意味着医疗器械企业面临新的机遇和挑战,作为医疗器械注册人熟悉这些必备的法规,对企业正常运行、产品如期顺利上市起到至关重要的作用国家食品药品监督管理总局已经发布和正在征求意见的系列法规文件目录如下,具体内容参见国家食品药品监督管理总局网站。
行政法规1. 医疗器械监督管理条例(国务院令第650号)2. 国务院关于修改《医疗器械监督管理条例》的决定(国务院令第680号)部门规章1. 医疗器械注册管理办法(CFDA局令第4号)2. 体外诊断试剂注册管理办法(CFDA局令第5号)3. 医疗器械说明书和标签管理规定(CFDA局令第6号)4. 医疗器械生产监督管理办法(CFDA局令第7号)医疗器械生产监督管理办法(修正版)(2017年11月21日发布)5. 医疗器械经营监督管理办法(CFDA局令第8号)医疗器械经营监督管理办法(修正版)(2017年11月21日发布)6. 药品医疗器械飞行检查办法(CFDA局令第14号)7. 医疗器械分类规则(CFDA局令第15号)8. 医疗器械使用质量监督管理办法(CFDA局令第18号)9. 医疗器械通用名称命名规则(CFDA局令第19号)10. 医疗器械临床试验质量管理规范(CFDA 国家卫计委令第25号)11. 医疗器械召回管理办法(CFDA局令第29号)12. 体外诊断试剂注册管理办法修正案(CFDA局令第30号)13. 关于调整部分医疗器械行政审批事项审批程序的决定(CFDA局令第32号)14. 医疗器械标准管理办法(CFDA局令第33号)15. 医疗器械网络销售监督管理办法(CFDA局令第38号)产品分类界定1. 关于可降解泪道栓子等53个产品分类界定的通知(食药监办〔2013〕11号)2. 关于体外高频治疗机等47个产品分类界定的通知(食药监办械管〔2013〕31号)3. 关于血细胞分离机用耗材等11个产品分类界定的通知(食药监办械管〔2013〕68号)4. 关于自体富血小板凝胶制备用套装等23个产品分类界定的通知(食药监办械管〔2013〕69号)5. 关于重症及麻醉临床信息系统等9个产品分类界定的通知(食药监办械管〔2013〕109号)6. 关于基因分析仪等3个产品分类界定的通知(食药监办械管〔2014〕8号)7. 关于生物电导扫描仪等11个产品分类界定的通知(食药监办械管〔2014〕10号)8. 关于角膜治疗仪等12个产品分类界定的通知(食药监办械管〔2014〕103号)9. 关于电子宫腔观察镜等30个产品分类界定的通知(食药监办械管〔2014〕149号)10. 关于交联胺化聚乙烯醇泡沫封堵肺减容系统等34个产品分类界定的通知(食药监办械管〔2014〕177号)11. 关于腹腔镜手术用内窥镜自动调控定位装置等61个产品分类界定的通知(食药监办械管〔2014〕198号)12. 关于乳腺摄影立体定位装置等153个产品分类界定的通知(食药监办械管〔2015〕49号)13. 关于人工血管接环等172个产品分类界定的通知(食药监办械管〔2015〕69号)14. 关于恒温核酸扩增检测仪等22个产品分类界定的通知(食药监办械管〔2015〕75号)15. 关于多功能超声骨刀等127个产品分类界定的通知(食药监办械管〔2015〕104号)16. 关于阴茎增大增粗拉伸器具产品分类界定事项的复函(食药监办械管函〔2016〕480号)通告1. 关于发布第一类医疗器械产品目录的通告(CFDA通告2014年第8号)2. 关于发布医疗器械产品技术要求编写指导原则的通告(CFDA通告2014年第9号)3. 关于发布免于进行临床试验的第二类医疗器械目录的通告(CFDA通告2014年第12号)4. 关于发布免于进行临床试验的第三类医疗器械目录的通告(CFDA通告2014年第13号)5. 关于发布需进行临床试验审批的第三类医疗器械目录的通告(CFDA通告2014年第14号)6. 关于医疗器械生产质量管理规范执行有关事宜的通告(CFDA通告2014年第15号)7. 关于发布体外诊断试剂临床试验技术指导原则的通告(CFDA通告2014年第16号)8. 关于发布体外诊断试剂说明书编写指导原则的通告(CFDA通告2014年第17号)9. 关于发布禁止委托生产医疗器械目录的通告(CFDA通告2014年第18号)10. 关于发布医疗器械生产企业供应商审核指南的通告(CFDA通告2015年第1号)11. 关于发布医疗器械临床评价技术指导原则的通告(CFDA通告2015年第14号)12. 关于发布医疗器械产品出口销售证明管理规定的通告(CFDA通告2015年第18号)13. 关于贯彻落实小微企业行政事业性收费优惠政策的通告(CFDA通告2015年第31号)14. 关于生产一次性使用无菌注、输器具产品有关事项的通告(CFDA通告2015年第71号)15. 关于发布医疗器械注册证补办程序等5个相关工作程序的通告(CFDA通告2015年第91号)16. 关于发布医疗器械注册指定检验工作管理规定的通告(CFDA通告2015年第94号)17. 关于发布医疗器械工艺用水质量管理指南的通告(CFDA通告2016年第14号)18. 关于第三类医疗器械生产企业实施医疗器械生产质量管理规范有关事宜的通告(CFDA通告2016年第19号)19. 关于发布《医疗器械临床试验伦理审查申请与审批表范本》等六个文件的通告(CFDA通告2016年第58号)20. 关于发布医疗器械生产企业质量管理体系年度自查报告编写指南的通告(CFDA 通告2016年第76号)21. 关于发布第二批免于进行临床试验医疗器械目录的通告(CFDA通告2016年第133号)22. 关于发布2016年第二批医疗器械临床试验监督抽查项目的通告(CFDA通告2016年第143号)23. 总局关于发布医疗器械生产企业质量控制与成品放行指南的通告(CFDA通告2016年第173号)24. 总局关于发布医疗器械审评沟通交流管理办法(试行)的通告(CFDA通告2017年第19号)25.总局关于发布第三批免于进行临床试验医疗器械目录的通告(CFDA通告2017年第170号)26. 总局关于需审批的医疗器械临床试验申请沟通交流有关事项的通告(CFDA通告2017年第184号)27. 总局关于发布医疗器械注册单元划分指导原则的通告(CFDA通告2017年第187号)28. 总局关于发布移动医疗器械注册技术审查指导原则的通告(CFDA通告2017年第222号)29. 总局关于发布接受医疗器械境外临床试验数据技术指导原则的通告(CFDA通告2018年第13号)政策解读1. 医疗器械抽验和不良事件监测部分(一)(2015年01月22日发布)2. 《医疗器械经营监督管理办法》部分(一)(2015年01月22日发布)3. 《医疗器械生产监督管理办法》部分(一)(2015年01月22日发布)4. 医疗器械注册管理法规解读之一(《医疗器械注册管理办法》和《体外诊断试剂注册管理办法》部分)(2015年02月05日发布)5. 医疗器械注册管理法规解读之二(《医疗器械说明书和标签管理规定》部分)(2015年02月05日发布)6. 关于《药品医疗器械飞行检查办法》的说明(2015年07月08日发布)7. 医疗器械注册管理法规解读之三(关于《医疗器械分类规则》的修订说明)(2015年07月16日)8. 医疗器械注册管理法规解读之四(2015年11月02日发布)9. 医疗器械注册管理法规解读之五(2015年11月19日发布)10. 医疗器械不良事件监测的主要目的和意义(2015年11月25日发布)11. 关于《医疗器械使用质量监督管理办法》的说明(2015年11月30日发布)12. 医疗器械注册管理法规解读之六(2016年01月07日发布)13. 关于《医疗器械通用名称命名规则》的说明(2016年01月27日发布)14. 《医疗器械临床试验质量管理规范》解读(2016年03月23日发布)15. 关于《医疗器械优先审批程序》的说明(2016年10月26日发布)16. 《医疗器械质量管理体系用于法规的要求》标准解读(一)(2017年02月04日发布)17. 《医疗器械质量管理体系用于法规的要求》标准解读(二)(2017年02月04日发布)18. 《医疗器械召回管理办法》解读(2017年02月08日发布)19. 《体外诊断试剂注册管理办法修正案》解读(2017年02月08日发布)20. 《医疗器械网络安全注册技术审查指导原则》解读(2017年03月02日发布)21. 《关于调整部分医疗器械行政审批事项审批程序的决定》解读(2017年04月06日发布)22. 《医疗器械标准管理办法》解读(2017年04月26日发布)23. 《医疗器械召回管理办法》解读之二(2017年05月24日发布)24. 图解政策:2017年器械注册管理改革有这4项重要举措(2017年07月14日发布)25. 图解政策:体外诊断试剂注册管理办法修正案(2017年07月28日发布)26. 创新医疗器械特别审批程序相关问题解读(2017年07月31日发布)27. 医疗器械临床试验质量管理相关问题解读(2017年07月31日发布)28. 《医疗器械标准管理办法》解读之一(2017年08月09日发布)29. 《医疗器械标准管理办法》解读之二(2017年08月09日发布)30. 《医疗器械网络安全注册技术审查指导原则》解读(2017年08月09日发布)31. 《医疗器械临床试验机构条件和备案管理办法》解读(2017年11月24日发布)32. 《医疗器械网络销售监督管理办法》解读(2017年12月22日发布)33. 《移动医疗器械注册技术审查指导原则》解读(2017年12月29日发布)通知性文件1. 关于进一步做好医疗器械产品分类界定工作的通知(食药监办械〔2013〕36号)2. 关于小型医用吸氧器监管有关问题的通知(食药监办法〔2013〕63号)3. 关于实施避孕套出口备案管理的通知(食药监办械监〔2013〕72号)4. 关于进一步加强医疗器械不良事件监测体系建设的指导意见(食药监械监〔2013〕205号)5. 关于印发医疗器械质量监督抽查检验管理规定的通知(食药监械监〔2013〕212号)6. 关于加强省级医疗器械技术审评能力建设的指导意见(食药监械管〔2013〕220号)7. 关于印发医疗器械生产日常监督现场检查工作指南的通知(食药监办械监〔2014〕7号)8. 关于印发创新医疗器械特别审批程序(试行)的通知(食药监械管〔2014〕13号)9. 关于认真贯彻实施《医疗器械监督管理条例》的通知(食药监法〔2014〕31号)10. 关于进一步做好医疗器械召回信息公开工作的通知(食药监办械监〔2014〕107号)11. 关于实施《医疗器械生产监督管理办法》和《医疗器械经营监督管理办法》有关事项的通知(食药监械监〔2014〕143号)12. 关于实施《医疗器械注册管理办法》和《体外诊断试剂注册管理办法》有关事项的通知(食药监械管〔2014〕144号)13. 关于实施第一类医疗器械备案有关事项的通知(食药监办械管〔2014〕174号)14. 关于印发医疗器械检验机构开展医疗器械产品技术要求预评价工作规定的通知(食药监械管〔2014〕192号)15. 关于印发境内第三类和进口医疗器械注册审批操作规范的通知(食药监械管〔2014〕208号)16. 关于印发境内第二类医疗器械注册审批操作规范的通知(食药监械管〔2014〕209号)17. 关于印发医疗器械生产企业分类分级监督管理规定的通知(食药监械监〔2014〕234号)18. 关于印发国家重点监管医疗器械目录的通知(食药监械监〔2014〕235号)19. 关于启用医疗器械生产经营许可备案信息系统的通知(食药监办械监函〔2014〕476号)20. 关于加强避孕套质量安全管理的通知(食药监械监〔2015〕30号)21. 关于印发体外诊断试剂质量评估和综合治理工作方案的通知(食药监办械监〔2015〕55号)22. 关于印发境内第三类医疗器械注册质量管理体系核查工作程序(暂行)的通知(食药监械管〔2015〕63号)23. 关于对取消和下放行政审批事项加强事中事后监管的意见(食药监法〔2015〕65号)24. 关于印发医疗器械经营企业分类分级监督管理规定的通知(食药监械监〔2015〕158号)25. 关于印发医疗器械经营环节重点监管目录及现场检查重点内容的通知(食药监械监〔2015〕159号)26. 关于印发医疗器械生产质量管理规范现场检查指导原则等4个指导原则的通知(食药监械监〔2015〕218号)27. 关于印发医疗器械经营质量管理规范现场检查指导原则的通知(食药监械监〔2015〕239号)28. 关于执行医疗器械和体外诊断试剂注册管理办法有关问题的通知(食药监械管〔2015〕247号)29. 关于印发医疗器械检验机构资质认定条件的通知(食药监科〔2015〕249号)30. 关于成立医疗器械分类技术委员会的通知(食药监械管〔2015〕259号)31. 关于进一步加强医疗器械抽验工作的通知(食药监办械监〔2016〕9号)32. 关于切实做好第三类医疗器械生产企业实施医疗器械生产质量管理规范有关工作的通知(食药监办械监〔2016〕12号)33. 关于医疗器械产品技术要求有关问题的通知(食药监办械管〔2016〕22号)34. 总局关于实施《医疗器械通用名称命名规则》有关事项的通知(食药监械管〔2016〕35号)35. 总局关于印发一次性使用无菌注射器等25种医疗器械生产环节风险清单和检查要点的通知(食药监械监〔2016〕37号)。

国家食品药品监管总局关于印发创新医疗器械特别审批程序(试行)的通知文章属性•【制定机关】国家食品药品监督管理总局(已撤销)•【公布日期】2014.02.07•【文号】食药监械管[2014]13号•【施行日期】2014.03.01•【效力等级】部门规范性文件•【时效性】失效•【主题分类】药政管理正文国家食品药品监管总局关于印发创新医疗器械特别审批程序(试行)的通知(食药监械管〔2014〕13号)各省、自治区、直辖市食品药品监督管理局:为了保障医疗器械的安全、有效,鼓励医疗器械的研究与创新,促进医疗器械新技术的推广和应用,推动医疗器械产业发展,总局组织制定了《创新医疗器械特别审批程序(试行)》,现印发给你们,请遵照执行。
国家食品药品监督管理总局2014年2月7日创新医疗器械特别审批程序(试行)第一条为了保障医疗器械的安全、有效,鼓励医疗器械的研究与创新,促进医疗器械新技术的推广和应用,推动医疗器械产业发展,根据《医疗器械监督管理条例》、《医疗器械注册管理办法》等法规和规章,制定本程序。
第二条食品药品监督管理部门对同时符合下列情形的医疗器械按本程序实施审评审批:(一)申请人经过其主导的技术创新活动,在中国依法拥有产品核心技术发明专利权,或者依法通过受让取得在中国发明专利权或其使用权;或者核心技术发明专利的申请已由国务院专利行政部门公开。
(二)产品主要工作原理/作用机理为国内首创,产品性能或者安全性与同类产品比较有根本性改进,技术上处于国际领先水平,并且具有显著的临床应用价值。
(三)申请人已完成产品的前期研究并具有基本定型产品,研究过程真实和受控,研究数据完整和可溯源。
第三条各级食品药品监督管理部门及相关技术机构,根据各自职责和本程序规定,按照早期介入、专人负责、科学审批的原则,在标准不降低、程序不减少的前提下,对创新医疗器械予以优先办理,并加强与申请人的沟通交流。
第四条申请人申请创新医疗器械特别审批,应当填写《创新医疗器械特别审批申请表》(见附件1),并提交支持拟申请产品符合本程序第二条要求的资料。

总局关于发布医疗器械审评沟通交流管理办法(试行)的通告(2017年第19号)2017年02月07日发布为贯彻实施《国务院关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号)、《创新医疗器械特别审批程序(试行)》(食药监械管〔2014〕13号)及《医疗器械优先审批程序》(国家食品药品监督管理总局公告2016年第168号),国家食品药品监督管理总局组织制定了《医疗器械审评沟通交流管理办法(试行)》(附件),现予发布。
特此通告。
附件:医疗器械审评沟通交流管理办法(试行)食品药品监管总局2017年2月3日2017年第19号通告附件.docx附件医疗器械审评沟通交流管理办法(试行)第一章总则第一条为贯彻落实医疗器械审评审批制度改革要求,鼓励医疗器械创新,保障医疗器械临床使用需求,加强国家食品药品监督管理总局医疗器械技术审评中心(以下简称器审中心)与申请人之间的沟通交流,依据《创新医疗器械特别审批程序(试行)》(食药监械管〔2014〕13号)和《医疗器械优先审批程序》(国家食品药品监督管理总局公告2016年第168号),制定本办法。
第二条本办法所指的沟通交流,系指创新医疗器械注册申请受理前、技术审评阶段和优先审批医疗器械注册申请技术审评阶段,经申请人提出,由器审中心与申请人就注册申请事项所进行的沟通交流。
第三条本办法中的创新医疗器械和优先审批医疗器械系指已同意按照《创新医疗器械特别审批程序(试行)》(食药监械管〔2014〕13号)审批的创新医疗器械和按照《医疗器械优先审批程序》(国家食品药品监督管理总局公告2016年第168号)审批的境内第三类和进口第二、三类医疗器械。
第二章沟通交流的形式第四条申请人需要对一般性技术问题进行核实或咨询时,可以通过器审中心技术审评咨询平台、电话、传真、邮件、信函等形式与器审中心审评部门(以下简称审评部门)进行沟通交流。
第五条适用于会议的沟通交流包括以下情形:(一)创新医疗器械在注册申请受理前召开的会议,主要包括讨论下列问题:1.重大技术问题;2.重大安全性问题;3.临床试验方案;4.阶段性临床试验结果的总结与评价;5.其他需要沟通交流的问题。

《用于罕见病防治医疗器械注册审查指导原则》(2018年第101号) ...国家食品药品监督管理总局医疗器械技术审批中心依据《创新医疗器械特别审批程序(试行)》(食药监械管〔2014〕13号),对申请优先审批的医疗器械注册申请进行审核。
诊断君根据CFDA和CMDE公示信息统计,自2014年3月1日办法实施以来,已纳入创新医疗器械特别审批产品共205个。
一、创新医疗器械及IVD产品分布注:红色为IVD,共45项(45/205=21.95%)。
二、创新医疗器械产品清单序号产品名称申请人法规1可吸收硬脑膜封合医用胶山东赛克赛斯药业科技有限公司2014年第1号2脑硬膜防渗医用涂敷系统北京赛奇科科技有限公司2014年第2号3具有无线程控功能的双通道植入式神经刺激系统苏州景昱医疗器械有限公司2014年第2号4左心耳封堵器系统先健科技(深圳)有限公司2014年第2号5经皮介入人工心脏瓣膜系统杭州启明医疗器械有限公司2014年第2号6生物型人工角膜广州优得清生物科技有限公司2014年第3号7组织工程人角膜内皮青岛宇明生物技术有限公司2014年第4号8可吸收药物冠脉支架系统先健科技(深圳)有限公司2014年第5号9肺动脉带瓣管道武汉亚心医疗科技有限公司2014年第5号10锥光束乳腺CT(科宁锥光束乳腺三维成像系统)科宁(天津)医疗设备有限公司2014年第5号11可降解镁骨内固定螺钉东莞宜安科技股份有限公司2014年第6号12胸骨板常州华森医疗器械有限公司2014年第6号13脱细胞角膜基质深圳艾尼尔角膜工程有限公司2014年第7号14具有精确标测肾交感神经功能的消融导管和神经刺激射频消融仪苏州信迈医疗器械有限公司2015年第1号15儿童型智能控制洗胃机天津市同业科技发展有限公司2015年第1号16药物洗脱外周球囊扩张导管北京先瑞达医疗科技有限公司2015年第2号17全吸收式生物血管支架系统Abbott Vascular2015年第2号18三维心脏电生理标测系统上海微创电生理医疗科技有限公司2015年第3号19三层仿生小口径人造血管三层仿生小口径人造血管2015年第3号20人工晶状体爱博诺德(北京)医疗科技有限公司2015年第3号21介入人工生物心脏瓣膜江苏苏州杰成医疗科技有限公司2015年第3号22三aPCS型角膜基质替代物青岛中皓生物工程有限公司2015年第4号23正电子发射断层成像装置明峰医疗系统股份有限公司2015年第4号24外科手术机器人定位系统北京天智航医疗科技股份有限公司2015年第4号25血管内动脉瘤密封系统(NELLIX? EndoVascular Aneurysm Sealing System) Endologix International Holdings B.V.2015年第5号26外科生物补片(膀胱、腹壁修补专用)上海松力生物技术有限公司2015年第5号27医用人工神经移植物江苏益通生物科技有限公司2015年第5号28腹主动脉覆膜支架系统北京华脉泰科医疗器械有限公司2015年第6号29分支型主动脉覆膜支架及输送系统(商品名:Castor)上海微创医疗器械(集团)有限公司2015年第6号30二尖瓣成形夹及导管输送系统Evalve, Inc. DBA Abbott Vascular Inc.2015年第7号31MicraTM经导管植入式无导线起搏系统Medtronic Inc.2015年第7号32迷走神经刺激系统北京品驰医疗设备有限公司2015年第8号33无框架脑立体定向手术系统北京柏惠维康科技有限公司2015年第8号34药物球囊扩张导管(商品名:ReewarmPTX)微创心脉医疗科技(上海)有限公司2015年第8号35折叠式人工玻璃体广州卫视博生物科技有限公司2015年第8号36植入型左心室辅助人工心脏重庆永仁心医疗器械有限公司2015年第8号37药物洗脱PTA球囊扩张导管浙江归创医疗器械有限公司2016年第1号38血管重建装置微创神通医疗科技(上海)有限公司2016年第1号39一次性可吸收钉皮下吻合器北京颐合恒瑞医疗科技有限公司2016年第1号40可变角双探头单光子发射计算机断层成像设备北京永新医疗设备有限公司2016年第1号41药物洗脱外周球囊导管先健科技(深圳)有限公司2016年第2号42用于管腔道、呼吸道检测的光学干涉断层成像系统广东永士达医疗科技有限公司2016年第2号43瓣膜成形环金仕生物科技(常熟)有限公司2016年第2号44钛合金髋关节镀膜球头中奥汇成科技股份有限公司2016年第2号45多孔钽骨填充材料重庆润泽医药有限公司2016年第2号46正电子发射及X射线计算机断层成像装置明峰医疗系统股份有限公司2016年第3号47无张力尿失禁悬吊系统深圳迈普再生医学科技有限公司2016年第3号48生物全降解冠脉雷帕霉素洗脱支架系统山东华安生物科技有限公司2016年第4号49生物可吸收雷帕霉素靶向洗脱冠脉支架系统上海微创医疗器械(集团)有限公司2016年第4号50心室辅助装置苏州同心医疗器械有限公司2016年第5号51髋关节假体系统北京固圣生物科技有限公司2016年第5号52全降解鼻窦药物支架系统浦易(上海)生物技术有限公司2016年第5号53肝脏储备功能检测仪武汉昊博科技有限公司2016年第5号54腔内肿瘤冷冻消融导管宁波胜杰康生物科技有限公司2016年第5号55骶神经刺激系统北京品驰医疗设备有限公司2016年第6号56具有心肺复苏质量监测功能的病人监护系统深圳迈瑞生物医疗电子股份有限公司2016年第7号57植入式心脏起搏器先健科技(深圳)有限公司2016年第7号58经导管主动脉人工瓣膜Boston Scientific Corporation2016年第7号59经导管主动脉瓣膜及输送系统上海微创医疗器械(集团)有限公司2016年第7号60卵圆孔未闭封堵器先健科技(深圳)有限公司2016年第7号61微孔灌注肾动脉消融导管心诺普医疗技术(北京)有限公司2016年第8号62分支型胸主动脉覆膜血管内支架系统W.L.GORE ASSOCIATES, INC.2016年第8号63主动脉瘤治疗用血层流调节支架及其血管造影控制输送系统CARDIATIS SA2016年第8号64动态血糖监测系统上海移宇科技有限公司2016年第9号65封堵器系统上海心瑞医疗科技有限公司2016年第9号66多电极肾动脉射频消融导管及多通道肾动脉射频消融仪上海安通医疗科技有限公司2016年第9号67骶神经刺激系统杭州承诺医疗科技有限公司2016年第10号68全降解聚合物基体药物(雷帕霉素)洗脱支架系统乐普(北京)医疗器械股份有限公司2016年第10号69血管内断层成像导管南京沃福曼医疗科技有限公司2016年第10号70无导线心脏起搏器及系统St.Jude Medical2016年第10号71脑血栓取出装置江苏尼科医疗器械有限公司2016年第11号72经导管主动脉瓣系统沛嘉医疗科技(苏州)有限公司2017年第1号73生物可吸收冠状动脉雷帕霉素洗脱支架系统上海百心安生物技术有限公司2017年第1号74介入术中磁共振系统上海爱立峰医疗科技有限公司2017年第1号75低能量脉冲式超声波治疗仪北京万孛力医疗器械有限公司2017年第1号76SPACO OMX6i 医用电子直线加速器广东中能加速器科技有限公司2017年第1号77低温冷冻手术系统(包含一次性使用无菌冷冻消融针)海杰亚(北京)医疗器械有限公司2017年第1号78皮肤光声显微成像仪广州佰奥廷电子科技有限公司2017年第1号79外周血管支架系统苏州茵络医疗器械有限公司2017年第1号80Cryofocus冷冻消融系统(包括冷冻消融设备、冷冻消融导管)康沣生物科技(上海)有限公司2017年第1号81冲击波治疗仪深圳市慧康精密仪器有限公司2017年第1号82左心耳封堵器系统杭州诺茂医疗科技有限公司2017年第1号83药物洗脱外周血管支架系统浙江归创医疗器械有限公司2017年第2号84氢氧气雾化机上海潓美医疗科技有限公司2017年第2号85神经外科机器人导航定位系统华科精准(北京)医疗科技有限公司2017年第2号86紫杉醇洗脱PTCA 球囊扩张导管紫杉醇洗脱PTCA球囊扩张导管2017年第2号87腹主动脉覆膜支架及输送系统微创心脉医疗科技(上海)有限公司2017年第2号88肾动脉射频消融导管上海微创电生理医疗科技股份有限公司2017年第2号89胶原蛋白软骨再生载体Ubiosis Co.Ltd2017年第2号90左心耳封堵器上海形状记忆合金材料有限公司2017年第3号91无菌心耳夹及输送系统北京迈迪顶峰医疗科技有限公司2017年第3号92低温等离子手术系统北京诺特斯科技有限公司2017年第4号93定量血流分数测量系统博动医学影像科技(上海)有限公司2017年第4号94吸附式血液透析系统美敦力医疗器械(成都)有限公司2017年第4号95正电子发射断层扫描及磁共振成像系统上海联影医疗科技有限公司2017年第4号96生物可吸收冠状动脉雷帕霉素洗脱支架系统北京阿迈特医疗器械有限公司2017年第4号97生物可吸收冠状动脉雷帕霉素洗脱支架系统深圳市信立泰生物医疗工程有限公司2017年第4号98近红外荧光成像系统北京数字精准医疗科技有限公司2017年第4号99外科手术封合剂杭州亚慧生物科技有限公司2017年第5号100IQQA-Guide三维影像术中导航系统医达极星医疗科技(苏州)有限公司2017年第6号101泌尿腔内碎石灌注吸引智能控压清石系统江西医为特科技有限公司2017年第6号102肾动脉交感神经多极射频消融导管系统Medtronic, Inc.2017年第6号103取栓支架珠海通桥医疗科技有限公司2017年第6号104用于阿片类药物成瘾患者防复吸治疗的植入式神经刺激系统苏州景昱医疗器械有限公司2017年第6号105生物可吸收冠状动脉雷帕霉素洗脱支架系统上海脉全医疗器械有限公司2017年第6号106左心耳封堵器系统上海普实医疗器械科技有限公司2017年第6号107髂动脉分叉支架系统先健科技(深圳)有限公司2017年第7号108直管型胸主动脉覆膜支架系统微创心脉医疗科技(上海)有限公司2017年第8号109植入式视网膜电刺激器深圳硅基仿生科技有限公司2017年第8号110心血管光学相干影像系统深圳市中科微光医疗器械技术有限公司2017年第8号111一次性可视内窥镜导管北京北方腾达科技发展有限公司2017年第8号112内窥镜手术器械操控系统山东威高手术机器人有限公司2017年第8号113心室辅助系统-植入式轴流血泵长治市久安人工心脏科技开发有限公司2017年第8号114压力感知磁定位灌注射频消融导管上海微创电生理医疗科技股份有限公司2017年第9号115胶原蛋白软骨再生载体康膝生物医疗(深圳)有限公司2017年第9号116内窥式光学相干断层成像系统南京微创医学科技股份有限公司2017年第10号117腹主动脉覆膜支架系统Lombard Medical, Ltd.2017年第10号118血管内断层成像系统南京沃福曼医疗科技有限公司2017年第10号119球囊扩张血管内覆膜支架系统W.L.Gore Associates, Inc.2017年第10号120神经套接管北京汇福康医疗技术股份有限公司2017年第10号121多极同步肺动脉射频消融导管无锡帕母医疗技术有限公司2017年第10号122医用直线加速器系统上海联影医疗科技有限公司2018年第1号123经导管心脏瓣膜及附件Edwards Lifesciences LLC2018年第1号124吻合口加固修补片北京博辉瑞进生物科技有限公司2018年第1号125全数字正电子发射及X射线断层成像扫描系统湖北锐世数字医学影像科技有限公司2018年第1号126复合陡脉冲治疗设备上海睿刀医疗科技有限公司2018年第2号127椎动脉雷帕霉素靶向洗脱支架系统微创神通医疗科技(上海)有限公司2018年第3号128消化道振动胶囊系统上海安翰医疗技术有限公司2018年第3号129单髁膝关节假体北京市春立正达医疗器械股份有限公司2018年第3号130定制个体化骨盆假体北京市春立正达医疗器械股份有限公司2018年第3号131可降解镁金属夹苏州奥芮济医疗科技有限公司2018年第3号132冠状动脉血流储备分数测量系统苏州润迈德医疗科技有限公司2018年第4号133经导管肺动脉瓣膜及输送系统北京迈迪顶峰医疗科技有限公司2018年第4号134冠状动脉生理功能评估软件北京昆仑医云科技有限公司2018年第4号135数字乳腺X射线摄影系统上海联影医疗科技有限公司2018年第4号136血管内成像系统全景恒升(北京)科学技术有限公司2018年第6号137三维多通道射频消融球囊导管Biosense Webster(Israel)Ltd.2018年第6号138经导管植入式主动脉瓣膜系统Medtronic CoreValve LLC2018年第6号139压力感应消融导管湖南埃普特医疗器械有限公司2018年第6号140植入式磁液悬浮心室辅助装置航天泰心科技有限公司2018年第7号141记忆合金腕关节固定器兰州西脉记忆合金股份有限公司2018年第7号142含镁可降解高分子骨修复材料深圳中科精诚医学科技有限公司2018年第7号143分支型术中支架系统微创心脉医疗科技(上海)有限公司2018年第8号144生物疝修补补片卓阮医疗科技(苏州)有限公司2018年第8号145锚定球囊扩张导管湖南埃普特医疗器械有限公司2018年第9号146血管内成像导管全景恒升(北京)科学技术有限公司2018年第10号147植入式脊髓刺激系统北京品驰医疗设备有限公司2018年第11号148混合闭环胰岛素泵MEDTRONIC MINIMED2018年第11号149人工角膜北京米赫医疗器械有限责任公司2018年第11号150调强放射治疗计划系统中科超精(安徽)科技有限公司2018年第12号151髂静脉支架系统苏州天鸿盛捷医疗器械有限公司2018年第12号152X射线立体定向放射外科治疗系统Zap Surgical Systems,Inc.2018年第12号153球形聚焦超声组织消融系统重庆海扶医疗科技股份有限公司2018年第13号154经导管主动脉瓣膜及可回收输送系统上海微创心通医疗科技有限公司2018年第13号155生物可吸收镁合金压缩螺钉Syntellix AG2018年第14号156肿瘤温敏栓塞剂江苏申命医疗科技有限公司2018年第15号157西罗莫司洗脱生物可吸收血管支架系统Meril Life Sciences Pvt.Ltd.2018年第15号158全降解聚合物雷帕霉素洗脱支架系统四川兴泰普乐医疗科技有限公司2018年第15号159外周支架系统先健科技(深圳)有限公司2018年第15号160经导管人工三尖瓣瓣膜宁波健世生物科技有限公司2018年第15号三、创新IVD产品清单序号产品名称申请人法规121三体、18三体和13三体检测试剂盒中山大学达安基因股份有限公司2014年第2号2基因测序仪深圳华因康基因科技有限公司2014年第2号3大肠癌甲基化基因检测试剂盒(PCR荧光探针法)博尔诚(北京)科技有限公司2014年第5号4MTHFR C677T基因检测试剂盒(PCR-金磁微粒层析法)西安金磁纳米生物技术有限公司2014年第7号5恒温扩增微流控芯片核酸分析仪博奥生物集团有限公司2015年第1号6SMN1基因外显子缺失检测试剂盒(荧光定量PCR法)上海五色石医学研究有限公司2015年第2号7红细胞寿命测定仪深圳市先亚生物科技有限公司2015年第4号8呼吸道病原菌核酸检测试剂盒(恒温扩增芯片法)博奥生物集团有限公司2015年第6号9人EGFR基因突变检测试剂盒(高通量测序法)深圳华因康基因科技有限公司2015年第6号10二十项耳聋相关基因检测试剂盒(微阵列芯片-飞行时间质谱法)北京毅新博创生物科技有限公司2015年第8号11胚胎植入前染色体非整倍体检测试剂盒(半导体测序法)苏州贝康医疗器械有限公司2016年第4号12miR-92a基因表达水平检测试剂盒(荧光RT-PCR 法)深圳市晋百慧生物有限公司2016年第5号13植入前胚胎染色体非整倍体检测试剂盒(可逆末端终止测序法)杭州贝瑞和康基因诊断技术有限公司2016年第7号14人乳腺癌分子分型定量检测试剂盒(PCR-荧光探针法)BioNTech Diagnostics GmbH2016年第7号15丙型肝炎病毒核酸定量检测试剂盒(PCR-荧光探针“磁珠-管法”)北京纳捷诊断试剂有限公司2016年第7号16胚胎植入前染色体非整倍体检测试剂盒(可逆末端终止测序法)北京中仪康卫医疗器械有限公司2016年第7号17人EGFR/ALK/BRAF/KRAS基因突变联合检测试剂盒(杂交捕获测序法)广州燃石医学检验所有限公司2016年第8号18全自动化学发光免疫分析仪北京联众泰克科技有限公司2016年第10号19恒温扩增多段磁导核酸分析仪杭州优思达生物技术有限公司2016年第10号20活化CD4细胞三磷酸腺苷(ATP)检测试剂盒(化学发光法)上海云泽生物科技有限公司2016年第10号21人类SDC2基因甲基化检测试剂盒(荧光PCR法)广州市康立明生物科技有限责任公司2017年第2号22GNAS基因突变检测试剂盒天津精耐特基因生物技术有限公司2017年第2号23人类EGFR基因突变检测试剂盒(多重荧光PCR法)厦门艾德生物医药科技股份有限公司2017年第2号24人类癌症多基因突变联合检测试剂盒(可逆末端终止测序法)厦门艾德生物医药科技股份有限公司2017年第2号25肺癌靶向药物基因突变检测试剂盒(高通量测序法)南京世和医疗器械有限公司2017年第3号26芯片式数字聚合酶链式反应(DPCR)分析系统南京科维思生物科技股份有限公司2017年第3号27生化免疫定量分析系统基蛋生物科技股份有限公司2017年第3号28人EGFR、KRAS、BRAF、PIK3CA、ALK、ROS1基因突变检测试剂盒(半导体测序法)天津诺禾致源生物信息科技有限公司2017年第3号29胃癌甲基化基因检测试剂盒(PCR荧光探针法博尔诚(北京)科技有限公司2017年第3号30新生儿总半乳糖测定试剂盒(荧光分析法)广州市丰华生物工程有限公司2017年第3号31胚胎植入前染色体非整倍体检测试剂盒(半导体测序法)序康医疗科技(苏州)有限公司2017年第5号32人类肿瘤多基因变异检测试剂盒(半导体测序法)厦门飞朔生物技术有限公司2017年第8号33无创血糖仪北京三联永汇医疗科技有限公司2017年第9号34胚胎植入前染色体非整倍体检测试剂盒(联合探针锚定聚合测序法)华大生物科技(武汉)有限公司2017年第10号35脑炎/脑膜炎多重病原体核酸联合检测试剂盒(封闭巢式多重PCR熔解曲线法)BioFire Diagnostics, LLC2018年第2号36细粒棘球蚴和多房棘球蚴核酸检测试剂盒(PCR-荧光探针法)青海知光精准医学科技有限公司2018年第3号37人EGFR基因T790M突变检测试剂盒(数字PCR 法)天津诺禾致源生物信息科技有限公司2018年第3号38幽门螺杆菌23S rRNA基因突变检测试剂盒(PCR-荧光探针法)上海芯超生物科技有限公司2018年第4号39KRAS基因突变及BMP3/NDRG4基因甲基化和便隐血联合检测试剂盒(PCR荧光探针法-胶体金法)杭州诺辉健康科技有限公司2018年第5号40寡糖链检测试剂盒(荧光毛细管电泳法)江苏先思达生物科技有限公司2018年第7号41BRCA1/2基因突变检测试剂盒(联合探针锚定聚合测序法)华大生物科技(武汉)有限公司2018年第7号42乙型肝炎病毒表面抗原(HBsAg)检测试剂盒(化学发光法)富士瑞必欧株式会社2018年第8号43肿瘤特异性蛋白70检测试剂盒(酶联免疫法)江苏科德生物医药科技有限公司2018年第12号44高危型人乳头瘤病毒(HPV)E6/E7mRNA 检测试剂盒(支链DNA信号扩增法)郑州科蒂亚生物技术有限公司2018年第13号45微卫星不稳定性(MSI)检测试剂盒(荧光PCR-毛细管电泳法)上海普洛麦格生物产品有限公司2018年第13号四、创新医疗器械及IVD产品清单序号产品名称申请人法规1可吸收硬脑膜封合医用胶山东赛克赛斯药业科技有限公司2014年第1号2脑硬膜防渗医用涂敷系统北京赛奇科科技有限公司2014年第2号321三体、18三体和13三体检测试剂盒中山大学达安基因股份有限公司2014年第2号4基因测序仪深圳华因康基因科技有限公司2014年第2号5具有无线程控功能的双通道植入式神经刺激系统苏州景昱医疗器械有限公司2014年第2号6左心耳封堵器系统先健科技(深圳)有限公司2014年第2号7经皮介入人工心脏瓣膜系统杭州启明医疗器械有限公司2014年第2号8生物型人工角膜广州优得清生物科技有限公司2014年第3号9组织工程人角膜内皮青岛宇明生物技术有限公司2014年第4号10可吸收药物冠脉支架系统先健科技(深圳)有限公司2014年第5号11肺动脉带瓣管道武汉亚心医疗科技有限公司2014年第5号12锥光束乳腺CT(科宁锥光束乳腺三维成像系统)科宁(天津)医疗设备有限公司2014年第5号13大肠癌甲基化基因检测试剂盒(PCR荧光探针法)博尔诚(北京)科技有限公司2014年第5号14可降解镁骨内固定螺钉东莞宜安科技股份有限公司2014年第6号15胸骨板常州华森医疗器械有限公司2014年第6号16MTHFR C677T基因检测试剂盒(PCR-金磁微粒层析法)西安金磁纳米生物技术有限公司2014年第7号17脱细胞角膜基质深圳艾尼尔角膜工程有限公司2014年第7号18具有精确标测肾交感神经功能的消融导管和神经刺激射频消融仪苏州信迈医疗器械有限公司2015年第1号19恒温扩增微流控芯片核酸分析仪博奥生物集团有限公司2015年第1号20儿童型智能控制洗胃机天津市同业科技发展有限公司2015年第1号21药物洗脱外周球囊扩张导管北京先瑞达医疗科技有限公司2015年第2号22SMN1基因外显子缺失检测试剂盒(荧光定量PCR法)上海五色石医学研究有限公司2015年第2号23全吸收式生物血管支架系统Abbott Vascular2015年第2号24三维心脏电生理标测系统上海微创电生理医疗科技有限公司2015年第3号25三层仿生小口径人造血管三层仿生小口径人造血管2015年第3号26人工晶状体爱博诺德(北京)医疗科技有限公司2015年第3号27介入人工生物心脏瓣膜江苏苏州杰成医疗科技有限公司2015年第3号28三aPCS型角膜基质替代物青岛中皓生物工程有限公司2015年第4号29正电子发射断层成像装置明峰医疗系统股份有限公司2015年第4号30红细胞寿命测定仪深圳市先亚生物科技有限公司2015年第4号31外科手术机器人定位系统北京天智航医疗科技股份有限公司2015年第4号32血管内动脉瘤密封系统(NELLIX? EndoVascular Aneurysm Sealing System) Endologix International Holdings B.V.2015年第5号33外科生物补片(膀胱、腹壁修补专用)上海松力生物技术有限公司2015年第5号34医用人工神经移植物江苏益通生物科技有限公司2015年第5号35呼吸道病原菌核酸检测试剂盒(恒温扩增芯片法)博奥生物集团有限公司2015年第6号36人EGFR基因突变检测试剂盒(高通量测序法)深圳华因康基因科技有限公司2015年第6号37腹主动脉覆膜支架系统北京华脉泰科医疗器械有限公司2015年第6号38分支型主动脉覆膜支架及输送系统(商品名:Castor)上海微创医疗器械(集团)有限公司2015年第6号39二尖瓣成形夹及导管输送系统Evalve, Inc. DBA Abbott Vascular Inc.2015年第7号40MicraTM经导管植入式无导线起搏系统Medtronic Inc.2015年第7号41二十项耳聋相关基因检测试剂盒(微阵列芯片-飞行时间质谱法)北京毅新博创生物科技有限公司2015年第8号42迷走神经刺激系统北京品驰医疗设备有限公司2015年第8号43无框架脑立体定向手术系统北京柏惠维康科技有限公司2015年第8号44药物球囊扩张导管(商品名:ReewarmPTX)微创心脉医疗科技(上海)有限公司2015年第8号45折叠式人工玻璃体广州卫视博生物科技有限公司2015年第8号46植入型左心室辅助人工心脏重庆永仁心医疗器械有限公司2015年第8号47药物洗脱PTA球囊扩张导管浙江归创医疗器械有限公司2016年第1号48血管重建装置微创神通医疗科技(上海)有限公司2016年第1号49一次性可吸收钉皮下吻合器北京颐合恒瑞医疗科技有限公司2016年第1号50可变角双探头单光子发射计算机断层成像设备北京永新医疗设备有限公司2016年第1号51药物洗脱外周球囊导管先健科技(深圳)有限公司2016年第2号52用于管腔道、呼吸道检测的光学干涉断层成像系统广东永士达医疗科技有限公司2016年第2号53瓣膜成形环金仕生物科技(常熟)有限公司2016年第2号54钛合金髋关节镀膜球头中奥汇成科技股份有限公司2016年第2号55多孔钽骨填充材料重庆润泽医药有限公司2016年第2号56正电子发射及X射线计算机断层成像装置明峰医疗系统股份有限公司2016年第3号57无张力尿失禁悬吊系统深圳迈普再生医学。

2014年1.国家食品药品监督管理总局关于发布医疗器械生产质量管理规范的公告(2014年第64号)/WS01/CL0087/111642.html2.《国家食品药品监督管理总局关于施行医疗器械经营质量管理规范的公告》(2014年第58号)/WS01/CL1294/110920.html3.关于医疗器械(含体外诊断试剂)注册申报有关问题的公告(2014年第129号)/WS01/CL0068/109780.html4.食品药品监管总局关于印发国家重点监管医疗器械目录的通知食药监械监〔2014〕235号/WS01/CL0845/107405.html5.食品药品监管总局关于印发医疗器械生产企业分类分级监督管理规定的通知食药监械监〔2014〕234号/WS01/CL0845/107404.html6.国家食品药品监督管理总局关于发布禁止委托生产医疗器械目录的通告(2014年第18号)/WS01/CL0087/107065.html7.食品药品监管总局办公厅关于实施第一类医疗器械备案有关事项的通知食药监办械管〔2014〕174号/WS01/CL0845/106435.html8.食品药品监管总局关于印发境内第二类医疗器械注册审批操作规范的通知食药监械管〔2014〕209号/WS01/CL0845/106258.html9.食品药品监管总局关于印发境内第三类和进口医疗器械注册审批操作规范的通知食药监械管〔2014〕208号/WS01/CL0845/106257.html10.国家食品药品监督管理总局关于发布体外诊断试剂说明书编写指导原则的通告(2014年第17号)/WS01/CL0087/106242.html11.国家食品药品监督管理总局关于发布体外诊断试剂临床试验技术指导原则的通告(2014年第16号)/WS01/CL0087/106241.html12.国家食品药品监督管理总局关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告(2014年第44号)/WS01/CL0087/106096.html13.国家食品药品监督管理总局关于公布医疗器械注册申报资料要求和批准证明文件格式的公告(2014年第43号)/WS01/CL0087/106095.html14.国家食品药品监督管理总局关于医疗器械生产质量管理规范执行有关事宜的通告(2014年第15号)/WS01/CL0087/106114.html15.国家食品药品监督管理总局关于发布需进行临床试验审批的第三类医疗器械目录的通告(2014年第14号)/WS01/CL0087/105374.html16.食品药品监管总局关于印发医疗器械检验机构开展医疗器械产品技术要求预评价工作规定的通知(食药监械管〔2014〕192号)/WS01/CL0845/105194.html17.国家食品药品监督管理总局关于发布免于进行临床试验的第三类医疗器械目录的通告(2014年第13号)/WS01/CL0087/105225.html18.国家食品药品监督管理总局关于发布免于进行临床试验的第二类医疗器械目录的通告(2014年第12号)/WS01/CL0087/105224.html19.食品药品监管总局关于实施《医疗器械注册管理办法》和《体外诊断试剂注册管理办法》有关事项的通知(食药监械管〔2014〕144号)/WS01/CL0845/103802.html20.食品药品监管总局关于实施《医疗器械生产监督管理办法》和《医疗器械经营监督管理办法》有关事项的通知(食药监械监〔2014〕143号)/WS01/CL0845/103801.html21.《医疗器械说明书和标签管理规定》(总局令第6号)/WS01/CL0053/103758.html22.《体外诊断试剂注册管理办法》(总局令第5号)/WS01/CL0053/103757.html23.《医疗器械注册管理办法》(总局令第4号)/WS01/CL0053/103756.html24.国家食品药品监督管理总局关于发布医疗器械产品技术要求编写指导原则的通告(2014年第9号)/WS01/CL0087/100814.html25.国家食品药品监督管理总局关于发布第一类医疗器械产品目录的通告(2014年第8号)/WS01/CL0087/100815.html26.国家食品药品监督管理总局关于第一类医疗器械备案有关事项的公告(2014年第26号)/WS01/CL0087/100816.html27.国家食品药品监督管理总局关于医疗器械生产经营备案有关事宜的公告(2014年第25号)/WS01/CL0087/100800.html28.国家食品药品监督管理总局关于贯彻实施《医疗器械监督管理条例》有关事项的公告(2014年第23号)/WS01/CL0087/100480.html29.《医疗器械监督管理条例》(国务院令第650号)/WS01/CL0784/97814.html30.总局关于印发创新医疗器械特别审批程序(试行)的通知(食药监械管〔2014〕13号)/WS01/CL0845/96654.html2015年1.《医疗器械通用名称命名规则》(总局令第19号)/WS01/CL0053/139000.html2.国家食品药品监督管理总局关于发布医疗器械注册指定检验工作管理规定的通告(2015年第94号)/WS01/CL0087/136660.html3.国家食品药品监督管理总局关于发布医疗器械注册证补办程序等5个相关程序的通告(2015年第91号)/WS01/CL0087/135860.html4.国家食品药品监督管理总局关于规范含银盐医疗器械注册管理有关事宜的公告(2015年第225号)/WS01/CL0087/134580.html5.食品药品监管总局关于执行医疗器械和体外诊断试剂注册管理办法有关问题的的通知(食药监械管〔2015〕247号)/WS01/CL0845/134021.html6.国家食品药品监督管理总局关于境内医疗器械生产企业跨省新开办企业时办理产品注册及生产许可有关事宜的公告(2015年第203号)/WS01/CL0087/133069.html7.《医疗器械使用质量监督管理办法》(总局令第18号)/WS01/CL0053/132880.html8.食品药品监管总局关于印发医疗器械医疗器械生产质量管理规范现场检查指导原则等4个指导原则的通知(食药监械监〔2015〕218号)/WS01/CL0845/130869.html9.关于体外诊断试剂临床试验机构盖章有关事宜的公告(2015年第154号)/WS01/CL0068/128860.html10.《医疗器械分类规则》(总局令第15号)/WS01/CL0053/124222.html11.国家食品药品监督管理总局关于发布医疗器械生产质量管理规范附录体外诊断试剂的公告(2015年第103号)/WS01/CL0087/124119.html12.国家食品药品监督管理总局关于发布医疗器械生产质量管理规范附录植入性医疗器械的公告(2015年第102号)/WS01/CL0087/124118.html13.国家食品药品监督管理总局关于发布医疗器械生产质量管理规范附录无菌医疗器械的公告(2015年第101号)/WS01/CL0087/124117.html14.国家食品药品监督管理总局关于发布医疗器械临床试验备案有关事宜的公告(2015年第87号)/WS01/CL0087/123460.html15.食品药品监管总局关于印发境内第三类医疗器械注册质量管理体系核查工作程序(暂行)的通知(食药监械管〔2015〕63号)/WS01/CL0845/121049.html16.《国家食品药品监督管理总局关于发布药品、医疗器械产品注册收费标准的公告》(2015年第53号)/WS01/CL1294/120201.html17.国家食品药品监督管理总局关于发布医疗器械临床评价技术指导原则的通告(2015年第14号)/WS01/CL0087/119643.html18.国家食品药品监督管理总局关于发布医疗器械生产企业供应商审核指南的通告(2015年第1号)/WS01/CL0087/112629.html2016年1.总局关于发布医疗器械生产企业质量控制与成品放行指南的通告(2016年第173号)/WS01/CL1294/168287.html2.总局关于发布医疗器械优先审批程序的公告(2016年第168号)/WS01/CL0087/165582.html3.总局关于发布第二批免于进行临床试验医疗器械目录的通告(2016年第133号)/WS01/CL0087/164956.html4.总局办公厅关于体外诊断试剂说明书文字性变更有关问题的通知(食药监办械管〔2016〕117号)/WS01/CL0845/161645.html5.总局办公厅关于贯彻实施《医疗器械临床试验质量管理规范》的通知(食药监办械管〔2016〕41号)/WS01/CL0845/149540.html6.总局关于实施《医疗器械通用名称命名规则》有关事项的通知(食药监械管〔2016〕35号)/WS01/CL0845/148881.html7.《医疗器械临床试验质量管理规范》(总局、卫计委令第25号)/WS01/CL0053/148101.html8.总局关于发布《医疗器械临床试验伦理审查申请与审批表范本》等六个文件的通告(2016年第58号)/WS01/CL0087/148126.html9.总局办公厅关于医疗器械产品技术要求有关问题的通知(食药监办械管〔2016〕22号)/WS01/CL0845/145601.html10.总局关于第三类医疗器械生产企业实施医疗器械生产质量管理规范有关事宜的通告(2016年第19号)/WS01/CL1294/144100.html2017年1.总局办公厅关于做好医疗器械检验有关工作的通知(食药监办械管〔2017〕187号)/WS01/CL0845/221407.html2.总局关于过敏原类、流式细胞仪配套用、免疫组化和原位杂交类体外诊断试剂产品属性及类别调整的通告(2017年第226号)/WS01/CL1294/220850.html3.《医疗器械网络销售监督管理办法》(总局令第38号)/WS01/CL1101/220098.html4.国家食品药品监督管理总局国家卫生和计划生育委员会关于发布医疗器械临床试验机构条件和备案管理办法的公告(2017年第145号)/WS01/CL0087/217367.html5.总局办公厅关于做好医疗器械临床试验机构备案工作的通知(食药监办械管〔2017〕161号)/WS01/CL0845/217380.html6.《医疗器械经营监督管理办法》(总局令第8号)(2017-11-21修订)/WS01/CL0053/217162.html7.《医疗器械生产监督管理办法》(总局令第7号)(2017-11-21修订)/WS01/CL1101/217161.html8.总局关于需审批的医疗器械临床试验申请沟通交流有关事项的通告(2017年第184号)/WS01/CL0087/216841.html9.总局关于进口医疗器械注册申请人和备案人名称使用中文的公告(2017年第131号)/WS01/CL0087/216229.html10.总局关于医疗器械经营备案有关事宜的公告(2017年第129号)/WS01/CL0050/216296.html11.总局办公厅关于规范医疗器械产品分类有关工作的通知(食药监办械管〔2017〕127号)/WS01/CL0845/177958.html12.总局关于发布聚氯乙烯输液输血器具中荧光物质识别及定量补充检验方法的公告(2017年第110号)/WS01/CL1294/177496.html13.总局关于实施《医疗器械分类目录》有关事项的通告(2017年第143号)/WS01/CL0087/177087.html14.总局关于发布医疗器械分类目录的公告(2017年第104号)/WS01/CL0087/177089.html15.总局办公厅关于印发2017年医疗器械行业标准制修订项目的通知(食药监办械管〔2017〕94号)/WS01/CL0845/174746.html16.总局关于贯彻实施《国务院关于修改〈医疗器械监督管理条例〉的决定》有关事项的公告(2017年第78号)/WS01/CL0087/174096.html17.《医疗器械标准管理办法》(总局令第33号)/WS01/CL0053/172049.html18.总局办公厅关于印发国家食品药品监督管理总局医疗器械分类技术委员会工作规则的通知(食药监办械管〔2017〕56号)/WS01/CL0845/171682.html19.《国家食品药品监督管理总局关于调整部分医疗器械行政审批事项审批程序的决定》(总局令第32号)/WS01/CL0053/171404.html20.总局关于成立医疗器械分类技术委员会专业组的通知(食药监械管〔2017〕27号)/WS01/CL0845/171324.html21.总局关于发布医疗器械技术审评专家咨询委员会管理办法的公告(2017年第36号)/WS01/CL0087/171212.html22.总局关于发布医疗器械优先审批申报资料编写指南(试行)的通告(2017年第28号)/WS01/CL0087/169620.html23.《体外诊断试剂注册管理办法修正案》(总局令第30号)/WS01/CL0053/169364.html24.《医疗器械召回管理办法》(总局令第29号)/WS01/CL0053/169345.html25.总局关于发布医疗器械审评沟通交流管理办法(试行)的通告(2017年第19号)/WS01/CL0087/169361.html2018年(截至5月7日)1. 总局办公厅关于实施《医疗器械网络销售监督管理办法》有关事项的通知(食药监办械监〔2018〕31号)/WS01/CL0050/225541.html2. 关于发布《自行取消进口第一类医疗器械备案工作程序》的公告(第206号)/WS01/CL0068/224399.html3. 国家药品监督管理局办公室关于公开征求《创新医疗器械特别审批程序(修订稿征求意见稿)》的意见/WS04/CL2051/227922.html。
附件1创新医疗器械特别审批程序(试行)(征求意见稿)第一条为鼓励医疗器械的研究与创新,促进自主创新医疗器械产业发展,根据《医疗器械监督管理条例》、《医疗器械注册管理办法》等法规和规章,制定本程序。
第二条食品药品监督管理部门对同时符合下列情形的医疗器械按本程序实施审评审批:(一)申请人具有产品核心技术的自主知识产权,权益状况明确。
申请人具有自主知识产权是指,申请人经过其主导的技术创新活动,在我国依法拥有发明专利的所有权,或依法通过受让取得在我国发明专利的所有权或使用权。
(二)产品主要工作原理/作用机理为国内首创,产品性能或安全性与同类产品比较有根本性改进,技术上处于国际领先水平,并且具有显著的临床应用价值。
(三)申请人已完成产品的前期研究并具有基本定型产品,研究过程真实和受控,研究数据完整和可溯源。
(四)申请人为中国境内的企业法人,产品在中国境内生产,并具有医疗器械生产企业许可证。
第三条各级食品药品监督管理部门及相关技术机构,根据各自职责和本程序规定,按照早期介入、专人负责、科学审批的原则,在标准不降低、程序不减少的前提下,对创新医疗器械予以优先办理,并加强与申请人的沟通交流。
第四条申请人申请创新医疗器械特别审批,应当填写《创新医疗器械特别审批申请表》(见附件1),并提交支持拟申请产品符合本程序第二条要求的资料。
资料应当包括:(一)申请人企业法人资格证明文件。
(二)医疗器械生产企业许可证。
(三)产品知识产权情况及证明文件。
(四)产品研发过程及结果的综述。
(五)产品技术文件,至少应包括:1. 产品的预期用途;2. 产品工作原理/作用机理;3. 产品主要技术指标及确定依据,主要原材料、关键元器件的指标要求,主要生产工艺过程及流程图,主要技术指标的检验方法。
(六)产品创新的证明性文件,至少应包括:1. 国家级信息或专利检索机构出具的查新报告;2. 核心刊物公开发表的能够充分说明产品临床应用价值的学术论文、专著及文件综述;3. 与产品主要技术相关的发明专利说明书;4. 国内外已上市同类产品应用情况的分析;5. 产品的创新内容及在临床应用的显著价值。
山东省创新医疗器械特别审批办法(征求意见稿)第一条为了鼓励医疗器械的研究与创新,促进医疗器械新技术的推广和应用,推动医疗器械产业发展,保障医疗器械的安全、有效,根据《医疗器械监督管理条例》(国务院令第650号)、《医疗器械注册管理办法》(国家食品药品监督管理总局令第4号)和《创新医疗器械特别审批程序(试行)》(食药监械管〔2014〕13号)等法规规章和有关规定,制定本办法。
第二条山东省境内创新医疗器械特别审批的申请初审、第二类创新医疗器械的技术审评、检验检测和注册审批、第一类创新医疗器械备案等活动,应当遵守本办法。
第三条创新医疗器械的注册、备案,在标准不降低、程序不减少的前提下,应当优先安排注册检验、体系核查、技术审评、行政审批和备案。
第四条省食品药品监督管理局(以下简称省局)负责创新医疗器械特别审批申请的初审,报国家食品药品监督管理总局(以下简称国家总局)审定并确定类别。
第五条省局负责第二类创新医疗器械注册审批。
设区的市食品药品监督管理局(以下简称市局)负责第一类创新医疗器械备案。
第六条对同时符合下列情形的,申请人可按照本规定申请创新医疗器械特别审批:(一)申请人经过其主导的技术创新活动,在中国依法拥有产品核心技术发明专利权,或者依法通过受让取得在中国发明专利权或其使用权,或者核心技术发明专利的申请已由国务院专利行政部门公开。
(二)产品主要工作原理或作用机理为国内首创,产品性能或者安全性与同类产品比较有根本性改进,技术上处于国际领先水平,并且具有显著的临床应用价值。
(三)申请人已完成产品的前期研究并具有基本定型产品,研究过程真实和受控,研究数据完整和可溯源。
第七条申请人应当填写《创新医疗器械特别审批申请表》(见附件1),向省局提出申请,并提交以下资料:(一)申请人企业法人资格证明文件。
(二)产品知识产权情况及证明文件。
(三)产品研发过程及结果的综述。
(四)产品技术文件。
至少应当包括:产品的预期用途、产品工作原理或作用机理、产品主要技术指标及确定依据、主要原材料和关键元器件的指标要求、主要生产工艺过程及流程图、主要技术指标的检验方法。
国家创新医疗器械特别审查程序国家创新医疗器械特别审查程序1. 背景介绍国家创新医疗器械特别审查程序,是指国家食品药品监督管理局为了鼓励和支持医疗器械创新,在确保产品安全和有效的前提下,为符合条件的医疗器械产品提供一种特殊审评通道,用于加快创新医疗器械的上市审评进度,减少审评周期。
2. 程序设立的必要性国家创新医疗器械特别审查程序的设立,是因为传统医疗器械审评流程存在审评周期长、费用高等问题,这对于创新医疗器械的研发和上市产生了一定的阻碍。
为了鼓励企业加大医疗器械研发投入,加快创新医疗器械产品的研发进程,国家食品药品监督管理局设立了国家创新医疗器械特别审查程序。
3. 程序的具体作用和意义国家创新医疗器械特别审查程序的设立,可以更加精准地满足创新医疗器械产品的审评需求,加速创新医疗器械产品的上市进程,促进医疗器械行业的创新发展。
通过提高医疗器械研发的效率,还可以更快地满足患者和医疗机构对于新型医疗器械产品的需求。
4. 程序的申报条件和流程申报国家创新医疗器械特别审查程序需要符合一定的条件,例如医疗器械产品具有明显的创新特点,在临床上具有重要的临床应用效果等。
而申报的流程则需要企业按照国家食品药品监督管理局相关规定提交相关材料,经过专家评审后确定是否符合国家创新医疗器械特别审查程序的条件。
5. 个人观点和理解国家创新医疗器械特别审查程序的设立,对于医疗器械行业的发展具有积极的促进作用。
通过加快创新医疗器械产品的上市进程,可以大大刺激企业增加医疗器械研发投入,推动医疗器械行业技术创新和产品升级。
也能够更快地让患者受益于新型医疗器械产品,提高医疗服务质量和水平。
总结回顾国家创新医疗器械特别审查程序的设立,是国家食品药品监督管理局为了促进医疗器械行业创新发展而采取的一项重要举措。
通过提供更加快速、精准的审评通道,在保证医疗器械产品安全和有效的前提下,加速创新医疗器械产品的上市审评进度,从而推动医疗器械行业的技术创新和产品更新换代。
创新医疗器械特别审批程序(试行)
食药监械管〔2014〕13号
2014-02-07
第一条为了保障医疗器械的安全、有效,鼓励医疗器械的研究与创新,促进医疗器械新技术的推广和应用,推动医疗器械产业发展,根据《医疗器械监督管理条例》、《医疗器械注册管理办法》等法规和规章,制定本程序。
第二条食品药品监督管理部门对同时符合下列情形的医疗器械按本程序实施审评审批:
(一)申请人经过其技术创新活动,在中国依法拥有产品核心技术发明专利权,或者依法通过受让取得在中国发明专利权或其使用权;或者核心技术发明专利的申请已由国务院专利行政部门公开。
(二)产品主要工作原理/作用机理为国内首创,产品性能或者安全性与同类产品比较有根本性改进,技术上处于国际领先水平,并且具有显著的临床应用价值。
(三)申请人已完成产品的前期研究并具有基本定型产品,研究过程真实和受控,研究数据完整和可溯源。
第三条各级食品药品监督管理部门及相关技术机构,根据各自职责和本程序规定,按照早期介入、专人负责、科学审批的原
则,在标准不降低、程序不减少的前提下,对创新医疗器械予以优先办理,并加强与申请人的沟通交流。
第四条申请人申请创新医疗器械特别审批,应当填写《创新医疗器械特别审批申请表》(见附件1),并提交支持拟申请产品符合本程序第二条要求的资料。
资料应当包括:
(一)申请人企业法人资格证明文件。
(二)产品知识产权情况及证明文件。
(三)产品研发过程及结果的综述。
(四)产品技术文件,至少应当包括:
1.产品的预期用途;
2.产品工作原理/作用机理;
3.产品主要技术指标及确定依据,主要原材料、关键元器件的指标要求,主要生产工艺过程及流程图,主要技术指标的检验方法。
(五)产品创新的证明性文件,至少应当包括:
1.信息或者专利检索机构出具的查新报告;
2.核心刊物公开发表的能够充分说明产品临床应用价值的学术论文、专著及文件综述;
3.国内外已上市同类产品应用情况的分析及对比(如有);
4.产品的创新内容及在临床应用的显著价值。
(六)产品安全风险管理报告。
(七)产品说明书(样稿)。
(八)其他证明产品符合本程序第二条的资料。
(九)境外申请人应当委托中国境内的企业法人作为代理人或者由其在中国境内的办事机构提出申请,并提交以下文件:
1.境外申请人委托代理人或者其在中国境内办事机构办理创新医疗器械特别审批申请的委托书;
2.代理人或者申请人在中国境内办事机构的承诺书;
3.代理人营业执照或者申请人在中国境内办事机构的机构登记证明。
(十)所提交资料真实性的自我保证声明。
申报资料应当使用中文。
原文为外文的,应当有中文译本。
第五条境内申请人应当向其所在地的省级食品药品监督管理部门提出创新医疗器械特别审批申请。
省级食品药品监督管理部门对申报项目是否符合本程序第二条要求进行初审,并于20个工作日内出具初审意见。
经初审不符合第二条要求的,省级食品药品监督管理部门应当通知申请人;符合第二条要求的,省级食品药品监督管理部门将申报资料和初审意见一并报送国家食品药品监督管理总局(以下简称食品药品监管总局)行政受理服务中心。
境外申请人应当向食品药品监管总局提出创新医疗器械特别审
批申请,食品药品监管总局行政受理服务中心对申报资料进行形式审查,对符合本程序第四条规定的形式要求的予以受理。
第六条食品药品监管总局行政受理服务中心对受理的特别审批申请,给予产品特别审批申请受理编号,受理编号编排方式为:械1-21为申请的年份;×2为产品流水号。
第七条食品药品监管总局医疗器械技术审评中心设立创新医疗器械审查办公室(以下简称创新医疗器械审查办公室),对创新医疗器械特别审批申请进行审查。
第八条食品药品监管总局受理创新医疗器械特别审批申请后,由创新医疗器械审查办公室组织专家进行审查,并于受理后40个工作日内出具审查意见。
第九条经创新医疗器械审查办公室审查,对拟进行特别审批的申请项目,应当在食品药品监管总局医疗器械技术审评中心网站将申请人、产品名称予以公示,公示时间应当不少于10个工作日。
对于公示有异议的,应当对相关意见研究后作出最终审查决定。
第十条创新医疗器械审查办公室作出审查决定后,将审查结果书面通知申请人,对境内企业的申请,同时抄送申请人所在地省级食品药品监督管理部门(格式见附件2)。
第十一条创新医疗器械审查办公室在审查创新医疗器械特别审批申请时一并对医疗器械管理类别进行界定。
对于境内企业申请,如产品被界定为第二类或第一类医疗器械,相应的省级或者设区市级食品药品监督管理部门可参照本程序进行后续工作和审评审批。
第十二条对于经审查同意按本程序审批的创新医疗器械,申请人所在地食品药品监督管理部门应当指定专人,应申请人的要求及时沟通、提供指导。
在接到申请人质量管理体系检查(考核)申请后,应当予以优先办理。
第十三条对于创新医疗器械,医疗器械检测机构在进行注册检测时,应当及时对生产企业提交的注册产品标准进行预评价,对存在问题的,应当及时向生产企业提出修改建议。
第十四条医疗器械检测机构应当在接受样品后优先进行医疗器械注册检测,并出具检测报告。
经过医疗器械检测机构预评价的注册产品标准和《拟申请注册医疗器械产品标准预评价意见表》应当加盖检测机构印章,随检测报告一同出具。
第十五条创新医疗器械的临床试验应当按照医疗器械临床试验相关规定的要求进行,食品药品监督管理部门应当根据临床试验的进程进行监督检查。
第十六条创新医疗器械临床研究工作需重大变更的,如临床试验方案修订,使用方法、规格型号、预期用途、适用范围或人群的调整等,申请人应当评估变更对医疗器械安全性、有效性和质量可控性的影响。
产品主要工作原理或作用机理发生变化的创新医疗器械,应当按照本审批程序重新申请。
第十七条对于创新医疗器械,在产品注册申请受理前以及技术审评过程中,食品药品监管总局医疗器械技术审评中心应当指定专人,应申请人的要求及时沟通、提供指导,共同讨论相关技术问题。
第十八条对于创新医疗器械,申请人可填写创新医疗器械沟通交流申请表(见附件3),就下列问题向食品药品监管总局医疗器械技术审评中心提出沟通交流申请:
(一)重大技术问题;
(二)重大安全性问题;
(三)临床试验方案;
(四)阶段性临床试验结果的总结与评价;
(五)其他需要沟通交流的重要问题。
第十九条食品药品监管总局医疗器械技术审评中心应当对申请人提交的沟通交流申请及相关资料及时进行审核,并将审核结果通知申请人(见附件4)。
食品药品监管总局医疗器械技术审评中心同意进行沟通交流的,应当明确告知申请人拟讨论的问题,与申
请人商定沟通交流的形式、时间、地点、参加人员等,安排与申请人沟通交流。
沟通交流应形成记录,记录需经双方签字确认,供该产品的后续研究及审评工作参考。
第二十条食品药品监管总局受理创新医疗器械注册申请后,应当将该注册申请项目标记为“创新医疗器械”,并及时进行注册申报资料流转。
第二十一条已受理注册申报的创新医疗器械,食品药品监管总局医疗器械技术审评中心应当优先进行技术审评;技术审评结束后,食品药品监管总局优先进行行政审批。
第二十二条属于下列情形之一的,食品药品监管总局可终止本程序并告知申请人:
(一)申请人主动要求终止的;
(二)申请人未按规定的时间及要求履行相应义务的;
(三)申请人提供伪造和虚假资料的;
(四)经专家审查会议讨论确定不宜再按照本程序管理的。
第二十三条食品药品监管总局在实施本程序过程中,应当加强与国务院各有关部门的沟通和交流,及时了解创新医疗器械的研发进展。
第二十四条突发公共卫生事件应急所需医疗器械,按照《医疗器械应急审批程序》办理。
第二十五条医疗器械注册管理要求和规定,本程序未涉及的,按照《医疗器械注册管理办法》等相关规定执行。
第二十六条本程序自2014年3月1日起施行。
附件:1.创新医疗器械特别审批申请表
2.创新医疗器械特别审批申请审查通知单
3.创新医疗器械沟通交流申请表
4.创新医疗器械沟通交流申请回复单。