[2019][北京初三一模化学分类汇编-基本实验及其原理分析]
- 格式:docx
- 大小:2.87 MB
- 文档页数:20


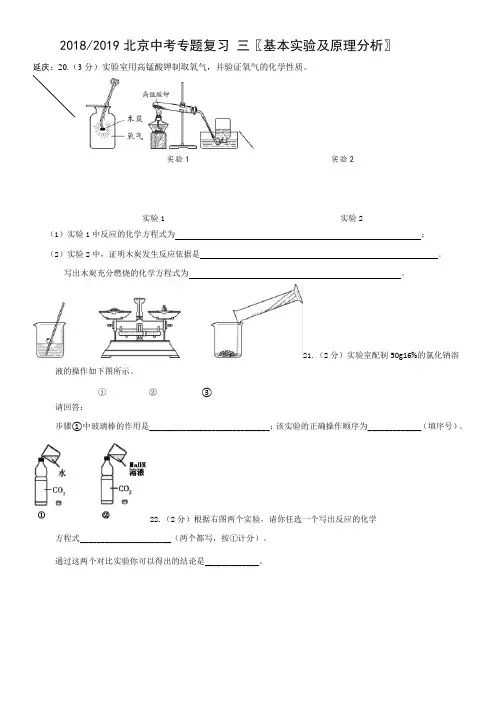
2018/2019北京中考专题复习三〖基本实验及原理分析〗延庆:20.(3分)实验室用高锰酸钾制取氧气,并验证氧气的化学性质。
实验1 实验2实验1 实验2(1)实验1中反应的化学方程式为;(2)实验2中,证明木炭发生反应依据是。
写出木炭充分燃烧的化学方程式为。
21.(2分)实验室配制50g16%的氯化钠溶液的操作如下图所示。
①②③请回答:步骤①中玻璃棒的作用是_____________________________;该实验的正确操作顺序为_____________(填序号)。
22.(2分)根据右图两个实验,请你任选一个写出反应的化学方程式______________________(两个都写,按①计分)。
通过这两个对比实验你可以得出的结论是_____________。
23.(4分)如图是某兴趣小组探究空气中氧气的体积分数的实验,回答下列问题:(1)电阻丝在实验中的作用是____________________________;(2)加足量白磷的目的是_____________________________;其燃烧的化学方程式为____________________________。
(3)装置冷却到室温,可观察到的现象是_______________________,据此得出空气中氧气的体积分数约为20%的结论。
西城:19.(2分)请从19-A或19-B两题中任选一个....作答,若两题均作答,按19-A计分。
20.(2分)“去除粗盐中难溶性杂质”的实验操作如下图所示。
(1)此实验的正确操作顺序是_____(填序号)。
(2)操作B中玻璃棒不断搅拌的目的是_____。
21.(3分)实验小组同学分别向下列试剂中滴加自制紫薯汁,现象记录如下:操作(1)紫薯汁_____(填“能”或“不能”)作酸碱指示剂。
(2)草木灰溶液呈_____(填“酸性”、“中性”或“碱性”)。
(3)向“蒸馏水中滴加紫薯汁”的目的是_____。
![[2019][北京朝阳区初三一模化学试卷及答案]](https://uimg.taocdn.com/f8502d70482fb4daa58d4b58.webp)
北京市朝阳区九年级综合练习(一)化学 试 卷 2019.5学校 班级 姓名 考号可能用到的相对原子质量:H 1 C 12 O 16 Mg 24 S 32 Fe 56第一部分 选择题(共12分)(每小题只有一个选项符合题意。
每小题1分) 1.1滴水中大约有1.67×1021个水分子,说明A .分子很小B .分子可分C .分子在运动D .分子间有间隔 2.去除粗盐中难溶性杂质的实验步骤中,均用到的一种仪器是A .烧杯B .量筒C .玻璃棒D . 漏斗 3.下列人体所必需的元素中,缺乏会引起骨质疏松的是A .铁B .锌C .碘D .钙 4.配制一定溶质质量分数的氯化钠溶液,下列操作不正确的是5.下列物质属于纯净物的是A .蒸馏水B .豆浆C .牛奶D .雪碧 6.下列符号能表示2个氯分子的是A .Cl 2B .2Cl 2C .2ClD .2Cl - 7.木炭在氧气中燃烧并检验生成物的实验如下图,下列说法不正确的是 A .燃烧发白光B .该反应放热C .生成一种无色气体D.烧杯中的物质是水8.下列物质的用途和性质,对应关系不正确的是A.铁锅炒菜——导热性B.二氧化碳制碳酸饮料——与水反应C.盐酸除铁锈——与金属反应D.熟石灰改良酸性土壤——与酸反应9.用数轴表示某些化学知识直观、简明、易记。
下列用数轴表示的化学知识,不正确的是A.生活中常见物质的pH:B.地壳中部分元素的含量:C.空气中部分成分的含量:D.部分金属的活动性顺序:10.下图是某反应的微观示意图。
下列说法不正确的是A.甲中氢、硫元素的质量比为1:16 B.反应后硫元素的化合价为+4C.参加反应的甲、乙分子个数比为1:2 D.反应后分子总数减少依据溶解度曲线和实验回答11~12题。
R是硝酸钾或氯化铵中的一种,硝酸钾和氯化铵的溶解度曲线如图1所示。
某化学小组进行了如图2所示实验。
11.①中溶液的质量为A.210 g B.160 g C.150 g D.60 g12.关于图2中烧杯内的物质,下列说法正确的是A.①、②中,溶液的溶质质量分数相等B.使③中的固体溶解,可采用降温的方法C.①、②、③中,只有③中溶液是饱和溶液D.①中溶液的溶质质量分数一定比③中溶液的溶质质量分数小第二部分非选择题(共33分)〖生活现象解释〗13.(2分)铁在自然界中广泛存在。

(完整)2019北京市东城区初三化学一模(word版可编辑修改)编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望((完整)2019北京市东城区初三化学一模(word版可编辑修改))的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为(完整)2019北京市东城区初三化学一模(word版可编辑修改)的全部内容。
东城区2018-2019学年度第二学期初三年级统一测试(一)化学试卷 2019.05学校班级姓名教育ID号可能用到的相对原子质量:H 1 C 12 O 16 S 32 Fe 56 Cu 64第一部分选择题(共12分)每小题只有1 个选项符合题意.每小题1分,共12分。
1.下列属于物理变化的是A。
水结成冰 B. 蜡烛燃烧 C。
食物腐败 D。
铁锅生锈2.下列人体所必须的元素中,中老年人缺少会引起骨质疏松的是A.锌 B。
铁 C。
钙 D.钠3。
下列有关水的说法不正确...的是A. 水可用于灭火 B。
水是一种常用的溶剂C. 水是由氢、氧元素组成D. 水分子是由氢分子和氧原子构成4.下列符号能表示2个氢原子的是A.2H+ B.2H C.H2 D.2H25.下列不属于...二氧化碳用途的是A.灭火B。
制汽水C。
光合作用D。
供给呼吸6.下列金属活动性最强的是A.锌B。
铜 C.钾D。
金7.铜用作导线主要利用金属铜的性质是A。
导电性 B.导热性 C.有金属光泽 D.密度较大8.煤油中含有噻吩(用X表示),噻吩具有令人不愉快的气味,其燃烧时发生反应的化学方程式表示为:X+6O 24CO2+SO2+2H2O,噻吩的化学式为A.CH4 B.C4H4S C.C4H6S D.C4H8S9.40℃时,KCl的溶解度为40g。

F G B B (东城)31.(5 分)下列字母 A-H 表示初中化学常见的物质,它们由氢、碳、氧、钠、氯、钙中的 2-3 种元素组成。
(1)A 俗称生石灰,则 A 是。
A 与 B (胃液中含有的酸)反应放出大量的热,该反应的化学方程式是。
(2)B 与 C 在溶液中发生的中和反应可表示为:B+C →D +E ,其中 D 是食盐的主要成分,E 是水。
能证明 B 、C 恰好完全反应,可选用的试剂是(填字母序号)。
A .石蕊溶液B .酚酞溶液C .酚酞溶液和锌粒D .pH 试纸(3) 能与 B 反应, 能与 C 反应生成 H ,且 F 与 G 反应生成白色沉淀。
写出 F 与 H 反应的化学方程式 。
(西城)21. (5 分)有一白色固体 X ,其主要成分是氯化钠,可能含有碳酸钙、氯化钙、硫酸铜和氢氧化钙中的一种或几种。
为探究其组成进行如下实验,主要流程及现象记录如下:【资料】氯化钙溶液呈中性,碳酸钠溶液呈碱性白色沉淀 A稀盐酸② 无色气体 C白色固体 X足量的水①白色沉淀 A无色溶液 B碳酸钠溶液③pH =7 的无色溶液回答下列问题:(1) 根据步骤①实验现象确定白色固体 X 中一定没有的物质是____________。
(2) 步骤②中发生反应的化学方程式是____________________________________。
(3) 步骤③中产生白色沉淀 A 的化学方程式是____________________________________。
(4) 白色固体 X 中的物质有____________。
(5) 将白色固体 X 转化成氯化钠固体的实验方案是_________________________________________。
(海淀)30.(5 分)下列字母 A~E 表示初中化学的常见物质,它们由氢、碳、氧、氯、钠、钙、铁中的 2~3 种元素组成。
已知:①CaCl 2、NaCl 溶液遇酚酞不变色,Na 2CO 3 溶液遇酚酞显红色;②Na 2CO 3 + CaCl 2CaCO 3↓ + 2NaCl 。



(东城)36.(5分)结合教材中关于二氧化碳收集方法的描述:二氧化碳能溶于水,一般不用排水法收集。
某化学小组分成两组进行实验,研究是否能用排水法收集二氧化碳的问题。
[查阅资料]二氧化碳不溶于饱和碳酸氢钠溶液。
[知识储备]写出下列化学方程式:①实验室制备二氧化碳的反应。
②二氧化碳与水反应。
(1)实验一:步骤一:室温下,取大小相同的两个集气瓶,用向上排空气法收集两瓶二氧化碳气体,小心地由瓶壁向瓶中各加入半瓶蒸馏水,瓶1用玻璃片盖好,瓶2盖上胶塞迅速振荡后,取下胶塞盖好玻璃片,两瓶静置相同的时间。
步骤二用燃着的木条同时伸入两瓶,观察到瓶1中的木条熄灭比瓶2中的快。
[实验结论]该实验说明,二氧化碳溶于水的量的多少与(填字母序号)有关。
A.水量的多少 B.水的温度 C.气体与水的接触面积 D.气体与水的接触时间[实验二]图1 图2室温下,用图1所示装置向试管内长时间通入二氧化碳;用图2所示装置,收集一瓶二氧化碳。
用pH计[实验结论]由a3数据可知,用图2所示装置收集二氧化碳时,二氧化碳在水中溶解的量很小。
根据上述结论,推测a1、a2和a3由小到大的顺序是。
[反思与交流]饱和碳酸氢钠溶液的作用是。
[实验结论]用图2所示装置,可以收集二氧化碳。
(西城)33(7分)课外小组同学进一步研究铁与氧气的反应。
【提出问题】铁丝燃烧时为什么会有“火星四射”的现象?【查阅资料】铁丝燃烧时“火星四射”现象与铁丝含碳量有关。
【进行实验】探究铁丝在氧气燃烧时“火星四射”的现象与其含碳量的关系。
【查阅资料】①自然界中铁的氧化物主要是Fe 3O 4和Fe 2O 3两种(FeO 易被氧化) ②铁的氧化物均能溶于酸溶液 【进行实验】测定黑色固体的成分。
同学们认为铁丝燃烧的现象还与氧气的浓度有关,所以想收集不同浓度的氧气进行相关实验。
若用排水集气法收集一瓶体积分数约为80%的氧气,预先应向容积为360 mL 的集气瓶中加水,水的体积为____mL 。

(东城)35.(5分)某化学兴趣小组用下图所示装置进行实验(装置的气密性良好)。
(1)如图1所示,让瓶内充满二氧化碳气体,先向广口瓶中加入A的溶液,振荡广口瓶,气球膨胀;再向广口瓶中滴加B中的溶液,振荡缩小,如此重复操作,气球可以反则:①分液漏斗A中可能是_____溶液,广口瓶,气球又复膨胀和缩小。
反应的化学方程式是。
图1图2②分液漏斗B中可能是_____溶液。
(2)如图2所示,将滴管甲中的液体挤出,气球明显鼓起,一段时间后恢复原状;再将滴管乙中的液体挤出,气球有明显鼓起且不恢复原状。
则滴管甲、乙和烧杯①、②中的物质可能是(填字母序号)。
A.甲:浓硫酸,①:水;乙:稀硫酸,②:碳酸钠B.甲:水,①:氯化钠;乙:稀盐酸,②:铁C.甲:水,①:氢氧化钠;乙:稀硫酸,②:锌D.甲:水,①:生石灰;乙:稀盐酸,②:氢氧化钠(西城)32(4分)下图所示装置有多种用途,利用其进行相关实验。
(1)检查装置气密性:关闭止水夹,从a处通入空气,观察到________________________,说明装置气密性良好。
(2)除杂:打开止水夹,从a处缓慢通入O2和CO2的混合气,瓶中液体无明显变化,在c处得到较纯的O2。
瓶中盛放的试剂是____________。
(3)获得稳定气流:打开止水夹,从a处通入不稳定的氧气流,在c处获得较为稳定的气流,此时观察到的现象是__________________________________。
(4)防止爆炸:气囊中有遇明火能爆炸的H2和O2混合气。
将气囊与a处相连,在c处连接尖嘴管,打开止水夹,通入混合气,在尖嘴处点燃气体,没有爆炸,原因是:①集气瓶中的水能降温和阻断燃烧;②___________________________________________________。
(海淀)34.(5分)为研究NaOH与盐酸的反应,同学们用以下试剂设计不同方案进行探究。
实验试剂:镁条、蒸馏水、稀盐酸、NaOH溶液、NaCl溶液等(1)小明取少量NaOH溶液于试管中,滴入酚酞,溶液变红,再滴加稀盐酸,振荡,红色褪去,可推断NaOH与盐酸发生了反应。
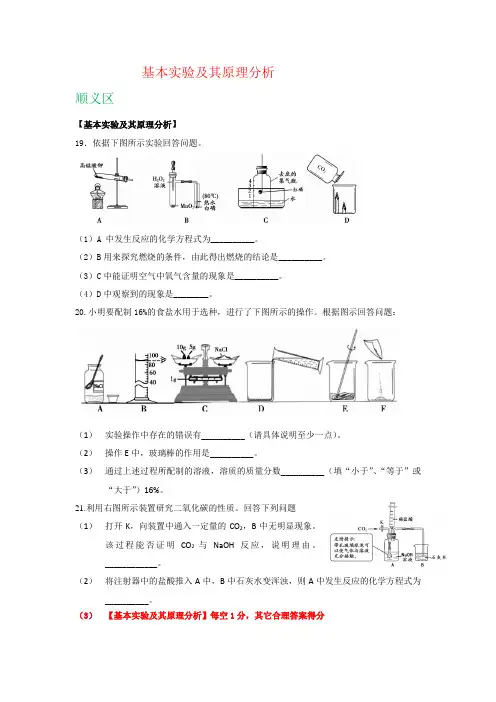
基本实验及其原理分析顺义区【基本实验及其原理分析】19.依据下图所示实验回答问题。
(1)A 中发生反应的化学方程式为__________。
(2)B用来探究燃烧的条件,由此得出燃烧的结论是__________。
(3)C中能证明空气中氧气含量的现象是__________。
(4)D中观察到的现象是________。
20.小明要配制16%的食盐水用于选种,进行了下图所示的操作。
根据图示回答问题:(1)实验操作中存在的错误有__________(请具体说明至少一点)。
(2)操作E中,玻璃棒的作用是__________。
(3)通过上述过程所配制的溶液,溶质的质量分数__________(填“小于”、“等于”或“大于”)16%。
21.利用右图所示装置研究二氧化碳的性质。
回答下列问题(1)打开K,向装置中通入一定量的CO2,B中无明显现象。
该过程能否证明CO2与NaOH反应,说明理由。
____________。
(2)将注射器中的盐酸推入A中,B中石灰水变浑浊,则A中发生反应的化学方程式为__________。
(3)【基本实验及其原理分析】每空1分,其它合理答案得分19.(1)2KMnO 4−→−∆K 2MnO 4+MnO 2+O 2↑ (2)可燃物燃烧需要与氧气接触 (3)集气瓶内水面升至“1”处 (4)蜡烛从上到下依次熄灭20.(1)试剂瓶塞没倒放(或称量时砝码放在左盘) (2)搅拌,加速食盐溶解 (3)小于21. (1)不能,NaOH 溶液中有水,水能溶解CO 2并与之发生反应 22. (2)Na 2CO 3+2HCl=2NaCl+H 2O+CO 2↑西城区〖基本实验及其原理分析〗19.(2分)用右图装置进行实验(夹持仪器略去)。
(1)锥形瓶中反应的化学方程式为______。
(2)木炭遇氧气燃烧时,现象是______。
20.(2分)为了研究物质的溶解现象,设计并进行了如下实验。
(1)实验一的目的是______。
密云区2019年中考一模化学试卷2019.04考生须知1.本试卷共8页,共23道小题,满分45分。
考试时间45分钟。
2.在试卷和答题卡上准确填写学校名称、姓名和准考证号。
3.试题答案一律填涂或书写在答题卡上,在试卷上作答无效。
4.在答题卡上,选择题用2B 铅笔作答,其他试题用黑色字迹签字笔作答。
可能用到的相对原子质量:H :1C:12O:16第一部分选择题(共12分)(每小题只有一个选项符合题意。
共12道小题,每小题1分,共12分)1.缺少下列元素会导致少年患佝偻病的是A.锌B.铁C.钙D.碘2.下列“水”能使无色酚酞溶液变红的是A.石灰水B.汽水C.冰水D.食盐水3.下列物质属于氧化物的是A.O 2B.CaOC.KMnO 4D.H 2SO 44.下列物质俗称与化学式对应正确的是A.纯碱NaClB.干冰-H 2OC.苛性钠-NaOHD.生石灰-Ca(OH)25.下列金属中,滴加稀盐酸后不会产生气泡的是A.锌B.铝C.铁D.铜6.铀是一种重要的工业原料,已知有一种铀原子中质子数为92,中子数为143,该原子的核外电子数为A.143B.92C.235D.517.我国自主研发的龙芯CPU 已经应用于包括北斗卫星在内的十几种国家重器中,芯片作为所有电脑、智能家电的核心部件,它是以高纯度的单质硅(Si)为材料制成的。
用化学方法制高纯硅的反应原理为:①2C+SiO 2═2CO↑+Si(粗硅)②Si+2Cl 2═SiC14(液态)③2H 2+SiCl 4═4HCl+Si(高纯硅)其中属于置换反应的是高温加热加热A.①B.①②C.②③D.①③根据以下信息完成8-9题。
20℃时,将20g a、b 两种固体,分别加入到盛有100g 水的烧杯中,充分搅拌后现象如图甲,升温到50℃时,现象如图乙,a、b 两种固体的溶解度曲线如图丙。
8.图中所示一定是饱和溶液的是A.20℃时的A 溶液B.20℃时的B 溶液C.50℃时的A 溶液D.50℃时的B 溶液9.50℃时a 溶液的溶质质量分数为A.20%B.16.7%C.28.6%D.24.2%10.下图所示的实验操作不正确...的是A.倾倒液体B.取用固体C.点燃酒精灯D.溶解固体11.纳米铁粉在空气中不易自燃,但稍加热即可剧烈燃烧,如图是纳米铁粉在锥形瓶中燃烧的实验。
北京市2021届初三专题复习一2021年各城区一模化学试题分类汇编根本实验及其原理分析(海淀一模)19.实验室用右图所示装置制取CO2.(1)反响的化学方程式为.(2)检验CO2是否集满的操作为20.用右图所示装置测定空气中氧气的含量.加热粗铜丝一段时间后,白磷燃烧.(1)上述实验说明铜具有的性质是.(2)能证实空气中氧气含量的现象是21.用以下图所示实验研究CQ的性质.CA B(1) A中的现象是 __________________________(2) B中紫色溶液变红的原因是.(3) C中没有观察到明显现象.取少量反响后的溶液于试管中,参加足量 ,观察到有气泡产生,说明C中发生了化学反响.(22) 右图所示装置进行实验(夹持仪器略去) .:白磷的着火点为40 C.(1)从长颈漏斗注入过氧化氢溶液,乙中发生反响的化学方程式为.(2)甲、丙中现象不同的原因是(23) 验小组做了如以下图所示实验.滴有粉里的(1)能证实甲中发生反响的现象是砥酸铝效片相片丙(2)乙中可观察到白色浑浊,那么发生反响的化学方程式为(3)丙中铁片上有红色固体析出,银片无明显变化.由该实验过程推断,金属活动性由强到弱为 _____________________(朝阳一模)19.右图是纳米铁粉在氧气中燃烧的实验.(1)纳米铁粉燃烧的化学方程式为 (2)锥形瓶中水的作用是 . 20.探究影响物质溶解性的因素.实验1实验2(1)实验1的目的是探究 对碳酸钠溶解性的影响. (2)实验2可获得的结论是 .21 .根据以下实验答复以下问题. :白磷的着火点是 40 Co(1)实验1中,能证实燃烧时温度需到达可燃物着火点的实验现象是 (2)实验2中,参加泡腾片(主要成分含柠檬酸、碳酸氢钠等)烛逐渐熄灭.产生上述现象的原因是无色溶液(1)参加B 溶液产生白色沉淀的原因是 (用化学方程式表示)(2)红色溶液中含有的物质有水、石蕊 23.研究小组利用以下图装置进行实验(注射器的摩擦力忽略不计):A 的容积为250 mL , B 中盛有足量的水,实验前 K 1、K 2、K 3均已关闭.实验2,观察到水中产生大量气泡、蜡22. 进行如下实验,研究物质的性质.实验1目也沉淀、红包溶液、「(1)A 中反响的化学方程式为,选择B 收集氧气的原因是(2) C 中可观察到铁丝剧烈燃烧、19 .以下图为实验的根本操作.比拟,读出pH20 .从20-A 或20-B 中任选一个作答.假设均作答,按 20-A 计分. 利用以下图所示的装置完成实验〔杠杆已经调至平衡〕20-A20-B放置较长一段时间后,左边铁粉布通入二氧化碳一段时间,左边乒乓球ED〔1〕检查A 装置的气密性.翻开向外拉注射器的活塞,松手后,观察到装置的气密性良好.〔2〕测定 A 瓶气体中二氧化碳含量.翻开 K1,用注射器向A 中注入20 mL NaOH 溶液〔足量〕, 关闭 进入 K1,充分反响后, 〔填实验操作〕,观察到B 中的水 A 中,当B 中液面不再变化时,测得 B 中减少了 60 mL 水,那么A 中CQ 的体积分数 约为 %. 〔东城一模〕18.用右图所示装置制取 Q,并进行Q 的性质实验. Q实验1实验2(1) 实验 1去除粗盐中难溶性杂质的正确操作顺序是(2) 实验 2测定溶液pH 时,用玻璃棒蘸取待测液滴到 〔填字母序号〕.上,将显示的颜色与标准比色卡C B 食盐水(2)比照实验②和③,可以得出可燃物燃烧的条件是22.利用以下图所示实验装置(气密性良好),验证浓硫酸、浓盐酸的挥发性.其中甲、乙、丙三个广口瓶中依次装有浓硫酸、浓氨水、浓盐酸.:2NH + H 2SO = (NH 4)2SO; (NH)2SO 为白色固体.实验步骤 实验操作实验现象① 翻开Ki,关闭K2,缓慢拉注射器 A 活塞 甲中液向上万无明显现象 ②翻开K2,关闭Ki,缓慢拉注射器B 活塞丙中液向上万出现大量白烟(1)丙中发生化合反响,生成大量白烟( NH4C1)的化学方程式为(2)该实验能够得出的结论是编P 实验操作实验现象 ① 铜帽加热后,立即罩在蜡烛火焰上 蜡烛熄灭 ② 铜圈加热后,立即罩在蜡烛火焰上 蜡烛继续燃烧 ③铜圈不加热,直接罩在蜡烛火焰上蜡烛熄灭O(1)验证可燃物燃烧需要 O2的现象是 -铜圈21.实验小组同学验证可燃物燃烧的条件,进行如下实验.铜帽③注射器R甲 丙乙 注射器A20-A 或20-B 两题中任选一个 作答,假设两题均作答,按 20-A 计分.(3)从微观角度解释甲中无白烟,而内中出现白烟的原因是(西城一模)19.用右图装置进行实验(夹持仪器略去)20. 22. 23. (1)锥形瓶中反响的化学方程式为 (2)木炭遇氧气燃烧时,现象是为了研究物质的溶解现象,设计并进行了如下实验.实验一 (1)实验一的目的是(2)实验二,加热后固体全部消失的原因是 右图实验能证实空气中氧气的含量O (1)白磷燃烧的化学方程式为(2)整个实验过程中,集气瓶内液面的变化: 进行如右图实验,研究物质的性质.A 中的现象是(2) (3) 气体 (1) (2) B 中反响的化学方程式为厂硝酸聊C 中滴入稀盐酸后得到溶液甲,向甲中继续滴加液,有白色沉淀生成.溶液甲中的溶质是实验二Ca(OH )2 溶 (填化学式).X 可能是02、CO 2中的一种或两种.用以下图装置进行实验(忽略气体的溶解)400 mL 气体X—►,澄苒 而灰水假设观察到 化学式). 假设气体X B 中始终未变浑浊,最终有 100 mL 液体进入C,那么气体X 的成分是A 中发生反响的化学方程式为 中只含有02,观察到的现象是 (丰台一模)19.实验室用右图装置制取02.(1) 用高镒酸钾制取氧气,反响的化学方程式为(填(2) 用向上排空气法收集氧气的原因是20.请从 的北演充分振荡&-O水7太阳%濯NaOH 基溶就;就林提存工;粉乩成璃单息可•以统,林鸟廛充(2)该实验中,甲溶液是.(3)能说明盐酸与氢氧化钠发生化学反响的依据是 23.某兴趣小组同学利用右图装置探究可燃物燃烧的条件.实验过程:① 将红磷和白磷分别放入两只试管中,一段时间后,A 、B 试管中无明显现象.② 用气囊鼓入空气至白磷和红磷露出水面,A 中白磷燃烧,B 中无20-A 配制160g 10%的氯化钠溶液 20-B 去除粗盐中的泥沙(1)实验的主要步骤是:⑤ 一 ________ 一③. (2)溶解时,用玻璃棒搅拌的目的是 __________ .(1)实验的主要步骤是:③ 一 _______ -②. (2)蒸发时,用玻璃棒搅拌的目的是 ____________ .A B(1)假设X 为紫色石蕊溶液,观察到的现象是 、澄清石灰水变浑浊.B 中发生反响的化学方程式为 .(2)假设X 为氢氧化钠溶液,通入与(1)中等体积的CO2,观察到B 中 无明显现象,其原因是 . 22.实验小组用pH 传感器探究稀盐酸和氢氧化钠溶液的反响.实验操作和测定结果如下图:21 .利用以下图装置研究二氧化碳的性质.7石灰龙;7、不€D明显现象.:红磷的着火点为 240C,白磷的着火点为 40 Co(1)仅通过比照实验②中露出水面的白磷和红磷可得到的结论(2)实验过程中,能说明可燃物燃烧需要氧气的实验现象是 (房山一模)19.实验室用以下图装置制取氧气.(1)高镒酸钾分解的化学方程式为 . (2)用排水法收集氧气的原因是 .20.用右图装置进行“铁丝在氧气中燃烧〞的实验.(1)实验现象为:剧烈燃烧, (2)集气瓶底部放水的作用是 .21 ."去除粗盐中难溶性杂质〞的实验操作如以下图所示.(1)此实验的正确操作顺序是 (填序号,下同). (2)操作②中,玻璃棒的作用是 . A.引流 B.加快溶解C.预防局部温度过高,液滴飞溅22 .如右图所示进行实验.(1)旋紧瓶盖后振荡,观察到的现象为(2)判断该实验能否证实二氧化碳与氢氧化钠发生了化学反响, 并说明理由:.23 .进行如下微型实验,研究物质的性质.一嫉酸纳落液ABC溶液(1) A 中无色酚酗:溶液变为红色,证实碳酸钠溶液显 性. (2) B 中产生大量气泡的原因是 (用化学方程式解释). (3)碳酸钠溶液在鉴别 C 、D 中的物质时,依据的不同现象是 (4) E 中发生复分解反响,产生白色沉淀,其反响的化学方程式为(1) A 中发生反响的化学方程式为 .(2) B 用来探究燃烧的条件,由此得出燃烧的结论是 (3) C 中能证实空气中氧气含量的现象是 ^.(4) D 中观察到的现象是 .(20)明要配制16%勺食盐水用于选种,进行了以下图所示的操作.根据图示答复以下问题:AB CDE(1)实验操作中存在的错误有 (请具体说明至少一点) (2)操作E 中,玻璃棒的作用是 (3)通过上述过程所配制的溶液, 溶质的质量分数 (填(21)用右图所示装置研究二氧化碳的性质.答复以下问题 (1)翻开K,向装置中通入一定量的 CO 2, B 中无明显现象.该过程能否证实 CO 2与NaOH 反响,说明理由.(2)将注射器中的盐酸推入 A 中,B 中石灰水变浑浊,那么 A(顺义一模)19.依据以下图所示实验答复以下问题.ABCD“小于〞、“等于〞或“大于〞)16%.中发生反响的化学方程式为(1) KMnO 4受热分解的化学方程式为 (2)用向上排空气法收集氧气的原因是(1)制取二氧化碳的化学方程式为 (2)证实二氧化碳与水发生反响的现象是(1)需要氯化钠和水的质量分别为 (2)实验操作顺序为E 、C 、(石景山一模)19. 22. 用右图装置进行空气中氧气含量测定的实验. (1)证实空气中氧气含量约为 1/5的实验现象是 (2)实验中观察到烧杯中的水变为红色,原因是 23.进行如下实验,研究氢氧化钙的化学性质. 20. 用如图装置进彳f CQ 制取和性质的实验.实验小组同学配制 50 g 质量分数为15%的氯化钠溶液.DE(1)溶液变为红色的是 (填序号).(2)没有明显现象试管中发生反响的化学方程式为(3)两支试管中出现浑浊现象,其原因是^(门头沟一模)20.根据以下图答复以下问题:商拉喉削A(1)实验室利用A装置制取氧气的化学方程式为(2)实验B中,观察到铁丝剧烈燃烧, ,放大量热.21 .用如以下图装置测定空气中氧气含量(夹持装置已略去) ,左侧直玻璃管中液面以上平分为(1)加热铜丝可以引燃白磷,利用的是铜有良好的性.(2)能证实空气中氧气含量的现象是(3)用白磷能测定空气中氧气含量的原因是.in(1)1处锥形瓶中发生反响的化学方程式为(2)写出n处枯燥管中的实验现象.(3)出处如何证实二氧化碳气体已经充满整个集气瓶?.(1)实验一:证实可燃物燃烧条件. A中放有过氧化氢溶液, B中放有一定量二氧化镒;C中放有约半瓶80c热水,C中左侧长导管出气口处放一块白磷.翻开分液漏斗活塞后观察到C中白磷燃烧.该实验证实可燃物燃烧的条件之一是 .该实验C中水的作用是c(2)实验二:证实二氧化碳与氢氧化钠发生化学反响. B中充满二氧化碳,C中液体是足量稀盐酸,翻开分液漏斗的活塞,将A中氢氧化钠溶液参加到广口瓶中,关闭活塞,实验过程中可观察到明显的实验现象,产生该现象的原因是.(平谷一模)19.根据以下图答复以下问题.A.实验室制取氧气B.实验室制取二氧化碳C.铁丝在氧气燃烧(1) A中药品假设为高镒酸钾,反响的化学方程式为.(2) B中用向上排空气法收集二氧化碳的原因是(3) C43铁丝燃烧的实验现象是.20.请从19-A或19-B两题中任选一个作答,假设两题均作答,按20-A计分.20-A去除粗盐中的泥沙(1) 实验的主要步骤是:③一f(填序号,下同).(2)蒸发时,用玻璃棒搅拌的目的是20-B配制160g10%J氯化钠溶液(1)实验的主要步骤是:⑤f f o(2)溶解时,用玻璃棒搅拌的目的是21.利用以下图完成各题.可供选择的根本实验操作如以下A.湿棉花可以吸收白烟 B .烧杯中热水的作用是提供热量实验a 、c 为枯燥的紫色石蕊试 纸b 、d 为湿润的紫色石蕊试 纸(1)甲实验的目的是(2)乙实验,假设电解18g 水,那么试管2内得到的气体质量为 (3)丙实验,说明二氧化碳密度大于空气且能与水反响的现象是 22 .化学课上,小丽以氢氧化钙为例探究碱的化学性质,如以下图所示:n 忙透量取适量氢氧化钙于试管中依次进行实验,并答复以下问题. (1)试管①没有明显现象,小丽需要作出的改良是 (2)试管②中观察到的现象是 (3)试管③中发生反响的化学方程式为23 .用右图装置(夹持仪器略去) 研究可燃物的燃条件.实验过程:①通入N2,将怵右侧局部放入热水中,a 、b 处白磷 均不燃烧;②通入空气,a 处白磷不燃烧,b 处白磷燃烧. 资料:白磷的着火点为40 C,能与这点应(1)实验过程中,能说明可燃物燃烧需要氧气的现象是(2)关于该实验的说法中,正确的选项是(填序号).1小粒 ,高桂做钾町引茗水OC.②中,a处白磷不燃烧的原因是温度没有到达着火点(延庆一模)19.根据以下图答复以下问题.A BCD(1)实验室制二氧化碳可选用的发生装置是 (填序号).收集二氧化碳用C不用D 装置的原因是.(2)实验室用高镒酸钾制氧气时,其反响的化学方程式为.20 .小明欲做两个实验,可供选择的根本实验操作如以下图:(1)去除粗盐中的泥沙实验,其主要步骤是:③ 一一 (填序号).(2)配制160g10%勺氯化钠溶液的实验中,假设图④变为仰视读数,其实验结果会(填“偏大〞或“偏小〞).21.请从21-A或21-B两题中任选一个作答,假设两题均作答,按21-A计分.A.探究二氧化碳与水反响B.探究铁的金属活动性22 .研究可燃物燃烧的条件.铜片:酒精灯火焰的温度约为500C, 一些物质的着火点如下表所示.(1)实验1:在铜片两端分别放置木块和无烟煤块, 点燃酒精灯加热一段时间, 能说明可燃物燃烧需要温度到达着火点的实验现象是.(2)实验2:将红磷置于铜片上,用沙土覆盖,点燃酒精灯持续加热,红磷始终不燃烧,其原因是.23 .实验小组用pH传感器探究盐酸和氢氧化钠的反响.测定结果如下图:(1)盐酸和氢氧化钠反响的化学方程式为(2)向烧瓶中缓慢注入稀盐酸,能说明盐酸与氢氧化钠发生化学反响的依据是(3) 60 s时,向烧瓶中参加过量碳酸钠溶液,那么烧瓶内溶液中的溶质是(密云一模)19.看图并请从19-A或19-B两题中任选1个作答,假设两题均作答,只一组计分.稀盐酸20 . “水〞在化学实验室中是经常用到的一种试剂,以以下图示实验中都用到了水.(1)如图甲,用此装置收集氧气前要将集气瓶中灌满水,其目的是 . (2)如图乙装置可用来测定空气中氧气的含量.实验进行到“B 〞环节可看到的现象是 ;A 烧杯中“ 80 c 热水〞的作用是 .21 .如图,化学小组同学制作了一个微型实验装置用来验证二氧化碳的性质.异型玻璃管A 内充满了二氧化碳气体(已检查装置气密性),注射器B 内吸取了一定量的浓氢氧化钠溶液, 广口瓶C中盛有一定量稀盐酸.实验开始前止水夹K 处于关闭状态.(1)将注射器中氢氧化钠溶液全部推入 A 中之前要进行的操作是 .(2)当C 中局部液体流入 A 中后迅速关闭止水夹 K,片刻后可看到的现象是 22 .某小组同学利用如下图装置探究铁生锈的条件.19-A19-B(1)用装置A 制备一瓶氧气,其制备原理为 (写出化学反响的方程式).(2)氧气可用C 装置收集,还可以用 收集(填写装置编号).(1)装置B 可用于实验室制取二氧化碳.写出 制取CO 反响的化学方程式为.(2)收集二氧化碳可选择 (填写装置编 号).(1)要证实铁生锈与氧气有关,需要进行的实验操作为 (2)实验中能说明铁生锈与水有关的实验现象是(3)充分反响后,将装置 A 、B 中分别注入少量 稀盐酸,两个广口瓶中现象的不同点是:(通州一模)19.从19-A 或19-B 中任选一个作答,假设均作答,按 19-A 计分.AB C(1)设计A 、C 的目的是.,由此也可以证实铁丝生锈情况.A 中反响的化学方程式19-A 实验室用右图装置制取 Q 19-B 实验室用右图装置制取 CO (1)反响的化学方程式为.(2)说明氧气已收集满的现象是 _________(1)反响的化学方程式为 (2)用向上排空气法收集CO 的原因.20.如下图,用细线系住宽 1cm 的铜片使之平衡,然后在铜片一端用酒精灯加热.(1)加热一段时间后,发现铜片不能保持平衡,请用质量守恒定律解释其原因.(2)假设想用右图装置证实铜具有导热性,还需要的操作是:21.用以下图所示实验验证可燃物燃烧的条件.Ki K,潮湿的铁丝枯燥的铁丝AB:红磷的着火点为 240C .(2)能验证可燃物需要02的现象是.22.t 2 c 时,将甲、乙各 80 g 分别放到盛有100 g 水的两个烧杯中,充分溶解后,恢复到 tzC,现象如图1,甲和乙的溶解度曲线如图 2.请结合图示答复以下问题:图1图2 (1)能说明固体甲对应的溶解度曲线是a 的证据是(2)以下关于12 c 时,甲、乙所得溶液的说法不正确的选项是 (填序号).A.溶质质量:甲 <乙B. 乙为饱和溶液,写出该反响的化学方程式 . (2)乙同学依据图2,认为甲同学实验无法确定酸碱恰好完全反响,其分析的原因是 . (3)丙同学用传感器测稀盐酸和NaOH 容液反响过程中的 pH 变化,测定结果如图3.请判断40s时,溶液中溶质的成分为(燕山一模)18.请从18-A 或18-B 两题中任选1个作答,假设两题均作答,按 18-A 计分.将溶液降温至t 1 C 时,甲、乙的溶解度相等.C.溶质质量分数:甲=乙D.(1)甲同学按图1进行实验,证实了盐酸和NaOH§液能发生化学反响,他依据的实验现象是19 .根据以下图答复以下问题.A B C D(1)实验室制取二氧化碳的反响方程式为,可选用的发生、收集装置是 (填序号).(2)实验室用高镒酸钾制氧气时,其反响的化学方程式为(3)粗盐提纯过程中, D装置可用于操作.20 .以下实验探究影响物质溶解性的因素.实验现象:A中几乎不溶B中固体可溶C中固体可溶.现象(填序号)说明不同的物质在同一溶剂中的溶解性不同.21 .某同学设计比照实验(如右图):两个体积相同、且均充满二氧化碳的锥形瓶,气球上端的玻璃管与外界大气相通.操作:分别向两锥形瓶中滴入2mL的氢氧化钠溶液和水,轻轻振荡.(1)设计该比照实验的目的是.(2)现象:观察到A、B两瓶内气球的变化情况是:.(3) B中发生的化学反响方程式为A B C D E 19-I19-II(1)实验室用高镒酸钾制取氧气的化 学方程式是—,发生装置选择 —.(2)氧气可选用 E 进行收集,其原因 是一.(1)实验室制取二氧化碳的化学方程式是—,收集装置选择 ______ . (2)二氧化碳的验满方法是 ______ .20 .以下图是与铁有关的局部实验,请答复以下问题.(1)甲中获得铁的化学方程式是 . (2)乙中证实铁发生反响的依据是(3)丙中能发生反响的原因是 ____________________________________21 .某实验小组利用以下图甲所示仪器进行“配制质量分数一定的氯化钠溶液〞的实验,按要求答复问题.(怀柔一模)19.依据以下实验室制取气体的发生和收集装置,选择“19-I 〞或“19-II 〞进行作答,二者均作答,按“ 19-I 〞进行计分.(1)按实验要求,甲中还缺少的玻璃仪器是 (填名称).(2)乙中所示称取氯化钠的操作出现了明显的错误,该错误操作导致了称取的氯化钠实际质量为 g .(3)假设依据丙所示的量取蒸储水的体积推测,那么该实验小组原方案配制的氯化钠溶液中溶质质 量分数为.(水的密度为 1g/cm 3)发生了反响;将铁粉换成卜列物质中的 (填序号),杠杆也会出现相似现象. A. NaClB. NaOHC. CaO(2)实验2中,通入CO 一段时间,右边乒乓球—(填“上升〞或“下降〞);再往集气瓶中滴入足量NaOH§液,杠杆重新平衡,其反响的化学方程式为北京市2021届初三专题复习一2021年各城区一模化学试题分类汇编根本实验及其原理分析参考答案(海淀一模)19. (1) CaCO + 2HC1CaC 2 + H 2O + CO4(2)将燃着的木条放在集气瓶口22.某课外活动中,学生利用如下图的杠杆完成探究实验,杠杆已调至平衡.(1)实验1中,较长时间后,左边铁粉布包下降,是由于铁粉与(2)玻璃管中水面上升至刻度1处(或其它合理答案)21. (1)澄清石灰水变浑浊(2) CO2与水反响生成碳酸,使紫色石蕊变红(3)盐酸/硫酸22. ( 1 ) 2H2O2 ^MO^ 2H2O + 02 T(2)甲中温度未达白磷着火点,丙中温度到达白磷着火点23. (1)红色溶液逐渐变无色(2) Ca(0H)2 + Na2CQ CaCQ J + 2Na0H(3) Fe> Cu>Ag(朝阳一模)19. (1) 3Fe+2O-Fe3O4 (2)预防高温熔融物炸裂瓶底20. (1)温度(2)溶剂的种类是影响物质溶解性的因素21. (1)甲中白磷不燃烧,乙中白磷燃烧(2)反响产生二氧化碳,隔绝了氧气22. (1) Ca(OHp+Na2CQ=CaC.J+2NaOH (2) NaCl、CaC2、HCl23. (1)活塞恢复至原位(2)翻开K2、K3 32(东城一模)18. (1) H202 M% H2O + 02 T 氧气不易溶于水MnO2(2)放热、火星四射、生成黑色固体19. (1) ACB (2) pH 试纸20-A 下降 6、H2O20-B 上升CO2 + 2NaOH = N&CQ + H2O21. (1)①中蜡烛熄灭,②中蜡烛继续燃烧(2)温度到达可燃物的着火点22. (1) NH3+ HCl = NH 4Cl(2)浓硫酸没有挥发性,浓盐酸具有挥发性(3)氨分子运动到甲、丙液面上方,甲中硫酸分子没有运动到液面上方与氨分子接触,而丙中氯化氢分子运动到液面上方并与氨分子接触反响生成氯化俊,故甲中无白烟,丙中出现白烟 (西城一模)19. (1) 2H2O2 ===== 22O + QT (2)木炭剧烈燃烧、发出白光、放热20. (1)比拟高镒酸钾在水和汽油中的溶解情况(2)硝酸钾的溶解水平随温度升高而增大21. (1) 4P + 5O2 ==== 22O5 (2)液面先下降,后上升至刻度1处22. (1)锌粒逐渐减少,有气泡产生(2) Fe2O3 + 6HCl === 2FeCl+ 3H2O(3) Na z CO s、NaCl23. (1) O2和CQ 2Na0H + C02 === NaCQ + H2O(2) B中澄清石灰水始终未变浑浊,最终装置C中进入400 mL液体(丰台一模)19. (1) 2KMnO4^ K2MnO4 + MnO2 + 02T(2)氧气密度比空气大20. 20-A (1)④20-B (1)①(2)使溶质和溶剂充分接触,加速溶解(2)均匀受热,预防液滴飞溅21. (1)石蕊溶液变红;Ca(OH)2+CO2 = HO +CaCO J(2)氢氧化钠消耗完通入的CO222. (1) HCl+ NaOH == NaCl+ 2O(2)氢氧化钠溶液(3) pH由小于7变到大于(或等于)723. (1)温度到达着火点是燃烧的条件之一(2)白磷露出水面前不燃烧,露出水面后燃烧(房山一模)19. (1) 2KMnO4=^= K2MnO4 + MnO2 + 02 T(2)氧气不易溶于水且不与水发生反响20. (1)火星四射,放出大量热,生成黑色固体(2)预防高温熔融物溅落,使集气瓶底炸裂21. (1)①③②(2) C22. (1)软塑料瓶变瘪(2)不能证实.由于NaOH溶液中含有水,二氧化碳能与水发生反响,也会使瓶内压强减小使瓶子变瘪23. (1)碱⑵ Na2CO3 + 2HCl === 2NaCl + H2O + CO2(3) C中无明显变化、D中石灰水变浑浊(4) Na2CO3 + CaCl2 === 2NaCl + CaC03 (顺义一模)19. (1) 2KMnO=^K2MnO+MnO+QT (2)可燃物燃烧需要与氧气接触(3)集气瓶内水面升至“ 1〞处(4)蜡烛从上到下依次熄灭20. (1)试剂瓶塞没倒放(或称量时祛码放在左盘) (2)搅拌,加速食盐溶解(3)小于21. (1)不能,NaOH§液中有水,水能溶解CO并与之发生反响(2) NaaCO+2HCl=2NaCl+h2O+COT(石景山一模)19. (1) 2KMnO4 = K2MnO4 + MnO2 + QT (2)氧气的密度比空气略大20. (1) CaCQ + 2HCl====CaC2 + H2O + CQ T (2)紫色石蕊溶液变红21 . (1) 7.5 g 和42.5 g (2) DAB22. (1)瓶中的液面上升了约1/5(2)红磷燃烧放热,使瓶内压强增大,水流到烧杯中23. (1) B (2) Ca(OH)2+ 2HCl ==== CaC+ 2H2O(3)均生成了难溶于水的碳酸钙(门头沟一模) 20. (1) 2KMnO4 K2MnO4 + MnO2 + 02 T(2)火星四射、生成黑色固体21. (1)导热性(2)直玻璃管中液面上升约一刻度(3)红磷能与氧气反响,反响后不生成气体22. (1) CaCO3 +2HCl== CaCl2 +H2O + CO2 (2)紫色石蕊变红色(3)将燃着的木条靠近集气瓶口,假设熄灭,说明集气瓶中已充满二氧化碳气体23. (1) A (2)②中无现象③中有气泡生成,无色液体变浅绿色24. (1)与氧气接触;升温,隔绝氧气(2) B中二氧化碳与氢氧化钠发生反响, B中内气压小于外界大气压,使C中液体倒吸入B中,与B中生成的碳酸钠反响产生气体, B中压强增大,C中有气泡冒出.(平谷一模)19. (1) 2KMnO &MnO + MnQ + 02T(2) CQ密度比空气大(3)剧烈燃烧、火星四射、放出大量的热,生成黑色固体.20.21. (1)高镒酸钾在水中的溶解性比在汽油中的好(3) 16g(4) a、c无现象,b比d先变红22. (1)向氢氧化钙溶液中先滴加酚Mt溶液(2)有白色沉淀产生(3) CO+ Ca(OH)2 CaCOj + H 2O23. (1) ①中b燃烧,②中b不燃烧(2) ABC(延庆一模)19. (1) B CQ密度比空气大(2) 2KMnO4 =^= &MnO4 + MnO2 + O2T20. ( 1)①②(2)偏小21. 21-A (1)将纸花一半喷湿放入CQ瓶中(2) CO2+ H2O === HCQ321-B (1) Fe + CuSO === Cu + FeSO(2)铁的金属活动性比氢强22. (1)木块燃烧,无烟煤块不燃烧(2)没有与氧气接触23. (1) NaOH+ HCl === NaCl + 2Q(2)红色溶液变为无色,pH逐渐减小至小于或等于7(3) NaCl、Na2CO3(密云一模)19. (1) 19-A: (1) 2KMnO^= "MnO+MnO+O T(2) B 19-B (1) CaCO+2HCl==CaCl2+HO+COT20. (1)排净空气,使收集的气体更纯洁(2)试管内液面升高约占试管中气体体积的1/5 ;使白磷的温度到达着火点21. (1)翻开止水夹k (2) A中产生大量气泡,注射器活塞向上运动22. (1)对A中铁丝观察一段时间后,翻开止水夹K1、K2,通入氧气后关闭止水夹K1、K2,继续观察(2)通一段时间氧气后A中铁丝外表生成红色固体而B中铁丝没有明显变化(3) A中铁丝外表红色固体减少,溶液由无色变为黄色, B中铁丝外表有气泡产生溶液由无色变为浅绿色(4) FezQ + 6HCl== 2FeCl 3 + 3H 2O(通州一模)(5) 合理给分21. (1)探究可燃物燃烧需要温度到达着火点(2) A中红磷燃烧,B中红磷不燃烧;22. (1) 12 c时,溶解度a> b, A中固体全溶,B中固体有剩余(2) AC23. (1)溶液由红色变为无色, HCl+NaOH= NaCl+H20(2)酚酗:溶液在pH〈8.2时溶液显无色,溶液仍有可能显碱性。
海淀区九年级第二学期期中练习化学2019.05 学校姓名准考据号1.本试卷共 6 页,共 24 道小题,满分45 分。
考2.在试卷和答题卡上正确填写学校名称、姓名和准考据号。
生3.试题答案一律填涂或书写在答题卡上,在试卷上作答无效。
须4.在答题卡上,选择题、绘图题用 2B 铅笔作答,其余试题用黑色笔迹署名笔作答。
知5.考试结束,将本试卷、答题卡和底稿纸一并交回。
可能用到的相对原子质量H 1C 12 O 16 Si 28 Cl 35.5第一部分选择题(共12 分)(每题只有 1 个选项切合题意。
每题 1 分)1.铁是血红蛋白的重要组分,缺铁会惹起贫血。
这里的“铁”是指A .铁原子B .铁元素C.铁单质 D .铁离子2.右图为空气成分表示图(按体积计算),此中“ c”代表的是A .氧气B .氮气b c aC.二氧化碳 D .罕有气体3.一些物质的 pH 范围以下,此中呈碱性的是A .柠檬汁( 2~ 3)B .牙膏( 8~ 9)C.西瓜汁( 5~ 6) D .橘子汁( 3~ 4)4.以下物质在氧气中焚烧,火星四射、生成黑色固体的是A .木炭B.铁丝C.蜡烛D.红磷5.以下实验操作正确的选项是A .稀释浓硫酸B .倾倒液体C.点燃酒精灯D.称量 NaCl 固体6.以下符号能表示 2 个氢分子的是A .2H B.2H +C. H2O D.2H 27.唐贞观年间用“开坛香十里,近邻醉三家”来赞美美酒。
香飘十里的原由是A .分子的质量很小B .分子间有间隔C.分子在不停运动 D .分子由原子组成8.以下物质的用途中,主要利用其物理性质的是A .熟石灰用于改进酸性土壤B.盐酸用于除铁锈C.金属用于制作导线D.氧气用于抢救9.“捕获”废气中的二氧化碳,并用于制备甲醇的微观表示图以下,以下说法正确的选项是A.两种反响物均为化合物B.甲醇分子的相对分子质量是32必定条件C.反响的方程式为CO2 + H 2CH3OH + H 2OD.生成的水中,氢元素和氧元素的质量比为2:1依照以下实验数据和溶解度曲线回答10~11 题。
2019年北京市初三化学一模分类汇编—基本实验及其原理分析〖基本实验及其原理分析〗朝阳区:19.(2分)右图是纳米铁粉在氧气中燃烧的实验。
(1)纳米铁粉燃烧的化学方程式为。
(2)锥形瓶中水的作用是。
20.(2分)探究影响物质溶解性的因素。
实验1 实验2(1)实验1的目的是探究对碳酸钠溶解性的影响。
(2)实验2可获得的结论是。
21.(2分)根据下列实验回答问题。
已知:白磷的着火点是40℃。
实验1 实验2(1)实验1中,能证明燃烧时温度需达到可燃物着火点的实验现象是。
(2)实验2中,加入泡腾片(主要成分含柠檬酸、碳酸氢钠等),观察到水中产生大量气泡、蜡烛逐渐熄灭。
产生上述现象的原因是。
22.(2分)进行如下实验,研究物质的性质。
(1)加入B溶液产生白色沉淀的原因是______(用化学方程式表示)。
(2)红色溶液中含有的物质有水、石蕊、______。
23.(3分)研究小组利用下图装置进行实验(注射器的摩擦力忽略不计)。
已知:A的容积为250 mL,B中盛有足量的水,实验前K1、K2、K3均已关闭。
(1)检查A装置的气密性。
打开K1,向外拉注射器的活塞,松手后,观察到,说明装置的气密性良好。
(2)测定A 瓶气体中二氧化碳含量。
打开K1,用注射器向A中注入20 mL NaOH溶液(足量),关闭K1,充分反应后,(填实验操作),观察到B 中的水进入A 中,当B中液面不再变化时,测得B中减少了60 mL水,则A中CO2的体积分数约为%。
东城区:18.(3分)用右图所示装置制取O2,并进行O2的性质实验。
(1)A中反应的化学方程式为_______,选择B收集氧气的原因是_________。
(2)C中可观察到铁丝剧烈燃烧、________。
19.(2分)下图为实验的基本操作。
A B C实验1 实验2(1)实验1去除粗盐中难溶性杂质的正确操作顺序是_______(填字母序号)。
(2)实验2测定溶液pH时,用玻璃棒蘸取待测液滴到________上,将显示的颜色与标准比色卡比较,读出pH。
20.(2分)从20-A或20-B中任选一个....作答。
若均作答,按20-A计分。
利用下图所示的装置完成实验(杠杆已经调至平衡)。
21. (2分)实验小组同学验证可燃物燃烧的条件,进行如下实验。
(1)验证可燃物燃烧需要O 2的现象是______。
(2)对比实验②和③,可以得出可燃物燃烧的条件是________。
22.(3分)利用下图所示实验装置(气密性良好),验证浓硫酸、浓盐酸的挥发性。
其中甲、乙、丙三个广口瓶中依次装有浓硫酸、浓氨水、浓盐酸。
房山区:19.(2分)实验室用右图装置制取氧气。
(1)高锰酸钾分解的化学方程式为。
(2)用排水法收集氧气的原因是。
20.(2分)用右图装置进行“铁丝在氧气中燃烧”的实验。
(1)实验现象为:剧烈燃烧,。
(2)集气瓶底部放水的作用是。
21.(2分)“去除粗盐中难溶性杂质”的实验操作如下图所示。
(1)此实验的正确操作顺序是(填序号,下同)。
(2)操作②中,玻璃棒的作用是_________。
A.引流B.加快溶解C.防止局部温度过高,液滴飞溅22.(2分)如右图所示进行实验。
(1)旋紧瓶盖后振荡,观察到的现象为。
(2)判断该实验能否证明二氧化碳与氢氧化钠发生了化学反应,并说明理由: 。
23.(4分)进行如下微型实验,研究物质的性质。
(1)A 中无色酚酞溶液变为红色,证明碳酸钠溶液显 性。
(2)B 中产生大量气泡的原因是 (用化学方程式解释)。
(3)碳酸钠溶液在鉴别C 、D 中的物质时,依据的不同现象是 。
(4)E 中发生复分解反应,产生白色沉淀,其反应的化学方程式为 。
丰台区:19.(2分)实验室用右图装置制取O 2。
(1)用高锰酸钾制取氧气,反应的化学方程式为 。
(2)用向上排空气法收集氧气的原因是 。
20.(2分)请从20-A 或20-B 两题中任选一个....作答,若两题均作答,按20-A 计分。
21.(3分)利用下图装置研究二氧化碳的性质。
(1)若X 为紫色石蕊溶液,观察到的现象是 、澄清石① ② ③ ④ ⑤灰水变浑浊。
B 中发生反应的化学方程式为 。
(2)若X 为氢氧化钠溶液,通入与(1)中等体积的CO 2,观察到B 中无明显现象,其原因是 。
22.(3分)实验小组用pH 传感器探究稀盐酸和氢氧化钠溶液的反应。
实验操作和测定结果如图所示:(1)盐酸和氢氧化钠反应的化学方程式为 。
(2)该实验中,甲溶液是 。
(3)能说明盐酸与氢氧化钠发生化学反应的依据是 。
23.(2分)某兴趣小组同学利用右图装置探究可燃物燃烧的条件。
实验过程:① 将红磷和白磷分别放入两只试管中,一段时间后,A 、B 试管中无明显现象。
② 用气囊鼓入空气至白磷和红磷露出水面,A 中白磷燃烧,B 中无明显现象。
已知:红磷的着火点为240℃,白磷的着火点为40℃。
(1)仅通过对比实验②中露出水面的白磷和红磷可得到的结论是 。
(2)实验过程中,能说明可燃物燃烧需要氧气的实验现象是 。
海淀区:A B19.(2分)实验室用右图所示装置制取CO2。
(1)反应的化学方程式为_________。
(2)检验CO2是否集满的操作为_________。
20.(2分)用右图所示装置测定空气中氧气的含量。
加热粗铜丝一段时间后,白磷燃烧。
(1)上述实验说明铜具有的性质是_________。
(2)能证明空气中氧气含量的现象是__________。
21.(3分)用下图所示实验研究CO2的性质。
A B C(1)A中的现象是_________。
(2)B中紫色溶液变红的原因是_________。
(3)C中没有观察到明显现象。
取少量反应后的溶液于试管中,加入足量_______,观察到有气泡产生,说明C中发生了化学反应。
22.(2分)用右图所示装置进行实验(夹持仪器略去)。
已知:白磷的着火点为40 ℃。
(1)从长颈漏斗注入过氧化氢溶液,乙中发生反应的化学方程式为_______。
(2)甲、丙中现象不同的原因是_______。
23.(3分)实验小组做了如下图所示实验。
甲 乙 丙(1)能证明甲中发生反应的现象是________。
(2)乙中可观察到白色浑浊,则发生反应的化学方程式为________。
(3)丙中铁片上有红色固体析出,银片无明显变化。
由该实验过程推断,金属活动性由强到弱为________。
门头沟区:20.(2分)根据下图回答问题:A B(1)实验室利用A 装置制取氧气的化学方程式为 。
(2)实验B 中,观察到铁丝剧烈燃烧, ,放大量热。
21.(3分)用如下图装置测定空气中氧气含量(夹持装置已略去),左侧直玻璃管中液面以上平分为5份。
(1)加热铜丝可以引燃白磷,利用的是铜有良好的 性。
(2)能证明空气中氧气含量的现象是 。
(3)用白磷能测定空气中氧气含量的原因是 。
燃烧匙水白磷粗铜丝22.(3分)用如图装置制取二氧化碳并完成部分性质实验ⅠⅡ Ⅲ(1)Ⅰ处锥形瓶中发生反应的化学方程式为 。
(2)写出Ⅱ处干燥管中的实验现象 。
(3)Ⅲ处如何证明二氧化碳气体已经充满整个集气瓶? 。
23.(2分)为探究铁、铜、银三种金属的活动性顺序,设计了A 、B 两个方案。
(1)能验证三种金属活动性顺序的方案是 (填“A”或“B”)。
(2)方案B 中,证明铁的活动性比铜强的现象是 。
24.(3分)实验小组用下图装置进行两个实验。
已知:白磷的着火点是40℃。
石灰石稀盐酸紫色石蕊溶液(1)实验一:证明可燃物燃烧条件。
A 中放有过氧化氢溶液,B 中放有一定量二氧化锰;C中放有约半瓶80℃热水,C 中左侧长导管出气口处放一块白磷。
打开分液漏斗活塞后观察到C 中白磷燃烧。
该实验证明可燃物燃烧的条件之一是 。
该实验C 中水的作用是 。
(2)实验二:证明二氧化碳与氢氧化钠发生化学反应。
B 中充满二氧化碳,C 中液体是足量稀盐酸,打开分液漏斗的活塞,将A 中氢氧化钠溶液加入到广口瓶中,关闭活塞,实验过程中可观察到明显的实验现象,产生该现象的原因是 。
石景山区:19.(2分)用右图装置进行O 2制取实验。
(1)KMnO 4受热分解的化学方程式为______。
(2)用向上排空气法收集氧气的原因是______。
20.(2分)用右图装置进行CO 2制取和性质的实验。
(1)制取二氧化碳的化学方程式为______。
(2)证明二氧化碳与水发生反应的现象是______。
21.(2分)实验小组同学配制50 g 质量分数为15%的氯化钠溶液。
ABCA B C D E(1)需要氯化钠和水的质量分别为 。
(2)实验操作顺序为E 、C 、 。
22.(2分)用右图装置进行空气中氧气含量测定的实验。
(1)证明空气中氧气含量约为1/5的实验现象是______。
(2)实验中观察到烧杯中的水变为红色,原因是______。
23.(3分)进行如下实验,研究氢氧化钙的化学性质。
(1)溶液变为红色的是 (填序号)。
(2)没有明显现象试管中发生反应的化学方程式为______。
(3)两支试管中出现浑浊现象,其原因是______。
顺义区:19.依据下图所示实验回答问题。
(1)A 中发生反应的化学方程式为__________。
(2)B 用来探究燃烧的条件,由此得出燃烧的结论是__________。
(3)C 中能证明空气中氧气含量的现象是__________。
(4)D 中观察到的现象是________。
A B C DE20.小明要配制16%的食盐水用于选种,进行了下图所示的操作。
根据图示回答问题:(1) 实验操作中存在的错误有__________(请具体说明至少一点)。
(2) 操作E 中,玻璃棒的作用是__________。
(3) 通过上述过程所配制的溶液,溶质的质量分数__________(填“小于”、“等于”或“大于”)16%。
21.利用右图所示装置研究二氧化碳的性质。
回答下列问题(1) 打开K ,向装置中通入一定量的CO 2,B 中无明显现象。
该过程能否证明CO 2与NaOH 反应,说明理由。
____________。
(2) 将注射器中的盐酸推入A 中,B 中石灰水变浑浊,则A 中发生反应的化学方程式为__________。
通州区:19. (2分)从19-A 或19-B 中任选一个作答,若均作答,按19-A 计分。
20.(2分)如图所示,用细线系住宽1cm 的铜片使之平衡,然后在铜片一端用酒精灯加热。
(1)加热一段时间后,发现铜片不能保持平衡,请用质量守恒定律解释其 原因 。
(2)若想用右图装置证明铜具有导热性,还需要的操作是: 。
21.(2分)用下图所示实验验证可燃物燃烧的条件。
已知:红磷的着火点为240℃。
A B C(1)设计A、C的目的是。
(2)能验证可燃物需要O2的现象是。