初中化学式大全-学生默写定制版(含答案)
- 格式:doc
- 大小:144.00 KB
- 文档页数:14
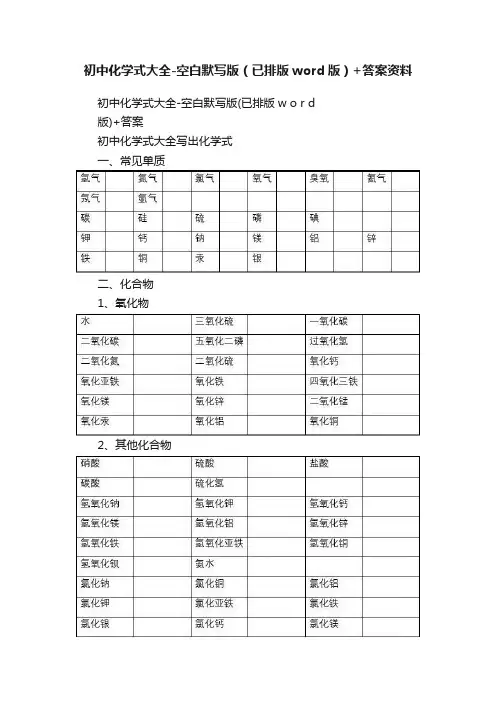
初中化学式大全-空白默写版(已排版word版)+答案资料初中化学式大全-空白默写版(已排版w o r d版)+答案初中化学式大全写出化学式一、常见单质二、化合物1、氧化物2、其他化合物3、常见有机化合物写出物质的学名、俗名写出物质的颜色和状态1、白色固体:2、绿色固体:3、蓝色固体:4、紫黑色固体:5、淡黄色固体:6、无色固体:7、银白色固体:9、红褐色固体:10、银白色:,(为银白色液态)11、黑色固体:溶液的颜色:凡含的溶液呈蓝色;凡含的溶液呈浅绿色;凡含的溶液呈棕黄色,其余溶液一般不无色。
(溶液为紫红色)11、无色液体:12、蓝色溶液:13、浅绿色溶液:14、黄色溶液:15、紫红色溶液:16、紫色溶液:沉淀(即不溶于水的盐和碱):①盐:白色↓:②碱:蓝色↓:红褐色↓:白色↓:6、(1)具有刺激性气体的气体:(2)无色无味的气体:▲注意:具有刺激性气味的液体:盐酸、硝酸、醋酸。
酒精为有特殊气体的液体。
7、有毒的,气体:CO 液体:CH3OH 固体:NaNO2 CuSO4(可作杀菌剂 ,与熟石灰混合配成天蓝色的粘稠状物质——波尔多液) (三)、气体的颜色17、红棕色气体:18、黄绿色气体:19、无色气体:写出化学方程式一、化合反应1、镁在空气中燃烧:2、铁在氧气中燃烧:3、铝在空气中燃烧:4、氢气在空气中燃烧:5、红磷在空气中燃烧:6、硫粉在空气中燃烧:7、碳在氧气中充分燃烧:8、8、碳在氧气中不充分燃烧:9、9、二氧化碳通过灼热碳层:10、10、一氧化碳在氧气中燃烧:11、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):12、生石灰溶于水:13、无水硫酸铜作干燥剂:14、钠在氯气中燃烧:二、分解反应15、实验室用双氧水制氧气:16、加热高锰酸钾:17、水在直流电的作用下分解:18、碳酸化学物理学报不稳定而分解:19、高温煅烧石灰石(二氧化碳工业制法):三、置换反应20、铁和硫酸铜溶液反应:21、锌和稀硫酸反应(实验室制氢气):22、镁和稀盐酸反应:23、氢气还原氧化铜:24、木炭还原氧化铜:25、甲烷在空气中燃烧:26、水蒸气通过灼热碳层:27、焦炭还原氧化铁:其他28、氢氧化钠溶液与硫酸铜溶液反应:29、甲烷在空气中燃烧:30、酒精在空气中燃烧:31、一氧化碳还原氧化铜:32、一氧化碳还原氧化铁:33、二氧化碳通过澄清石灰水(检验二氧化碳):34、氢氧化钠和二氧化碳反应(除去二氧化碳):35、35、石灰石(或小学音乐教案大理石)与稀盐酸反应(二氧化碳的实验室制法):36、碳酸钠与浓盐酸反应(泡沫灭火器的原理):一.物质与氧气的反应:二.(1)单质与氧气的反应:三.1. 镁在空气中燃烧:四.2. 铁在氧气中燃烧:五.3. 铜在空气中受热:六.4. 铝在空气中燃烧:七.5. 氢气中空气中燃烧:八.6. 红磷在空气中燃烧:九.7. 硫粉在空气中燃烧:十.8. 碳在氧气中充分燃烧:十一.9. 碳在氧气中不充分燃烧:十二.(2)化合物与氧气的反应:十三.10. 一氧化碳在氧气中燃烧:11.甲烷在空气中燃烧:12.12. 酒精在空气中燃烧:13.二.几个分解反应:14.13. 水在直流电的作用下分新概念英语第一册解:15.14. 加热碱式碳酸铜:16.15. 加热氯酸钾(有少量的二氧化锰):17.16. 加热高锰酸钾:18.17. 碳酸不稳定而分解:19.18. 高温煅烧石灰石:20.三.几个氧化还原反应:21.19. 氢气还原氧化铜:22.20. 木炭还原氧化铜:23.2 初三化学方程式大合集24.21. 焦炭还原氧化铁:25.22. 焦炭还原四氧化三铁:26.23. 一氧化碳还原氧化铜:27.24. 一氧化碳还原氧化铁:28.25. 一氧化碳还原四氧化三铁:29.四.单质、氧化物、酸、碱、盐的相互关系30.(1)金属单质+酸 -------- 盐+氢气(置换反应)31.26. 锌和稀硫酸32.27. 铁和稀硫酸33.28. 镁和稀硫酸34.29. 铝和稀硫酸35.30. 锌和稀盐酸36.31. 铁和稀盐酸37.32. 镁和语文教案格式稀盐酸38.33. 铝和稀盐酸39.(2)金属单质+盐(溶液) ------- 另一种金属+另一种盐40.34. 铁和硫酸铜溶液反应:41.35. 锌和硫酸铜溶液反应:42.36. 铜和硝酸汞溶液反应:43.(3)碱性氧化物+酸 -------- 盐+水44.37. 氧化铁和稀盐酸反应:45.38. 氧化铁和稀硫酸反应:46.39. 氧化铜和稀盐酸反应:47.40. 氧化铜和稀硫酸反应:48.41. 氧化镁和稀硫酸反应:49.42. 氧化钙和稀盐酸反应:50.(4)酸性氧化物+碱 -------- 盐+水51.43.苛性钠暴露在空气中变质:52.44.苛性钠吸收二氧化硫气体:53.45.苛性钠吸收三氧化硫气体:54.46.消石灰放在空气中变质:55.47. 消石灰吸收二氧化硫:56.(5)酸+碱 -------- 盐+水57.48.盐酸和烧碱起反应:58.49. 盐酸和氢氧化钾反应:59.50.盐酸和氢氧化铜反应:60.51. 盐酸和氢氧化钙反应:61.52. 盐酸和氢氧化铁反应:62.53.氢氧化铝药物治疗胃酸过多:63.54.硫酸和烧碱反应:64.55.硫酸和氢氧化钾反应:65.56.硫酸和氢氧化铜反应:66.57. 硫酸和氢氧化铁反应:67.58. 硝酸和烧碱反应:68.(6)酸+盐 -------- 另一种酸+另一种盐69.59.大理石与稀盐酸反应:70.60.碳酸钠与稀盐酸反应:71.61.碳酸镁与稀盐酸反应:72.62.盐酸和硝酸银溶液反应:73.63.硫酸和碳酸钠反应:74.64.硫酸和氯化钡溶液反应:75.(7)碱+盐 -------- 另一种碱+另一种盐76.65.氢氧化钠与硫酸铜:77.66.氢氧化钠与氯化铁:78.67.氢氧化钠与氯化镁:79.68. 氢氧化钠与氯化铜:80.69. 氢氧化钙与碳酸钠:81.(8)盐+盐 ----- 两种新盐82.70.氯化钠溶液和硝酸银溶液:71.硫酸钠和氯化钡:五.其它反应:72.二氧化碳溶解于水:73.生石灰溶于水:74.氧化钠溶于水:75.三氧化硫溶于水:76.硫酸铜晶体受热分解:77.无水硫酸铜作干燥剂:。

初中化学方程式大全一、氧气的性质:(1)单质与氧气的反应:(化合反应)1. 镁在空气中燃烧:2. 铁在氧气中燃烧:3. 铜在空气中受热:4. 铝在空气中燃烧:5. 氢气中空气中燃烧:6. 红磷在空气中燃烧(研究空气组成实验):7. 硫粉在空气中燃烧:8. 碳在氧气中充分燃烧:9. 碳在氧气中不充分燃烧:(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:11. 甲烷在空气中燃烧:12. 酒精在空气中燃烧:(3)氧气的来源:13.玻义耳研究空气的成分实验14.加热高锰酸钾:15.过氧化氢在二氧化锰作催化剂条件下分解反应15.氯酸钾在二氧化锰作催化剂加热条件下分解:二、自然界中的水:16.水在直流电的作用下分解: 17.生石灰溶于水:18.二氧化碳可溶于水:三、质量守恒定律:19.镁在空气中燃烧: 20.铁和硫酸铜溶液反应:21.氢气还原氧化铜:四、碳和碳的氧化物:(1)碳的化学性质23. 碳在氧气中充分燃烧不充分燃烧:24.木炭还原氧化铜: 25.焦炭还原氧化铁:(2)煤炉中发生的三个反应:(几个化合反应)26.煤炉的底层: 27.煤炉的中层:28.煤炉的上部蓝色火焰的产生:(3)二氧化碳的制法与性质:29.大理石与稀盐酸反应(实验室制二氧化碳):30.碳酸不稳定而分解: 31.二氧化碳可溶于水:32.高温煅烧石灰石(工业制二氧化碳):33.石灰水与二氧化碳反应(鉴别二氧化碳):(4)一氧化碳的性质:34.一氧化碳还原氧化铜: 35.一氧化碳的可燃性:其它反应:36.碳酸钠与稀盐酸反应(灭火器的原理):五、燃料及其利用:37.甲烷在空气中燃烧:38.酒精在空气中燃烧:39.氢气中空气中燃烧:六、金属(1)金属与氧气反应:40.镁在空气中燃烧: 41.铁在氧气中燃烧: 42.铜在空气中受热: 43. 铝在空气中形成氧化膜:(2)金属单质 + 酸 ---- 盐 + 氢气(置换反应)44. 锌和稀硫酸45. 铁和稀硫酸46. 镁和稀硫酸47.铝和稀硫酸48. 锌和稀盐酸49. 铁和稀盐酸50. 镁和稀盐酸51.铝和稀盐酸(3)金属单质 + 盐(溶液) ----- 新金属 + 新盐52. 铁和硫酸铜溶液反应: 53. 锌和硫酸铜溶液反应: 54. 铜和硝酸汞溶液反应:(3)金属铁的治炼原理:55. CO和 Fe2O3七、酸、碱、盐1、酸的化学性质(1)酸 + 金属 -------- 盐 + 氢气(见上)(2)酸 + 金属氧化物-------- 盐 + 水56. 氧化铁和稀盐酸反应: 57. 氧化铁和稀硫酸反应:58. 氧化铜和稀盐酸反应: 59. 氧化铜和稀硫酸反应:(3)酸 + 碱 -------- 盐 + 水(中和反应)60.盐酸和烧碱起反应:61. 盐酸和氢氧化钙反应:62. 氢氧化铝药物治疗胃酸过多:63. 硫酸和烧碱反应:(4)酸 + 盐 -------- 另一种酸 + 另一种盐64.大理石与稀盐酸反应:65.碳酸钠与稀盐酸反应:66.碳酸氢钠与稀盐酸反应:67. 硫酸和氯化钡溶液反应:2、碱的化学性质(1)碱 + 非金属氧化物 -------- 盐 + 水68.苛性钠暴露在空气中变质:69.苛性钠吸收二氧化硫气体: 70.苛性钠吸收三氧化硫气体: 71.消石灰放在空气中变质: 72. 消石灰吸收二氧化硫:(2)碱 + 酸---- 盐 + 水(中和反应,方程式见上)(3)碱 + 盐 -------- 另一种碱 + 另一种盐73. 氢氧化钙与碳酸钠:3、盐的化学性质(1)盐(溶液) + 金属单质—--新金属 +新盐74. 铁和硫酸铜溶液反应:(2)盐 + 酸-------- 另一种酸 + 另一种盐75.碳酸钠与稀盐酸反应碳酸氢钠与稀盐酸反应:(3)盐 + 碱 -------- 另一种碱 + 另一种盐76. 氢氧化钙与碳酸钠:(4)盐 + 盐 ----- 两种新盐77.检验氯离子:氯化钠溶液和硝酸银溶液78.检验硫酸根:硫酸钠和氯化钡:79.检验铵根离子:硝酸铵或碳酸铵或碳酸氢铵与氢氧化钠,初中化学方程式大全三、氧气的性质:(1)单质与氧气的反应:(化合反应)1. 镁在空气中燃烧:2Mg + O2 2MgO2. 铁在氧气中燃烧:3Fe + 2O2 Fe3O43. 铜在空气中受热:2Cu + O2 2CuO4. 铝在空气中燃烧:4Al + 3O2 2Al2O35. 氢气中空气中燃烧:2H2 + O2 2H2O6. 红磷在空气中燃烧(研究空气组成实验):4P + 5O2 2P2O57. 硫粉在空气中燃烧: S + O2 SO28. 碳在氧气中充分燃烧:C + O2 CO29. 碳在氧气中不充分燃烧:2C + O2 2CO (2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO + O2 2CO211. 甲烷在空气中燃烧:CH4 + 2O2 CO2 + 2H2O12. 酒精在空气中燃烧:C2H5OH + 3O2 2CO2 + 3H2O(3)氧气的来源:13.玻义耳研究空气的成分实验 2HgOHg+ O2↑14.加热高锰酸钾:2KMnO4 K2MnO4 + MnO2 + O2↑15.过氧化氢在二氧化锰作催化剂条件下分解反应:2H2O2 2H2O+ O2↑15.氯酸钾在二氧化锰作催化剂加热条件下分解:2KClO3 2 KCl +3O2↑四、自然界中的水:16.水在直流电的作用下分解:2H2O 2H2↑+ O2↑17.生石灰溶于水:CaO + H2O == Ca(OH)218.二氧化碳可溶于水: H2O + CO2==H2CO3三、质量守恒定律:19.镁在空气中燃烧:2Mg + O2 2MgO20.铁和硫酸铜溶液反应:Fe + CuSO4=== FeSO4+ Cu21.氢气还原氧化铜:H2 + CuO Cu + H2O四、碳和碳的氧化物:(1)碳的化学性质23. 碳在氧气中充分燃烧:C + O2 CO2不充分燃烧:2C + O2 2CO24.木炭还原氧化铜:C+ 2CuO 2Cu + CO2↑25.焦炭还原氧化铁:3C+ 2Fe2O3 4Fe + 3CO2↑(2)煤炉中发生的三个反应:(几个化合反应)26.煤炉的底层:C + O2 CO227.煤炉的中层:CO2 + C 2CO28.煤炉的上部蓝色火焰的产生:2CO + O2 2CO2(3)二氧化碳的制法与性质:29.大理石与稀盐酸反应(实验室制二氧化碳):CaCO3 + 2HCl == CaCl2 + H2O + CO2↑30.碳酸不稳定而分解:H2CO3 == H2O + CO2↑31.二氧化碳可溶于水: H2O + CO2== H2CO332.高温煅烧石灰石(工业制二氧化碳):CaCO3 CaO + CO2↑33.石灰水与二氧化碳反应(鉴别二氧化碳):Ca(OH)2 + CO2 === CaCO3↓+ H2O(4)一氧化碳的性质:34.一氧化碳还原氧化铜:CO+ CuO Cu + CO235.一氧化碳的可燃性:2CO + O2 2CO2其它反应:36.碳酸钠与稀盐酸反应(灭火器的原理):Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑五、燃料及其利用:37.甲烷在空气中燃烧:CH4 + 2O2 CO2 + 2H2O38.酒精在空气中燃烧:C2H5OH + 3O2 2CO2 + 3H2O39.氢气中空气中燃烧:2H2 + O2 2H2O六、金属(1)金属与氧气反应:40.镁在空气中燃烧:2Mg + O2 2MgO41.铁在氧气中燃烧:3Fe + 2O2 Fe3O442. 铜在空气中受热:2Cu + O2 2CuO43. 铝在空气中形成氧化膜:4Al + 3O2 = 2Al2O3(2)金属单质 + 酸 ---- 盐 + 氢气(置换反应)44. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑45. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑46. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑47. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3 H2↑48. 锌和稀盐酸Zn + 2HCl == ZnCl2 + H2↑49. 铁和稀盐酸Fe + 2HCl == FeCl2 + H2↑50. 镁和稀盐酸Mg+ 2HCl == MgCl2 + H2↑51.铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3 H2↑(3)金属单质 + 盐(溶液) ----- 新金属 + 新盐52. 铁和硫酸铜溶液反应:Fe + CuSO4== FeSO4+ Cu53. 锌和硫酸铜溶液反应:Zn + CuSO4 ==ZnSO4 + Cu54. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 == Cu(NO3)2 + Hg(3)金属铁的治炼原理:55.3CO+ Fe2O3 2Fe + 3CO2七、酸、碱、盐1、酸的化学性质(1)酸 + 金属 -------- 盐 + 氢气(见上)(2)酸 + 金属氧化物-------- 盐 + 水56. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl ==2FeCl3 + 3H2O57. 氧化铁和稀硫酸反应:Fe2O3+ 3H2SO4== Fe2(SO4)3+ 3H2O58. 氧化铜和稀盐酸反应:CuO + 2HCl ==CuCl2+ H2O59. 氧化铜和稀硫酸反应:CuO + H2SO4== CuSO4+ H2O (3)酸 + 碱 -------- 盐 + 水(中和反应)60.盐酸和烧碱起反应:HCl + NaOH == NaCl +H2O 61. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 == CaCl2 + 2H2O 62. 氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 == AlCl3 + 3H2O 63. 硫酸和烧碱反应:H2SO4+ 2NaOH == Na2SO4+ 2H2O (4)酸 + 盐 -------- 另一种酸 + 另一种盐64.大理石与稀盐酸反应:CaCO3 + 2HCl == CaCl2 + H2O + CO2↑65.碳酸钠与稀盐酸反应:Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑66.碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑67. 硫酸和氯化钡溶液反应:H2SO4 + BaCl2 == BaSO4↓+ 2HCl2、碱的化学性质(1)碱 + 非金属氧化物 -------- 盐 + 水68.苛性钠暴露在空气中变质:2NaOH + CO2 == Na2CO3 + H2O69.苛性钠吸收二氧化硫气体:2NaOH + SO2 == Na2SO3 + H2O70.苛性钠吸收三氧化硫气体:2NaOH + SO3 == Na2SO4 + H2O71.消石灰放在空气中变质:Ca(OH)2 + CO2 == CaCO3↓+ H2O72. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 == CaSO3↓+ H2O(2)碱 + 酸---- 盐 + 水(中和反应,方程式见上)(3)碱 + 盐 -------- 另一种碱 + 另一种盐73. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH3、盐的化学性质(1)盐(溶液) + 金属单质—--新金属 +新盐74. 铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu(2)盐 + 酸-------- 另一种酸 + 另一种盐75.碳酸钠与稀盐酸反应:Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑(3)盐 + 碱 -------- 另一种碱 + 另一种盐76. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH (4)盐 + 盐 ----- 两种新盐77.检验氯离子:氯化钠溶液和硝酸银溶液:NaCl + AgNO3 == AgCl↓ + NaNO378.检验硫酸根:硫酸钠和氯化钡:Na2SO4 + BaCl2 == BaSO4↓ + 2NaCl79.检验铵根离子:硝酸铵或碳酸铵或碳酸氢铵与氢氧化钠,NH4NO3+ NaOH == NaNO3+NH3↑+ H2ONH4HCO3+ NaOH == Na2CO3+NH3↑+ H2O。
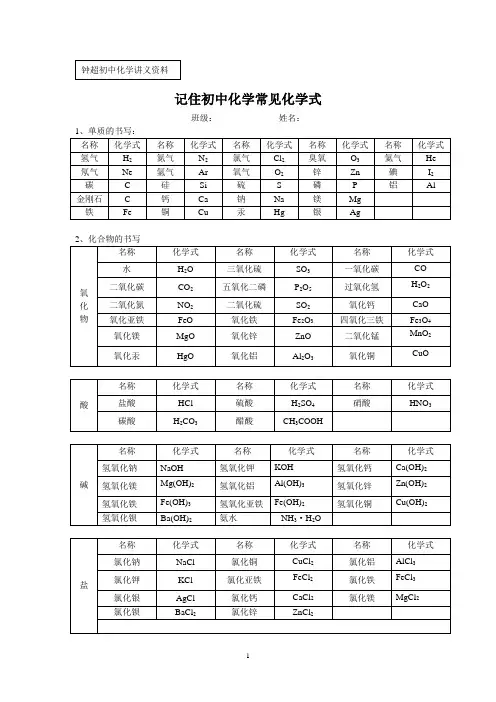

初中化学式大全-空白默写版(已排版w o r d版)+答案初中化学式大全写出化学式一、常见单质二、化合物1、氧化物2、其他化合物3、常见有机化合物写出物质的学名、俗名写出物质的颜色和状态1、白色固体:2、绿色固体:3、蓝色固体:4、紫黑色固体:5、淡黄色固体:6、无色固体:7、银白色固体:9、红褐色固体:10、银白色:,(为银白色液态)11、黑色固体:溶液的颜色:凡含的溶液呈蓝色;凡含的溶液呈浅绿色;凡含的溶液呈棕黄色,其余溶液一般不无色。
(溶液为紫红色)11、无色液体:12、蓝色溶液:13、浅绿色溶液:14、黄色溶液:15、紫红色溶液:16、紫色溶液:沉淀(即不溶于水的盐和碱):①盐:白色↓:②碱:蓝色↓:红褐色↓:白色↓:6、(1)具有刺激性气体的气体:(2)无色无味的气体:▲注意:具有刺激性气味的液体:盐酸、硝酸、醋酸。
酒精为有特殊气体的液体。
7、有毒的,气体:CO 液体:CH3OH 固体:NaNO2 CuSO4(可作杀菌剂 ,与熟石灰混合配成天蓝色的粘稠状物质——波尔多液)(三)、气体的颜色17、红棕色气体:18、黄绿色气体:19、无色气体:写出化学方程式一、化合反应1、镁在空气中燃烧:2、铁在氧气中燃烧:3、铝在空气中燃烧:4、氢气在空气中燃烧:5、红磷在空气中燃烧:6、硫粉在空气中燃烧:7、碳在氧气中充分燃烧:8、8、碳在氧气中不充分燃烧:9、9、二氧化碳通过灼热碳层:10、10、一氧化碳在氧气中燃烧:11、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):12、生石灰溶于水:13、无水硫酸铜作干燥剂:14、钠在氯气中燃烧:二、分解反应15、实验室用双氧水制氧气:16、加热高锰酸钾:17、水在直流电的作用下分解:18、碳酸化学物理学报不稳定而分解:19、高温煅烧石灰石(二氧化碳工业制法):三、置换反应20、铁和硫酸铜溶液反应:21、锌和稀硫酸反应(实验室制氢气):22、镁和稀盐酸反应:23、氢气还原氧化铜:24、木炭还原氧化铜:25、甲烷在空气中燃烧:26、水蒸气通过灼热碳层:27、焦炭还原氧化铁:其他28、氢氧化钠溶液与硫酸铜溶液反应:29、甲烷在空气中燃烧:30、酒精在空气中燃烧:31、一氧化碳还原氧化铜:32、一氧化碳还原氧化铁:33、二氧化碳通过澄清石灰水(检验二氧化碳):34、氢氧化钠和二氧化碳反应(除去二氧化碳):35、35、石灰石(或小学音乐教案大理石)与稀盐酸反应(二氧化碳的实验室制法):36、碳酸钠与浓盐酸反应(泡沫灭火器的原理):一.物质与氧气的反应:二.(1)单质与氧气的反应:三.1. 镁在空气中燃烧:四.2. 铁在氧气中燃烧:五.3. 铜在空气中受热:六.4. 铝在空气中燃烧:七.5. 氢气中空气中燃烧:八.6. 红磷在空气中燃烧:九.7. 硫粉在空气中燃烧:十.8. 碳在氧气中充分燃烧:十一.9. 碳在氧气中不充分燃烧:十二.(2)化合物与氧气的反应:十三.10. 一氧化碳在氧气中燃烧:11.甲烷在空气中燃烧:12.12. 酒精在空气中燃烧:13.二.几个分解反应:14.13. 水在直流电的作用下分新概念英语第一册解:15.14. 加热碱式碳酸铜:16.15. 加热氯酸钾(有少量的二氧化锰):17.16. 加热高锰酸钾:18.17. 碳酸不稳定而分解:19.18. 高温煅烧石灰石:20.三.几个氧化还原反应:21.19. 氢气还原氧化铜:22.20. 木炭还原氧化铜:23.2 初三化学方程式大合集24.21. 焦炭还原氧化铁:25.22. 焦炭还原四氧化三铁:26.23. 一氧化碳还原氧化铜:27.24. 一氧化碳还原氧化铁:28.25. 一氧化碳还原四氧化三铁:29.四.单质、氧化物、酸、碱、盐的相互关系30.(1)金属单质+酸 -------- 盐+氢气(置换反应)31.26. 锌和稀硫酸32.27. 铁和稀硫酸33.28. 镁和稀硫酸34.29. 铝和稀硫酸35.30. 锌和稀盐酸36.31. 铁和稀盐酸37.32. 镁和语文教案格式稀盐酸38.33. 铝和稀盐酸39.(2)金属单质+盐(溶液) ------- 另一种金属+另一种盐40.34. 铁和硫酸铜溶液反应:41.35. 锌和硫酸铜溶液反应:42.36. 铜和硝酸汞溶液反应:43.(3)碱性氧化物+酸 -------- 盐+水44.37. 氧化铁和稀盐酸反应:45.38. 氧化铁和稀硫酸反应:46.39. 氧化铜和稀盐酸反应:47.40. 氧化铜和稀硫酸反应:48.41. 氧化镁和稀硫酸反应:49.42. 氧化钙和稀盐酸反应:50.(4)酸性氧化物+碱 -------- 盐+水51.43.苛性钠暴露在空气中变质:52.44.苛性钠吸收二氧化硫气体:53.45.苛性钠吸收三氧化硫气体:54.46.消石灰放在空气中变质:55.47. 消石灰吸收二氧化硫:56.(5)酸+碱 -------- 盐+水57.48.盐酸和烧碱起反应:58.49. 盐酸和氢氧化钾反应:59.50.盐酸和氢氧化铜反应:60.51. 盐酸和氢氧化钙反应:61.52. 盐酸和氢氧化铁反应:62.53.氢氧化铝药物治疗胃酸过多:63.54.硫酸和烧碱反应:64.55.硫酸和氢氧化钾反应:65.56.硫酸和氢氧化铜反应:66.57. 硫酸和氢氧化铁反应:67.58. 硝酸和烧碱反应:68.(6)酸+盐 -------- 另一种酸+另一种盐69.59.大理石与稀盐酸反应:70.60.碳酸钠与稀盐酸反应:71.61.碳酸镁与稀盐酸反应:72.62.盐酸和硝酸银溶液反应:73.63.硫酸和碳酸钠反应:74.64.硫酸和氯化钡溶液反应:75.(7)碱+盐 -------- 另一种碱+另一种盐76.65.氢氧化钠与硫酸铜:77.66.氢氧化钠与氯化铁:78.67.氢氧化钠与氯化镁:79.68. 氢氧化钠与氯化铜:80.69. 氢氧化钙与碳酸钠:81.(8)盐+盐 ----- 两种新盐82.70.氯化钠溶液和硝酸银溶液:71.硫酸钠和氯化钡:五.其它反应:72.二氧化碳溶解于水:73.生石灰溶于水:74.氧化钠溶于水:75.三氧化硫溶于水:76.硫酸铜晶体受热分解:77.无水硫酸铜作干燥剂:初中化学式大全答案写出化学式一、常见单质二、化合物1、氧化物2、其他化合物3、常见有机化合物写出物质的学名、俗名写出物质的颜色和状态3、白色固体:MgO、P2O5、CaO、 NaOH、Ca(OH)2、KClO3、KCl、Na2CO3、NaCl、无水CuSO4;2、绿色固体:碱式碳酸铜 Cu2(OH)2CO33、蓝色固体:氢氧化铜硫酸铜晶体4、紫黑色固体:高锰酸钾5、淡黄色固体:硫6、无色固体:冰干冰金刚石7、银白色固体:银铁镁铝汞等金属9、红褐色固体:氢氧化铁10、铁、镁为银白色(汞为银白色液态)11、黑色固体:石墨、炭粉、铁粉、CuO、MnO2、Fe3O43、红色固体:Cu、Fe2O3、HgO、红磷溶液的颜色:凡含Cu2+的溶液呈蓝色;凡含Fe2+的溶液呈浅绿色;凡含Fe3+的溶液呈棕黄色,其余溶液一般不无色。

初中化学方程式大全MnO 2 △ 一、 氧气的性质: (1)单质与氧气的反应:(化合反应) 1. 镁在空气中燃烧: 2. 铁在氧气中燃烧: 3. 铜在空气中受热: 4. 铝在空气中燃烧: 5. 氢气中空气中燃烧: 6. 红磷在空气中燃烧(研究空气组成实验): 7. 硫粉在空气中燃烧: 8. 碳在氧气中充分燃烧: 9. 碳在氧气中不充分燃烧: (2)化合物与氧气的反应: 10. 一氧化碳在氧气中燃烧: 11. 甲烷在空气中燃烧: 12. 酒精在空气中燃烧: (3)氧气的来源: 13.玻义耳研究空气的成分实验 14.加热高锰酸钾: 15.过氧化氢在二氧化锰作催化剂条件下分解反应 15.氯酸钾在二氧化锰作催化剂加热条件下分解: 二、 自然界中的水: 16.水在直流电的作用下分解: 17.生石灰溶于水: 18.二氧化碳可溶于水: 三、质量守恒定律: 19.镁在空气中燃烧: 20.铁和硫酸铜溶液反应: 21.氢气还原氧化铜: 四、碳和碳的氧化物:(1)碳的化学性质23. 碳在氧气中充分燃烧不充分燃烧:24.木炭还原氧化铜: 25. 焦炭还原氧化铁: (2)煤炉中发生的三个反应:(几个化合反应) 26.煤炉的底层: 27.煤炉的中层:28.煤炉的上部蓝色火焰的产生:(3)二氧化碳的制法与性质:29.大理石与稀盐酸反应(实验室制二氧化碳): 30.碳酸不稳定而分解: 31.二氧化碳可溶于水: 32.高温煅烧石灰石(工业制二氧化碳): 33.石灰水与二氧化碳反应(鉴别二氧化碳): (4)一氧化碳的性质: 34.一氧化碳还原氧化铜: 35.一氧化碳的可燃性:其它反应: 36.碳酸钠与稀盐酸反应(灭火器的原理): 五、燃料及其利用: 37.甲烷在空气中燃烧:38.酒精在空气中燃烧: 39. 氢气中空气中燃烧: 六、金属 (1)金属与氧气反应: 40. 镁在空气中燃烧: 41. 铁在氧气中燃烧: 42. 铜在空气中受热: 43. 铝在空气中形成氧化膜: (2)金属单质 + 酸 ---- 盐 + 氢气 (置换反应) 44. 锌和稀硫酸45. 铁和稀硫酸46. 镁和稀硫酸47. 铝和稀硫酸48. 锌和稀盐酸49. 铁和稀盐酸 50. 镁和稀盐酸51.铝和稀盐酸 (3)金属单质 + 盐(溶液) ----- 新金属 + 新盐52. 铁和硫酸铜溶液反应: 53. 锌和硫酸铜溶液反应: 54. 铜和硝酸汞溶液反应:(3)金属铁的治炼原理: 55. CO 和 Fe 2O 3 七、酸、碱、盐 1、酸的化学性质 (1)酸 + 金属 -------- 盐 + 氢气(见上)(2)酸 + 金属氧化物-------- 盐 + 水 56. 氧化铁和稀盐酸反应: 57. 氧化铁和稀硫酸反应:58. 氧化铜和稀盐酸反应: 59. 氧化铜和稀硫酸反应: (3)酸 + 碱 -------- 盐 + 水(中和反应) 60.盐酸和烧碱起反应:61. 盐酸和氢氧化钙反应:62. 氢氧化铝药物治疗胃酸过多:63. 硫酸和烧碱反应:(4)酸 + 盐 -------- 另一种酸 + 另一种盐 64.大理石与稀盐酸反应:65.碳酸钠与稀盐酸反应: 66.碳酸氢钠与稀盐酸反应:67. 硫酸和氯化钡溶液反应:2、碱的化学性质(1) 碱 + 非金属氧化物 -------- 盐 + 水 68.苛性钠暴露在空气中变质:69.苛性钠吸收二氧化硫气体: 70.苛性钠吸收三氧化硫气体: 71.消石灰放在空气中变质: 72. 消石灰吸收二氧化硫: (2)碱 + 酸---- 盐 + 水(中和反应,方程式见上) (3)碱 + 盐 -------- 另一种碱 + 另一种盐 73. 氢氧化钙与碳酸钠: 3、盐的化学性质(1)盐(溶液) + 金属单质—--新金属 +新盐 74. 铁和硫酸铜溶液反应:(2)盐 + 酸-------- 另一种酸 + 另一种盐 75.碳酸钠与稀盐酸反应 碳酸氢钠与稀盐酸反应:(3)盐 + 碱 -------- 另一种碱 + 另一种盐 76. 氢氧化钙与碳酸钠: (4)盐 + 盐 ----- 两种新盐77.检验氯离子:氯化钠溶液和硝酸银溶液 78.检验硫酸根:硫酸钠和氯化钡:79.检验铵根离子:硝酸铵或碳酸铵或碳酸氢铵与氢氧化钠,初中化学方程式大全三、 氧气的性质: (1)单质与氧气的反应:(化合反应) 1. 镁在空气中燃烧:2Mg + O 2 点燃2MgO2. 铁在氧气中燃烧:3Fe + 2O 2 点燃Fe 3O 43. 铜在空气中受热:2Cu + O 2 △4. 铝在空气中燃烧:4Al + 3O 2点燃2Al 2O 35. 氢气中空气中燃烧:2H 2 + O 2MnO 2 MnO 2 △点燃2H 2O6. 红磷在空气中燃烧(研究空气组成实验): 4P + 5O 2点燃2P 2O 57. 硫粉在空气中燃烧: S + O 2点燃SO 28. 碳在氧气中充分燃烧:C + O 2点燃CO 29. 碳在氧气中不充分燃烧:2C + O 2点燃2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO + O 2点燃2CO 211. 甲烷在空气中燃烧:CH 4 + 2O 2点燃CO 2 + 2H 2O12. 酒精在空气中燃烧:C 2H 5OH + 3O 2点燃2CO 2 + 3H 2O(3)氧气的来源:13.玻义耳研究空气的成分实验 2HgO △2 ↑14.加热高锰酸钾:2KMnO 4 △K 2MnO 4 + MnO 2 + O 2↑15.过氧化氢在二氧化锰作催化剂条件下分解反应:2H 2O 2 2H2O+ O 2 ↑ 15.氯酸钾在二氧化锰作催化剂加热条件下分解:2KClO 3 2 KCl +3O 2↑ 四、 自然界中的水:16.水在直流电的作用下分解:2H 2O通电2H 2↑+ O 2 ↑17.生石灰溶于水:CaO + H 2O == Ca(OH)218.二氧化碳可溶于水:H 2O + CO 2==H 2CO 3三、质量守恒定律:19.镁在空气中燃烧:2Mg+ O 2点燃2MgO20.铁和硫酸铜溶液反应:Fe + CuSO 4 === FeSO 4 + Cu21.氢气还原氧化铜:H 2 + CuO △Cu + H 2O四、碳和碳的氧化物: (1)碳的化学性质 23. 碳在氧气中充分燃烧:C + O 2点燃CO 2不充分燃烧:2C + O 2点燃2CO24.木炭还原氧化铜:C+ 2CuO高温2Cu + CO 2↑25. 焦炭还原氧化铁:3C+ 2Fe 2O 3高温4Fe + 3CO 2↑(2)煤炉中发生的三个反应:(几个化合反应)26.煤炉的底层:C + O 2点燃CO 2 27.煤炉的中层:CO 2 + C高温2CO28.煤炉的上部蓝色火焰的产生:2CO+ O 2点燃2CO 2(3)二氧化碳的制法与性质: 29.大理石与稀盐酸反应(实验室制二氧化碳):CaCO 3 + 2HCl == CaCl 2 + H 2O + CO 2↑30.碳酸不稳定而分解:H 2CO 3 == H 2O +CO 2↑31.二氧化碳可溶于水: H 2O + CO 2==H 2CO 332.高温煅烧石灰石(工业制二氧化碳):CaCO 3高温CaO + CO 2↑33.石灰水与二氧化碳反应(鉴别二氧化碳): Ca(OH)2 + CO 2 === CaCO 3 ↓+ H 2O (4)一氧化碳的性质:34.一氧化碳还原氧化铜:CO+ CuO △Cu + CO 235.一氧化碳的可燃性:2CO + O 2点燃2CO 2其它反应:36.碳酸钠与稀盐酸反应(灭火器的原理):Na 2CO 3 + 2HCl == 2NaCl + H 2O + CO 2↑ 五、燃料及其利用:37.甲烷在空气中燃烧:CH 4 + 2O 2点燃CO 2 + 2H 2O38.酒精在空气中燃烧:C 2H 5OH + 3O 2点燃2CO 2 + 3H 2O39. 氢气中空气中燃烧:2H 2 + O 2点燃2H 2O六、金属(1)金属与氧气反应: 40. 镁在空气中燃烧:2Mg + O 2点燃2MgO41. 铁在氧气中燃烧:3Fe + 2O 2点燃Fe 3O 442. 铜在空气中受热:2Cu + O 2 △2CuO43. 铝在空气中形成氧化膜:4Al + 3O 2 = 2Al 2O 3 (2)金属单质 + 酸 ---- 盐 + 氢气 (置换反应) 44. 锌和稀硫酸Zn + H 2SO 4 = ZnSO 4 + H 2↑ 45. 铁和稀硫酸Fe + H 2SO 4 = FeSO 4 + H 2↑△46. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑47. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3 H2↑48. 锌和稀盐酸Zn + 2HCl == ZnCl2 + H2↑49. 铁和稀盐酸Fe + 2HCl == FeCl2 + H2↑50. 镁和稀盐酸Mg+ 2HCl == MgCl2 + H2↑51.铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3 H2↑(3)金属单质 + 盐(溶液) ----- 新金属 + 新盐52. 铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu53. 锌和硫酸铜溶液反应:Zn + CuSO4 ==ZnSO4 + Cu54. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 == Cu(NO3)2 + Hg(3)金属铁的治炼原理:55.3CO+ Fe2O3高温2Fe + 3CO2七、酸、碱、盐1、酸的化学性质(1)酸 + 金属 -------- 盐 + 氢气(见上)(2)酸 + 金属氧化物-------- 盐 + 水56. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl ==2FeCl3 + 3H2O57. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 == Fe2(SO4)3 + 3H2O58. 氧化铜和稀盐酸反应:CuO + 2HCl ==CuCl2 + H2O59. 氧化铜和稀硫酸反应:CuO + H2SO4 == CuSO4 + H2O(3)酸 + 碱 -------- 盐 + 水(中和反应)60.盐酸和烧碱起反应:HCl + NaOH == NaCl +H2O61. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 == CaCl2 + 2H2O62. 氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 == AlCl3 + 3H2O63. 硫酸和烧碱反应:H2SO4+ 2NaOH== Na2SO4 + 2H2O(4)酸 + 盐 -------- 另一种酸+ 另一种盐64.大理石与稀盐酸反应:CaCO3 + 2HCl == CaCl2 + H2O + CO2↑65.碳酸钠与稀盐酸反应:Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑66.碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑67. 硫酸和氯化钡溶液反应:H2SO4 + BaCl2 == BaSO4↓+ 2HCl2、碱的化学性质(1)碱 + 非金属氧化物 -------- 盐 + 水68.苛性钠暴露在空气中变质:2NaOH + CO2 == Na2CO3 + H2O69.苛性钠吸收二氧化硫气体:2NaOH + SO2 == Na2SO3 + H2O70.苛性钠吸收三氧化硫气体:2NaOH + SO3 == Na2SO4 + H2O71.消石灰放在空气中变质:Ca(OH)2 + CO2 == CaCO3↓+ H2O72. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 == CaSO3↓+ H2O(2)碱 + 酸---- 盐 + 水(中和反应,方程式见上)(3)碱 + 盐 -------- 另一种碱 + 另一种盐73. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH3、盐的化学性质(1)盐(溶液) + 金属单质—--新金属 +新盐74. 铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu(2)盐 + 酸-------- 另一种酸 + 另一种盐75.碳酸钠与稀盐酸反应:Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑(3)盐 + 碱 -------- 另一种碱 + 另一种盐76. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH(4)盐 + 盐 ----- 两种新盐77.检验氯离子:氯化钠溶液和硝酸银溶液:NaCl + AgNO3 == AgCl↓ + NaNO378.检验硫酸根:硫酸钠和氯化钡:Na2SO4 + BaCl2 == BaSO4↓ + 2NaCl79.检验铵根离子:硝酸铵或碳酸铵或碳酸氢铵与氢氧化钠,?NH4NO3 + NaOH == NaNO3 + ?NH3↑+ H2O?NH4HCO3+ NaOH == Na2CO3 + ?NH3↑+ H2O。
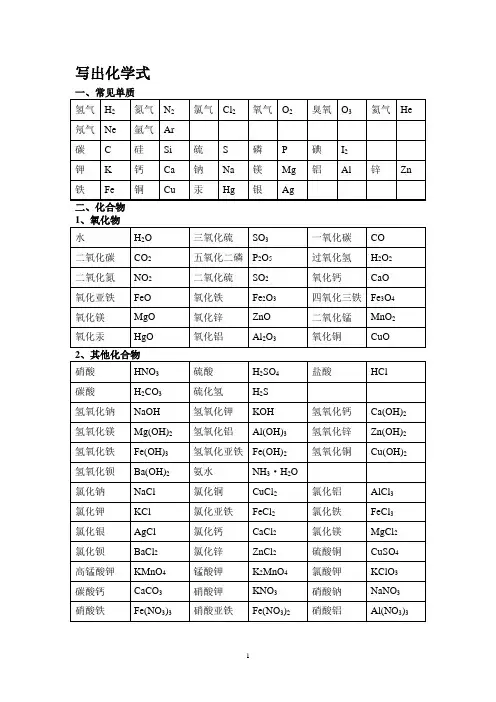
写出化学式写出物质的学名、俗名写出物质的颜色和状态1、白色固体:MgO、P2O5、CaO、NaOH、Ca(OH)2、KClO3、KCl、Na2CO3、NaCl、无水CuSO4;2、绿色固体:碱式碳酸铜Cu2(OH)2CO33、蓝色固体:氢氧化铜硫酸铜晶体4、紫黑色固体:高锰酸钾5、淡黄色固体:硫6、无色固体:冰干冰金刚石7、银白色固体:银铁镁铝汞等金属9、红褐色固体:氢氧化铁10、铁、镁为银白色(汞为银白色液态)11、黑色固体:石墨、炭粉、铁粉、CuO、MnO2、Fe3O43、红色固体:Cu、Fe2O3、HgO、红磷溶液的颜色:凡含Cu2+的溶液呈蓝色;凡含Fe2+的溶液呈浅绿色;凡含Fe3+的溶液呈棕黄色,其余溶液一般不无色。
(高锰酸钾溶液为紫红色)11、无色液体:水,双氧水12、蓝色溶液:硫酸铜溶液,氯化铜溶液,硝酸铜溶液13、浅绿色溶液:硫酸亚铁溶液,氯化亚铁溶液,硝酸亚铁溶液14、黄色溶液:硫酸铁溶液,氯化铁溶液,硝酸铁溶液15、紫红色溶液:高锰酸钾溶液16、紫色溶液:石蕊溶液沉淀(即不溶于水的盐和碱):①盐:白色↓:CaCO3、BaCO3(溶于酸)AgCl、(也不溶于稀HNO3) 等②碱:蓝色↓:Cu(OH)2红褐色↓:Fe(OH)3白色↓:BaSO4其余碱。
6、(1)具有刺激性气体的气体:NH3、SO2、HCl(皆为无色)(2)无色无味的气体:O2、H2、N2、CO2、CH4、CO(剧毒)▲注意:具有刺激性气味的液体:盐酸、硝酸、醋酸。
酒精为有特殊气体的液体。
7、有毒的,气体:CO 液体:CH3OH 固体:NaNO2 CuSO4(可作杀菌剂,与熟石灰混合配成天蓝色的粘稠状物质——波尔多液)(三)、气体的颜色17、红棕色气体:二氧化氮18、黄绿色气体:氯气19、无色气体:氧气氮气氢气二氧化碳一氧化碳二氧化硫氯化氢气体等大多数气体。
写出化学方程式一、化合反应1、镁在空气中燃烧:2Mg+ O2点燃2MgO2、铁在氧气中燃烧:3Fe +2O2点燃Fe3O43、铝在空气中燃烧:4Al+ 3O2点燃2Al2O34、氢气在空气中燃烧:2H2 +O2点燃2H2O5、红磷在空气中燃烧:4P +5O2点燃2P2O56、硫粉在空气中燃烧:S+ O2点燃27、碳在氧气中充分燃烧:C +O点燃CO28、碳在氧气中不充分燃烧:2点燃2CO9、二氧化碳通过灼热碳层:2高温2CO10、一氧化碳在氧气中燃烧:2CO +O点燃2CO211:CO2 +H2O === H2CO312、生石灰溶于水:CaO+ H2O === Ca(OH)213、无水硫酸铜作干燥剂:CuSO4 +5H2O ==== CuSO4·5H2O14、钠在氯气中燃烧:2Na+ Cl点燃2NaCl二、分解反应15、实验室用双氧水制氧气:2H2O2 MnO2 2H2O +O2↑16、加热高锰酸钾:2KMnO加热K2MnO4 + MnO2+O2↑172O 通电2H2↑+O2↑18、碳酸化学物理学报不稳定而分解:H2CO3 === H2O +CO2↑19、高温煅烧石灰石(二氧化碳工业制法):CaCO3高温CaO+ CO2↑三、置换反应20、铁和硫酸铜溶液反应:Fe+ CuSO4 == FeSO4 +Cu21、锌和稀硫酸反应(实验室制氢气):Zn+ H2SO4 == ZnSO4+H2↑22、镁和稀盐酸反应:Mg +2HCl === MgCl2 +H2↑23、氢气还原氧化铜:H2 +CuO 加热Cu +H2O24、木炭还原氧化铜:高温2Cu +CO2↑25、甲烷在空气中燃烧:CH4点燃CO2+2H2O26、水蒸气通过灼热碳层:H2高温H2 +CO27、焦炭还原氧化铁:3C +2Fe2O3高温4Fe +3CO2↑其他28、氢氧化钠溶液与硫酸铜溶液反应:2NaOH+ CuSO4 == Cu(OH)2↓+ Na2SO429、甲烷在空气中燃烧:CH4 +2O2点燃CO2 +2H2O30、酒精在空气中燃烧:C2H52点燃2CO2 +3H2O31、一氧化碳还原氧化铜:CO +CuO 加热Cu+ CO232、一氧化碳还原氧化铁:3CO+ Fe23高温2Fe+ 3CO233:Ca(OH)2+ CO2 ==== CaCO3 ↓+ H2O34、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH+ CO2 ==== Na2CO3 +H2O35、石灰石(或小学音乐教案大理石)与稀盐酸反应(二氧化碳的实验室制法):CaCO3 +2HCl === CaCl2 +H2O +CO2↑36、碳酸钠与浓盐酸反应(泡沫灭火器的原理): Na2CO3+ 2HCl === 2NaCl +H2O +CO2↑一.物质与氧气的反应:(1)单质与氧气的反应:1. 镁在空气中燃烧:2Mg+ O2点燃2MgO2. 铁在氧气中燃烧:3Fe+ 2O2点燃Fe3O43. 铜在空气中受热:2Cu+ O2加热4. 铝在空气中燃烧:4Al +3O2 点燃2Al2O35. 氢气中空气中燃烧:2H22点燃2H2O6. 红磷在空气中燃烧:4P+ 5O2点燃2P2O57. 硫粉在空气中燃烧:S +O点燃 28. 碳在氧气中充分燃烧:2点燃CO29. 碳在氧气中不充分燃烧:2点燃2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO+ O2点燃2CO211. 甲烷在空气中燃烧:CH4 +2O2点燃CO2 2H2O12. 酒精在空气中燃烧:C2H52点燃2CO2+3H2O二.几个分解反应:13. 水在直流电的作用下分新概念英语第一册解:2H2O 通电2H2↑+ O2↑14. 加热碱式碳酸铜:Cu2(OH)2CO3加热2CuO +H22↑15. 3 ==== 2KCl+ 3O2↑16. 加热高锰酸钾:2KMnO4 加热K2MnO4 +MnO2 +O2↑17. 碳酸不稳定而分解:H2CO3 === H2O +CO2↑18. 高温煅烧石灰石:CaCO高温CaO +CO2↑三.几个氧化还原反应:19. 氢气还原氧化铜:H2+ CuO 加热Cu+ H2O20. 木炭还原氧化铜:高温2Cu +CO2↑2 初三化学方程式大合集21. 焦炭还原氧化铁:3C+ 2Fe2O高温4Fe+ 3CO2↑22. 焦炭还原四氧化三铁:2C +Fe34高温3Fe+ 2CO2↑23. 一氧化碳还原氧化铜:CO +CuO 加热Cu+ CO224. 一氧化碳还原氧化铁:3CO+ Fe23高温2Fe +3CO225. 一氧化碳还原四氧化三铁:34高温3Fe+ 4CO2(1)金属单质+酸-------- 盐+氢气(置换反应)26. 锌和稀硫酸Zn+ H2SO4 = ZnSO4+ H2↑27. 铁和稀硫酸Fe +H2SO4 = FeSO4+ H2↑28. 镁和稀硫酸Mg +H2SO4 = MgSO4 +H2↑29. 铝和稀硫酸2Al+ 3H2SO4 = Al2(SO4)3 +3H2↑30. 锌和稀盐酸Zn +2HCl === ZnCl2+ H2↑31. 铁和稀盐酸Fe+ 2HCl === FeCl2+ H2↑32. 镁和语文教案格式稀盐酸Mg 2HCl === MgCl2+ H2↑33. 铝和稀盐酸2Al+ 6HCl == 2AlCl3 +3H2↑(2)金属单质+盐(溶液)------- 另一种金属+另一种盐34. 铁和硫酸铜溶液反应:Fe+ CuSO4 === FeSO4+ Cu35. 锌和硫酸铜溶液反应:Zn+ CuSO4 === ZnSO4+ Cu36. 铜和硝酸汞溶液反应:Cu +Hg(NO3)2 === Cu(NO3)2 +Hg(3)碱性氧化物+酸-------- 盐+水37. 氧化铁和稀盐酸反应:Fe2O3+ 6HCl === 2FeCl3+ 3H2O38. 氧化铁和稀硫酸反应:Fe2O3 +3H2SO4 === Fe2(SO4)3+ 3H2O39. 氧化铜和稀盐酸反应:CuO +2HCl ==== CuCl2 +H2O40. 氧化铜和稀硫酸反应:CuO +H2SO4 ==== CuSO4+ H2O41. 氧化镁和稀硫酸反应:MgO+ H2SO4 ==== MgSO4+ H2O42. 氧化钙和稀盐酸反应:CaO +2HCl ==== CaCl2 +H2O(4)酸性氧化物+碱-------- 盐+水43.苛性钠暴露在空气中变质:2NaOH +CO2 ==== Na2CO3+H2O44.苛性钠吸收二氧化硫气体:2NaOH +SO2 ==== Na2SO3 +H2O45.苛性钠吸收三氧化硫气体:2NaOH+ SO3 ==== Na2SO4+ H2O46.消石灰放在空气中变质:Ca(OH)2+ CO2 ==== CaCO3 ↓+ H2O47. 消石灰吸收二氧化硫:Ca(OH)2 +SO2 ==== CaSO3↓+H2O(5)酸+碱-------- 盐+水48.盐酸和烧碱起反应:HCl+ NaOH ==== NaCl+ H2O49. 盐酸和氢氧化钾反应:HCl+ KOH ==== KCl+H2O50.盐酸和氢氧化初中家长会课件铜反应:2HCl+ Cu(OH)2 ==== CuCl2 +2H2O51. 盐酸和氢氧化钙反应:2HCl+ Ca(OH)2 ==== CaCl2 +2H2O52. 盐酸和氢氧化铁反应:3HCl+ Fe(OH)3 ==== FeCl3 +3H2O53.氢氧化铝药物治疗胃酸过多:3HCl +Al(OH)3 ==== AlCl3 +3H2O54.硫酸和烧碱反应:H2SO4 +2NaOH ==== Na2SO4 +2H2O55.硫酸和氢氧化钾反应:H2SO4 +2KOH ==== K2SO4 +2H2O56.硫酸和氢氧化铜反应:H2SO4 +Cu(OH)2 ==== CuSO4 +2H2O57. 硫酸和氢氧化铁反应:3H2SO4 +2Fe(OH)3==== Fe2(SO4)3+ 6H2O58. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O(6)酸+盐-------- 另一种酸+另一种盐59.大理石与稀盐酸反应:CaCO3 +2HCl === CaCl2 H2O +CO2↑60.碳酸钠与稀盐酸反应: Na2CO3 +2HCl === 2NaCl +H2O+ CO2↑61.碳酸镁与稀盐酸反应: MgCO3 +2HCl === MgCl2 +H2O+CO2↑62.盐酸和硝酸银溶液反应:HCl+ AgNO3=== AgCl↓+ HNO363.硫酸和碳酸钠反应:Na2CO3 +H2SO4 === Na2SO4 +H2O +CO2↑64.硫酸和氯化钡溶液反应:H2S O4 +BaCl2 ==== BaSO4↓+ 2HCl(7)碱+盐-------- 另一种碱+另一种盐65.氢氧化钠与硫酸铜:2NaOH CuSO4 ==== Cu(OH)2↓ Na2SO466.氢氧化钠与氯化铁:3NaOH FeCl3 ==== Fe(OH)3↓ 3NaCl67.氢氧化钠与氯化镁:2NaOH MgCl2 ==== Mg(OH)2↓ 2NaCl68. 氢氧化钠与氯化铜:2NaOH CuCl2 ==== Cu(OH)2↓ 2NaCl69. 氢氧化钙与碳酸钠:Ca(OH)2 Na2CO3 === CaCO3↓ 2NaOH(8)盐+盐----- 两种新盐70.氯化钠溶液新概念英语第二册和硝酸银溶液:NaCl +AgNO3==== AgCl↓+ NaNO371.硫酸钠和氯化钡:Na2SO4+ BaCl2 ==== BaSO4↓+ 2NaCl五.其它反应:72.二氧化碳溶解于水:CO2+ H2O === H2CO373.生石灰溶于水:CaO+ H2O === Ca(OH)274.氧化钠溶于水:Na2O +H2O ==== 2NaOH75.三氧化硫溶于水:SO3 +H2O ==== H2SO476.硫酸铜晶体受热分解:CuSO4·5H2O 加热CuSO4 5H2O77.无水硫酸铜作干燥剂:CuSO4+ 5H24·5H2。

酸的通性:①酸能与反应②酸+ →盐+盐酸和镁条反应:现象:硫酸和铁粉反应:现象:③酸+ →盐+ 水盐酸和氧化铜反应:现象:硫酸和铁锈反应:现象:④酸+ →+盐酸和氢氧化钠反应:硫酸和氢氧化钾反应:⑤酸+ 盐→+盐酸和大理石反应:现象:盐酸和硝酸银反应:现象:硫酸和氯化钡反应:现象:可溶性碱的通性:①可溶性碱能与反应②可溶性碱+ →盐+氢氧化钙和二氧化碳反应:现象:氢氧化钠和二氧化碳反应:氢氧化钠和二氧化硫反应:氢氧化钠和三氧化硫反应:氢氧化钠和二氧化硅反应:③可溶性碱+ →新碱+氢氧化钠和氯化铜反应:现象:氢氧化钠和氯化铁反应:现象:氢氧化钙和碳酸钠反应:现象:④所有碱+ →+氢氧化钙和盐酸反应:氢氧化铜和盐酸反应:现象:氢氧化铁和硫酸反应:现象:盐的性质:①盐+ →+盐酸和大理石反应:现象:盐酸和硝酸银反应:现象:硫酸和氯化钡反应:现象:②盐+ →+氢氧化钠和氯化铜反应:现象:氢氧化钠和氯化铁反应:现象:氢氧化钙和碳酸钠反应:现象:氢氧化钠和硫酸铵反应:现象:③盐+ →+氯化钠和硝酸银反应:现象:硫酸钠和氯化钡反应:现象:金属活动性顺序:(H)金属的性质:①金属+ →镁条在空气中燃烧:现象:铁生锈:现象:铁在氧气中燃烧:现象:铜在空气中加热:现象:②()金属+ →+ 氢气()和硫酸反应:()和硫酸反应:()和硫酸反应:()和硫酸反应:③()金属+ →+ ()金属铁和硫酸铜反应:现象:铜和硝酸银反应:现象:酸的通性:①酸能与 酸碱指示剂 反应②酸 + (活泼)金属 → 盐 + 氢气盐酸和镁条反应:↑+===+222H MgCl Mg HCl现象: 白色固体逐渐消失,产生气泡硫酸和铁粉反应:↑+===+2442H FeSO Fe SO H现象: 黑色粉末逐渐消失,产生气泡,溶液变浅绿色③酸 + 金属氧化物 → 盐 + 水盐酸和氧化铜反应:O H CuCl CuO HCl 222+===+现象: 黑色粉末逐渐消失,溶液变蓝色硫酸和铁锈反应:O H SO Fe O Fe SO H 234232423)(3+====+现象: 红色固体逐渐消失,溶液变黄色④酸 + 碱 → 盐 + 水盐酸和氢氧化钠反应:O H NaCl NaOH HCl 2+===+硫酸和氢氧化钾反应:O H SO K KOH SO H 2424222+===+⑤酸 + 盐 → 新酸 + 新盐盐酸和大理石反应:↑++===+22232CO O H CaCl CaCO HCl现象: 固体逐渐消失,产生气泡盐酸和硝酸银反应:↓+===+AgCl HNO AgNO HCl 33现象: 产生白色沉淀硫酸和氯化钡反应:↓+===+42422BaSO HCl BaCl SO H现象: 产生白色沉淀可溶性碱的通性:①可溶性碱能与 酸碱指示剂 反应②可溶性碱 + 非金属氧化物 → 盐 + 水氢氧化钙和二氧化碳反应:O H CaCO CO OH Ca 2322)(+↓===+现象: 溶液变浑浊/产生白色沉淀氢氧化钠和二氧化碳反应:O H CO Na CO NaOH 23222+===+氢氧化钠和二氧化硫反应:O H SO Na SO NaOH 23222+===+氢氧化钠和三氧化硫反应:O H SO Na SO NaOH 24232+===+氢氧化钠和二氧化硅反应:O H SiO Na SiO NaOH 23222+===+③可溶性碱 + 可溶性盐 → 新碱 + 新盐氢氧化钠和氯化铜反应:↓+===+22)(22OH Cu NaCl CuCl NaOH现象: 产生蓝色絮状沉淀氢氧化钠和氯化铁反应:↓+===+33)(33OH Fe NaCl FeCl NaOH现象: 产生红褐色沉淀氢氧化钙和碳酸钠反应:NaOH CaCO CO Na OH Ca 2)(3322+↓===+现象: 产生白色沉淀④所有碱 + 酸 → 盐 + 水氢氧化钙和盐酸反应:O H CaCl HCl OH Ca 22222)(+===+氢氧化铜和盐酸反应:O H CuCl HCl OH Cu 22222)(+===+现象: 蓝色固体消失,溶液变蓝色氢氧化铁和硫酸反应:O H SO Fe SO H OH Fe 23424236)(3)(2+===+现象: 红褐色固体消失,溶液变黄色盐的性质:①盐 + 酸 → 新盐 + 新酸盐酸和大理石反应:↑++===+22232CO O H CaCl CaCO HCl现象: 固体逐渐消失,产生气泡盐酸和硝酸银反应:↓+===+AgCl HNO AgNO HCl 33现象: 产生白色沉淀硫酸和氯化钡反应:↓+===+42422BaSO HCl BaCl SO H现象: 产生白色沉淀②盐 + 碱 → 新盐 + 新碱氢氧化钠和氯化铜反应:↓+===+22)(22OH Cu NaCl CuCl NaOH现象: 产生蓝色絮状沉淀氢氧化钠和氯化铁反应:↓+===+33)(33OH Fe NaCl FeCl NaOH现象: 产生红褐色沉淀氢氧化钙和碳酸钠反应:NaOH CaCO CO Na OH Ca 2)(3322+↓===+现象: 产生白色沉淀氢氧化钠和硫酸铵反应:↑++===+3242424222)(NH O H SO Na NaOH SO NH 现象: 产生刺激性气味的气体③盐 + 盐 → 新盐 + 新盐氯化钠和硝酸银反应:↓+===+AgCl NaNO AgNO NaCl 33现象: 产生白色沉淀硫酸钠和氯化钡反应:↓+===+42422BaSO NaCl BaCl SO Na现象: 产生白色沉淀金属活动性顺序:K Ca Na Mg Al Zn Fe Sn Pb (H ) Cu Hg Ag Pt Au 金属的性质:①金属 + 氧气 → 金属氧化物 镁条在空气中燃烧:MgO O Mg 222点燃+现象: 发出耀眼的白光,生成白色固体铁生锈:322O Fe 23Fe 4===+O现象: 表面出现红褐色固体 铁在氧气中燃烧:432O Fe 2Fe 3点燃O +现象: 剧烈燃烧,放出大量热,火星四射,生成黑色固体 铜在空气中加热:O O Cu 2Cu 22∆+现象: 生成黑色固体②( 活泼 )金属 + 酸 → 盐 + 氢气( 镁 )和硫酸反应:↑+===+2442H H MgSO SO Mg( 铝 )和硫酸反应:↑+===+2342423)(H 32H SO Al SO Al( 锌 )和硫酸反应:↑+===+2442H Zn H ZnSO SO( 铁 )和硫酸反应:↑+===+2442H FeSO SO H Fe③( 较活泼 )金属 + 盐 → 新盐 + (较不活泼)金属铁和硫酸铜反应:Cu Cu 44+===+FeSO SO Fe现象: 红色固体析出,溶液变浅绿色铜和硝酸银反应:Ag NO 2)(Cu AgNO 2Cu 233+===+现象: 白色固体析出,溶液变蓝色。
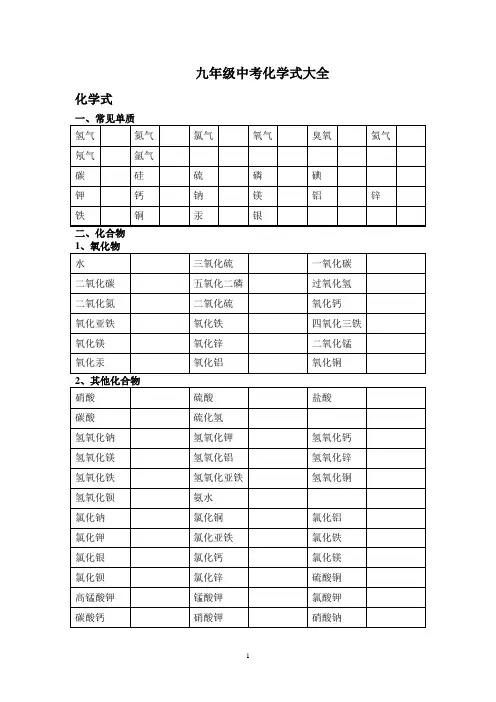
九年级中考化学式大全化学式写出物质的学名、俗名写出物质的颜色和状态1、白色固体:2、绿色固体:3、蓝色固体:4、紫黑色固体:6、无色固体:7、银白色固体:9、红褐色固体:10、银白色:,(为银白色液态)11、黑色固体:溶液的颜色:凡含的溶液呈蓝色;凡含的溶液呈浅绿色;凡含的溶液呈棕黄色,其余溶液一般不无色。
(溶液为紫红色)11、无色液体:12、蓝色溶液:13、浅绿色溶液:14、黄色溶液:15、紫红色溶液:16、紫色溶液:沉淀(即不溶于水的盐和碱):①盐:白色↓:等②碱:蓝色↓:红褐色↓:白色↓:6、(1)具有刺激性气体的气体:(2)无色无味的气体:▲注意:具有刺激性气味的液体:盐酸、硝酸、醋酸。
酒精为有特殊气体的液体。
7、有毒的,气体:CO 液体:CH3OH 固体:NaNO2 CuSO4(可作杀菌剂,与熟石灰混合配成天蓝色的粘稠状物质——波尔多液)(三)、气体的颜色18、黄绿色气体:19、无色气体:写出化学方程式一、化合反应1、镁在空气中燃烧:2、铁在氧气中燃烧:3、铝在空气中燃烧:4、氢气在空气中燃烧:5、红磷在空气中燃烧:6、硫粉在空气中燃烧:7、碳在氧气中充分燃烧:8、碳在氧气中不充分燃烧:9、二氧化碳通过灼热碳层:10、一氧化碳在氧气中燃烧:11、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):12、生石灰溶于水:13、无水硫酸铜作干燥剂:14、钠在氯气中燃烧:二、分解反应15、实验室用双氧水制氧气:16、加热高锰酸钾:17、水在直流电的作用下分解:18、碳酸化学物理学报不稳定而分解:19、高温煅烧石灰石(二氧化碳工业制法):三、置换反应20、铁和硫酸铜溶液反应:21、锌和稀硫酸反应(实验室制氢气):22、镁和稀盐酸反应:23、氢气还原氧化铜:24、木炭还原氧化铜:25、甲烷在空气中燃烧:26、水蒸气通过灼热碳层:27、焦炭还原氧化铁:其他28、氢氧化钠溶液与硫酸铜溶液反应:29、甲烷在空气中燃烧:30、酒精在空气中燃烧:31、一氧化碳还原氧化铜:32、一氧化碳还原氧化铁:33、二氧化碳通过澄清石灰水(检验二氧化碳):34、氢氧化钠和二氧化碳反应(除去二氧化碳):35、石灰石(或小学音乐教案大理石)与稀盐酸反应(二氧化碳的实验室制法):36、碳酸钠与浓盐酸反应(泡沫灭火器的原理):一.物质与氧气的反应:(1)单质与氧气的反应:1. 镁在空气中燃烧:2. 铁在氧气中燃烧:3. 铜在空气中受热:4. 铝在空气中燃烧:5. 氢气中空气中燃烧:6. 红磷在空气中燃烧:7. 硫粉在空气中燃烧:8. 碳在氧气中充分燃烧:9. 碳在氧气中不充分燃烧:(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:11.甲烷在空气中燃烧:12. 酒精在空气中燃烧:二.几个分解反应:13. 水在直流电的作用下分新概念英语第一册解:14. 加热碱式碳酸铜:15. 加热氯酸钾(有少量的二氧化锰):16. 加热高锰酸钾:17. 碳酸不稳定而分解:18. 高温煅烧石灰石:三.几个氧化还原反应:19. 氢气还原氧化铜:20. 木炭还原氧化铜:2 初三化学方程式大合集21. 焦炭还原氧化铁:22. 焦炭还原四氧化三铁:23. 一氧化碳还原氧化铜:24. 一氧化碳还原氧化铁:25. 一氧化碳还原四氧化三铁:四.单质、氧化物、酸、碱、盐的相互关系(1)金属单质+酸-------- 盐+氢气(置换反应)26. 锌和稀硫酸27. 铁和稀硫酸28. 镁和稀硫酸29. 铝和稀硫酸30. 锌和稀盐酸31. 铁和稀盐酸32. 镁和语文教案格式稀盐酸33. 铝和稀盐酸(2)金属单质+盐(溶液)------- 另一种金属+另一种盐34. 铁和硫酸铜溶液反应:35. 锌和硫酸铜溶液反应:36. 铜和硝酸汞溶液反应:(3)碱性氧化物+酸-------- 盐+水37. 氧化铁和稀盐酸反应:38. 氧化铁和稀硫酸反应:39. 氧化铜和稀盐酸反应:40. 氧化铜和稀硫酸反应:41. 氧化镁和稀硫酸反应:42. 氧化钙和稀盐酸反应:(4)酸性氧化物+碱-------- 盐+水43.苛性钠暴露在空气中变质:44.苛性钠吸收二氧化硫气体:45.苛性钠吸收三氧化硫气体:46.消石灰放在空气中变质:47. 消石灰吸收二氧化硫:(5)酸+碱-------- 盐+水48.盐酸和烧碱起反应:49. 盐酸和氢氧化钾反应:50.盐酸和氢氧化铜反应:51. 盐酸和氢氧化钙反应:52. 盐酸和氢氧化铁反应:53.氢氧化铝药物治疗胃酸过多:54.硫酸和烧碱反应:55.硫酸和氢氧化钾反应:56.硫酸和氢氧化铜反应:57. 硫酸和氢氧化铁反应:58. 硝酸和烧碱反应:(6)酸+盐-------- 另一种酸+另一种盐59.大理石与稀盐酸反应:60.碳酸钠与稀盐酸反应:61.碳酸镁与稀盐酸反应:62.盐酸和硝酸银溶液反应:63.硫酸和碳酸钠反应:64.硫酸和氯化钡溶液反应:(7)碱+盐-------- 另一种碱+另一种盐65.氢氧化钠与硫酸铜:66.氢氧化钠与氯化铁:67.氢氧化钠与氯化镁:68. 氢氧化钠与氯化铜:69. 氢氧化钙与碳酸钠:(8)盐+盐----- 两种新盐70.氯化钠溶液和硝酸银溶液:71.硫酸钠和氯化钡:五.其它反应:72.二氧化碳溶解于水:73.生石灰溶于水:74.氧化钠溶于水:75.三氧化硫溶于水:76.硫酸铜晶体受热分解:77.无水硫酸铜作干燥剂:初中化学式大全答案写出化学式写出物质的学名、俗名写出物质的颜色和状态3、白色固体:MgO、P2O5、CaO、NaOH、Ca(OH)2、KClO3、KCl、Na2CO3、NaCl、无水CuSO4;2、绿色固体:碱式碳酸铜Cu2(OH)2CO33、蓝色固体:氢氧化铜硫酸铜晶体4、紫黑色固体:高锰酸钾5、淡黄色固体:硫6、无色固体:冰干冰金刚石7、银白色固体:银铁镁铝汞等金属9、红褐色固体:氢氧化铁10、铁、镁为银白色(汞为银白色液态)11、黑色固体:石墨、炭粉、铁粉、CuO、MnO2、Fe3O43、红色固体:Cu、Fe2O3、HgO、红磷溶液的颜色:凡含Cu2+的溶液呈蓝色;凡含Fe2+的溶液呈浅绿色;凡含Fe3+的溶液呈棕黄色,其余溶液一般不无色。

MnO2△初中化学方程式大全一、氧气的性质:(1)单质与氧气的反应:(化合反应)1. 镁在空气中燃烧:2. 铁在氧气中燃烧:3. 铜在空气中受热:4. 铝在空气中燃烧:5. 氢气中空气中燃烧:6. 红磷在空气中燃烧(研究空气组成实验):7. 硫粉在空气中燃烧:8. 碳在氧气中充分燃烧:9. 碳在氧气中不充分燃烧:(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:11. 甲烷在空气中燃烧:12. 酒精在空气中燃烧:(3)氧气的来源:13.玻义耳研究空气的成分实验14.加热高锰酸钾:15.过氧化氢在二氧化锰作催化剂条件下分解反应15.氯酸钾在二氧化锰作催化剂加热条件下分解:二、自然界中的水:16.水在直流电的作用下分解: 17.生石灰溶于水:18.二氧化碳可溶于水:三、质量守恒定律:19.镁在空气中燃烧: 20.铁和硫酸铜溶液反应:21.氢气还原氧化铜:四、碳和碳的氧化物:(1)碳的化学性质23. 碳在氧气中充分燃烧不充分燃烧:24.木炭还原氧化铜: 25.焦炭还原氧化铁:(2)煤炉中发生的三个反应:(几个化合反应)26.煤炉的底层: 27.煤炉的中层:28.煤炉的上部蓝色火焰的产生:(3)二氧化碳的制法与性质:29.大理石与稀盐酸反应(实验室制二氧化碳):30.碳酸不稳定而分解: 31.二氧化碳可溶于水:32.高温煅烧石灰石(工业制二氧化碳):33.石灰水与二氧化碳反应(鉴别二氧化碳):(4)一氧化碳的性质:34.一氧化碳还原氧化铜: 35.一氧化碳的可燃性:其它反应:36.碳酸钠与稀盐酸反应(灭火器的原理):五、燃料及其利用:37.甲烷在空气中燃烧:38.酒精在空气中燃烧:39.氢气中空气中燃烧:六、金属(1)金属与氧气反应:40.镁在空气中燃烧: 41.铁在氧气中燃烧: 42.铜在空气中受热: 43. 铝在空气中形成氧化膜:(2)金属单质 + 酸 ---- 盐 + 氢气(置换反应)44. 锌和稀硫酸45. 铁和稀硫酸46. 镁和稀硫酸47.铝和稀硫酸48. 锌和稀盐酸49. 铁和稀盐酸50. 镁和稀盐酸51.铝和稀盐酸(3)金属单质 + 盐(溶液) ----- 新金属 + 新盐52. 铁和硫酸铜溶液反应: 53. 锌和硫酸铜溶液反应: 54. 铜和硝酸汞溶液反应:(3)金属铁的治炼原理:55. CO和 Fe2O3七、酸、碱、盐1、酸的化学性质(1)酸 + 金属 -------- 盐 + 氢气(见上)(2)酸 + 金属氧化物-------- 盐 + 水56. 氧化铁和稀盐酸反应: 57. 氧化铁和稀硫酸反应:58. 氧化铜和稀盐酸反应: 59. 氧化铜和稀硫酸反应:(3)酸 + 碱 -------- 盐 + 水(中和反应)60.盐酸和烧碱起反应:61. 盐酸和氢氧化钙反应:62. 氢氧化铝药物治疗胃酸过多:63. 硫酸和烧碱反应:(4)酸 + 盐 -------- 另一种酸 + 另一种盐64.大理石与稀盐酸反应:65.碳酸钠与稀盐酸反应:66.碳酸氢钠与稀盐酸反应:67. 硫酸和氯化钡溶液反应:2、碱的化学性质(1)碱 + 非金属氧化物 -------- 盐 + 水68.苛性钠暴露在空气中变质:69.苛性钠吸收二氧化硫气体: 70.苛性钠吸收三氧化硫气体: 71.消石灰放在空气中变质: 72. 消石灰吸收二氧化硫:(2)碱 + 酸---- 盐 + 水(中和反应,方程式见上)(3)碱 + 盐 -------- 另一种碱 + 另一种盐73. 氢氧化钙与碳酸钠:3、盐的化学性质(1)盐(溶液) + 金属单质—--新金属 +新盐74. 铁和硫酸铜溶液反应:(2)盐 + 酸-------- 另一种酸 + 另一种盐75.碳酸钠与稀盐酸反应碳酸氢钠与稀盐酸反应:(3)盐 + 碱 -------- 另一种碱 + 另一种盐76. 氢氧化钙与碳酸钠:(4)盐 + 盐 ----- 两种新盐77.检验氯离子:氯化钠溶液和硝酸银溶液78.检验硫酸根:硫酸钠和氯化钡:79.检验铵根离子:硝酸铵或碳酸铵或碳酸氢铵与氢氧化钠,MnO 2 MnO 2 △初中化学方程式大全三、 氧气的性质: (1)单质与氧气的反应:(化合反应)1. 镁在空气中燃烧:2Mg + O 2 点燃2MgO2. 铁在氧气中燃烧:3Fe + 2O 2点燃Fe 3O 43. 铜在空气中受热:2Cu + O 2 △2CuO4. 铝在空气中燃烧:4Al + 3O 2点燃2Al 2O 35. 氢气中空气中燃烧:2H 2 + O 2点燃2H 2O6. 红磷在空气中燃烧(研究空气组成实验):4P + 5O 2 点燃2P 2O 57. 硫粉在空气中燃烧: S + O 2 点燃SO 2 8. 碳在氧气中充分燃烧:C + O 2 点燃 CO 2 9. 碳在氧气中不充分燃烧: 2C + O 2 点燃2CO (2)化合物与氧气的反应: 10. 一氧化碳在氧气中燃烧: 2CO + O 2 点燃 2CO 2 11. 甲烷在空气中燃烧: CH 4 + 2O 2 点燃CO 2 + 2H 2O12. 酒精在空气中燃烧:C 2H 5OH + 3O 2点燃2CO 2 + 3H 2O(3)氧气的来源:13.玻义耳研究空气的成分实验 2HgO△Hg+ O 2 ↑ 14.加热高锰酸钾:2KMnO 4△K 2MnO 4 + MnO 2 + O 2↑15.过氧化氢在二氧化锰作催化剂条件下分解反应:2H 2O 2 2H 2O+ O 2 ↑ 15.氯酸钾在二氧化锰作催化剂加热条件下分解:2KClO 3 2 KCl +3O 2↑ 四、 自然界中的水:16.水在直流电的作用下分解:2H 2O 通电2H 2↑+ O 2 ↑17.生石灰溶于水:CaO + H 2O == Ca(OH)2 18.二氧化碳可溶于水: H 2O + CO 2==H 2CO 3 三、质量守恒定律: 19.镁在空气中燃烧:2Mg + O 2 点燃2MgO 20.铁和硫酸铜溶液反应:Fe + CuSO 4 === FeSO 4 + Cu21.氢气还原氧化铜:H 2 + CuO △Cu + H 2O 四、碳和碳的氧化物:(1)碳的化学性质 23. 碳在氧气中充分燃烧:C + O 2 点燃CO 2 不充分燃烧:2C + O 2 点燃2CO 24.木炭还原氧化铜:C+ 2CuO 高温2Cu + CO 2↑ 25. 焦炭还原氧化铁:3C+ 2Fe 2O 3 高温4Fe + 3CO 2↑ (2)煤炉中发生的三个反应:(几个化合反应)26.煤炉的底层:C + O 2 点燃CO 2 27.煤炉的中层:CO 2 + C高温2CO28.煤炉的上部蓝色火焰的产生:2CO + O 2点燃2CO 2(3)二氧化碳的制法与性质:29.大理石与稀盐酸反应(实验室制二氧化碳): CaCO 3 + 2HCl == CaCl 2 + H 2O + CO 2↑30.碳酸不稳定而分解:H 2CO 3 == H 2O + CO 2↑ 31.二氧化碳可溶于水: H 2O + CO 2== H 2CO 3 32.高温煅烧石灰石(工业制二氧化碳):CaCO 3 高温CaO + CO 2↑ 33.石灰水与二氧化碳反应(鉴别二氧化碳): Ca(OH)2 + CO 2 === CaCO 3 ↓+ H 2O (4)一氧化碳的性质:34.一氧化碳还原氧化铜:CO+ CuO △Cu + CO 2 35.一氧化碳的可燃性:2CO + O 2点燃2CO 2其它反应:36.碳酸钠与稀盐酸反应(灭火器的原理):Na 2CO 3 + 2HCl == 2NaCl + H 2O + CO 2↑ 五、燃料及其利用:37.甲烷在空气中燃烧:CH 4 + 2O 2 点燃CO 2 + 2H 2O 38.酒精在空气中燃烧:C 2H 5OH + 3O 2点燃2CO 2 + 3H 2O39. 氢气中空气中燃烧:2H 2 + O 2点燃2H 2O六、金属(1)金属与氧气反应: 40. 镁在空气中燃烧:2Mg + O 2点燃2MgO41. 铁在氧气中燃烧:3Fe + 2O 2点燃Fe 3O 442. 铜在空气中受热:2Cu + O 2△2CuO△43. 铝在空气中形成氧化膜:4Al + 3O2 = 2Al2O3(2)金属单质 + 酸 ---- 盐 + 氢气(置换反应)44. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑45. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑46. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑47. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3 H2↑48. 锌和稀盐酸Zn + 2HCl == ZnCl2 + H2↑49. 铁和稀盐酸Fe + 2HCl == FeCl2 + H2↑50. 镁和稀盐酸Mg+ 2HCl == MgCl2 + H2↑51.铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3 H2↑(3)金属单质 + 盐(溶液) ----- 新金属 + 新盐52. 铁和硫酸铜溶液反应:Fe + CuSO4== FeSO4+ Cu53. 锌和硫酸铜溶液反应:Zn + CuSO4 ==ZnSO4 + Cu54. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 == Cu(NO3)2 + Hg (3)金属铁的治炼原理:55.3CO+ Fe2O3高温2Fe + 3CO2七、酸、碱、盐1、酸的化学性质(1)酸 + 金属 -------- 盐 + 氢气(见上)(2)酸 + 金属氧化物-------- 盐 + 水56. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl ==2FeCl3 + 3H2O 57. 氧化铁和稀硫酸反应:Fe2O3+ 3H2SO4== Fe2(SO4)3+ 3H2O58. 氧化铜和稀盐酸反应:CuO + 2HCl ==CuCl2+ H2O59. 氧化铜和稀硫酸反应:CuO + H2SO4== CuSO4+ H2O (3)酸 + 碱 -------- 盐 + 水(中和反应)60.盐酸和烧碱起反应:HCl + NaOH == NaCl +H2O 61. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 == CaCl2 + 2H2O 62. 氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 == AlCl3 + 3H2O 63. 硫酸和烧碱反应:H2SO4+ 2NaOH == Na2SO4+ 2H2O(4)酸 + 盐 -------- 另一种酸 + 另一种盐64.大理石与稀盐酸反应:CaCO3 + 2HCl == CaCl2 + H2O + CO2↑65.碳酸钠与稀盐酸反应:Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑66.碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑67. 硫酸和氯化钡溶液反应:H2SO4 + BaCl2 == BaSO4↓+ 2HCl2、碱的化学性质(1)碱 + 非金属氧化物 -------- 盐 + 水68.苛性钠暴露在空气中变质:2NaOH + CO2 == Na2CO3 + H2O69.苛性钠吸收二氧化硫气体:2NaOH + SO2 == Na2SO3 + H2O70.苛性钠吸收三氧化硫气体:2NaOH + SO3 == Na2SO4 + H2O71.消石灰放在空气中变质:Ca(OH)2 + CO2 == CaCO3↓+ H2O72. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 == CaSO3↓+ H2O(2)碱 + 酸---- 盐 + 水(中和反应,方程式见上)(3)碱 + 盐 -------- 另一种碱 + 另一种盐73. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH3、盐的化学性质(1)盐(溶液) + 金属单质—--新金属 +新盐74. 铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu(2)盐 + 酸-------- 另一种酸 + 另一种盐75.碳酸钠与稀盐酸反应:Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑(3)盐 + 碱 -------- 另一种碱 + 另一种盐76. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH(4)盐 + 盐 ----- 两种新盐77.检验氯离子:氯化钠溶液和硝酸银溶液:NaCl + AgNO3 == AgCl↓ + NaNO378.检验硫酸根:硫酸钠和氯化钡:Na2SO4 + BaCl2 == BaSO4↓ + 2NaCl79.检验铵根离子:硝酸铵或碳酸铵或碳酸氢铵与氢氧化钠,NH4NO3+ NaOH == NaNO3+NH3↑+ H2ONH4HCO3+ NaOH == Na2CO3+NH3↑+ H2O。

MnO 2 △ 初中化学方程式大全一、 氧气的性质: (1)单质与氧气的反应:(化合反应) 1. 镁在空气中燃烧: 2. 铁在氧气中燃烧: 3. 铜在空气中受热: 4. 铝在空气中燃烧: 5. 氢气中空气中燃烧: 6. 红磷在空气中燃烧(研究空气组成实验): 7. 硫粉在空气中燃烧: 8. 碳在氧气中充分燃烧: 9. 碳在氧气中不充分燃烧: (2)化合物与氧气的反应: 10. 一氧化碳在氧气中燃烧: 11. 甲烷在空气中燃烧: 12. 酒精在空气中燃烧: (3)氧气的来源: 13.玻义耳研究空气的成分实验 14.加热高锰酸钾: 15.过氧化氢在二氧化锰作催化剂条件下分解反应 15.氯酸钾在二氧化锰作催化剂加热条件下分解: 二、 自然界中的水: 16.水在直流电的作用下分解: 17.生石灰溶于水: 18.二氧化碳可溶于水: 三、质量守恒定律: 19.镁在空气中燃烧: 20.铁和硫酸铜溶液反应: 21.氢气还原氧化铜: 四、碳和碳的氧化物: (1)碳的化学性质 23. 碳在氧气中充分燃烧不充分燃烧:24.木炭还原氧化铜: 25. 焦炭还原氧化铁:(2)煤炉中发生的三个反应:(几个化合反应) 26.煤炉的底层: 27.煤炉的中层: 28.煤炉的上部蓝色火焰的产生: (3)二氧化碳的制法与性质: 29.大理石与稀盐酸反应(实验室制二氧化碳): 30.碳酸不稳定而分解: 31.二氧化碳可溶于水: 32.高温煅烧石灰石(工业制二氧化碳):33.石灰水与二氧化碳反应(鉴别二氧化碳):(4)一氧化碳的性质:34.一氧化碳还原氧化铜: 35.一氧化碳的可燃性:其它反应:36.碳酸钠与稀盐酸反应(灭火器的原理): 五、燃料及其利用: 37.甲烷在空气中燃烧:38.酒精在空气中燃烧:39. 氢气中空气中燃烧:六、金属(1)金属与氧气反应:40. 镁在空气中燃烧: 41. 铁在氧气中燃烧: 42. 铜在空气中受热: 43. 铝在空气中形成氧化膜:(2)金属单质 + 酸 ---- 盐 + 氢气 (置换反应) 44. 锌和稀硫酸45. 铁和稀硫酸46. 镁和稀硫酸47. 铝和稀硫酸48. 锌和稀盐酸49. 铁和稀盐酸50. 镁和稀盐酸51.铝和稀盐酸(3)金属单质 + 盐(溶液) ----- 新金属 + 新盐52. 铁和硫酸铜溶液反应: 53. 锌和硫酸铜溶液反应: 54. 铜和硝酸汞溶液反应:(3)金属铁的治炼原理:55. CO 和 Fe 2O 3 七、酸、碱、盐 1、酸的化学性质 (1)酸 + 金属 -------- 盐 + 氢气(见上) (2)酸 + 金属氧化物-------- 盐 + 水 56. 氧化铁和稀盐酸反应: 57. 氧化铁和稀硫酸反应:58. 氧化铜和稀盐酸反应: 59. 氧化铜和稀硫酸反应: 60.盐酸和烧碱起反应:61. 盐酸和氢氧化钙反应: 62. 氢氧化铝药物治疗胃酸过多:63. 硫酸和烧碱反应:(4)酸 + 盐 -------- 另一种酸 + 另一种盐 64.大理石与稀盐酸反应:65.碳酸钠与稀盐酸反应:66.碳酸氢钠与稀盐酸反应:67. 硫酸和氯化钡溶液反应:2、碱的化学性质 (1) 碱 + 非金属氧化物 -------- 盐 + 水 68.苛性钠暴露在空气中变质:69.苛性钠吸收二氧化硫气体: 70.苛性钠吸收三氧化硫气体: 71.消石灰放在空气中变质: 72. 消石灰吸收二氧化硫:(2)碱 + 酸---- 盐 + 水(中和反应,方程式见上) (3)碱 + 盐 -------- 另一种碱 + 另一种盐73. 氢氧化钙与碳酸钠: 3、盐的化学性质 (1)盐(溶液) + 金属单质—--新金属 +新盐 74. 铁和硫酸铜溶液反应:(2)盐 + 酸-------- 另一种酸 + 另一种盐 75.碳酸钠与稀盐酸反应 碳酸氢钠与稀盐酸反应: (3)盐 + 碱 -------- 另一种碱 + 另一种盐 76. 氢氧化钙与碳酸钠: (4)盐 + 盐 ----- 两种新盐 77.检验氯离子:氯化钠溶液和硝酸银溶液 78.检验硫酸根:硫酸钠和氯化钡: 79.检验铵根离子:硝酸铵或碳酸铵或碳酸氢铵与氢氧化钠,MnO 2 MnO 2 △初中化学方程式大全三、 氧气的性质: (1)单质与氧气的反应:(化合反应)1. 镁在空气中燃烧:2Mg + O 2 点燃2MgO 2. 铁在氧气中燃烧:3Fe + 2O 2点燃Fe 3O 43. 铜在空气中受热:2Cu + O 2 △ 2CuO4. 铝在空气中燃烧: 4Al + 3O 2 点燃2Al 2O 3 5. 氢气中空气中燃烧:2H 2 + O 2 点燃2H 2O 6. 红磷在空气中燃烧(研究空气组成实验):4P + 5O 2 点燃2P 2O 5 7. 硫粉在空气中燃烧: S + O 2 点燃SO 2 8. 碳在氧气中充分燃烧:C + O 2 点燃 CO 2 9. 碳在氧气中不充分燃烧: 2C + O 2 点燃2CO (2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧: 2CO + O 2 点燃 2CO 211. 甲烷在空气中燃烧: CH 4 + 2O 2点燃CO 2 + 2H 2O12. 酒精在空气中燃烧:C 2H 5OH + 3O 2点燃2CO 2 + 3H 2O(3)氧气的来源:13.玻义耳研究空气的成分实验 2HgO △Hg+ O 2 ↑14.加热高锰酸钾:2KMnO 4△K 2MnO 4 + MnO 2 + O 2↑15.过氧化氢在二氧化锰作催化剂条件下分解反应:2H 2O 2 2H 2O+ O 2 ↑15.氯酸钾在二氧化锰作催化剂加热条件下分解:2KClO 3 2 KCl +3O 2↑ 四、 自然界中的水: 16.水在直流电的作用下分解:2H 2O 通电2H 2↑+ O 2 ↑17.生石灰溶于水:CaO + H 2O == Ca(OH)2 18.二氧化碳可溶于水: H 2O + CO 2==H 2CO 3三、质量守恒定律: 19.镁在空气中燃烧:2Mg + O 2点燃2MgO 20.铁和硫酸铜溶液反应:Fe + CuSO 4 === FeSO 4 + Cu 21.氢气还原氧化铜:H 2 + CuO △Cu + H 2O 四、碳和碳的氧化物:(1)碳的化学性质23. 碳在氧气中充分燃烧:C + O 2点燃CO 2 不充分燃烧:2C + O 2 点燃2CO 24.木炭还原氧化铜:C+ 2CuO高温2Cu + CO 2↑25. 焦炭还原氧化铁:3C+ 2Fe 2O 3高温4Fe + 3CO 2↑(2)煤炉中发生的三个反应:(几个化合反应)26.煤炉的底层:C + O 2点燃CO 2 27.煤炉的中层:CO 2 + C高温2CO28.煤炉的上部蓝色火焰的产生:2CO + O 2点燃2CO 2(3)二氧化碳的制法与性质:29.大理石与稀盐酸反应(实验室制二氧化碳): CaCO 3 + 2HCl == CaCl 2 + H 2O + CO 2↑30.碳酸不稳定而分解:H 2CO 3 == H 2O + CO 2↑ 31.二氧化碳可溶于水: H 2O + CO 2== H 2CO 3 32.高温煅烧石灰石(工业制二氧化碳):CaCO 3 高温CaO + CO 2↑ 33.石灰水与二氧化碳反应(鉴别二氧化碳): Ca(OH)2 + CO 2 === CaCO 3 ↓+ H 2O (4)一氧化碳的性质:34.一氧化碳还原氧化铜:CO+ CuO △Cu + CO 2 35.一氧化碳的可燃性:2CO + O 2点燃2CO 2其它反应:36.碳酸钠与稀盐酸反应(灭火器的原理):Na 2CO 3 + 2HCl == 2NaCl + H 2O + CO 2↑ 五、燃料及其利用:37.甲烷在空气中燃烧:CH 4 + 2O 2 点燃CO 2 + 2H 2O 38.酒精在空气中燃烧:C 2H 5OH + 3O 2点燃2CO 2 + 3H 2O39. 氢气中空气中燃烧:2H 2 + O 2点燃2H 2O六、金属△(1)金属与氧气反应:40.镁在空气中燃烧:2Mg + O2点燃2MgO41.铁在氧气中燃烧:3Fe + 2O2点燃Fe3O442. 铜在空气中受热:2Cu + O2△2CuO43. 铝在空气中形成氧化膜:4Al + 3O2 = 2Al2O3(2)金属单质 + 酸 ---- 盐 + 氢气(置换反应)44. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑45. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑46. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑47. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3 H2↑48. 锌和稀盐酸Zn + 2HCl == ZnCl2 + H2↑49. 铁和稀盐酸Fe + 2HCl == FeCl2 + H2↑50. 镁和稀盐酸Mg+ 2HCl == MgCl2 + H2↑51.铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3 H2↑(3)金属单质 + 盐(溶液) ----- 新金属 + 新盐52. 铁和硫酸铜溶液反应:Fe + CuSO4== FeSO4+ Cu53. 锌和硫酸铜溶液反应:Zn + CuSO4 ==ZnSO4 + Cu54. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 == Cu(NO3)2 + Hg (3)金属铁的治炼原理:55.3CO+ Fe2O3高温2Fe + 3CO2七、酸、碱、盐1、酸的化学性质(1)酸 + 金属 -------- 盐 + 氢气(见上)(2)酸 + 金属氧化物-------- 盐 + 水56. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl ==2FeCl3 + 3H2O 57. 氧化铁和稀硫酸反应:Fe2O3+ 3H2SO4== Fe2(SO4)3+ 3H2O 58. 氧化铜和稀盐酸反应:CuO + 2HCl ==CuCl2+ H2O 59. 氧化铜和稀硫酸反应:CuO + H2SO4== CuSO4+ H2O(3)酸 + 碱 -------- 盐 + 水(中和反应)60.盐酸和烧碱起反应:HCl + NaOH == NaCl +H2O61. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 == CaCl2 + 2H2O62. 氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 == AlCl3 + 3H2O63. 硫酸和烧碱反应:H2SO4+ 2NaOH == Na2SO4+ 2H2O(4)酸 + 盐 -------- 另一种酸 + 另一种盐64.大理石与稀盐酸反应:CaCO3 + 2HCl == CaCl2 + H2O + CO2↑65.碳酸钠与稀盐酸反应:Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑66.碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑67. 硫酸和氯化钡溶液反应:H2SO4 + BaCl2 == BaSO4↓+ 2HCl2、碱的化学性质(1)碱 + 非金属氧化物 -------- 盐 + 水68.苛性钠暴露在空气中变质:2NaOH + CO2 == Na2CO3 + H2O69.苛性钠吸收二氧化硫气体:2NaOH + SO2 == Na2SO3 + H2O70.苛性钠吸收三氧化硫气体:2NaOH + SO3 == Na2SO4 + H2O71.消石灰放在空气中变质:Ca(OH)2 + CO2 == CaCO3↓+ H2O72. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 == CaSO3↓+ H2O(2)碱 + 酸---- 盐 + 水(中和反应,方程式见上)(3)碱 + 盐 -------- 另一种碱 + 另一种盐73. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH3、盐的化学性质(1)盐(溶液) + 金属单质—--新金属 +新盐74. 铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu(2)盐 + 酸-------- 另一种酸 + 另一种盐75.碳酸钠与稀盐酸反应:Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑(3)盐 + 碱 -------- 另一种碱 + 另一种盐76. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH(4)盐 + 盐 ----- 两种新盐77.检验氯离子:氯化钠溶液和硝酸银溶液:NaCl + AgNO3 == AgCl↓ + NaNO378.检验硫酸根:硫酸钠和氯化钡:Na2SO4 + BaCl2 == BaSO4↓ + 2NaCl79.检验铵根离子:硝酸铵或碳酸铵或碳酸氢铵与氢氧化钠,NH4NO3+ NaOH == NaNO3+NH3↑+ H2ONH4HCO3+ NaOH == Na2CO3+NH3↑+ H2O。

化学式大全默写答案一、常见单质氢气:H2氖气:Ne碳:C钾:K铁:Fe氮气:N2氩气:Ar硅:Si钙:Ca铜:Cu氯气:Cl2硫:S钠:Na汞:Hg氧气:O2磷:P镁:Mg银:Ag臭氧:O3碘:I2铝:Al氦气:He锌:Zn二、化合物1、氧化物水:H2O二氧化碳:CO2二氧化氮:NO2氧化亚铁:FeO氧化镁:MgO氧化汞:HgO三氧化硫:SO3一氧化碳:CO过氧化氢:H2O2 氧化钙:CaO五氧化二磷:P2O5二氧化硫:SO2氧化铁:Fe2O3氧化锌:ZnO氧化铝:Al2O3硫酸:H2SO4硫化氢:H2S氢氧化钾:___氢氧化铝:Al(OH)3 氢氧化亚铁:Fe(OH)2 氨水:NH3·H2O氯化铜:CuCl2氯化亚铁:FeCl2氯化钙:CaCl2氯化锌:ZnCl2锰酸钾:KMnO4硝酸钾:KNO3硝酸亚铁:Fe(NO3)2 硫酸铜:CuSO4氯酸钾:KClO3硝酸钠:NaNO3硝酸铝:Al(NO3)3碳酸钠:Na2CO3碳酸氢钠:NaHCO3硝酸银:AgNO3硫酸钡:BaSO4甲烷:CH4乙醇:C2H5OH碳酸铵:(NH4)2CO3硫酸___:FeSO4硝酸铵:NH4NO3葡萄糖:C6H12O6三、常见有机化合物金刚石、石墨:C干冰(固体二氧化碳):CO2水银、汞Hg、苛性钠、火碱NaOH、生石灰CaO、碳酸钠晶体Na2CO3·10H2O、钙酒精、乙醇C2H5OH、氨气NH3、盐酸、氢氯酸HCl、胆矾、蓝矾、硫酸铜晶体CuSO4·5H2O、亚硫酸H2SO3、碳酸氢钠、小苏打NaHCO3、氢硫酸H2S、甲醇CH3OH、熟石灰、消石Ca(OH)2、醋酸、乙酸CH3COOH、灰、纯碱Na2CO3、亚硝酸钠NaNO2、氨水、一水合NH3·H2O、铜绿、孔雀石Cu2(OH)2CO3.以下是一些化学物质的名称和性质:1、白色固体:氧化镁(MgO)、五氧化二磷(P2O5)、氧化钙(CaO)、氢氧化钠(NaOH)、氢氧化钙(Ca(OH)2)、高氯酸钾(KClO3)、氯化钾(KCl)、碳酸钠(Na2CO3)、氯化钠(NaCl)、无水硫酸铜(CuSO4);2、绿色固体:碱式碳酸铜(Cu2(OH)2CO3);3、蓝色固体:氢氧化铜、硫酸铜晶体;4、紫黑色固体:高锰酸钾;5、淡黄色固体:硫;6、无色固体:干冰、金刚石;7、银白色固体:银、铁、镁、铝、汞等金属;8、红褐色固体:氢氧化铁;9、铁、镁为银白色(汞为银白色液态);10、黑色固体:石墨、炭粉、铁粉、氧化铜、二氧化锰、三氧化二铁;11、红色固体:铜、三氧化二铁、氧化汞、红磷。
写出化学式一、常见单质氢气H2氮气N2氯气Cl2氧气O2臭氧O3氦气He 氖气Ne氩气Ar碳C硅Si硫S磷P碘I2钾K钙Ca钠Na镁Mg铝Al锌Zn 铁Fe铜Cu汞Hg银Ag二、化合物1、氧化物水H2O三氧化硫SO3一氧化碳CO二氧化碳CO2五氧化二磷P2O5过氧化氢H2O2二氧化氮NO2二氧化硫SO2氧化钙CaO氧化亚铁FeO氧化铁Fe2O3四氧化三铁Fe3O4氧化镁MgO氧化锌ZnO二氧化锰MnO2氧化汞HgO氧化铝Al2O3氧化铜CuO2、其他化合物硝酸HNO3硫酸H2SO4盐酸HCl碳酸H2CO3硫化氢H2S氢氧化钠NaOH氢氧化钾KOH氢氧化钙Ca(OH)2氢氧化镁Mg(OH)2氢氧化铝Al(OH)3氢氧化锌Zn(OH)2氢氧化铁Fe(OH)3氢氧化亚铁Fe(OH)2氢氧化铜Cu(OH)2氢氧化钡Ba(OH)2氨水NH3·H2O氯化钠NaCl氯化铜CuCl2氯化铝AlCl3氯化钾KCl氯化亚铁FeCl2氯化铁FeCl3氯化银AgCl氯化钙CaCl2氯化镁MgCl2氯化钡BaCl2氯化锌ZnCl2硫酸铜CuSO4高锰酸钾KMnO4锰酸钾K2MnO4氯酸钾KClO3碳酸钙CaCO3硝酸钾KNO3 硝酸钠NaNO3硝酸铁Fe(NO3)3硝酸亚铁Fe(NO3)2硝酸铝Al(NO3)3碳酸钠Na 2CO 3碳酸钙CaCO 3碳酸铵(NH 4)2CO 3碳酸氢钠NaHCO 3硫酸铁Fe 2(SO 4)3硫酸亚铁FeSO 4硝酸银AgNO 3硝酸钡Ba(NO 3)2硝酸铵NH 4NO 3硫酸钡BaSO 43、常见有机化合物甲烷CH 4乙醇C 2H 5OH葡萄糖C 6H 12O 6写出物质的学名、俗名写出物质的颜色和状态1、白色固体:MgO 、P 2O 5、CaO 、NaOH 、Ca(OH)2、KClO3、KCl 、Na 2CO 3、NaCl 、无水CuSO4;2、绿色固体:碱式碳酸铜Cu 2(OH)2CO 33、蓝色固体:氢氧化铜硫酸铜晶体4、紫黑色固体:高锰酸钾5、淡黄色固体:硫6、无色固体:冰干冰金刚石7、银白色固体:银铁镁铝汞等金属9、红褐色固体:氢氧化铁10、铁、镁为银白色(汞为银白色液态)金刚石、石墨 C 干冰(固体二氧化碳)CO 2水银、汞Hg 苛性钠、火碱、烧碱NaOH 生石灰、氧化钙CaO 碳酸钠晶体、纯碱晶体Na 2CO 3·10H 2O酒精、乙醇C 2H 5OH 氨气(碱性气体)NH 3盐酸、氢氯酸HCl 胆矾、蓝矾、硫酸铜晶体CuSO 4·5H 2O亚硫酸H 2SO 3碳酸氢钠、小苏打NaHCO 3 氢硫酸H 2S 甲醇(有毒、失明、死亡)CH 3OH 熟石灰、消石灰Ca(OH)2醋酸、乙酸(具有酸的通性)CH 3COOH纯碱Na 2CO 3亚硝酸钠(工业用盐、有毒)NaNO 2氨水、一水合氨NH 3·H 2O (为常见的碱,具有碱的通性,是一种不含金属离子的碱)铜绿、孔雀石(分解生成三种氧化物的物质)Cu 2(OH)2CO 311、黑色固体:石墨、炭粉、铁粉、CuO、MnO2、Fe3O43、红色固体:Cu、Fe2O3、HgO、红磷溶液的颜色:凡含Cu2+的溶液呈蓝色;凡含Fe2+的溶液呈浅绿色;凡含Fe3+的溶液呈棕黄色,其余溶液一般不无色。
九年级中考化学式大全化学式写出物质的学名、俗名写出物质的颜色和状态1、白色固体:2、绿色固体:3、蓝色固体:4、紫黑色固体:6、无色固体:7、银白色固体:9、红褐色固体:10、银白色:,(为银白色液态)11、黑色固体:溶液的颜色:凡含的溶液呈蓝色;凡含的溶液呈浅绿色;凡含的溶液呈棕黄色,其余溶液一般不无色。
(溶液为紫红色)11、无色液体:12、蓝色溶液:13、浅绿色溶液:14、黄色溶液:15、紫红色溶液:16、紫色溶液:沉淀(即不溶于水的盐和碱):①盐:白色↓:等②碱:蓝色↓:红褐色↓:白色↓:6、(1)具有刺激性气体的气体:(2)无色无味的气体:▲注意:具有刺激性气味的液体:盐酸、硝酸、醋酸。
酒精为有特殊气体的液体。
7、有毒的,气体:CO 液体:CH3OH 固体:NaNO2 CuSO4(可作杀菌剂,与熟石灰混合配成天蓝色的粘稠状物质——波尔多液)(三)、气体的颜色18、黄绿色气体:19、无色气体:写出化学方程式一、化合反应1、镁在空气中燃烧:2、铁在氧气中燃烧:3、铝在空气中燃烧:4、氢气在空气中燃烧:5、红磷在空气中燃烧:6、硫粉在空气中燃烧:7、碳在氧气中充分燃烧:8、碳在氧气中不充分燃烧:9、二氧化碳通过灼热碳层:10、一氧化碳在氧气中燃烧:11、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):12、生石灰溶于水:13、无水硫酸铜作干燥剂:14、钠在氯气中燃烧:二、分解反应15、实验室用双氧水制氧气:16、加热高锰酸钾:17、水在直流电的作用下分解:18、碳酸化学物理学报不稳定而分解:19、高温煅烧石灰石(二氧化碳工业制法):三、置换反应20、铁和硫酸铜溶液反应:21、锌和稀硫酸反应(实验室制氢气):22、镁和稀盐酸反应:23、氢气还原氧化铜:24、木炭还原氧化铜:25、甲烷在空气中燃烧:26、水蒸气通过灼热碳层:27、焦炭还原氧化铁:其他28、氢氧化钠溶液与硫酸铜溶液反应:29、甲烷在空气中燃烧:30、酒精在空气中燃烧:31、一氧化碳还原氧化铜:32、一氧化碳还原氧化铁:33、二氧化碳通过澄清石灰水(检验二氧化碳):34、氢氧化钠和二氧化碳反应(除去二氧化碳):35、石灰石(或小学音乐教案大理石)与稀盐酸反应(二氧化碳的实验室制法):36、碳酸钠与浓盐酸反应(泡沫灭火器的原理):一.物质与氧气的反应:(1)单质与氧气的反应:1. 镁在空气中燃烧:2. 铁在氧气中燃烧:3. 铜在空气中受热:4. 铝在空气中燃烧:5. 氢气中空气中燃烧:6. 红磷在空气中燃烧:7. 硫粉在空气中燃烧:8. 碳在氧气中充分燃烧:9. 碳在氧气中不充分燃烧:(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:11.甲烷在空气中燃烧:12. 酒精在空气中燃烧:二.几个分解反应:13. 水在直流电的作用下分新概念英语第一册解:14. 加热碱式碳酸铜:15. 加热氯酸钾(有少量的二氧化锰):16. 加热高锰酸钾:17. 碳酸不稳定而分解:18. 高温煅烧石灰石:三.几个氧化还原反应:19. 氢气还原氧化铜:20. 木炭还原氧化铜:2 初三化学方程式大合集21. 焦炭还原氧化铁:22. 焦炭还原四氧化三铁:23. 一氧化碳还原氧化铜:24. 一氧化碳还原氧化铁:25. 一氧化碳还原四氧化三铁:四.单质、氧化物、酸、碱、盐的相互关系(1)金属单质+酸-------- 盐+氢气(置换反应)26. 锌和稀硫酸27. 铁和稀硫酸28. 镁和稀硫酸29. 铝和稀硫酸30. 锌和稀盐酸31. 铁和稀盐酸32. 镁和语文教案格式稀盐酸33. 铝和稀盐酸(2)金属单质+盐(溶液)------- 另一种金属+另一种盐34. 铁和硫酸铜溶液反应:35. 锌和硫酸铜溶液反应:36. 铜和硝酸汞溶液反应:(3)碱性氧化物+酸-------- 盐+水37. 氧化铁和稀盐酸反应:38. 氧化铁和稀硫酸反应:39. 氧化铜和稀盐酸反应:40. 氧化铜和稀硫酸反应:41. 氧化镁和稀硫酸反应:42. 氧化钙和稀盐酸反应:(4)酸性氧化物+碱-------- 盐+水43.苛性钠暴露在空气中变质:44.苛性钠吸收二氧化硫气体:45.苛性钠吸收三氧化硫气体:46.消石灰放在空气中变质:47. 消石灰吸收二氧化硫:(5)酸+碱-------- 盐+水48.盐酸和烧碱起反应:49. 盐酸和氢氧化钾反应:50.盐酸和氢氧化铜反应:51. 盐酸和氢氧化钙反应:52. 盐酸和氢氧化铁反应:53.氢氧化铝药物治疗胃酸过多:54.硫酸和烧碱反应:55.硫酸和氢氧化钾反应:56.硫酸和氢氧化铜反应:57. 硫酸和氢氧化铁反应:58. 硝酸和烧碱反应:(6)酸+盐-------- 另一种酸+另一种盐59.大理石与稀盐酸反应:60.碳酸钠与稀盐酸反应:61.碳酸镁与稀盐酸反应:62.盐酸和硝酸银溶液反应:63.硫酸和碳酸钠反应:64.硫酸和氯化钡溶液反应:(7)碱+盐-------- 另一种碱+另一种盐65.氢氧化钠与硫酸铜:66.氢氧化钠与氯化铁:67.氢氧化钠与氯化镁:68. 氢氧化钠与氯化铜:69. 氢氧化钙与碳酸钠:(8)盐+盐----- 两种新盐70.氯化钠溶液和硝酸银溶液:71.硫酸钠和氯化钡:五.其它反应:72.二氧化碳溶解于水:73.生石灰溶于水:74.氧化钠溶于水:75.三氧化硫溶于水:76.硫酸铜晶体受热分解:77.无水硫酸铜作干燥剂:初中化学式大全答案写出化学式写出物质的学名、俗名写出物质的颜色和状态3、白色固体:MgO、P2O5、CaO、NaOH、Ca(OH)2、KClO3、KCl、Na2CO3、NaCl、无水CuSO4;2、绿色固体:碱式碳酸铜Cu2(OH)2CO33、蓝色固体:氢氧化铜硫酸铜晶体4、紫黑色固体:高锰酸钾5、淡黄色固体:硫6、无色固体:冰干冰金刚石7、银白色固体:银铁镁铝汞等金属9、红褐色固体:氢氧化铁10、铁、镁为银白色(汞为银白色液态)11、黑色固体:石墨、炭粉、铁粉、CuO、MnO2、Fe3O43、红色固体:Cu、Fe2O3、HgO、红磷溶液的颜色:凡含Cu2+的溶液呈蓝色;凡含Fe2+的溶液呈浅绿色;凡含Fe3+的溶液呈棕黄色,其余溶液一般不无色。
(高锰酸钾溶液为紫红色)11、无色液体:水,双氧水12、蓝色溶液:硫酸铜溶液,氯化铜溶液,硝酸铜溶液13、浅绿色溶液:硫酸亚铁溶液,氯化亚铁溶液,硝酸亚铁溶液14、黄色溶液:硫酸铁溶液,氯化铁溶液,硝酸铁溶液15、紫红色溶液:高锰酸钾溶液16、紫色溶液:石蕊溶液沉淀(即不溶于水的盐和碱):①盐:白色↓:CaCO3、BaCO3(溶于酸)AgCl、(也不溶于稀HNO3) 等②碱:蓝色↓:Cu(OH)2红褐色↓:Fe(OH)3白色↓:BaSO4其余碱。
6、(1)具有刺激性气体的气体:NH3、SO2、HCl(皆为无色)(2)无色无味的气体:O2、H2、N2、CO2、CH4、CO(剧毒)▲注意:具有刺激性气味的液体:盐酸、硝酸、醋酸。
酒精为有特殊气体的液体。
7、有毒的,气体:CO 液体:CH3OH 固体:NaNO2 CuSO4(可作杀菌剂,与熟石灰混合配成天蓝色的粘稠状物质——波尔多液)(三)、气体的颜色17、红棕色气体:二氧化氮18、黄绿色气体:氯气19、无色气体:氧气氮气氢气二氧化碳一氧化碳二氧化硫氯化氢气体等大多数气体。
写出化学方程式一、化合反应1、镁在空气中燃烧:2Mg+ O2点燃2MgO2、铁在氧气中燃烧:3Fe +2O2点燃Fe3O43、铝在空气中燃烧:4Al+ 3O2点燃2Al2O34、氢气在空气中燃烧:2H2 +O2点燃2H2O5、红磷在空气中燃烧:4P +5O2点燃2P2O56、硫粉在空气中燃烧:S+ O2点燃27、碳在氧气中充分燃烧:C +O点燃CO28、碳在氧气中不充分燃烧:2点燃2CO9、二氧化碳通过灼热碳层:2高温2CO10、一氧化碳在氧气中燃烧:2CO +O点燃2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 +H2O === H2CO312、生石灰溶于水:CaO+ H2O === Ca(OH)213、无水硫酸铜作干燥剂:CuSO4 +5H2O ==== CuSO4·5H2O14、钠在氯气中燃烧:2Na+ Cl点燃2NaCl二、分解反应15、实验室用双氧水制氧气:2H2O2 MnO2 2H2O +O2↑16、加热高锰酸钾:2KMnO4 加热K2MnO4 + MnO2+O2↑17、水在直流电的作用下分解:2H2O 通电2H2↑+O2↑1823 === H2O +CO2↑19、高温煅烧石灰石(二氧化碳工业制法):CaCO3高温CaO+ CO2↑三、置换反应20、铁和硫酸铜溶液反应:Fe+ CuSO4 == FeSO4 +Cu21、锌和稀硫酸反应(实验室制氢气):Zn+ H2SO4 == ZnSO4+H2↑22、镁和稀盐酸反应:Mg +2HCl === MgCl2 +H2↑23、氢气还原氧化铜:H2 +CuO 加热Cu +H2O24、木炭还原氧化铜:高温2Cu +CO2↑25、甲烷在空气中燃烧:CH4 2 点燃CO2+2H2O26、水蒸气通过灼热碳层:H2O +C 高温H2 +CO27、焦炭还原氧化铁:3C +2Fe2O3高温4Fe +3CO2↑其他28、氢氧化钠溶液与硫酸铜溶液反应:2NaOH+ CuSO4 == Cu(OH)2↓+ Na2SO429、甲烷在空气中燃烧:CH4 +2O2点燃CO2 +2H2O30、酒精在空气中燃烧:C2H52点燃2CO2 +3H2O31、一氧化碳还原氧化铜:CO +CuO 加热Cu+ CO232、一氧化碳还原氧化铁:3CO+ Fe23高温2Fe+ 3CO233:Ca(OH)2+ CO2 ==== CaCO3 ↓+ H2O34、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH+ CO2 ==== Na2CO3 +H2O35、石灰石(或小学音乐教案大理石)与稀盐酸反应(二氧化碳的实验室制法):CaCO3 +2HCl === CaCl2 +H2O +CO2↑36、碳酸钠与浓盐酸反应(泡沫灭火器的原理): Na2CO3+ 2HCl === 2NaCl +H2O +CO2↑一.物质与氧气的反应:(1)单质与氧气的反应:1. 镁在空气中燃烧:2Mg+ O2点燃2MgO2. 铁在氧气中燃烧:3Fe+ 2O2点燃Fe3O43. 铜在空气中受热:2Cu+ O2加热4. 铝在空气中燃烧:4Al +3O2 点燃2Al2O35. 氢气中空气中燃烧:2H22点燃2H2O6. 红磷在空气中燃烧:4P+ 5O2点燃2P2O57. 硫粉在空气中燃烧:S +O点燃 28. 碳在氧气中充分燃烧:2点燃CO29. 碳在氧气中不充分燃烧:2点燃2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO+ O2点燃2CO211. 甲烷在空气中燃烧:CH4 +2O2点燃2 2H2O12. 酒精在空气中燃烧:C2H5OH +3O2点燃2CO2+3H2O二.几个分解反应:13. 水在直流电的作用下分新概念英语第一册解:2H2O 通电2H2↑+ O2↑14. 加热碱式碳酸铜:Cu2(OH)2CO3加热2CuO +H22↑15. 3 ==== 2KCl+ 3O2↑16. 加热高锰酸钾:2KMnO4 加热K2MnO4 +MnO2 +O2↑17. 碳酸不稳定而分解:H232O +CO2↑18. 高温煅烧石灰石:CaCO高温CaO +CO2↑三.几个氧化还原反应:19. 氢气还原氧化铜:H2+ CuO 加热Cu+ H2O20. 木炭还原氧化铜:高温2Cu +CO2↑2 初三化学方程式大合集21. 焦炭还原氧化铁:3C+ 2Fe2O高温4Fe+ 3CO2↑22. 焦炭还原四氧化三铁:2C +Fe34高温3Fe+ 2CO2↑23. 一氧化碳还原氧化铜:CO +CuO 加热Cu+ CO224. 一氧化碳还原氧化铁:3CO+ Fe2O3高温2Fe +3CO225. 一氧化碳还原四氧化三铁:34高温3Fe+ 4CO2(1)金属单质+酸-------- 盐+氢气(置换反应)26. 锌和稀硫酸Zn+ H2SO4 = ZnSO4+ H2↑27. 铁和稀硫酸Fe +H2SO4 = FeSO4+ H2↑28. 镁和稀硫酸Mg +H2SO4 = MgSO4 +H2↑29. 铝和稀硫酸2Al+ 3H2SO4 = Al2(SO4)3 +3H2↑30. 锌和稀盐酸Zn +2HCl === ZnCl2+ H2↑31. 铁和稀盐酸Fe+ 2HCl === FeCl2+ H2↑32. 镁和语文教案格式稀盐酸Mg 2HCl === MgCl2+ H2↑33. 铝和稀盐酸2Al+ 6HCl == 2AlCl3 +3H2↑(2)金属单质+盐(溶液)------- 另一种金属+另一种盐34. 铁和硫酸铜溶液反应:Fe+ CuSO4 === FeSO4+ Cu35. 锌和硫酸铜溶液反应:Zn+ CuSO4 === ZnSO4+ Cu36. 铜和硝酸汞溶液反应:Cu +Hg(NO3)2 === Cu(NO3)2 +Hg(3)碱性氧化物+酸-------- 盐+水37. 氧化铁和稀盐酸反应:Fe2O3+ 6HCl === 2FeCl3+ 3H2O38. 氧化铁和稀硫酸反应:Fe2O3 +3H2SO4 === Fe2(SO4)3+ 3H2O39. 氧化铜和稀盐酸反应:CuO +2HCl ==== CuCl2 +H2O40. 氧化铜和稀硫酸反应:CuO +H2SO4 ==== CuSO4+ H2O41. 氧化镁和稀硫酸反应:MgO+ H2SO4 ==== MgSO4+ H2O42. 氧化钙和稀盐酸反应:CaO +2HCl ==== CaCl2 +H2O(4)酸性氧化物+碱-------- 盐+水43.苛性钠暴露在空气中变质:2NaOH +CO2 ==== Na2CO3+H2O44.苛性钠吸收二氧化硫气体:2NaOH +SO2 ==== Na2SO3 +H2O45.苛性钠吸收三氧化硫气体:2NaOH+ SO3 ==== Na2SO4+ H2O46.消石灰放在空气中变质:Ca(OH)2+ CO2 ==== CaCO3 ↓+ H2O 47. 消石灰吸收二氧化硫:Ca(OH)2 +SO2 ==== CaSO3↓+H2O(5)酸+碱-------- 盐+水48.盐酸和烧碱起反应:HCl+ NaOH ==== NaCl+ H2O49. 盐酸和氢氧化钾反应:HCl+ KOH ==== KCl+H2O50.盐酸和氢氧化铜反应:2HCl+ Cu(OH)2 ==== CuCl2 +2H2O51. 盐酸和氢氧化钙反应:2HCl+ Ca(OH)2 ==== CaCl2 +2H2O52. 盐酸和氢氧化铁反应:3HCl+ Fe(OH)3 ==== FeCl3 +3H2O53.氢氧化铝药物治疗胃酸过多:3HCl +Al(OH)3 ==== AlCl3 +3H2O54.硫酸和烧碱反应:H2SO4 +2NaOH ==== Na2SO4 +2H2O55.硫酸和氢氧化钾反应:H2SO4 +2KOH ==== K2SO4 +2H2O56.硫酸和氢氧化铜反应:H2SO4 +Cu(OH)2 ==== CuSO4 +2H2O57. 硫酸和氢氧化铁反应:3H2SO4 +2Fe(OH)3==== Fe2(SO4)3+ 6H2O58. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O(6)酸+盐-------- 另一种酸+另一种盐59.大理石与稀盐酸反应:CaCO3 +2HCl === CaCl2 H2O +CO2↑ 60.碳酸钠与稀盐酸反应: Na2CO3 +2HCl === 2NaCl +H2O+ CO2↑ 61.碳酸镁与稀盐酸反应: MgCO3 +2HCl === MgCl2 +H2O+CO2↑ 62.盐酸和硝酸银溶液反应:HCl+ AgNO3=== AgCl↓+ HNO363.硫酸和碳酸钠反应:Na2CO3 +H2SO4 === Na2SO4 +H2O +CO2↑64.硫酸和氯化钡溶液反应:H2S O4 +BaCl2 ==== BaSO4↓+ 2HCl (7)碱+盐-------- 另一种碱+另一种盐65.氢氧化钠与硫酸铜:2NaOH CuSO4 ==== Cu(OH)2↓ Na2SO4 66.氢氧化钠与氯化铁:3NaOH FeCl3 ==== Fe(OH)3↓ 3NaCl 67.氢氧化钠与氯化镁:2NaOH MgCl2 ==== Mg(OH)2↓ 2NaCl68. 氢氧化钠与氯化铜:2NaOH CuCl2 ==== Cu(OH)2↓ 2NaCl69. 氢氧化钙与碳酸钠:Ca(OH)2 Na2CO3 === CaCO3↓ 2NaOH(8)盐+盐----- 两种新盐70.氯化钠溶液和硝酸银溶液:NaCl +AgNO3==== AgCl↓+ NaNO3 71.硫酸钠和氯化钡:Na2SO4+ BaCl2 ==== BaSO4↓+ 2NaCl五.其它反应:72.二氧化碳溶解于水:CO2+ H2O === H2CO373.生石灰溶于水:CaO+ H2O === Ca(OH)274.氧化钠溶于水:Na2O +H2O ==== 2NaOH75.三氧化硫溶于水:SO3 +H2O ==== H2SO476.硫酸铜晶体受热分解:CuSO4·5H2O 加热CuSO4 5H2O77.无水硫酸铜作干燥剂:CuSO4+ 5H24·5H2。