物质结构基础
- 格式:doc
- 大小:48.50 KB
- 文档页数:4


第一章物质结构基础【知识导航】“上帝粒子”:希格斯玻色子(英语:Higgs boson)是粒子物理学标准模型中所预言的最后一种基本粒子(模型预言了62种基本粒子,已发现61种,包括质子、中子、电子、夸克等),以物理学者彼得·希格斯命名,是一种具有质量的玻色子,没有自旋,不带电荷,非常不稳定,在生成后会立刻衰变。
2012年7月4日,CERN(欧洲核子研究组织)宣布LHC(大型强子对撞机)的紧凑渺子线圈探测到两种新粒子,这两个粒子极像希格斯玻色子,但还有待物理学者进一步分析确定。
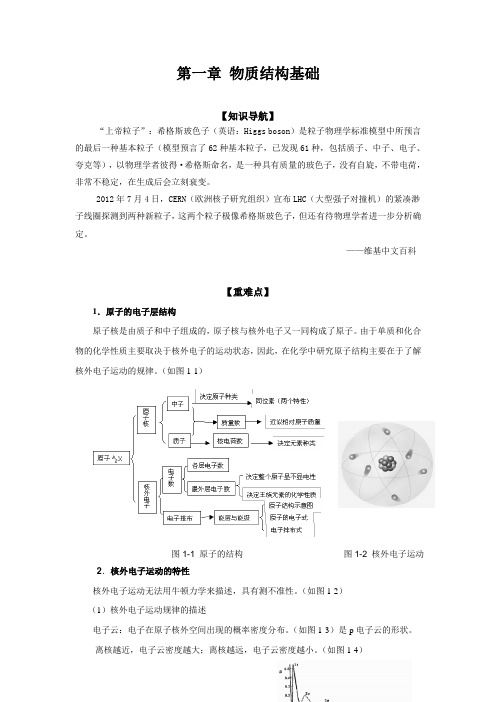
——维基中文百科【重难点】1.原子的电子层结构原子核是由质子和中子组成的,原子核与核外电子又一同构成了原子。
由于单质和化合物的化学性质主要取决于核外电子的运动状态,因此,在化学中研究原子结构主要在于了解核外电子运动的规律。
(如图1-1)图1-1 原子的结构图1-2 核外电子运动2.核外电子运动的特性核外电子运动无法用牛顿力学来描述,具有测不准性。
(如图1-2)(1)核外电子运动规律的描述电子云:电子在原子核外空间出现的概率密度分布。
(如图1-3)是p电子云的形状。
离核越近,电子云密度越大;离核越远,电子云密度越小。
(如图1-4)图1-3 p亚层结构图1-4 核外电子概率分布(2)核外电子运动状态的描述——四个量子数(n、l、m、m s)多电子原子中,决定能量的量子数是n、l。
(3)核外电子的排布遵循能量最低原理、泡利不相容原理及洪特规则。
根据n+0.7l的整数部分相同,近似分成若干近似的能级组。
3.原子结构与周期律元素周期律:元素的性质(原子半径、电离能、电负性、金属性等)随着核电荷数的递增而呈现周期性的变化。
一般而言,同一周期元素,从左到右原子半径逐渐减小,电离能和电负性逐渐增大,金属性减弱,非金属性增强。
同一族元素,从上到下原子半径逐渐增大,电离能和电负性逐渐减小,金属性增强,非金属性减弱。
周期表中共有7个周期,16个族(7个主族、7个副族、1个0族、1个第Ⅷ族)。

生命的物质基础及结构基础
生命体的物质基础主要包括有机物和无机物。
无机物是构成生命体的辅助物质,包括水和无机盐等。
水是生命体内
最重要的无机物,它是生命活动的基本介质,参与到化学反应和调节温度等。
无机盐是包括钠、钾、钙、镁、磷等元素的化合物,它们在生命体内
起到调节酸碱平衡和细胞内外物质交换等重要作用。
生命体的结构基础主要包括细胞和组织。
细胞是构成生命体的最基本单位,具有自我复制和自我维持的能力。
细胞内含有细胞膜、细胞质和细胞核等结构。
细胞膜是细胞的外壳,由脂
质和蛋白质组成,起到控制物质进出细胞的作用。
细胞质是细胞内的液体,包含水和溶质等,承载着细胞内的化学反应。
细胞核是细胞内的控制中心,存储遗传信息,指挥细胞的生命活动。
组织是由相同或相似类型的细胞组成的结构。
生命体内包含多种不同
的组织,如肌肉组织、神经组织和上皮组织等。
不同的组织具有不同的功能,通过相互协作维持生命体的正常功能。
总之,生命的物质基础主要包括有机物和无机物,有机物是构成生命
体的主要组成部分,无机物则是辅助物质。
生命的结构基础主要包括细胞
和组织,细胞是生命体的基本单位,组织则是由相同或相似类型的细胞组
成的结构。
这些物质基础和结构基础相互作用,共同维持着生命的运行和
发展。

物质结构基础知识点总结大一物质结构基础知识点总结一、原子与分子结构原子是构成物质的基本单元,包含质子、中子和电子三种粒子。
质子带正电荷,中子不带电荷,电子带负电荷。
原子中的质子和中子集中在核心部分,电子则绕核心运动,构成原子的电子壳层。
原子中的质子数称为原子序数,决定了元素的性质。
分子是由两个或更多原子相互结合而成。
分子中的原子通过化学键相互连接,常见的化学键有离子键、共价键和金属键等。
离子键是通过正负离子之间的吸引力形成的,共价键是通过原子间电子的共享形成的。
二、晶体结构晶体是由许多规则排列的原子、离子或分子组成的固体。
晶体结构可以通过晶格参数和晶胞来描述。
晶格参数包括晶胞长度、夹角和晶面的指数。
晶体可以分为晶体和非晶体两类,晶体具有长程有序性,而非晶体无长程有序性。
晶体的结构可以通过X射线衍射、电子衍射和中子衍射等实验手段来研究。
常见的晶体类型包括立方晶系、六方晶系、正交晶系等。
三、晶体缺陷晶体中存在各种缺陷,包括点缺陷、线缺陷和面缺陷。
点缺陷包括空位、间隙原子和杂质原子等。
线缺陷包括螺旋位错和位错线等。
面缺陷包括晶界、层错和穿透性等。
晶体缺陷会影响晶体的物理和化学性质,如导电性、热导率和力学性能等。
有些晶体缺陷还可以改善晶体的性质,如钙钛矿结构中的杂质掺杂可以提高材料的光学性能。
四、化合物与混合物化合物是由两种以上不同元素组成的纯物质。
化合物的化学组成和比例是确定的,具有特定的化学性质。
化合物可以通过化学反应进行分解,生成新的物质。
混合物是由两种或更多不同组分混合而成的物质。
混合物的组分和比例可以变化,没有固定的化学性质。
混合物可以通过物理手段进行分离,如过滤、蒸馏和萃取等。
五、聚合物结构聚合物是由重复单元组成的高分子化合物。
聚合物的结构可以分为线性聚合物、支化聚合物和交联聚合物等。
聚合物的结构会影响其物理和化学性质,如熔点、溶解性和机械性能等。
六、材料的晶体结构与性能材料的晶体结构与其性能密切相关。

高三物质结构基础知识点一、原子的组成原子是物质的最小单位,由原子核和电子构成。
原子核由质子和中子组成,质子带正电,中子不带电,电子带负电。
二、元素和化合物元素是由相同类型的原子组成的物质,可以用化学符号表示。
化合物是由不同元素的原子通过化学键连接而成的物质。
三、化学键化学键是原子之间相互吸引而形成的连接。
常见的化学键有离子键、共价键和金属键。
1. 离子键离子键是由正负电荷相互吸引而形成的化学键。
正离子和负离子通过电荷吸引在一起。
离子键通常形成于金属和非金属元素之间。
2. 共价键共价键是由电子的共用而形成的化学键。
共价键形成于两个非金属元素之间,它们共享电子对以达到稳定状态。
3. 金属键金属键是金属元素中的原子间的化学键。
金属元素的原子通过电子云相互吸引而形成金属键。
四、晶体结构晶体是由具有规则排列方式的原子或离子组成的固体。
常见的晶体结构有离子晶体和共价晶体。
1. 离子晶体离子晶体由正负离子组成,形成离子晶体的化学键为离子键。
离子晶体具有高熔点、易溶于水和良好的导电性。
2. 共价晶体共价晶体由共享电子对相互连接的原子组成,形成共价晶体的化学键为共价键。
共价晶体具有较低的熔点、溶于非极性溶剂,不导电。
五、金属结构金属结构是由金属原子组成的固体。
金属原子之间通过金属键相连,形成金属结构。
金属结构具有良好的导电性、导热性和延展性。
六、有机化合物有机化合物是由碳和氢以及其他元素构成的化合物。
有机化合物广泛存在于自然界和生物体内,包括烃类、醇类、酮类、醛类等。
七、分子结构分子是由原子通过共价键连接而成的结构单元。
分子结构决定了物质的性质和化学反应。
八、化学反应化学反应是指物质之间发生化学变化的过程。
常见的化学反应有氧化还原反应、酸碱中和反应、水解反应等。
九、化学式和化学方程式化学式是表示化学物质组成的记号,化学方程式是表示化学反应过程的式子。
化学方程式由反应物、产物和反应条件组成。
总结:高三物质结构基础知识点涵盖了原子的组成、元素和化合物、化学键、晶体结构、金属结构、有机化合物、分子结构、化学反应、化学式和化学方程式等内容。
物质结构基础试题及答案一、选择题1. 物质是由什么构成的?A. 分子B. 原子C. 电子D. 质子和中子答案:B2. 原子核由什么组成?A. 电子B. 质子和中子C. 原子D. 分子答案:B3. 元素的化学性质主要由什么决定?A. 原子核B. 电子C. 质子D. 中子答案:B4. 哪种粒子带有正电荷?A. 电子B. 质子C. 中子D. 分子答案:B5. 哪种粒子带有负电荷?A. 电子B. 质子C. 中子D. 分子答案:A二、填空题1. 原子由____和____组成,其中____带有正电荷,____带有负电荷。
答案:原子核,电子,质子,电子2. 原子核由____和____组成,它们都是不带电的粒子。
答案:质子,中子3. 元素周期表中的元素按照____和____的递增顺序排列。
答案:原子序数,电子层数三、简答题1. 描述原子的结构。
答案:原子由位于中心的原子核和围绕原子核运动的电子组成。
原子核由质子和中子组成,质子带有正电荷,中子不带电。
电子带有负电荷,位于原子核外的电子云中。
2. 什么是化学键?答案:化学键是原子之间通过共享、转移或吸引电子而形成的连接。
这种连接使得原子能够结合形成分子或化合物。
四、计算题1. 如果一个碳原子有6个电子,那么它有多少个质子?答案:6个2. 一个氧原子的原子序数是8,它的原子核中有多少个质子和中子?答案:氧原子的原子核中有8个质子和通常8个中子(氧的常见同位素是氧-16)。
物质的结构必考知识点归纳物质的结构是化学和物理学中的基础概念,它涉及到原子、分子、晶体等微观粒子的组成和排列方式。
以下是物质结构的必考知识点归纳:1. 原子结构:原子是物质的基本单位,由原子核和电子组成。
原子核包含质子和中子,而电子在原子核周围以特定的轨道运动。
2. 元素周期表:元素周期表是按照原子序数排列的元素列表,它展示了元素的周期性和族性。
元素的化学性质主要由其原子序数决定。
3. 化学键:化学键是原子之间通过共享、转移或吸引电子而形成的连接。
主要类型有共价键、离子键和金属键。
4. 分子结构:分子是由两个或更多原子通过化学键连接而成的稳定结构。
分子的几何形状和化学性质受其原子排列和化学键类型的直接影响。
5. 晶体结构:晶体是由原子、离子或分子按照一定规律排列形成的固体。
晶体结构的类型包括立方晶系、四方晶系、六方晶系等。
6. 晶格缺陷:晶格缺陷是晶体中原子排列的不规则性,包括点缺陷、线缺陷和面缺陷。
这些缺陷会影响晶体的物理性质。
7. 非晶体与准晶体:与晶体相比,非晶体没有长程有序的原子排列,而准晶体则具有长程有序但不具备传统晶体的周期性。
8. 纳米材料:纳米材料是指具有纳米尺度(1-100纳米)的材料,它们展现出独特的物理化学性质,如量子效应、表面效应等。
9. 超分子化学:超分子化学研究分子之间通过非共价键(如氢键、π-π堆叠等)形成的复杂结构和功能。
10. 材料的宏观性质与微观结构的关系:材料的宏观性质,如硬度、弹性、导电性等,与其微观结构紧密相关。
例如,金属的导电性与其自由电子的分布有关。
11. X射线晶体学:X射线晶体学是一种用于确定晶体结构的技术,通过测量X射线在晶体中的衍射模式来解析原子的位置。
12. 扫描隧道显微镜:扫描隧道显微镜(STM)是一种能够观察到原子尺度表面结构的仪器,它利用量子隧道效应来探测样品表面的电子态。
这些知识点是物质结构领域的基础,对于理解物质的组成、性质和反应机制至关重要。
第七章物质结构基础一填空题:1 电子排布式为[Kr]4d85s2的元素,位于周期表中第()周期,第()族。
2 在4个量子数中,决定原子轨道形状的是(),决定原子轨道在空间伸展方向的是()。
3 对于多电子原子来说,影响轨道能量高低的因素除主量子数外,还有()。
4 核外电子排布遵循的3个原则是()、()、()。
5 杂化轨道的数目,等于参与杂化的原子轨道的()。
6 角量子数表示电子云的(),磁量子数表示电子云的()。
7 p轨道的角度分布图与p电子云的角度分布图相比,前者要()些,且具有()之分。
8 n=3,l=1的原子轨道在空间有()种伸展方向。
9 NH3和H2O 的键角不同,原因是()。
10 BF3的B原子以()杂化,其空间的几何构型为()。
11 (1) n=4和l=0的电子有2个,n=3和l=2 的电子有6个,该元素是()。
(2) 3d为全满,4s中有1个电子的元素是()。
12 H2O 分子之间存在着()键,致使H2O 的沸点()于H2S、H2Se等;H2O中存在着的分子间力有(),以()为主,这是因为H2O有()。
13 共价键的特征是具有()和()。
14 sp2杂化轨道之间的夹角为(),分子构型呈()。
15 分别写出27号元素Co的:(1)原子的电子排布式();(2)原子的价电子构型();(3)+2价离子的价电子构型();(4)并指出元素Co在周期系中所属的周期、族()。
16 C2H6 、NH3、C2H5OH、H3BO3、CH4,上述化合物存在分子之间氢键的有()。
二判断题17 由极性键形成的分子,不一定是极性分子。
18 氢原子中,4s轨道能量高于3d。
19 含有氢原子的分子中,都有氢键存在。
20 参与杂化的原子轨道应是同一原子内能量相等的原子轨道。
21 在NH3和H2O分子间只存在氢键、取向力和诱导力。
22 电负性差值越大的元素形成的分子极性越强。
23 在CH4、CH3Cl及CCl4 3种分子中,碳原子的轨道杂化类型一样。
24 sp2杂化是指1个s电子和2个p电子进行杂化。
25 由1个ns轨道和3个np 轨道杂化而形成4个sp3杂化轨道。
26 色散力仅存在于非极性分子之间。
27 色散力存在于一切分子之间。
28 范德华力是永远存在于分子与分子之间的一种作用力,它没有饱和性和方向性。
29 元素周期表中,所有的族序数,就是该族元素的外层电子数。
30 在稀有气体(He、Ne、Ar等)及其他单原子蒸气(如Na(g)中),只有色散力存在。
31 在同一原子中,具有一组相同的量子数的电子不能多于1个。
32 取向力只存在于极性分子与极性分子之间。
33 以极性键结合的双原子分子一定是极性分子。
三选择题:34 下列化合物中有氢键的是()。
A CH3OHB CH3OCH3C HOOHD A和C35 量子数n、l、m不能决定()。
A 原子轨道的能量B 原子轨道的数目C 原子轨道的形状D 电子的数目36 电子的钻穿本领与其受其他电子屏蔽的效应之间的关系()。
A 钻穿本领越大,受屏蔽的效应越小B 钻穿本领越大,受屏蔽的效应越大C 钻穿本领越小,可以不考虑屏蔽效应D 两者无关37 在多电子原子中,有下列4个电子,其中能量最高的电子是()。
A(2,1,1,-1/2) B (2,1,0,-1/2)C (3,1,1,-1/2)D (3,2,-2,-1/2)38 下列用来表示核外电子运动状态的各组量子数中,合理的是()。
A(2,1,-1,-1/2)B(2,1,0,0)C(3,1,2,1/2)D(1,2,0,-1/2)39 下列用来表示核外电子运动状态的各组量子数中,合理的是()。
A n=2,l=2,m=0,m s=+1/2B n=4,l=2,m=0,m s=+1/2C n=2,l=3,m=-1,m s=-1/2D n=2,l=0,m=1,m s=+1/240 下列原子或离子具有5个单电子的是()。
A Fe2+B FC Mn2+D N41 关于原子半径,下列叙述不正确的是()。
A 同一周期元素,从左到右随原子序数的增加,原子半径递减B 同一主族元素,从上倒下随电子层数的增多,原子半径依次增大C 同种元素的共价半径、金属半径和范德华半径必相等D 按照量子力学原理,原子半径是个近似值42 下列元素中,第一电离能最大的是()。
A B B Be C N D O43 下列元素中,第一电离能最大的是()。
A LiB BeC MgD B44 下列元素中,电负性最大的是()。
A KB SC OD Cl45 下列分子中键角最小的是()。
A NH3B BF3C HgCl2D H2O46 只需克服色散力就能沸腾的物质是()。
A HClBC C N2D MgCO347 量子力学中的一个原子轨道()。
A 与波尔理论中的原子轨道等同B 指n具有一定数值的一个波函数C 指n,l,m 3个量子数都具有一定数值的一个波函数D 指n,l,m,m s 4个量子数都具有一定数值的一个波函数48 稀有气体能够液化是由于分子间存在有()。
A 取向力B 诱导力C 色散力D 氢键49 杂化轨道理论能较好地解释()。
A 共价键的形成B 共价键的键能C 分子的空间构型D 上述均正确50 对于角量子数l=2的一个电子,其磁量子数m为()。
A 只有一个数值B 是3个数之中的任一个C 是5个数值中的任一个D 有无限多个数值51 苯与水分子间存在的作用力是()。
A 取向力、诱导力B 取向力、色散力C 诱导力、色散力D 取向力、诱导力、色散力52 决定共价键方向性的因素是()。
A 电子配对B 原子轨道最大重叠C 自旋方向相同的电子互斥D 泡利原理53 下列各组量子数中不是表示3d1电子的一组是:()。
A (4,3,2,1/2)B(3,2,2,-1/2)C (3,2,0,1/2)D(3,2,-1,-1/2)54 用量子数描述某元素基态原子的一个电子的状态,它的l=3,m=0,ms=+1/2,这时它的n值可以是()。
A 1B 2C 3D 455 NH3分子中,氮原子以sp3杂化轨道成键,NH3分子空间几何构型是()。
A 正方形B 四面体型C 三角锥型D T字型56 下列化合物()不含有双键或叁键。
A C2H4B HCNC COD H2O57 原子的下列排布属于激发态的是()。
A 1s22s12p1B 1s22s2C 1s22s22p1D 1s22s22p258 下列化学键中,极性最弱的是()。
A H—FB O—FC C—FD Ca—F59 下列物质中,氢键最强的是()。
A H2OB H2SC HClD HF60 Fe 原子的电子排布式为1s22s22p63s23p63d64s2,其未配对的电子数是()。
A 0B 2C 4D 661 核外电子运动状态的描述正确的是()。
A 电子绕原子核做圆周运动B 电子在离核一定距离的球面上运动C 电子在核外一定的空间范围内运动D 电子的运动和地球绕太阳运动一样62 形成π键的条件是()。
A s与s轨道重叠B s与p轨道重叠C p与p轨道“头碰头”重叠D p与p轨道“肩并肩”重叠63 如果一个原子的主量子数是3,则它()。
A 只有s 电子B 只有s和p电子C 只有s、p和d电子D 只有d电子第七章物质结构基础参考答案一填空题:1五;Ⅷ。
2角量子数;磁量子数。
3角量子数。
4能量最低原理;泡利不相容原理;洪德规则。
5总数。
6形状;空间伸展方向。
7胖;正负。
8 3。
9参加杂化的孤对电子的数目不同。
10 sp2;平面三角形。
11 (1) Fe;(2) Cu。
12 氢;高;色散力、诱导力、取向力;取向力;较大的偶极矩或极性。
13方向性;饱和性。
14 120°;平面三角形。
15(1)1s22s22p63s23p63d74s2;(2)3d74s2;(3)3d7;(4)第4周期,Ⅷ族。
16 NH3、C2H5OH、H3BO3。
二判断题17对;18对;19错;20错;21错;22错;23对;24错;25对;26错;27对;28对;29错;30对;31对;32对;33对。
三选择题:34 D;35 D;36 A;37 D;38 A;39 B;40 C;41 C;42 C;43 B;44 C;45 D;46 C;47 C;48 C;49 C;50 C;51 C;52 B;53 A;54 D;55 C;56 D;57 A;58 B;59 D;60 C;61 C;62 D ;63 C。