不共存离子对
- 格式:doc
- 大小:14.00 KB
- 文档页数:1

常见的有色离子:Cu2+浅蓝Fe3+棕黄Fe2+浅绿(极浅)MnO4-紫[Fe(CN)6]3-血红黄色:AgI、Ag3PO4、P4(黄磷)、溴水(黄--橙)、FeS2、Al2S3、甲基橙在弱酸性、中性或碱性环境中、某些蛋白质加硝酸。
淡黄色:S、Na2O2、TNT、PCl5、AgBr、浓HNO3(混有NO2)、浓HCl(混有Fe3+)、硝基苯(溶有NO2)。
灰黄色:Mg3N2棕黄色:FeCL3溶液、碘水(深黄--褐)黑色:CuO、Cu S、Ag2S、Cu2S、PbS、HgS(黑色或红色)、FeS、FeO、Fe3O4、MnO2、CuO、Ag2O、I2(紫黑)、Si(灰黑)、C、Ag、KMnO4(紫黑)、石油绿色:CuCl2溶液、Cu2(OH)2CO3、FeSO4/7H2O(浅绿)、F2(浅黄绿)、Cl2(黄绿)、氯水(浅黄绿)红色:Cu、Fe(SCN)2+、甲基橙在酸性环境中、紫色石蕊试液在酸性环境中、酚酞在碱性环境中、品红试液、红磷(暗红)、Br2(深红棕)、Br2在CCl4溶液中(紫红)、苯酚被空气氧化(粉红)棕色:固体FeCl3、固体CuCl2、NO2(红棕)、Fe2O3(红棕)紫色:KMnO4溶液、I2在CCl4溶液中灰色:As、Sn、Fe3C褐色:碘酒、2Fe2O3/3H2O、Fe(OH)3(红褐)蓝色:CuSO4/5H2O、Cu(OH)2、淀粉遇碘、紫色石蕊试液在碱性环境中,Cu2+的稀溶液离子共存:离子共存问题是离子反应知识体系中的一个重要侧面,是每年高考的必考知识点。
离子共存的前提条件是离子之间不能发生离子反应,若能发生反应则相应的离子在溶液中不能大量共存。
正确判断离子之间能否大量共存,关键要掌握常见离子的性质明确离子不能大量共存的原因。
1、离子之间可以发生反应产生难溶物或微溶物而不能大量共存。
如Ag+和Cl-、Br-、I-;Ba2+、Ca2+与CO32-、SO42-;Cu2+与CO32-、OH-、S2-等。

离子不能大量共存的几种情况离子不能大量共存的情况主要有以下几种:1.复分解反应生成难溶性物质:如果离子之间发生复分解反应,生成了难溶性的物质,这些物质就会沉淀下来,导致离子不能大量共存。
例如,钡离子和硫酸根离子会生成硫酸钡沉淀,铜离子和氢氧根离子会生成氢氧化铜沉淀等。
2.复分解反应生成气体:如果离子之间发生复分解反应,生成了气体,这些气体就会逸出溶液,导致离子不能大量共存。
例如,碳酸根离子和氢离子会生成二氧化碳气体,铵根离子和氢氧根离子会生成氨气等。
3.复分解反应生成弱电解质:如果离子之间发生复分解反应,生成了弱电解质,这些弱电解质在水溶液中不能完全电离,导致离子不能大量共存。
例如,醋酸根离子和氢离子会生成醋酸弱电解质,磷酸根离子和氢离子会生成磷酸弱电解质等。
4.氧化还原反应:如果离子之间发生氧化还原反应,导致电子转移,使某些离子失去电子而某些离子得到电子,这些离子不能共存。
例如,亚铁离子和硝酸根离子会发生氧化还原反应,三价铁离子和碘离子会发生氧化还原反应等。
5.络合反应:如果离子之间发生络合反应,生成了络合物,这些络合物在水溶液中不能完全电离,导致离子不能大量共存。
例如,银离子和硫氰根离子会生成硫氰化银络合物,铜离子和氨分子会生成铜氨络合物等。
6.发生双水解反应:某些离子之间会发生双水解反应,即这些离子在水中会结合成水解反应的产物,导致离子不能大量共存。
例如,铝离子和碳酸根离子、偏铝酸根离子和铵根离子等会发生双水解反应。
7.形成沉淀或聚合:某些离子之间可以形成沉淀或聚合,导致离子不能大量共存。
例如,银离子和氯离子会形成氯化银沉淀,亚铁离子和氢氧根离子会形成氢氧化亚铁沉淀等。
8.存在隐蔽的限制条件:有时在题目中可能存在隐蔽的限制条件,如pH值、温度等的影响,也会导致某些离子不能大量共存。
例如,在酸性条件下,硝酸根离子具有氧化性,能够氧化碘离子、亚铁离子等;在碱性条件下,氢氧根离子能够与铜离子、铁离子等形成沉淀等。

高中化学离子共存知识点归纳
①离子共存定律:在水溶液中,相似的离子不可共存,而大多数异质
的离子能够共存;
②离子共存的几种方式:(1)强相互作用:离子之间通过电荷的相
互作用使得相邻的离子相互吸引,形成离子对。
(2)离子偶联:当离子
之间产生特定的作用力时,他们可以结合成离子偶联物。
(3)离子排斥:由离子的量子势阻碍,形成离子排斥,使相似离子在空间上分布不均匀。
③离子共存在生物体内的应用:离子共存原理是调节细胞电位、生理
反应、酸碱平衡、能量转运、催化反应等的重要依据,对生命的运作至关
重要。

离子不能共存的类型一、离子不能共存的原因:反应物中某些离子浓度的减小是离子不能大量共存的原因。
二、离子不能共存的类型1、离子互换反应(复分解反应):(1)生成沉淀(难溶或微溶性物质)如:CaCO3、Mg(OH)2、BaSO4、AgSO4等(2)生成气体(挥发性物质)如:CO2、NH3、H2S等(3)生成难电离的物质(弱电解质)如:CH3COOH、NH3·H2O、H2O等2、双水解反应:弱酸所对应的阴离子与弱碱所对应的阳离子互相促进双水解进行到底。
如:Al3+与CO32-、S2-HCO3-、AlO2-;NH4+与SiO32-、AlO2-;Fe3+(Fe2+)与CO32-、HCO3-、AlO2- 等。
3、络合反应:如 Fe3+与 SCN-;Fe(SCN)2+、Fe(SCN)3、Ag(NH3)+、[Cu(NH3)4]2+等]4、氧化还原反应:如氧化性离子:Fe3+、MnO4-、NO3-(酸性条件下)、ClO-还原性离子:S2-、I-;Fe2+(其中只有Fe3+与Fe2+可以共存)三、常见的前提设置1、对溶液性质的要求:(1)颜色:无色透明溶液中一定无Cu2+、Fe2+、Fe3+、MnO4-。
因为Cu2+(蓝色)、Fe3+(棕黄色)、Fe2+ (浅绿色)、MnO4-(紫红色)、MnO42-(绿色)等都有颜色。
(2)溶液的酸碱性:如25℃时由水电离出的C(H+)或C(OH-)=1.0×10-12mol/L表示的是该溶液可能为强酸性或者为强碱性;与Al作用产生氢气(高二内容);室温时某指示剂的颜色(如酚酞变红);室温下pH=1或13的溶液等。
2、特殊要求:如在××离子存在下不能共存的;因发生氧化还原反应,而不能大量共存的;因生成沉淀和气体而不能大量共存的等。
3、注意限制条件的设置,看清是问“能”、“不能”,还是“一定能”、“一定不能”等对选项的限制条件。
4、S2O32-与 H+不能共存,因为 2H+ +S2O32-→ S↓ + SO2↑+H2O 发生氧化还原反应。

离子能否共存的原因与判断方法河北省宣化县第一中学栾春武判断离子能否大量共存实际上就是判断离子之间能否反应,只要离子间相互反应,那么就不能大量共存。
下面就离子能否共存的原因与判断方法归纳如下:一、常见的离子不能大量共存的原因:(1)发生复分解反应生成难溶物、挥发性物质和难电离物质时不能大量共存。
如:①若阴阳离子能相互结合生成难溶物或微容物性盐,就不能大量共存。
如常见的Ba2+、Ca2+ 与CO32-、SO32-、SO42-、PO43-、SiO32-等;再如常见的Ag+ 与Cl-、Br-、I-、PO43-、CO32-、SO42-、S2-等。
②弱碱的阳离子不能与OH-大量共存。
如常见的Fe2+、Fe3+、Cu2+、NH4+、Ag+、Mg2+、Al3+、Zn2+等与OH-不能大量共存。
③弱酸根阴离子不能与H+ 大量共存。
如常见的CH3COO-、F-、CO32-、SO32-、S2-、PO43-等与H+ 不能大量共存。
④弱酸的酸式阴离子与H+ 或OH-均不能大量共存。
如常见的HCO3-、HSO3-、HS-、H2PO42-等既不能与H+ 大量共存也不能与OH-大量共存。
-、HPO4(2)若离子间能发生氧化还原反应,也不能大量共存。
如:①在酸性条件下,MnO4-具有较强的氧化性,与常见的Cl-、Br-、I-、S2-等能发生氧化还原反应,而不能大量共存;同样,NO3-在酸性条件下也具有较强的氧化性,与Br-、I-、S2-、Fe2+、SO32-等不能大量共存。
②在中性条件下,NO3-与I-、Fe2+ 等可以大量共存。
③无论是在酸性或碱性条件下,ClO-都具有氧化性,与常见的还原性离子如I-、Fe2+、S2-、SO32-等均不能大量共存。
(3)若阴、阳离子间发生“双水解”反应,有的促进反应进行,不能大量共存。
常见的能发生“双水解”反应离子归纳如下:① Al3+与HS-、S-、CO32-、HCO3-、AlO2-、SiO32-、ClO-等;② Fe3+与CO32-、HCO3-、AlO2-、ClO-等;③ NH4+与AlO2-、SiO32-等;发生“双水解”反应时,由于水解彻底,可用“===”连接反应物和产物,水解生成的难容物或挥发性物质要加沉淀符号“↓”或气体反符号“↑”。

1、由于发生复分解反应,离子不能大量共存(1)有气体产生:如CO32-、SO32-、S2-、HCO3-、HSO3-、HS-等易挥发的弱酸的酸根与H+不能大量共存。
(2)有沉淀生成:①如Ba2+、Ca2+、Mg2+、Ag+等不能与SO32-、SO42-、 CO32-等大量共存;②Mg2+、Fe2+、Ag+、Al3+、Zn2+、Cu2+、Fe3+等不能与OH-大量共存;③Pb2+与Cl-,Fe2+与S2-、Ca2+与PO43-、Ag+与I-不能大量共存。
(3)有弱电解质生成:①如OH-、CH3COO-、PO43-、HPO42-、H2PO4-、F-、ClO-、AlO2-、SiO32-、CN-、C17H35COO-、C6H5O-、等与 H+不能大量共存;②一些酸式弱酸根如HCO3-、HPO42-、HS-、H2PO4-、HSO3-不能与OH-大量共存;NH4+与OH-不能大量共存;③弱碱的简单阳离子(比如:Cu2+、Al3+、Fe3+、Fe2+、Mg2+等等)不能与OH-大量共存2、能相互发生氧化还原反应的离子[①+②]不能大量共存:①常见还原性较强的离子有:Fe2+、I-、HS-、S2-、SO32-、H SO3-;②氧化性较强的离子有:Fe3+、ClO-、MnO4-、Cr2O72-、FeO42-、(H++NO3-);③此外,S2O32-与H+也不能共存(发生歧化反应);④在酸性或碱性的介质中由于发生氧化还原反应而不能大量共存;3、发生盐的双水解反应的离子不能大量共存,凡水解使溶液显酸性的阳离子与水解使溶液显碱性的阴离子不能大量共存的有:①(Al3+与 HS-、S2-、SiO32-、C6H5O-、AlO2-、CO32-、HCO3-)发生盐的双水解反应;②(Fe3+与 SiO32-、C6H5O-、AlO2-、CO32-、HCO3-)发生盐的双水解反应;③(NH4+与 SiO32-、AlO2-)浓溶液发生盐的双水解反应;注意:①(Fe3+与 S2 -、HS-)发生氧化还原反应,而不发生盐的双水解反应;②S2-与Cu2+、Fe2+、Pb2+、Ag+、Hg2+等发生复分解反应不能大量共存;③(NH4+与 CO32-、HCO3-)双水解反应较弱仍可大量共存。

中学化学中常见离子共存问题归纳:在溶液中离子共存问题的实质是:哪能些离子刘不能发生反应,能发生反应者不能共存。
主要的反应类型有四类;复分解反应、氧化还原反应、络合反应、双水解反应。
中学化学常见不能共存的离子组如下:1、看是否因发生氧化还原反应而不共存:常见的如下:Fe3+与S2-、I-不能共存;;;NO3-(H+)、MnO4-(H+)、ClO-(H+)、Cr2O72-(H+)、H2O2、等与S2-、I-、SO32-、Fe2+等不能共存。
;;;;;;;;;;另在酸性条件下,特殊离子间不共存并附离子方程式如下:①H+与S2O32-:②H+与SO32- 和S2-:③H+与ClO- 和Cl- :④H+与MnO4- 和Cl- :2、看是否发生复分解反应而不共存:具体又分三种情况:①生成难溶于混合体系的物质:(即常理解为生成沉淀的一大类)常见的如下:H+与SiO32-、AlO2-、C17H35COO- ;;;OH-与除NH4+之外的所有的弱碱金属阳离子均生成难溶的碱;Ag+与Cl-、OH-、S2-、I-、Br-、SO32-、CO32-、SiO32-、PO43-、SO42- 等;Pb2+与OH-、S2-、SO32-、CO32-、SiO32-、PO43-、SO42-等;Ba2+、Ca2+与SO32-、CO32-、SiO32-、PO43-、SO42-等;Fe2+、Cu2+、Mg2+、Zn2+等与OH-、S2-、SO32-、CO32-、SiO32-、PO43-等;S2-(H2S)与Ag+、Cu2+、Pb2+、Hg2+、Fe2+与S2-反应与H2S不反应。
②生成易挥发的物质:(即常理解为生成气体的一大类)常见的如下:H+与S2-(H2S)、SO32-(HSO3-)、CO32-(HCO3-)不共存,OH-与NH4+加热时生成氨气不共存;另外有些时侯也要特别注意HCl和HNO3的挥发性。
③生成难电离的物质:(即初中常理解为生成水的)除了生成水的以外主要就是H+与弱酸根离子生成难电离的弱酸以及OH-与NH4+常温时生成NH3·H2O难电离。

2021年15期┆41研究高中化学中的离子共存问题探讨吐尔逊古丽·玉山摘 要:离子共存是高中化学知识中学生必须进行掌握的重点内容。
在化学溶液中,很多的离子都无法共存,是由于离子是带电的,形成离子的原子之间以及原子团之间也会产生反应。
在高中化学知识学习中,对于离子共存问题进行分析,对于离子化合物知识的学习非常有帮助。
关键词:高中;化学知识;离子共存 许多同学在进入到高中化学课程的学习后,对于“离子共存”问题感觉不会做,也即是判断溶液中离子可否共存的相关问题。
有的时候哪怕是得出答案,但是也感觉没有底气,模模糊糊。
但是,众所周知的是离子共存问题是高中化学最为常见的问题,也是近些年高考的常客。
一、离子共存离子反应是向着离子减弱的方向进行,离子共存本质上是指离子能不能发生化学反应,若离子之间不能发生离子反应,则能共存。
相反如果溶液中的离子之间能发生反应,则不能共存。
离子之间发生反应需要考虑许多方面的因素,如:溶液中的离子间是否有挥发性物质生成、是否有难溶性物质生成、是否有弱电解质生成等。
二、高考试题中离子共存类问题丢分的主要原因化学高考试题中离子共存类问题是必考的内容,而且考题的难度相对高一些,主要体现在,考题看起来难度不大,但是要做出准确的答案却不是很容易,所以,很多的学生都会在这类考题上丢分。
存在这种现象的主要原因就是学生在学习化学元素以及化合物知识的时候,仅仅是针对每一个知识点进行学习,而不会对所有的相关知识进行系统化梳理,使得学习中存储知识的过程中,所有的知识处于零散状态。
当在考试中需要这些知识的时候,由于对知识的记忆不完整,没有全面系统地掌握,就会产生知识提取错误的现象。
由于对化学物质之间所产生的反应规律并不是很清楚,就会导致高考试题中离子共存类问题丢分。
三、离子共存判断类题目的解题依据所谓离子共存类题目,也就是几种离子在同一溶液中可以大量共存,离子之间不会产生化学反应,如果离子之间可以发生化学反应,则表示其无法大量共存。
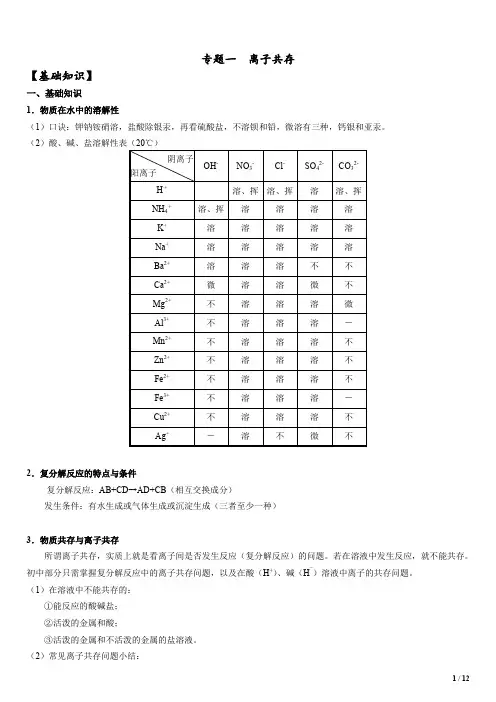
专题一离子共存【基础知识】一、基础知识1.物质在水中的溶解性(1)口诀:钾钠铵硝溶,盐酸除银汞,再看硫酸盐,不溶钡和铅,微溶有三种,钙银和亚汞。
(2)酸、碱、盐溶解性表(20℃)2.复分解反应的特点与条件复分解反应:AB+CD→AD+CB(相互交换成分)发生条件:有水生成或气体生成或沉淀生成(三者至少一种)3.物质共存与离子共存所谓离子共存,实质上就是看离子间是否发生反应(复分解反应)的问题。
若在溶液中发生反应,就不能共存。
初中部分只需掌握复分解反应中的离子共存问题,以及在酸(H+)、碱(H¯)溶液中离子的共存问题。
(1)在溶液中不能共存的:①能反应的酸碱盐;②活泼的金属和酸;③活泼的金属和不活泼的金属的盐溶液。
(2)常见离子共存问题小结:①生成难溶物或微溶物:如:SO42-与Ba2+、Ag+;OH-与Cu2+、Fe3+、Mg2+、Al3+;Ag+与Cl-、CO32-、SO32-、S2-;Mg2+、Ba2+、Ca2+与CO32-、SO32-、PO43-等不能大量共存。
②生成气体或挥发性物质:如:NH4+与OH-;H+与CO32-、HCO3-等不能大量共存。
③生成水:OH-与H+不能大量共存。
(3)附加隐含条件的应用规律:①溶液无色透明时,则溶液中肯定没有有色离子。
常见的有色离子是Cu2+(蓝色)、Fe2+(浅绿色)、Fe3+(黄棕色)、MnO4-(紫色)。
②碱性溶液中肯定不存在与OH-起反应的离子;酸性溶液中肯定不存在与H+起反应的离子。
酸性溶液:pH<7的溶液、能使pH试纸变红的溶液、使石蕊试液变红等,在分析各选项组的离子时,还需考虑H+的存在;碱性溶液:pH>7的溶液、能使pH试纸变蓝的溶液,使石蕊试液变蓝或使酚酞试液变红的溶液等,在分析各选项组的离子时,还需考虑OH-的存在。
③能与金属反应产生H2的溶液、在分析各选项组的离子时,还需考虑H+或OH-的存在。
注意:①分析问题时还要看清楚题目要求回答的是能大量共存还是不能大量共存,不要选出相反的答案。

离子能否大量共存问题的分析与判断判断离子能否大量共存实际上就是判断离子之间能否反应,只要离子间相互反应,那么就不能大量共存,否则就能大量共存。
下面讨论离子能否共存的原因与判断方法:一、常见的离子不能大量共存的原因:(1)发生复分解反应生成难溶物、挥发性物质和难电离物质时不能大量共存。
如:①若阴阳离子能相互结合生成难溶物或微容物性盐,就不能大量共存。
如常见的Ba2+、Ca2+ 与CO32-、SO32-、SO42-、PO43-、SiO32-等;再如常见的Ag+ 与Cl-、Br-、I-、PO43-、CO32-、SO42-、S2-等。
②弱碱的阳离子不能与OH-大量共存。
如常见的Fe2+、Fe3+、Cu2+、NH4+、Ag+、Mg2+、Al3+、Zn2+等与OH-不能大量共存。
③弱酸根阴离子不能与H+ 大量共存。
如常见的CH3COO-、F-、CO32-、SO32-、S2-、PO43-等与H+ 不能大量共存。
④弱酸的酸式阴离子与H+ 或OH-均不能大量共存。
如常见的HCO3-、HSO3-、HS-、H2PO4-、HPO42-等既不能与H+ 大量共存也不能与OH-大量共存。
(2)若离子间能发生氧化还原反应,也不能大量共存。
如:①在酸性条件下,MnO4-具有较强的氧化性,与常见的Cl-、Br-、I-、S2-等能发生氧化还原反应,而不能大量共存;同样,NO3-在酸性条件下也具有较强的氧化性,与Br-、I-、S2-、Fe2+、SO32-等不能大量共存。
②在中性条件下,NO3-与I-、Fe2+ 等可以大量共存。
③无论是在酸性或碱性条件下,ClO-都具有氧化性,与常见的还原性离子如I-、Fe2+、S2-、SO32-等均不能大量共存。
(3)若阴、阳离子间发生“双水解”反应,有的促进反应进行,不能大量共存。
常见的能发生“双水解”反应离子归纳如下:①Al3+与HS-、S-、CO32-、HCO3-、AlO2-、SiO32-、ClO-等;②Fe3+与CO32-、HCO3-、AlO2-、ClO-等;③NH4+与AlO2-、SiO32-等;发生“双水解”反应时,由于水解彻底,可用“===”连接反应物和产物,水解生成的难容物或挥发性物质要加沉淀符号“↓”或气体反符号“↑”。

强酸可以和强酸的酸根离子共存;但不能与弱酸根离子共存(F-、CO32-、ClO-、S2-、SiO32-等)2强碱OH-与弱碱的阳离子(如Cu2+、NH4+、Al3+等)不能共存。
3弱酸的酸式根离子与H+、OH-都不能共存,如HCO3-、HS-、HSO3-、HPO42-等。
但强酸的酸式根离子只与碱不能共存,如HSO4-。
4复分解反应是有难溶物(微溶物)生成、难电离物质生成、易挥发物质生成。
由于难溶物、难电离物微粒之间有比较强的相互作用,分子难以电离成离子;挥发性物质生成并从溶液中分离,都导致溶液中离子浓度降低,使离子不能大量共存。
如Cl-与Ag+;Ba2+与SO42-;CO32-、H+;H+、OH-;OH-与NH4+;H+、CH3COO-等。
5强氧化剂和强还原剂不能共存(但Fe3+、Fe2+因没有中间价态可以共存)
—1—。
一、因复分解反应而不能大量共存的离子1.有水生成
如:H+与OH–;
OH–与HS–、HSO
3–、HCO
3–等
2.有气体生成
如:H+与CO
32–、HCO
3–、HS–、S2–、HSO
3–、SO
32–;
OH–与NH
4+
3.有难溶物生成
如:SO
42–与Ag+、Ca2+、Pb2+、Ba2+
Cl–与Ag+、Hg+
CO
32–、PO
43–、S2–、SO
32–等与除了K+、Na+、NH
4+以外的金属离子所组成的盐均不溶于水。
二、因氧化还原而不能大量共存的离子
1.典型的具氧化性的离子
例:MnO
4–、Cr
2O
72–、NO
3–、ClO–、Fe3+等
2.典型的具还原性的离子
例:Fe2+、S2–(HS–)、I–、SO
32–等
顺序:S2–> SO
32–> I–> Fe2+
3.它们之间的反应情况:
(1)MnO
4–、Cr
2O
72–、ClO–:在酸性、中性、碱性条件下都可氧化I–、S2–、SO 32–。
在酸性条件下氧化Fe2+、Cl–、Br–等
(2)NO
3–离子:只在酸性条件下可氧化Fe2+、S2–、I–、SO 32–等。
(3) Fe3+离子:任何条件下可氧化I–、S2–、SO 32–。
(4) SO
32–、S2–在酸性条件下能发生氧化还原反应。
离子间不能大量共存1.离子间因直接发生离子反应而不能大量共存溶液中离子之间不能大量共存的本质原因是离子之间发生了离子反应,离子之间常因发生下列离子反应而不能大量共存。
⑴离子间反应生成沉淀凡是能在水溶液中相互结合生成难溶物或微溶物的离子之间都不能大量共存,如,Ca2+与CO32-、Ba2+与SO42-、Ag+与Cl-、Mg2+与0H-等之间能发生沉淀反应而不能大量共存。
⑵离子间反应生成气体凡是能水溶液中相互作用生成气体的离子之间也不能大量共存。
如,H+与CO32-、H+与HCO3-等之间能发生反应生成气体而不能大量共存。
⑶离子间反应有弱电解质生成若水溶液中的离子之间能发生作用生成难电离的弱电解质,不能大量共存。
如,HCO3-与0H-、NH4+与0H-、H+与CH3COO-等之间都不能大量共存。
⑷离子之间发生氧化还原反应若是溶液中的离子之间相互作用时,有电子得失,离子之间也不能大量共存。
如Fe3+与I-、Cu2+与I-等之间可以发生氧化还原反应而不能大量共存。
⑸离子之间发生其它反应如Fe3+能与SCN-在水溶液中结合生成[Fe(SCN)]2+、Al3+能与HCO3-在水溶液中发生反应生成Al(OH)3和CO2而不能大量共存。
2.离子间因在外界条件下发生反应而不能大量共存有些离子之间在水溶液中并不能直接发生离子反应,因而在通常情况下大量地共存是安全的,但一旦具备发生离子反应的条件,离子之间便不可能大量共存。
⑴在H+存在下不能大量共存一些离子可以稳定的存在于同一溶液中,但溶液一旦处于酸性条件,这些离子间便因为发生氧化还原反应而不能大量共存。
这类反应在相当多的情况下发生在含氧氧化剂与还原剂的离子之间,如MnO4-与Cl-、NO3-与Fe2+、ClO-与Cl-、SO32-与S2-等之间可以大量共存,而H+存在下,也即在酸性条件下他们都不能大量共存。
⑵在OH-存在下不能大量共存某些离子之间可以安全地共存于同一溶液中,如果溶液出现碱性,就会引起离子间发生一系列反应,导致离子间不能大量共存,如Ca2+与HCO3-之间可以大量地共存,若是在碱性条件下,HCO3-会转化为CO32-而与Ca2+发生沉淀。
氧化还原反应不共存
由于发生氧化还原反应,离子不能大量共存
1、具有较强还原性的离子不能与具有较强氧化性的离子大量共存。
如I-和Fe3+不能大量共存是由于2I-+2Fe3+=I2+2Fe2+。
2、在酸性或碱性的介质中由于发生氧化还原反应而不能大量共存。
如NO3-和I-在中性或碱性溶液中可以共存,但在有大量H+存在情况下则不能共存;SO32-和S2-在碱性条件下也可以共存,但在酸性条件下则由于发生2S2-+SO32-+6H+=3S↓+3H2O反应不能存在。
3一般说来,有氧化性的离子(如MnNO4-、ClO-、Fe3+、NO3-等)与有还原性的离子(如S2-、Br-、I-、SO32-、Cl-、Fe2+等)不能大量共存。
注意以下几种情况:
①在有H+存在时,MnO4-、ClO-、NO3-的氧化性会增强。
②Fe3+与Fe2+可以共存,因为它们之间不存在中间价态。
Fe3+不能氧化Cl-。
③NO3-(有H+时)不能氧化Cl-。
判断离子共存的四原则离子共存知识是高考的热点,也是每年高考的必考内容。
离子能否共存其实就是看离子之间能否发生反应,能反应,则不能大量共存;否则,能大量共存。
在判断离子能否共存时,常用到以下四大原则: 1肯定性原则肯定性原则就是根据实验现象推出溶液中肯定存在或肯定不存在的离子。
此原则常根据一色、四反应、三特等来确定溶液中存在或不存在的离子。
(1)一色:无色溶液中不存在Fe2+、Fe3+、Cu2+、MnO4-、CrO42-、Cr2O72-等有色离子。
(2)四反应:发生以下四大反应,均不能共存。
①复分解反应离子间相互反应能生成难溶物、易挥发物质、难电离物质都不能大量共存。
I. 生成难溶物:如Ba2+、Ca2+等不能与SO42-、CO32-等大量共存;Ag+与Cl-、SO42-、CO32- 等不能大量共存。
为了确定哪些物质难溶,我们最好能记住溶解性口诀表:钾钠铵硝皆可溶、盐酸盐不溶银亚汞;硫酸盐不溶钡和铅、碳磷酸盐多不溶;多数酸溶碱少溶、只有钾钠铵钡溶;几种微溶物要牢记、口诀中未有皆下沉。
II. 生成易挥发物质:如H+与CO32-、HCO3-、S2-、HS-、SO32-、HSO3-等;OH-与NH4+。
III. 生成难电离物质:如H+与F-、ClO-、PO43-、CH3COO-等弱酸根离子。
②氧化还原反应常见的四种氧化性离子有:Fe3+、NO3-、MnO4-、ClO-,常见的六种还原性离子有:Fe2+、S2-、SO32-、I-、Br-、Cl-。
其中Fe3+ 能将S2-、SO32-、I-氧化而不能大量共存;NO3-在酸性条件下能将Fe2+、S2-、SO32-、I-、Br-氧化而不能大量共存;MnO4-、ClO- 在碱性或中性条件下能将S2-、SO32-、I- 等氧化而不能大量共存,在酸性条件下可以将上述六种还原性离子都氧化而不能大量共存。
除此之外,S2-与SO32-在碱性条件下可以共存,但酸性条件下则会发生氧化还原反应而不能大量共存。
银离子与硫酸根离子不共存
从化学角度来看,银离子与硫酸根离子发生沉淀反应的化学方程式如下:
Ag+ + SO4^2→ Ag2SO4↓。
因此,根据化学反应的原理,银离子与硫酸根离子不共存的现象是由于它们会发生沉淀反应而导致的。
这一现象在化学实验和分析中具有重要意义,因为可以利用这一特性来分离和检测溶液中的银离子和硫酸根离子。
总的来说,银离子与硫酸根离子不共存的现象是基于化学反应和沉淀形成的原理,这一现象在化学实验和分析中具有重要的应用价值。
不共存离子对
H+与OH-CO32-HCO3-ClO-CH3COO-HSO3-SO32-AlO2-S2-HS-SiO32-(H2SiO3白,下同)
OH-与NH4+Al3+(白)HCO3-Fe3+(红棕色)Fe2+(白)Mg2+(白)Cu2+(白)Zn2+(白)Ag+(白,不稳定迅速变成灰黑色氧化银)
CO32-与Ca2+(白)Ba2+(白)Fe2+(白)Fe3+(双水解)Mg2+(白)Cu2+(白)Zn2+(白)Al3+(双水解)Ag+(白)H+
SO42-与Ca2+(白)Ba2+(白)Ag+(白)
Ag+与OH-(白)CO32-(白)SO42-(白)Cl-(白)Br-(淡黄)I-(黄)S2-(灰黑色)
Ba2+与SO42-(白)CO32-(白)SO32-(白)
Mg2+与OH-(白)CO32-(白)S2-(白)
Al3+与OH-(白)CO32-(双水解)HCO3-(双水解)
Zn2+与OH-(白)CO32-(白)S2-(白色至灰白色或浅黄色)
Fe2+与OH-(白,不稳定在空气中迅速氧化为红棕色Fe(OH)3)CO32-(白)S2-(黑褐色)K3[Fe(CN)6](蓝)Fe3+与OH-(红棕色)CO32-(双水解)S2-(黄绿)SCN-(红色)
Cu2+与OH-(蓝)CO32-(白色)S2-(黑褐色)
S2-与Al3+(双水解)HCO3-(双水解)Fe3+(黄绿)Fe2+(黑褐色)Ag+(黑)Mg2+(白)Zn2+(白色至灰白色或浅黄色)
I-与Ag+(黄)Cu2+(金黄)Fe3+(发生氧化还原)
组合
当H+与MnO4-同时共存时,可以与溶液中的还原性离子发生氧化还原反应,诸如Fe2+S2-I-SO32-HSO3-H2O2CN-等
Cr2O72-、NO3-在酸性环境(富含H+)均可与还原性物质发生氧化还原反应,如Fe2+S2-I-SO32-HSO3-H2O2CN-等溶液中离子颜色:Cu2+蓝Fe2+浅绿Fe3+棕黄MnO4-紫红Cr3+绿色Cr2O72-橙色CrO42-黄色
焰色反应K+(紫色,透过蓝色钴玻璃)Na+黄色Cu2+绿色。