溶出度试验影响因素及溶出度方法开发
- 格式:docx
- 大小:70.32 KB
- 文档页数:11

影响溶出度测定试验结果的因素主要有以下几个方面:
一、药物性质
药物的溶解性和稳定性对溶出度测试有很大影响。
不稳定的药物可能会在测试过程中分解,导致测得的结果不准确。
二、溶出介质的选择
不同的溶出介质,对药物的溶解度有不同的影响。
选择合适的溶出介质可以更准确地反映药物在体内的吸收情况。
三、测试方法的选择
不同的溶出度测试方法,其结果可能有所不同。
例如,桨法和篮法测试结果可能有所差异。
因此,在选择测试方法时,需要考虑到实验目的和要求。
四、温度的影响
溶出度测试过程中,温度是一个重要的因素。
温度过高或过低都可能导致药物的溶解速度发生变化,从而影响测试结果。
五、搅拌速率的影响
搅拌速率的快慢也会影响药物的溶解度。
较高的搅拌速率可以使药物更快地溶解,但是也可能导致药物的不均匀分布。
六、样品制备的影响
样品制备的过程中,药物的粉碎程度、颗粒大小等因素都会影响到溶出度测试的结果。
因此,需要严格按照操作规程进行样品制备。
七、测定设备的精度和准确性
测定设备的精度和准确性对测试结果也有很大影响。
如果设备存在误差,那么测试结果就会受到影响。
综上所述,影响溶出度测定试验结果的因素较多,需要在试验中充分考虑这些因素,以确保得到准确可靠的结果。

浅析影响片剂溶出度的主要因素【摘要】片剂溶出度是评价药物释放性能的重要参数,受多种因素影响。
药物的特性、制备工艺、溶出介质、环境条件以及搅拌速度均对片剂溶出度产生影响。
本文通过分析这些因素,深入探讨了它们对片剂溶出度的影响机制。
药物的溶解度、溶出速度直接影响着片剂的释放行为。
制备工艺的不同会导致片剂溶出度的变化。
溶出介质的选择和环境条件的改变也会影响片剂溶出度的结果。
搅拌速度的调节对片剂溶出度有一定影响。
综合分析这些因素,可以更好地控制片剂的释放性能,提高药物疗效。
展望未来,研究人员可进一步探索影响片剂溶出度的机制,优化片剂的制备工艺,以提高片剂的药效和生物利用度。
需要注意到本研究的局限性,进一步研究和探索仍有待于未来。
【关键词】片剂溶出度、药物性质、制备工艺、溶出介质、环境条件、搅拌速度、影响因素、研究方向、局限性。
1. 引言1.1 影响片剂溶出度的重要性片剂溶出度是评价药物释放性能的重要指标之一,直接影响着药物在体内的吸收和疗效。
药物必须在体内溶解并释放出来才能被机体吸收,而片剂溶出度的高低会影响药物的生物利用度和治疗效果。
一个有效的片剂应当在规定的时间内释放出足够的药物,以确保在体内的药物浓度能够达到治疗的疗效浓度,同时又要避免药物过量、或者因为释放速度过快而出现毒副作用。
评价影响片剂溶出度的主要因素对于研究和开发药物具有重要意义。
只有深入了解影响片剂溶出度的各种因素,才能有针对性地进行剂型设计和制备工艺的优化,以提高药物的生物利用度,增强药效,减少毒副作用,从而更好地服务于临床治疗。
通过研究这些因素,可以更好地指导片剂的研发生产,为患者提供更加安全有效的药物治疗方案。
1.2 研究背景片剂溶出度是影响药物治疗效果的重要参数之一。
研究表明,片剂溶出度直接影响药物在体内的释放速率和吸收速度,进而影响药物的疗效和副作用。
对于片剂溶出度的研究具有重要的理论和实践意义。
随着药物剂型的不断更新和药物制备技术的不断进步,对片剂溶出度的研究也变得日益重要。

溶出度色谱条件方法开发
1. 色谱柱的选择,选择合适的色谱柱对于溶出度试验至关重要。
柱的尺寸、填料类型和填充物粒径等因素都会影响分离效果和分析
时间。
2. 流动相的选择,流动相的成分和pH值对于溶出度试验的结
果有重要影响。
需要考虑选择合适的有机溶剂和缓冲液,以确保对
样品中化合物的有效提取和分离。
3. 梯度程序的优化,通过优化梯度程序,可以实现对样品中不
同化合物的有效分离。
需要考虑梯度时间、斜率和温度等因素,以
获得最佳的分离效果。
4. 检测方法的选择,根据样品的性质和分析要求,选择合适的
检测方法,如紫外-可见吸收检测、荧光检测或质谱检测等。
5. 方法验证和优化,最后,需要对开发的溶出度色谱条件方法
进行验证和优化,确保其在分析样品时的准确性、灵敏度和重复性。
总之,溶出度色谱条件方法开发需要综合考虑色谱柱、流动相、
梯度程序、检测方法以及方法验证等多个方面,以确保获得准确、可靠的分析结果。

试论片剂溶出度影响因素目的:分析影响片剂溶出度的因素,进而提高片剂溶出度和药物产品质量。
方法:以实验研究的方式,对影响片剂溶出度的各种工艺参数,如颗粒粒度和大小、压片压力等进行实验分析,以得出最优工艺,提高片剂溶出度。
结果:对片剂溶出度影响最大的因素是润滑剂和崩解剂的使用量,粘合剂的温度、压片的压力、颗粒的粒径大小及硬度也会影响片剂的溶出度,而片剂直径对片剂溶出度的影响不大。
结论:为了提高片剂溶出度,提高产品质量,必须掌控科学合理的润滑剂及崩解剂用量。
标签:片剂;溶出度;影响因素片剂是一种常用的口服制剂剂型,其质量的高低与原料、辅料、颗粒硬度及大小、处方组成、工艺条件等因素相关[1]。
溶出度是反应片剂质量的重要指标,不仅反应了片剂的质量,还反应体内药物吸收和药效情况[2]。
本文旨在分析影响片剂溶出度的因素,进而提高片剂溶出度和药物产品质量,具体操作如下。
1 试验材料材料:盐酸环丙沙星(山东)、头炮氨苄(哈尔滨)、克拉霉素(浙江)、拉西地平(浙江)、淀粉、乳糖、硬脂酸镁(均为药用级)、竣甲基淀粉钠。
工具:智能溶出仪(天津大学)、电子天平及ZPW-21旋转式压片机。
2 试验方法及结果2.1辅料对片剂溶出度的影响2.1.1不同含量崩解剂对片剂溶出度的影响选取试验原粉,以不同的工艺处方添加辅料进行制粒,处方分别为:一:内加2%的羧甲基淀粉钠,二:内加6%的羧甲基淀粉钠,三:内加10%的羧甲基淀粉钠,四:外加1%的羧甲基淀粉钠,五:内加6%的羧甲基淀粉钠,外加2%的羧甲基淀粉钠。
取各个颗粒后进行压片,用智能溶出仪来检测片剂的溶出度,见表1。
由此可见,不同含量的崩解剂对片剂溶出度有重要影响,一般而言,同时添加内外崩解剂所达到的溶出度指标最优。
2.1.2不同含量润滑剂对片剂溶出度的影响选取试验原粉,以相同的工艺处方添加辅料进行制粒,在同批次颗粒加入不同比例的硬脂酸镁混合后进行压片,分别为1%、2%、6%、10%。

溶出度项目实验设计溶出度是指固体溶解在溶液中的能力,是药物溶解性的重要性能指标之一、药物溶出度可以影响其在体内的吸收和药效的发挥。
因此,对于新药物的溶出度评价至关重要。
本实验旨在通过测定固体药物在不同溶剂中的溶解度来评估药物的溶出度,并探究影响药物溶解度的因素。
实验目的:1.测定固体药物在不同溶剂中的溶解度;2.探究溶剂种类对药物溶解度的影响;3.探究温度对药物溶解度的影响。
实验材料和设备:1.固体药物样品;2.不同溶剂(例如水、乙醇、正丁醇等);3.恒温槽或恒温培养箱;4.磁力搅拌器;5.离心机;6.注射器;7.试管和烧杯等实验用具。
实验步骤:1.准备不同溶剂:选取水、乙醇和正丁醇等常用溶剂。
分别将这些溶剂倒入烧杯或试管中,量取适量(约10mL)。
2.准备药物样品:选取合适的固体药物样品,将其粉碎并过筛,以获得均匀的颗粒。
3.测定不同溶剂中的溶解度:将药物样品加入不同溶剂中的试管中,将试管放置在恒温槽或恒温培养箱中,并设置不同的温度,如30°C、37°C和45°C等。
使用磁力搅拌器在相同的条件下(如转速等)下均匀搅拌溶液。
待溶解达到平衡后,可使用注射器将溶液取出一定体积,放入离心机中离心一定时间,以使固体颗粒沉淀下来。
然后取上清液(溶液中的溶解物质)进行浓度测定。
4.浓度测定:可选用紫外分光光度计、高效液相色谱仪等设备对上清液中溶解物质的浓度进行测定。
5.数据处理:根据浓度测定结果,计算出不同温度下溶解度的平均值,并绘制药物溶解度-温度曲线。
预期结果及讨论:1.预期根据药物的化学特性和溶剂的极性等因素,不同药物在不同溶剂中的溶解度会有差异。
2.预期药物在温度升高的情况下,溶解度会增加。
这是因为温度升高可以提高药物分子的动力学能量,促进溶解过程。
3.绘制药物溶解度-温度曲线后,可以对药物在不同溶剂和温度下的溶解特性进行综合评估,并可以与理论模型进行对比,以判断溶解模型的适用性。

17吴小林.临床上利福平与格列齐特的相互作用.国外医药#抗生素分册,2004,25(2):9618N i e m iM,B ackm an J T,N euvon en M,et a l.E ff ects of rifa m pi n on t he phar m acok i neti cs and phar m acodyna m ics of g l yburide and g li p i z i de.C li n Phar m aco lTher,2001,69(6):40019N i e m iM,K i vistK T,Backm an J T,e t a l.E ffect of rif a m p i ci n on t he phar m acok i neti cs and phar m acodyna m ics of gli m epiri de.B r J C li n Phar-maco,l2000,50(6):59120Park J Y,K i m K A,KangM H,e ta l.E ffect of rifa mp i n on t he phar m a-cok i n etics of rosi g lit azone i n healt hy sub j ects.C li n Phar m acol Th er.2004,75(3):15721Scheen A J.Drug-d rug and food-drug phar macok i n eti c i n t eracti on s w i th ne w i n s u li notrop i c agents rep agli n i d e and nategli n ide.C li n Phar m a-cok i n et,2007,46(2):9322Kyrk l und C,Backm an J T,K ivist&o K T,e ta l.Rifa m pin greatl y reduces p l as m a s i m vastati n and s i m vas t ati n aci d con centrati on s.C li n Phar m acol Ther,2000,68(6):59223Scri ptureC D,P i eper J A.C li n i cal phar macok i n eti cs of fl uvastati n.C li n Phar m acok i net,2001,40(4):26324Lau Y Y,Okoch iH,H uang Y,et a l.Phar m acok i n eti cs of atorvastati n and i ts hydroxym etabolites i n rats and t h e effects of con co m it an t rifa m p-i ci n si ngle doses:relevance of firs t-pass effect from h epatic uptake transporters,and i ntesti n al and hep ati c m etabolis m.Drug M etabo li s m and D is position,2006,34(7):117525R i d titid W,W ongnaw a M,M ahatt hanatraku l W.et al.R ifa mp i nm arked l y decreas es p l as m a concen trations of p razi quan tel i n healt hy vo-l un t eers.C lin Ph ar m acolTh er,2002,72(5):50526N ijland H M,Rus l a m iR,Suroto A J.et a l.R i fa m p i ci n reduces plas m a concentrati on s of m oxifloxaci n i n p ati en ts w i th t ub erculos i s.C li n In f ectD i s,2007,45(8):100127G ebh art B C,B ark er B C,M ark e w itz B A et a l.Decreased ser um li n-ezoli d l evels i n a criti ca ll y ill patient recei v i ng con co m it an t li n ezoli d and rif a m p i n.Ph ar m acot herapy,2007,27(3):47628Ri b era E,A z ua j e C,Lopez R M et al.par m acok i n eti c i nteracti on be-t w een rifa mp ici n and t h e once-dail y co m b i nati on of saqu i navir and lo w -dose ritonav i r i n H I V-i nfected pati en ts w it h tubercu l osis.J An ti m-i crob Che m ot h er,2007,59(4):69029J us t esen U S,Andersen A B,K lit gaard N A,e t al.Phar m acok i n eti c i n-teraction b et w een rif a m p i n and the co mb i n ati on of i nd i navir and l ow-dose ritonav i r i n H I V-i n fected p ati en ts.C li n In f ectD is,2004,38(3): 42630郭婕,罗鹃,朱珠.抗肿瘤新药)))舒尼替尼.中国药学杂志,2007, 42(13):103731D i ck i nson B D,A lt m an R D,N i elsen N H,e t al.Drug i n t eracti on s be-t w een oral contraceptives and an tibiotics.Ob stet Gyneco l,2001,98(5):85332M ach avara m K K,Gundu J,Y a m s aniM R.E ffect of ket oconazol e and ri-fa mp ici n on the phar m acok i netics of ran i ti d i ne i n healthy hum an vol un-teer:a poss i b l e ro l e of P-gl ycoprotei n.Drug M etabol D r ug In t eract, 2006,22(1):47药品溶出度测定中的影响因素分析*唐素芳(天津市药品检验所,天津300070)摘要为保证溶出度测定数据的客观性和准确性,本文分析了溶出度测定中的影响因素,从溶出仪的调试与校正、溶出介质的配制与脱气、取样过程、胶囊壳的干扰和过滤材料的吸附等方面对溶出度测定结果的偏离进行纠正。

药物制剂的溶解度与溶出度研究药物制剂的溶解度与溶出度是制药领域中重要的研究内容。
溶解度指的是药物在溶剂中的溶解程度,而溶出度则是指药物从固体制剂中溶出的速度。
这两个参数对于药物的吸收和药效有着重要影响,因此在制剂开发及药物评价中都需要进行充分的研究。
本文将探讨药物制剂的溶解度与溶出度的研究方法和其在药物开发中的意义。
一、溶解度的研究方法药物制剂的溶解度可以通过一系列实验方法进行准确测定。
常用的方法包括:1. 固体过饱和法:将药物固体与溶剂充分混合,并维持一段时间后,通过过滤等方法将未溶解的固体分离出来,然后测定溶解液中的药物浓度。
这种方法适用于溶解度较低的药物。
2. 体积法:将药物加入溶剂中,并充分搅拌使其溶解。
然后测定所需的溶剂体积。
溶解度可通过药物溶解质量与溶剂体积之比计算得出。
3. 比色法:将药物溶解于适当的溶剂中,然后利用比色法测定溶液中的药物浓度。
这种方法对于颜色较深的药物非常适用。
4. 温度法:在一定温度下,将药物加入溶剂中,溶解后测定溶液中的药物浓度。
通过改变温度,可以研究药物溶解度与温度之间的关系。
二、溶出度的研究方法药物制剂的溶出度研究主要是通过体外溶出实验来进行。
常用的方法包括:1. 流速法:将药物制剂(如片剂、胶囊等)放入溶出仪器中,通过设定一定的流速,模拟胃肠道中的流动情况。
然后收集溶出液,并测定其中的药物浓度。
这种方法适用于固体制剂的溶出度研究。
2. 曲线拟合法:通过拟合药物溶出曲线,可以得到溶出速度相关的参数。
通过比较不同制剂的溶出曲线,可以评价其释放行为的差异。
3. 菲克定律:利用菲克定律,可以推导出在一定条件下药物的溶出过程。
通过计算溶出速度常数和溶出度等参数,可以评估药物制剂释放的特性。
三、溶解度与溶出度的意义药物的溶解度和溶出度对于药物的吸收和药效有着重要作用。
其意义主要体现在以下几个方面:1. 药物吸收:药物必须在胃肠道中溶解才能被有效吸收。
溶解度的研究有助于了解药物在不同溶液中的溶解情况,进而指导药物的给药途径设计及制剂优化。

溶出度实验方法的研究和建立溶出度是指化学物质在一定条件下溶于溶剂中的能力。
溶出度实验方法的研究和建立对于制药、化学工程以及环境科学等领域具有重要意义。
下面将介绍一种常用的溶出度实验方法-体外释放试验法,并给出其研究和建立过程的详细说明。
体外释放试验法是一种常用的溶出度实验方法,通过模拟人体内的环境,评价药物等化合物从药物制剂中释放出的速度和程度。
下面将详细介绍该方法的研究和建立过程。
1.实验装置准备准备好体外释放试验仪器,包括溶出度仪、恒温槽、振荡器等。
根据需要选择合适的器械和试剂。
2.试剂准备根据所需测定的化合物的性质和条件,在溶剂中溶解待测物质,以得到一定浓度的溶液。
溶剂的选择应考虑到化合物的溶解度、稳定性和毒性等因素。
3.实验方案设计根据研究目的和要求,设计合理的实验方案。
确定试样的浓度、容量、溶剂种类、温度和pH值等条件。
4.实验操作将试样加入溶出度仪的容器中,然后将仪器放入恒温槽中,控制好温度,开始试验。
试验过程中需要不断摇动试样,以促进化合物的溶解和释放。
定时取样,测定样品中待测物质的浓度。
5.数据处理根据实验结果,绘制溶出度曲线。
可以使用不同的数据处理方法,如累积溶出度法、一级反应动力学模型、零级反应动力学模型等来分析数据和计算药物的释放速率和程度。
同时,需要对实验结果进行统计学处理,例如计算平均值、标准偏差等。
6.结果分析与讨论对实验结果进行分析与讨论,了解药物的溶出性质和释放规律。
将实验结果与理论预测进行比较,探讨实验结果的合理性和可信度。
7.结论与总结根据实验结果得出结论,并总结实验的方法和步骤,提出改进建议和进一步研究的方向。
总之,溶出度实验方法的研究和建立需要进行实验方案设计、试剂准备、实验操作、数据处理、结果分析与讨论等步骤。
在实验过程中需要严格控制条件,以获得准确可靠的结果。
通过该实验方法研究和建立,可以评价化合物从制剂中的释放速率和程度,为制药、化学工程以及环境科学等领域的研究和开发提供重要参考。
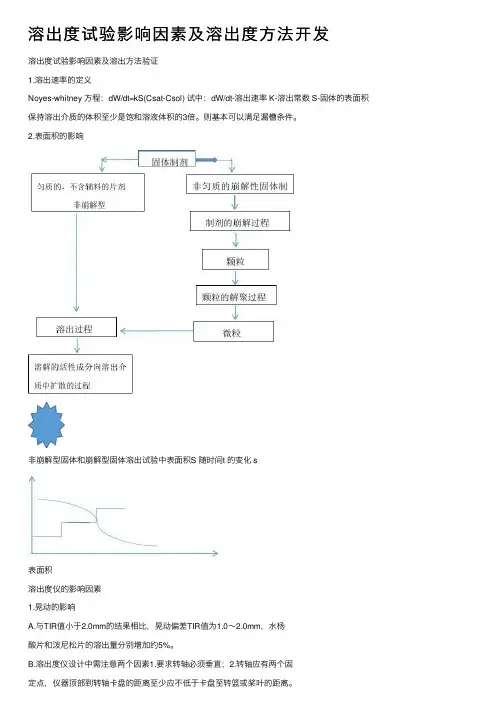
溶出度试验影响因素及溶出度⽅法开发溶出度试验影响因素及溶出⽅法验证1.溶出速率的定义Noyes-whitney ⽅程:dW/dt=kS(Csat-Csol) 试中:dW/dt-溶出速率 K-溶出常数 S-固体的表⾯积保持溶出介质的体积⾄少是饱和溶液体积的3倍。
则基本可以满⾜漏槽条件。
2.表⾯积的影响⾮崩解型固体和崩解型固体溶出试验中表⾯积S 随时间t 的变化 s表⾯积溶出度仪的影响因素1.晃动的影响A.与TIR值⼩于2.0mm的结果相⽐,晃动偏差TIR值为1.0~2.0mm,⽔杨酸⽚和泼尼松⽚的溶出量分别增加约5%。
B.溶出度仪设计中需注意两个因素1.要求转轴必须垂直;2.转轴应有两个固定点,仪器顶部到转轴卡盘的距离⾄少应不低于卡盘⾄转篮或桨叶的距离。
2.转轴的直线度a.转轴的直线度是控制晃动的关键仪器指标,应确保其直线度b.溶出度仪的涉及要求桨叶或篮体的顶端距卡盘的距离⾄少要6英⼨(15.2cm)。
3.其它搅拌装置的变动因素A.篮杆和桨杆是精密部件,使⽤时应⼩⼼,这些精密仪器在实验室的抽屉中存放时,会破坏不锈钢桨表⾯的。
引起弯曲和变性。
应有适当的⽀架供转轴存放。
B.桨叶应没有锐⾓。
尖锐部分会引起涡流⽽不是层流。
取⽤或放置篮时只能接触篮的上部边框,随着时间的增加,特别是在酸性介质时,筛⽹的孔径会有变化。
可⽤放⼤镜检,必要时需更换篮。
4.振动4.1振动的来源A实验室中能产⽣振动的仪器,包括通风橱和离⼼机,空调,风扇,离⼼机等。
B.⼈员⾛动,关门,开门。
C.早期⽔浴加热和溶出仪连在⼀起,⽬前的溶出度仪设计都采⽤外置循环泵与⽔浴连接。
4.2应将盛有溶出介质的溶出杯的各种来源的振动⽔平降低到0.1mil。
5.搅拌装置的准直度转轴的轴线与溶出杯的中⼼轴线间的偏离和倾斜对溶出介质流体动⼒学影响严重,可使溶出结果差异达到±25%。
影响结果很明显。
6.溶出杯中转轴的中⼼度7.搅拌速度规定转速⼀般不得过4%,转速的变化对溶出速率的影响⼏乎是线性的。

药物制剂中溶出度的影响因素研究随着科技的不断进步,药物制剂领域也在不断的发展壮大。
药物的溶出度是指药物从药物制剂中释放出来的速度和程度。
溶出度的大小对药物的吸收和效果产生重要影响。
本文将探讨药物制剂中溶出度的影响因素。
一、药物的化学特性药物的化学特性是影响药物制剂中溶出度的重要因素之一。
不同的药物有着不同的溶解度和相溶性,溶解度越高,在制剂中释放出来的速度也会越快。
同时,药物的溶解度受到pH值的影响,不同的pH值对药物的溶解度有不同的影响。
二、药物制剂的制备方法药物制剂的制备方法也是影响药物溶出度的因素之一。
不同的制剂方法会导致药物分子在制剂中的分布不同,进而影响药物的释放速度。
例如,常见的制剂方法包括湿法制剂、干法制剂和油包囊法等,这些方法在药物分子大小、结构以及释放机制上存在差异,因此对溶出度会有不同的影响。
三、药物制剂的溶出介质药物制剂的溶出介质也是影响药物溶出度的重要因素。
溶出介质的选择与药物的特性密切相关。
一般情况下,溶解度较高的药物可以在不同的溶解介质中快速溶出,而溶解度较低的药物则需要合适的溶解介质来促进溶解。
此外,溶出介质的温度和pH值对溶出度也有一定的影响。
四、药物制剂的物理特性药物制剂的物理特性也会对药物溶出度产生影响。
例如,药物粒子的大小、形状和分布都会影响药物在制剂中的扩散速率和溶出速率。
此外,制剂中所含的胶凝剂和填料等物质也会对药物的释放速度产生一定影响。
五、环境条件环境条件对药物溶出度也有一定的影响。
例如,温度、湿度和环境压力等因素都可能对药物制剂中溶出度产生影响。
药物制剂在不同的环境条件下,药物的扩散速率和溶解速率都可能会有所不同。
六、贮存条件贮存条件是影响药物制剂中溶出度的重要因素之一。
药物制剂在不同的贮存条件下,药物的溶解度和相溶性可能会发生变化,从而影响溶出度。
因此,合理的贮存条件也是确保药物溶出度稳定性的关键。
总结:药物制剂中溶出度的影响因素是多方面的。
药物的化学特性、制剂的制备方法、溶出介质、物理特性,以及环境条件和贮存条件等因素都会对药物溶出度产生影响。

溶出度概况及注意事项溶出度是指溶质在一定条件下在溶剂中溶解的程度,是溶解过程中溶质溶解与析出之间的平衡状态。
溶解是物质从一个相转移到另一个相的过程,溶出度则是描述溶解的程度。
溶出度的研究对于理解化学反应、分离纯化、药物制剂等方面具有重要意义。
以下是有关溶出度的概况及注意事项。
一、概况:1.影响溶出度的因素:-溶质特性:溶质的化学性质、分子结构、极性、分子量等都会影响溶质的溶解度。
-溶剂特性:溶剂的性质、极性、温度、压力等会影响溶质的溶解度。
-温度:对于大部分物质来说,温度升高溶解度会增加,但也有例外。
-压力:只有在液体中含有气体的情况下,压力对溶解度有影响。
2.溶解度的表示方法:-质量百分比溶解度:溶质在溶剂中的质量与溶液总质量的比值。
-摩尔溶解度:单位质量的溶剂中所含溶质的量。
-摩尔分数溶解度:溶质摩尔数与溶液总摩尔数的比值。
3.溶解度的计算方法:溶解度的计算一般采用实验测定和理论计算两种方法。
实验测定可以通过溶质在溶剂中的质量或摩尔量的测定来确定溶解度。
而理论计算则可以采用各种模型和物理性质来预测溶解度。
4.应用领域:溶解度的研究在许多领域中有广泛应用,如药物制剂、冶金工艺、环境科学、化学反应等。
在药物制剂中,了解药物的溶解度可以帮助优化配方、控制溶出速度,提高药物的吸收和生物利用度。
二、注意事项:1.实验条件的控制:试验中应该严格控制实验条件,如温度、压力、pH值等,因为这些因素都可能对溶解度产生影响。
2.溶出度曲线的测定:为了了解溶质在溶液中的浓度随时间变化的规律,可以进行溶出度曲线的测定。
实验时应该注意样品的制备和条件的一致性。
3.溶出度与溶质构象的关系:溶质的构象变化对其溶解度也会产生影响。
因此,在研究溶出度时,要考虑溶质的构象变化情况。
4.溶质的溶解度极限:溶质的溶解度是有极限的,即溶液中溶质的浓度达到一定值后不再增加。
这个极限值受到溶质本身性质以及实验条件的影响。
5.溶出度对于剂量的控制:在药物制剂中,了解溶解度可以帮助控制药物的剂量,从而达到理想的治疗效果。
一、溶出度测量方法1.1转篮法篮法是通过固定制剂的位置过的尽可能重现的液-固接触层。
不足之处如制剂中的黏性物质容易堵塞筛网;对溶出介质中溶解气体极其敏感以及当颗粒逸出网篮并浮在溶出介质中时会造成流苏的变动; 另外在试验中发现转篮法还存在着一个较为实际的问题: 例如篮内装得较满时,在仪器转动过程中仅仅可以能使释放的介质与篮外层的部分相接触,所以就常常不能较为客观地反映出溶出规律。
1.2桨法此方法克服了篮法的诸多不足。
但是该方法对搅拌桨和溶出杯几何尺寸的精度有相当高的要求,搅拌桨运动方向的微小改变都会引起溶出结果的变动,而这些结果的变动是可接受的。
浆法具有极易导致样品上浮的缺点。
1.3往复筒法 1995 年 USP 23 版收载了该法( 第3 法) ,应用于缓释制剂,特别是小丸( 或微丸) 制剂的释放度检查。
该仪器装置采用两端装有筛网的透明中空圆筒。
将样品置于圆筒中并将两端筛网紧固后,该装置在置于水浴中并内装有溶出介质的玻璃管中轻轻上下往复,解聚后的颗粒“悬浮”在往复运动的液流中。
为部分模拟人体胃肠道环境,可用于存放不同 pH 介质的一系列玻璃管作为溶出杯。
往复筒法的优点是所需介质少,易于改变 pH、减少死时间以及避免降解等。
用于缓控释制剂溶出检查。
该仪器通常被称为“Bio-Dis”,目前,Varian 和 Erwe-ka 等厂商提供了此种仪器。
1.4流池法( flow-through apparatus) 该方法就是将制剂置于样品池中,溶出介质在泵压下通过流通池。
该方法已经列入 USP36 版的第 4 法和《欧洲药典》( 第七版) 的官方标准,可用于篮法和桨法中有饱和度问题的药物。
用于片剂和包衣片、栓剂、软胶囊、植入剂、微胶囊、粉末和颗粒等制剂溶出速率的测定。
特别适用于缓释制剂的检测以及需要改变介质 pH 的溶出或释放度的分析,还可为难溶性药物提供恒定的漏槽条件。
该方法具有与自动取样技术的天然适配性。
固体制剂溶出度测定实验讨论固体制剂溶出度测定是药物体外评价中重要的质量控制手段之一。
它是指通过一定条件下的实验方法测定药物固体制剂在模拟生理条件下,随时间逐渐溶出药物的量。
本文将从实验方法、影响因素和实验数据分析等多方面进行讨论。
实验方法:1.器材准备:需准备类似于下降篮、漏斗、织滤布、烧杯和磁力搅拌器等实验器材。
2.环境条件:实验室温度应保持在25℃±1℃,湿度应保持在60%±5%。
3.溶媒选择:通常可以使用PBS缓冲液或模拟胃肠液等模拟溶液作为溶媒。
4.确定药物适宜量:根据药物的特点,确定药物适宜的量,一般为0.1g。
5.药物制剂样品取样:将药物制剂样品粉碎,挑选合适的粉末取大约等于2g的样品。
6.实验过程:将取样的固体制剂加入下降篮中,浸泡在37℃±0.5℃的模拟胃肠液中,通过磁力搅拌器搅拌使其均匀溶解,每隔一定时间取一定量样品,通过紫外分光光度计检测仪测定药物溶出量。
影响因素:1.固体制剂溶出度与药物的物化性质有关。
如药物颗粒度、结晶度、溶解度,药物粉末的含量、添加剂及制备工艺等因素均会影响药物的溶出度。
2.溶出介质条件也对药物溶出度有影响。
如模拟胃肠液的pH值、温度、搅拌速度、容量等因素会影响药物的溶出度。
3.试验条件的变化也可能影响药物溶出度。
如溶媒的流速、模拟胃肠液的配比、搅拌器转速等都可能影响药物的溶出度。
实验数据分析:1.制备好的固体制剂在模拟胃肠液中溶出的曲线可以是线性和非线性类型。
2.可以通过计算药物的平均溶出速率来确定药物在不同时间段内的溶出速率。
3.可以计算50%药物释放时间来评估药物产品的质量,这意味着50%的药物在多长时间内被释放。
4.可以计算溶出度参数,比如时间点的总溶出度、总量溶出度等,来进行更全面的分析。
总结:固体制剂溶出度测定实验对于制定合理的药物剂型处方、优化制剂工艺以及保障药物质量安全具有重要的意义。
因此,在实验过程中需要特别关注实验参数的标准化和控制,以确保实验结果的准确性和可重复性。
药物制剂中溶出度的模型建立研究溶出度是指药物在溶解介质中的溶解速率,是药物释放和吸收的重要因素之一。
溶出度的模型建立研究对于了解药物的释放行为、优化药物制剂的性能和预测药物的口服吸收等具有重要意义。
本文将探讨药物制剂中溶出度模型的建立方法及其应用。
一、药物制剂中溶出度的影响因素药物溶出度受多种因素影响,包括药物本身的性质、溶解介质、制剂特性和操作条件等。
药物本身的特性如溶解度、分子量、溶解度速率常数等将直接影响其在溶解介质中的溶解速率。
溶解介质的选择、pH值、温度等也会对溶出度产生重要影响。
制剂特性包括颗粒度、药物分散度、药物载体等对溶出度起到重要作用。
操作条件如搅拌速度、溶解度检测方法等也对药物溶出度有一定的影响。
二、药物溶出度模型的建立方法在研究药物溶出度模型时,可以采用多种数学模型来描述药物的溶解动力学过程。
常见的药物溶出度模型有零阶动力学模型、一阶动力学模型、Higuchi方程、Korsmeyer-Peppas方程等。
1. 零阶动力学模型零阶动力学模型假设溶出速率与溶解物的浓度无关,其方程可表示为:其中C_0为药物的初始浓度,C_t为时间t时刻的浓度,k_0为零阶溶解速率常数。
2. 一阶动力学模型一阶动力学模型假设溶出速率与溶解物的浓度成正比,其方程可表示为:其中k为一阶溶解速率常数。
3. Higuchi方程Higuchi方程假设药物溶解速率与溶解物的浓度成正比,与时间的平方根成反比,其方程可表示为:其中Q为溶出物的量,k_H为Higuchi方程常数。
4. Korsmeyer-Peppas方程Korsmeyer-Peppas方程适用于探索非Fickian扩散和自由体积扩散的复杂情况,其方程可表示为:其中n为扩散机制指数,k_kp为Korsmeyer-Peppas方程常数。
三、溶出度模型的应用溶出度模型的建立不仅帮助我们理解药物的溶解行为,还可以用于制剂性能的评价和控制。
通过模型,我们可以预测药物在不同制剂中的释放行为,为制剂的优化提供理论指导。
溶出度试验影响因素及溶出方法验证1.溶出速率的定义Noyes-whitney 方程:dW/dt=kS(Csat-Csol) 试中:dW/dt-溶出速率 K-溶出常数 S-固体的表面积保持溶出介质的体积至少是饱和溶液体积的3倍。
则基本可以满足漏槽条件。
2.表面积的影响非崩解型固体和崩解型固体溶出试验中表面积S 随时间t 的变化 s表面积溶出度仪的影响因素1.晃动的影响A.与TIR值小于2.0mm的结果相比,晃动偏差TIR值为1.0~2.0mm,水杨酸片和泼尼松片的溶出量分别增加约5%。
B.溶出度仪设计中需注意两个因素1.要求转轴必须垂直;2.转轴应有两个固定点,仪器顶部到转轴卡盘的距离至少应不低于卡盘至转篮或桨叶的距离。
2.转轴的直线度a.转轴的直线度是控制晃动的关键仪器指标,应确保其直线度b.溶出度仪的涉及要求桨叶或篮体的顶端距卡盘的距离至少要6英寸(15.2cm)。
3.其它搅拌装置的变动因素A.篮杆和桨杆是精密部件,使用时应小心,这些精密仪器在实验室的抽屉中存放时,会破坏不锈钢桨表面的。
引起弯曲和变性。
应有适当的支架供转轴存放。
B.桨叶应没有锐角。
尖锐部分会引起涡流而不是层流。
取用或放置篮时只能接触篮的上部边框,随着时间的增加,特别是在酸性介质时,筛网的孔径会有变化。
可用放大镜检,必要时需更换篮。
4.振动4.1振动的来源A实验室中能产生振动的仪器,包括通风橱和离心机,空调,风扇,离心机等。
B.人员走动,关门,开门。
C.早期水浴加热和溶出仪连在一起,目前的溶出度仪设计都采用外置循环泵与水浴连接。
4.2应将盛有溶出介质的溶出杯的各种来源的振动水平降低到0.1mil。
5.搅拌装置的准直度转轴的轴线与溶出杯的中心轴线间的偏离和倾斜对溶出介质流体动力学影响严重,可使溶出结果差异达到±25%。
影响结果很明显。
6.溶出杯中转轴的中心度7.搅拌速度规定转速一般不得过4%,转速的变化对溶出速率的影响几乎是线性的。
8.篮法的变动由于表面张力的作用,有时会在标准转篮的顶部形成较大的气泡。
当旋转的网篮下降进入溶出杯时,可能不会发生气泡,但这种操作不符合USP(711)的要求。
网篮底部的气泡在篮体转动后会自动消失。
如果在试验过程中产生气泡或气泡消失,分析人员应注意观察记录。
9.溶出介质的影响A.溶解气体的释放是影响溶出结果的主要变动因素之一。
FDA的科学家们在早期就提出,如果在溶出杯、转轴、篮或桨偶然出现闪亮现象,警示我们可能是溶解的气体释放,可能影响检测结果。
泼尼松片在溶出介质不脱气的情况下,溶出速率的相对标准偏差增加10%。
溶解的气体对溶出结果的影响程度没有一定的规律。
B.脱气的方式加热,通氦气,加热并通氦气,加热并超声,加热并抽真空,超声并抽真空,超声。
研究结论显示加热处理并通氦气是效果最好的脱气方式。
经典的煮沸技术可以将饱和溶解氧降低55%。
C.介质的体积的影响;缓释迟释制剂需回补,应有防止溶媒挥发的装置。
D.温度的影响10.吸附在收集供试品前,让足够多的样本溶液通过滤器,是吸附点饱和,这样过滤后溶液中的药物没有损失。
应选择吸附性质已知的过滤器。
溶出度试验方法的建立和验证1.初步评估1.1过滤的兼容性过滤的作用是除去未溶解的制剂及辅料,如果不过滤样品会继续在溶剂中溶出,要求取样后立即过滤。
过滤器的选择:1.考虑孔径的大小,从0.20 to 70 µm均可,如果样品的粒径较小的话,可以调整使用孔径更小的滤膜。
滤膜的兼容性:滤膜的吸收:滤膜的回收率,滤膜上样品的损失量和样品溶液的浓度有关,应考虑不同浓度下滤膜的吸收。
滤膜对药物的吸附有饱和性,可以采用弃去初滤液的方式收集样品。
1.滤膜应提前用溶出介质润湿。
2.考虑滤膜中的提取物干扰样品的测定,可以采用比较过滤液和未过滤液的样品。
3.滤膜孔径的选择应考虑需过滤的体积和粒径,使用大粒径的滤膜过滤少量样品会引起样品的损失,使用粒径小的滤膜会增大压力和引起滤膜堵塞。
4.采用对照品溶液与过滤后对照品溶液;供试品溶液与过滤后供试品溶液进行比较过滤的影响。
1.2在不同介质的溶解性和稳定性1.2.1药物两个重要的性质,一个为溶解性以及在特定pH下的稳定性。
选择溶出介质组成时,应考察缓冲盐、pH值以及表面活性剂对药物溶解性和稳定性的影响。
A建立溶出度方法时,应使其满足漏槽条件,B不建议使用水相-有机相混合溶剂,但经过相关验证该类溶出介质亦可接受。
C,纯化水作为溶出介质,并不理想,首先,水质决定于水源,pH不可控;其次,pH值的变化可能发生在日间,甚至在试验过程中受药物原辅料的影响发生改变,使用于溶出速率不受溶出介质影响的药物。
D 口服剂型的溶出特点应在1.2-6.8的pH范围内,稀盐酸、缓冲盐(磷酸盐和醋酸盐、水)进行考察(缓释制剂为1.2-7.5)。
还应考察缓冲盐及酸浓度对溶解性等的影响。
E.溶出介质中个别含有一定比例的表面活性剂(十二烷基硫酸钠,聚山梨酯)以增加溶解性,表面活性剂的使用和浓度,应在多个浓度水平进行考察,一般应在其临界胶束浓度之上,常见的表面活性剂的浓度见下表:在使用表面活性剂时需关注其级别和纯度,不同来源的吐温80可能影响HPLC 测定时的系统适用性。
在钾盐0.5M和SDS合用时,会有沉淀产生。
溶出介质和装置的选择可参考FDA数据库中的溶出方法:FDA. Recommended dissolution1.3体积和溶媒根据溶出度测定法(711),当胶囊或糖胶片的溶出度因明胶交联引起检查结果不符合规定时,可在溶出介质中加入适量的酶,见胶囊溶出度测试及相关质量属性(1094).在溶出介质的选择过程中,需注意样品在测定过程中应稳定。
在某些情况下可在溶出介质中加入抗氧剂等,如果样品很易降解,监控降解杂质或是同时监控制剂是合适的。
采用原位光谱技术优于HPLC法。
药典中的篮法和桨法一般采用溶出介质为500-1000ml,个别情况下可以采用2-4L;往复筒法(装置3),流通池法要求较低量的溶出介质100-200ml。
二,方法开发2.METHOD DEVELOPMENT1. METHOD DEVELOPMENT2.1 Deaeration2.2 Sinkers2.3 Agitation2.4 Study Design2.4.1 Time Points2.4.2 Observations2.4.3 Sampling2.4.4 Cleaning2.5 Data Handling2.6 Dissolution Procedure Assessment2. ANALYTICAL FINISH3.1 Sample Processing3.2 Filters3.3 Centrifugation3.4 Analytical Procedure3.5 Spectrophotometric Analysis3.6 HPLC3.4. AUTOMATION4.1 Medium Preparation4.2 Sample Introduction and Timing4.3 Sampling and Filtration4.4 Cleaning4.5 Operating Software and Computation of Results4.6 Common Deviations from the Compendia Procedures That MayRequire Validation三.方法验证3.1专属性/空白干扰应验证辅料、其它活性成分及降解产物对测定结果无显著干扰,空白包括除活性成分之外的辅料和包衣(还有油墨、沉降蓝及胶囊壳),空白干扰的测定可称取空白样品的混合粉末并溶解或分散在溶出介质中,空白干扰不得过2%。
对于缓释制剂,空白干扰试验使用空白制剂优于混合粉末,因空白制剂比混合粉末更接近药品对各辅料的释放过程。
如空白辅料干扰大于2%,为避免干扰必须对方法进行改进:①选择其它波长;②使用更长的波长以扣除基线;③使用HPLC法。
3.2线性范围应配制药物不同浓度的溶液,其浓度范围应涵盖药物释放时的最低和最高浓度。
对照溶液配制时,可使用有机溶剂以提高药物溶解性,待测溶液中有机溶剂不得过5%,否则应进行验证。
3.3准确度/回收率准确度通常需制备不同的样品,应包含药物及制剂中其它所有成分(如辅料、包衣材料及胶囊壳),其浓度范围应涵盖释放过程中可能出现的最低和最高浓度。
取对应量的对照贮备溶液而非药物粉末置溶出杯中。
测得的回收率应在加入量的95%~105%。
制备多个浓度梯度的溶液可有助于试验。
迟释制剂在检查酸中释放量时存在特殊情况。
不高于10%的限度应经过验证。
3.4精密度试验重复性是指对对照溶液或样品溶液进行重复测定。
中间精密度:尽可能使用含量均匀度良好的药品进行测定,如无法获得,则可使用空白片和活性药物成分测定中间精密度。
至少两个人员进行操作,分别配制不同的对照品溶液和溶出介质。
通常操作人员应使用不同的溶出度仪,分光光度计或高效液相色谱仪。
两组同浓度溶出度测定结果的平均值之间的应符合以下规定,溶出度低于85%的时间点,绝对误差应不高于10%,溶出度高于85%的时间点,绝对误差应不高于5%。
3.5对照品和样品溶液的稳定性对照溶液和供试溶液稳定性可接受的限度为98-102%。
3.6溶出曲线的制备与原研药溶出曲线比较,采用四个pH范围的溶出介质,绘制溶出曲线生物等效性和溶出特性在FDA文件中发现的生物不等效的药品记录中,有80%的产品溶出度差。
一个活性成分的溶出度特性并不表示其溶出结果与药品的生物利用度之间有严格的相关性。
比如一个快速溶解的药物,可能其溶出度结果和生物利用度不具有相关性。
只有当溶出速率与人体吸收速率相当或低于人体吸收速率时,溶出速率才能成为限速步骤。
只有在这种情况下,溶出结果才与生物利用度之间有明确的秩序相关性。
溶出度试验是药品研发和批间质量控制的一种重要且很有价值的工具。
FDA指导原则:口服固体速释制剂豁免体内生物利用度和生物等效性研究。
人体生物等效性试验豁免指导原则(国家食品药品监督管理局)二、基于BCS(生物药剂分类系统)的生物等效豁免根据BCS分类系统,药品被分为以下四类:第一类:高溶解性、高渗透性(High Solubility- High Permeability)第二类:低溶解性、高渗透性(Low Solubility-High Permeability)第三类:高溶解性、低渗透性(High Solubility-Low Permeability)第四类:低溶解性、低渗透性(Low Solubility-Low Permeability)当口服固体常释制剂在体内的溶出相对于胃排空时间快或非常快,并且具有很高的水溶性和肠道渗透性时,药物的吸收速率和吸收程度就不会依赖于药物的溶出时间或在胃肠道的通过时间。