钠及其化合物
- 格式:doc
- 大小:115.00 KB
- 文档页数:8




钠及其化合物一、钠1>介绍:在地壳中钠的含量为2.83%,居第六位,主要以钠盐的形式存在,如食盐(氯化钠)、智利硝石(硝酸钠)、纯碱(碳酸钠)等。
钠也是人体肌肉和神经组织中的主要成分之一。
已发现的钠的同位素共有15种,包括钠19至钠33,其中只有钠23是稳定的,其他同位素都带有放射性。
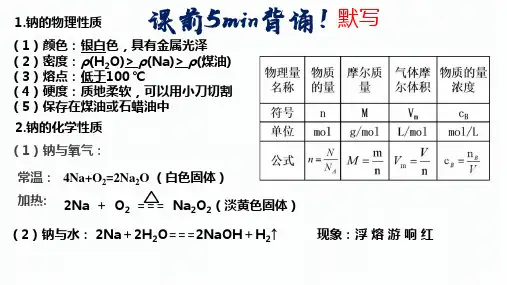
2>物理性质:钠是一种质软(可以用小刀切)、银白色,有金属光泽的金属,具有良好的导电性、导热性、密度比水小,比煤油大(P na=0.979g/cm³),钠的熔点是97.81℃,沸点是882.9℃。
钠单质还具有良好的延展性,硬度低。
钾钠合金(液态)是原子堆导热剂。
单质还具有良好的延展性,硬度也低。
3>化学性质:钠原子的最外层只有一个电子,很容易失去,所以有强还原性。
因此,钠的化学性质非常活波,在与其他物质发生强还原反应时,做还原剂。
都是由0价升为+1价。
金属性强,其离子氧化性弱。
4>与非金属反应①钠与氢气的反应2Na+H2=△=2NaH (固态氢化物,含氢二元化合物,白色固体)②钠与氧气反应1、在空气中缓慢氧化使钠表面变暗,生成不稳定的白色固体4Na+O2==2Na2O(白色固体)2、在空气或氧气中燃烧生成淡黄色固体(黄色火焰)2Na+O2=△/点燃=Na2O2(淡黄色固体)Ⅰ、常温下钠在空气中的变化A: 实验现象:切去外皮的金属放置在空气中,过一会儿,切面上的的变化为银白色变暗。
B: 变化的原因:常温下,钠与空气中的氧气发生反应,在钠表面生成了一层(薄)氧化物(Na2O),白色。
C:实验结论:常温条件下,金属钠在空气中就会发生明显变化。
这说明:钠比铁、镁、铝等金属的活泼性强。
Ⅱ、在加热条件下钠在空气中的变化实验现象:取一小块钠放在坩埚上加热,发生的现象为钠剧烈燃烧,产生黄色火焰,生成一种淡黄色固体。
注:在常温下和加热条件下,钠在空气中变化的比较:a:加热条件下反应更剧烈;b:产物不同,常温生成Na2O,加热生成Na2O2c:钠在空气中点燃时,迅速熔化为一个闪亮的小球,发出黄色火焰,生成过氧化钠(Na2O2)和少量超氧化钠(Na2O4)。

一、钠的原子结构与性质的关系钠原子结构如下:最外层只有1个电子,在化学变化中易失去最外层电子,呈现很强的金属性,在氧化还原反应中作还原剂,具有强还原性。
二、钠的物理性质(1)银白色金属;(2)密度小,ρ(Na)=0.97g/cm3,比水的密度小;(3)熔点和沸点低,熔点97.81℃,沸点882.9℃;(4)硬度小,金属钠可用小刀切割;(5)钠是热和电的良导体。
可简单概括成:银白色、质软、轻金属。
三、钠的化学性质1.钠与非金属反应与O2反应:缓慢氧化现象:新切的钠表面变暗剧烈氧化 2Na+O2Na2O2 现象:明亮的黄色火焰,生成淡黄色固体与Cl2反应: 2Na+Cl22NaCl 现象:黄色火焰,生成白色固体与S反应: 2Na + SNa2S 现象:加热生成白色固体,研磨易爆炸2、钠与水反应2Na+2H2O=2NaOH+H2↑离子方程式:2Na + 2H2O=2Na+ + 2OH-+ H2↑实验现象现象解释①钠浮在水面上ρ(Na)<ρ(H2O)②熔化成小球(银白色、闪亮) 反应放热,钠的熔点低③有嘶嘶声反应放热④钠球在水面迅速游动钠与水反应生成气体(H2)⑤滴入酚酞后溶液变红生成碱性物质NaOH[思考]钠在空气中长期放置有哪些现象?如何解释?将一小块银白色金属钠露置于空气中,很快看到钠表面变暗,过一段时间又会逐渐变潮湿,再过一些时间又转变为白色固体,最后变成白色粉末。
这是因为金属钠在空气中发生了如下反应:变暗是因为:4Na+O2=2Na2O变潮湿是因为生成的NaOH易潮解:Na2O+H2O=2NaOH(如空气较潮湿,也有可能发生:2Na+2H2O=2NaOH+H2↑)转变为白色固体,最后又变成白色粉末的原因:2NaOH+CO2+9H2O=Na2CO3·10H2O,Na2CO3·10H2ONa2CO3+10H2O(十水合碳酸钠在干燥的空气中发生风化而失去结晶水)银白色金属钠3.钠与酸反应现象:比与水反应更剧烈,甚至爆炸。



钠及其化合物(一)钠Na1、单质钠的物理性质:钠质软、银白色、熔点低、密度比水的小但比煤油的大2、单质钠的化学性质:①钠与O2反应常温下:4Na + O2=2Na2O (新切开的钠放在空气中容易变暗)加热时:2Na + O2==Na2O2(钠先熔化后燃烧,发出黄色火焰,生成淡黄色固体Na2O2。
)钠在空气中的变化过程:Na―→Na2O―→NaOH―→Na2CO3·10H2O(结晶)―→Na2CO3(风化),最终得到是一种白色粉末。
一小块钠置露在空气中的现象:银白色的钠很快变暗(生成Na2O),跟着变成白色固体(NaOH),然后在固体表面出现小液滴(NaOH易潮解),最终变成白色粉未(最终产物是Na2CO3)。
②钠与H2O反应2Na+2H2O=2NaOH+H2↑离子方程式:2Na++2H2O=2Na++2OH-+H2↑(注意配平)实验现象:钠浮在水面上,熔成小球,在水面上游动,有哧哧的声音,最后消失,在反应后的溶液中滴加酚酞,溶液变红。
“浮——钠密度比水小;游——生成氢气;响——反应剧烈;熔——钠熔点低;红——生成的NaOH遇酚酞变红”。
③钠与盐溶液反应如钠与CuSO4溶液反应,应该先是钠与H2O反应生成NaOH与H2,再和CuSO4溶液反应,有关化学方程式:2Na+2H2O=2NaOH+H2↑CuSO4+2NaOH=Cu(OH)2↓+Na2SO4总的方程式:2Na+2H2O+CuSO4=Cu(OH)2↓+Na2SO4+H2↑实验现象:钠熔成小球,在液面上四处游动,有蓝色沉淀生成,有气泡放出。
K、Ca、Na三种单质与盐溶液反应时,先与水反应生成相应的碱,碱再和盐溶液反应。
④钠与酸反应:2Na+2HCl=2NaCl+H2↑(反应剧烈)离子方程式:2Na+2H+=2Na++H2↑3、钠的存在:以化合态存在4、钠的保存:保存在煤油或石蜡中通电5、工业制钠:电解熔融的NaCl:2NaCl(熔融) 2Na + Cl2↑6、钠的用途:①在熔融的条件下钠可以制取一些金属,如钛、锆、铌、钽等;② 钠钾合金是快中子反应堆的热交换剂;③ 钠蒸气可作高压钠灯,发出黄光,射程远,透雾能力强。

钠及其化合物一、单质钠1、钠及其化合物的物理性质:(1)钠的物理性质:色、有金属光泽,质、密度,熔点(2)Na2O: 色固体,化合物,电解质(强或若)Na2O2:色固体,化合物,电解质(强或若)Na2CO3:俗名或,色粉末,易溶于水NaHCO3:俗名,易溶于水。
2、化学性质:(1)与氧气反应(钠与氧气的反应与条件有关)常温条件下的反应:点燃条件下的反应:氧化钠与水的反应:过氧化钠与水反应:(2)与水(酸)的反应钠与水反应的化学方程式为:钠与酸反应的离子方程式为:钠投入水中的反应现象:①、浮在水面上:说明钠的密度比水小②、熔化成光亮的小球:说明钠的熔点,该反应为反应③、小球在水面上迅速游动:说明有气体产生④、发出嘶嘶的响声:说明反应剧烈⑤、溶液中滴入酚酞显红色:说明生成的溶液呈碱性。
结论:钠的密度比水小,熔点低,反应放热,有气体和碱性物质生成。
钠与酸溶液反应时先与酸反应,再与水反应(3)与碱、盐的溶液反应,实际是与其中的先反应,产物再与反应。
例如:钠与硫酸铜的反应总反应式:结构解释:Na原子结构示意图,在周期表中的位置,Na原子易(“得到”或“失去”)个电子成为稳定结构,作剂,表现出强性,在自然界以态(“游离”或“化合”)形式存在。
少量钠可保存在中,钠着火不能用水来灭火,一般用。
二、钠的氧化物名称过氧化钠氧化钠化学式颜色与水反应方程式与CO2反应方程式稳定性比较Na2O是碱性氧化物能与水直接化和生成碱,与酸反应生成盐和水。
三、钠重要的盐——碳酸钠和碳酸氢钠Na 2CO 3NaHCO 3俗称水溶性 均 溶于水,溶解性 >溶液酸碱性 水溶液均显 性,同浓度碱性: >热稳定性 稳定不稳定 与盐酸反应 与盐酸反应剧烈程度 >与CaCl2溶液反应现象相互转化鉴别方法碳酸钠和碳酸氢钠都是盐,但水溶液都显碱性,涉及的离子方程式为:碳酸钠和碳酸氢钠的化学性质 Ca(OH)2 反应试剂 Na 2CO 3NaHCO 3酸 盐酸碳酸—— 碱 NaOH ——Ca(OH)2CaCl 2——四、焰色反应钠: 黄色钾:透过蓝色钴玻璃是紫色 铁:绿色操作:用洁净的 铂丝蘸取待测物,在外焰上烧灼,观察火焰颜色。
钠1.钠元素位于周期表第三周期IA族,自然界中钠只能以化合态的形态存在2.钠的物理性质钠是银白色、硬度较小(软)、密度较小(小于1)、熔沸点低(熔点低于水的沸点)的金属,常温下为固体,有良好的导电导热性。
3.钠的存放和取用少量金属钠可保存在煤油里,大量的金属钠则保存在铁筒中用石蜡密封。
4.钠的化学性质钠原子序号是11,最外层电子为1个,容易失去电子,表现出强还原性。
(1)跟氧气反应:钠在空气中自然反应:4Na+O2 === 2Na2O(白色)2Na+O2 Na2O2 (淡黄色)现象:产生黄色火焰,有大量白烟,生成淡黄色固体(2)钠与水反应,可见到下列现象①钠投入水中并浮在水面上。
②钠立即跟水反应,发出嘶嘶响声,产生气体。
③同时钠熔成一个闪亮的小球并在水面上向各方向迅速游动最后消失。
④反应后的水溶液使酚酞变红。
原因:密度小于水,反应放热且钠的熔点低,放出的气体使钠球受力不均匀,与水反应生成了碱性物质,说明产生了可燃气体,且收集较纯。
结论:2Na+2H2O =2NaOH +H2 ↑离子方程式:2Na+2H2O =2Na++2OH-+H2 ↑5.与稀酸溶液的反应实质:2Na +2H+ =====2Na++H2↑6.与某些盐的反应①与熔融盐 4Na+TiCl4 4NaCl+Ti②与盐溶液反应(先与水反应):如Na 投入CuSO4溶液中:2Na+2H2O =2NaOH +H2 ↑ 2NaOH + CuSO4 ===Cu(OH)2↓+Na2SO4两式合写:2Na+2H2O+ CuSO4 ===Cu(OH)2↓+Na2SO4+H2 ↑7.金属钠的用途:原子反应堆导热剂,制NaCO3,做航海钠灯,炼金属(如Ti)。
8.钠的重要化合物。
1.氧化钠和过氧化钠2.物理性质:有很强的腐蚀性,易潮解,易吸水(常用作干燥剂),极易溶于水,溶于水时会放出大量的热,受热熔化时不分解。
氢氧化钠俗称火碱、烧碱、苛性钠。
化学性质:a.是一元碱,具有碱的通性。
钠及其化合物一、钠的性质㈠实验探究实验1:钠的取用实验操作:用镊子从盛于广口瓶的煤油中取出一块金属钠,用滤纸吸干其表面的煤油,用小刀切割下一小块。
Array⑴金属钠为块状固体,刚从煤油中取出的钠表面是色的。
⑵钠能放在煤油中,是因为钠的密度比煤油小,钠不与煤油反应。
⑶钠保存在煤油中,目的是隔绝空气和水。
⑷钠能用小刀切割,说明钠的硬度小。
⑸刚切开的切口表面呈色,但很快变暗。
这是因为。
⑹取用后多余的钠,应该放回原瓶。
实验3:钠与水的反应实验4:钠露置空气中Na(s)→Na 2O(s)→NaOH(s)→NaOH(aq)→Na 2CO 3(aq) →Na 2CO 3·10H 2O(s) →Na 2CO 3(s)实验5∶测定金属钠的相对原子质量㈡性质总结⒈结构决定性质:钠元素“位·构·性”⒉物理性质:⑴色态: ⑵硬度:比铁、铝、镁的硬度 ⑶熔点:比水的沸点 ,比酒精的沸点 。
⑷密度:比水的密度 ,比煤油、酒精的密度 。
⒊化学性质: ⑴与非金属反应①4Na+O 2=2Na 2O (白) 2Na+O 2Na 2O 2(淡黄) ②2Na+Cl 2=2NaCl ③2Na+S=Na 2S ⑵与水剧烈反应:2Na+2H 2O=2NaOH+H 2↑ 2Na+2H 2O=2Na ++2OH -+H 2↑ ①反应实质:与水电离出的H +反应。
②与酸溶液的反应:易着火或爆炸。
先与酸电离出的H +反应,酸反应完后,继续与水反应。
③与碱溶液的反应:与水反应。
+4NaNa+KCl二、氧化钠和过氧化钠㈠实验探究实验1:滴水生火用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉剧烈燃烧起来。
⑴由上述实验现象所得出的有关过氧化钠跟水反应的结论是:第一,有氧气生成;第二,。
⑵某研究性学习小组拟用如右上图装置进行实验,以证明上述结论。
用以验证第一条结论的实验方法是。
用以验证第二条结论的实验方法及现象是。