化学电源教案 新人教版选修4
- 格式:doc
- 大小:2.66 MB
- 文档页数:18


第二節化學電源一、化學電池的種類化學電池:借助於化學能直接轉變為電能的裝置。
化學電池的主要部分是電解質溶液,和浸在溶液中的正極和負極,使用時將兩極用導線接通,就有電流產生,因而獲得電能。
化學電池放電到一定程度,電能減弱,有的經充電復原又可使用,這樣的電池叫蓄電池,如鉛蓄電池、銀鋅電池等;有的不能充電復原,稱為原電池,如乾電池、燃料電池等。
下麵介紹化學電池的種類:1.乾電池:普通鋅錳乾電池的簡稱,在一般手電筒中使用鋅錳乾電池,是用鋅皮製成的鋅筒作負極兼做容器,中央插一根碳棒作正極,碳棒頂端加一銅帽。
在石墨碳棒周圍填滿二氧化錳和炭黑的混合物,並用離子可以通過的長纖維紙包裹作隔膜,隔膜外是用氯化鋅、氯化銨和澱粉等調成糊狀作電解質溶液;電池頂端用蠟和火漆封口。
在石墨周圍填充ZnCl2、NH4Cl和澱粉糊作電解質,還填有MnO2作去極化劑(吸收正極放出的H2,防止產生極化現象,即作去極劑),澱粉糊的作用是提高陰、陽離子在兩個電極的遷移速率。
電極反應為:負極 Zn-2 e-=Zn2+正極 2+2 e-=2NH3+H2H2+2MnO2=Mn2O3+H2O正極產生的NH3又和ZnCl2作用:Zn2++4NH3=[Zn(NH3)4]2+乾電池的總反應式:Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+Mn2O3+H2O或 2Zn+4NH4Cl+2MnO2=[Zn(NH3)2]Cl2+ZnCl2+Mn2O3+H2O 正極生成的氨被電解質溶液吸收,生成的氫氣被二氧化錳氧化成水。
乾電池的電壓1.5 V —1.6 V。
在使用中鋅皮腐蝕,電壓逐漸下降,不能重新充電復原,因而不宜長時間連續使用。
這種電池的電量小,在放電過程中容易發生氣漲或漏液。
而今體積小,性能好的鹼性鋅—錳乾電池是電解液由原來的中性變為離子導電性能更好的鹼性,負極也由鋅片改為鋅粉,反應面積成倍增加,使放電電流大加幅度提高。
鹼性乾電池的容量和放電時間比普通乾電池增加幾倍。

学习必备欢迎下载4.2 化学电源教案新人教版选修4课题原电池第四章第二节化学电源课型新授课授课人高二化时1月 20日班级高二化学学任教间教学目标重点 1.掌握几种典型电池的用途和特点.2.掌握几种典型化学电池的电极反应难点 1.掌握几种典型电池的用途和特点. 2.掌握几种典型化学电池的电极反应教学方法讲授法、合作探究法教学环节教学内容总体设计个性化设时间计组织教学复习提问导入新课讲授新课师生相互问好原电池的工作原理已复习内容导入新课一、化学电池的种类二典型电池的介绍1.碱性锌—锰干电池:负极: Zn + 2OH- - 2e- = Zn(OH)2正极: 2MnO+2H2O+2e-=2MnOOH+2OH-电解质: KOH电池反应 :Zn+2MnO+2HO=2MnOOH+Zn(OH)指名背诵创设情境幻灯展示师生共同完成各组讨论,抢答1525学习必备欢迎下载课堂小结巩固练习布置作业板书设计教学反思2.银锌钮扣电池负极: Zn+2OH-2e = Zn OH2正极: Ag2O+ H2O+ 2e =2Ag+ 2OH总反应式: Zn+ Ag2 O+ H2O== Zn OH2+ 2Ag3.铅蓄电池负极: Pb+SO24-- 2e = PbSO4↓正极: PbO2+ 4H++SO24-+ 2e=PbSO4↓+2H2O5.燃料电池负极 H2+ 2OH- 2 e = 2H2O正极O 2+2HO+4 e=4OH电池总反应式为:2H+O2= 2H2O课堂检测完成训练案内容总结知识要点,画出知识树,构建知识体系。
原电池各组讨论展示成果,教师明确原理幻灯片展示组内独立完成独立完成20331。

高中化学选修四教学案:第四章第二节化学电源教学设计一、教材分析通过以前章节的学习,学生已经掌握了能量守恒定律、化学反应的限度、化学反应进行的方向和化学反应的自发性、以及原电池的原理等理论知识,为本节的学习做好了充分的理论知识准备。
化学电池是依据原电池原理开发的具有很强的实用性,和广阔的应用范围的技术产品。
本节的教学是理论知识在实践中的延伸和拓展,将抽象的理论和学生在日常生活中积累的感性体验联系起来,帮助学生进一步的深入认识化学电池。
现代科技的飞速发展也带动了电池工业的进步,各种新型的电池层出不穷。
教材选取具有代表性的三大类电池,如生活中最常用的一次电池(碱性锌锰电池)、二次电池(铅蓄电池)、和在未来有着美好应用前景燃料电池。
简介了电池的基本构造,工作原理,性能和适用范围。
同时向学生渗透绿色环保的意识。
二、教学目标1.知识目标:(1)知道日常生活中常用的化学电源和新型化学电池;(2)认识一次电池、二次电池、燃料电池等几类化学电池;(3) 会书写常用化学电池的电极反应式及总反应式。
2.能力目标:培养学生观察、分析、整理、归纳总结、探究等能力。
3.情感、态度和价值观目标:感悟研制新型电池的重要性以及化学电源可能会引起的环境问题,初步形成较为客观、正确的能源观,增强学生的环保意识。
三、教学重点难点重点:化学电源的结构及电极反应的书写难点:化学电源的结构及电极反应的书写四、学情分析在化学2中学生已学习了氧化还原反应的初步知识,前一节又已经学过原电池的基本内容,知道原电池的定义,形成条件,简单得电极反应等,所以在此基础上,进一步学习化学电源的知识。
学生能通过对实验现象的观察、有关数据的分析和得出相关结论,具有一定的观察能力、实验能力和思维能力。
五、教学方法1.实验探究与启发讨论法。
2.学案导学:见后面的学案。
3.新授课教学基本环节:预习检查、总结疑惑→情境导入、展示目标→合作探究、精讲点拨→反思总结、当堂检测→发导学案、布置预习六、课前准备1.学生的学习准备:初步把握实验的原理和方法步骤。

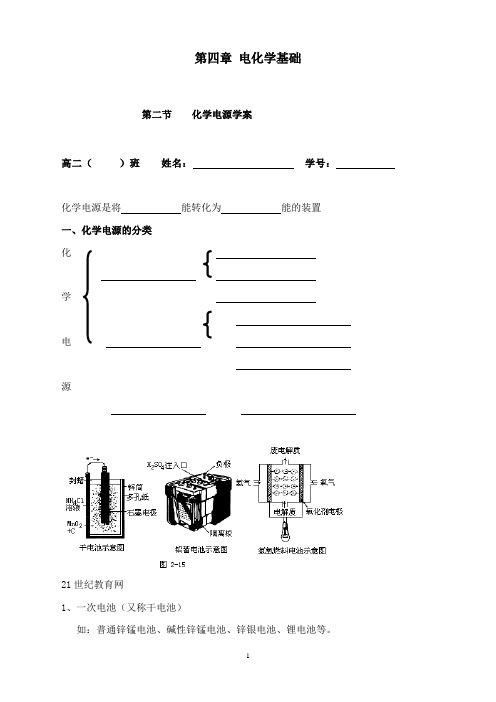
第四章电化学基础第二节化学电源学案高二()班姓名:学号:化学电源是将能转化为能的装置一、化学电源的分类化学电源21世纪教育网1、一次电池(又称干电池)如:普通锌锰电池、碱性锌锰电池、锌银电池、锂电池等。
放电 充电 (1)碱性锌锰电池,电解质是KOH ,其电极反应:负极(Zn ): 正极(MnO 2):总反应:(2)锌银电池的负极是Zn ,正极是Ag 2O ,电解质是KOH ,其电极总反应如下:Zn + Ag 2O = ZnO + 2Ag则:负极( ):正极( ):2、二次电池(又称充电电池或蓄电池)Pb (s)+ PbO 2(s) +2H 2SO 4(aq) 2PbSO 4(s) +2H 2O(l)①其放电电极反应:负极( ): 正极( ): ②其充电反应是上述反应的逆过程,则电极反应:(电化学上规定:发生氧化反应的电极为阳极,发生还原反应的电极为阴极) 阴极: 阳极:3、燃料电池燃料电池是一种持续地将燃料和氧化剂的化学能直接转换成电能的化学电池。
它与一般的化学电源不同,一般化学电池的活性物质储存在电池内部,故而限制了电池的容量,而燃料电池的电极本身不包括活性物质,只是一个催化转化元件。
如:氢氧燃料电池。
①中性介质时,电极反应:负极: 正极: 总反应:21世纪教育网②酸性介质时,电极反应:负极:正极:总反应:碱性介质时,电极反应:负极:正极:总反应:外,烃、肼、甲醇、氨、煤气等液体或气体,均可作燃料电池的燃料;除纯除H2氧气外,空气中的氧气也可作氧化剂。
练习、新型燃料电池,甲烷、氧气及KOH电解质溶液,用Pt作两个电极,写出两个电极的电极反应式和总反应式。
21世纪教育网。
选修4第四章第二节化学电源教学设计一、教材分析本节内容选自人教版化学选修4第四章第二节。
在选修4第一章学生着重研究了化学能与热能的关系,本章则着重研究化学能与电能的关系,均属于能量转化的范畴。
在上节学习原电池原理的基础上,本节是原电池原理的具体应用,是理论知识在实践中的延伸和拓展。
从本节教材一开始设置的“学与问”可以看出:教材要求学生自觉地将自己已经积累的感性知识与教学内容紧密联系起来。
另外,教材中提供了“锌银电池”、“锂电池”、“微型燃料电池”等阅读资料,目的是帮助学生了解电池工业发展的现状和前景,从而引导学生注重电化学与生产生活和科技发展的紧密联系。
在具体知识方面,教科书先概要性地介绍了电池的分类、优点以及质量优劣的判断标准,接着以碱性锌锰电池、铅蓄电池和氢氧燃料电池作为三类电池的典型代表,详细地介绍了他们的基本构造、工作原理、性能和应用,目的是让学生深入了解典型电池的构造并理解其工作原理。
二、学情分析从理论知识基础看,学生通过以前章节的学习学生已经掌握了能量守恒定律、氧化还原反应的本质、化学反应进行的方向以及原电池原理等理论知识基础。
从感性认知情况看,学生在日常的生活中经常接触到各种电池,对电池的种类和性能有一定的感性认知基础。
从学习心理看,学生对本节知识会有强烈的好奇心理和探究欲望。
三、教学目标(一)2020年修订的化学课程标准提出以下课程要求:内容要求:认识化学能与电能相互转化的实际意义及其重要应用。
了解常见化学电源的工作原理。
学业要求:能列举常见的化学电源,并能利用相关信息分析化学电源的工作原理。
能分析能源的利用对自然环境和社会发展的影响。
(二)课标要求在本节教学的具体体现:1.通过阅读教材,了解化学电池的分类、优点和优劣判断标准。
2.通过了解各类典型电池的基本构造,判断正负极,书写电极反应式深入理解化学电池工作原理,逐渐养成“宏观辨识与微观探析”的化学核心素养。
3.通过课堂上了解化学电池的发展史、对比各类典型电池的优劣,课后动手制作化学电池、调查化学电池的应用和回收,逐渐养成“科学精神与社会责任”、“科学探究与创新意识”的化学核心素养。
第二节化学电源1.了解化学电源的种类及其工作原理,知道化学电源在生产、生活和国防中的实际应用。
2.认识化学能与电能相互转化的实际意义及其重要作用。
3.掌握一次电池、二次电池、燃料电池的反应原理,会书写电极反应式。
(重难点)一次电池、二次电池教材整理1一次电池1.碱性锌锰电池(1)构造:(2)组成:正极:MnO2;负极:Zn;电解质:KOH。
(3)工作原理:负极反应:Zn+2OH--2e-===Zn(OH)2;正极反应:2MnO2+2H2O+2e-===2MnOOH+2OH-;总反应:Zn+2MnO2+2H2O===2MnOOH+Zn(OH)2。
2.银锌电池(1)构造:(2)组成:负极:Zn;正极:Ag2O;电解质:KOH。
(3)工作原理:负极反应:Zn+2OH--2e-===Zn(OH)2;正极反应:Ag2O+H2O+2e-===2Ag+2OH-;总反应:Zn+Ag2O+H2O===Zn(OH)2+2Ag。
教材整理2二次电池(以铅蓄电池为例)1.构造2.组成负极:Pb;正极:PbO2;电解质:H2SO4溶液。
3.工作原理(1)放电过程:负极:Pb(s)+SO2-4(aq)-2e-===PbSO4(s)(氧化反应);正极:PbO2(s)+4H+(aq)+SO2-4(aq)+2e-===PbSO4(s)+2H2O(l) 总反应:Pb(s)+PbO2(s)+2H2SO4(aq)===2PbSO4(s)+2H2O(l) (2)充电过程:阴极:PbSO4(s)+2e-===Pb(s)+SO2-4(aq);阳极:PbSO4(s)+2H2O(l)-2e-===PbO2(s)+4H+(aq)+SO2-4(aq);总反应:2PbSO4(s)+2H2O(l)===Pb(s)+PbO2(s)+2H2SO4(aq)。
(3)铅蓄电池的充、放电过程:Pb+PbO2+2H2SO4放电充电2PbSO4+2H2O[探究·升华][思考探究]H2是一种优质燃料,热值高。
(人教版选修4)第四章《电化学基础》教学设计第二节化学电源(共一课时)通过各类化学电源的实验探究和特点分析,体验并享受科学探究的快乐,提升学生的自主探索创新能力,树立节约资源和环境保护意识。
【引入】自第二次世界大战以来,为了适应工业以及宇宙航行等新技术的发展需要,先后研制成的多种电池。
其包括锌银电池、锂电池、太阳电池等。
其优点包括自重小、体积小、容量大、温度适应范围宽、使用安全、储存期长、维护方便等,这些电池就是我们本节课要重点学习的新型化学电源。
【板书】活动一、化学电池【讨论1】(1)依据Fe+H2SO4===FeSO4+H2↑如何设计原电池?【交流】可选用铁片作负极,铜片(或石墨)作正极,用导线连接后,置于电解质溶液稀硫酸中。
【讨论2】(2)若电极材料选铜和石墨,电解质溶液选硫酸铁溶液,外加导线,也能构成原电池,其电极反应式实什么?【交流】负极为Cu-2e-===Cu2+;正极为2Fe3++2e-===2Fe2+。
【讨论3】(3)若(2)题中电极材料选铜和铁,则电极反应式及总反应式该如何书写?【交流1】负极为Fe-2e-===Fe2+,正极为2Fe3++2e-===2Fe2+【交流2】其电池总反应的离子方程式为Fe+2Fe3+===3Fe2+。
【探】以上三种电池能否提供持续稳定的电流?为什么?【交流】以上三种电池均未使用盐桥,原电池里的负极材料直接与电解质溶液接触,不论电池是否工作都会持续反应,当负极材料消耗完,电池就会失效,因此,这些原电池都不能提供持续稳定的电流。
为了能提持续供稳定的电流,人们就根据原电池的原理,设计了多种多样的新型化学电池。
C.该电池放电过程中电解质溶液浓度增大D.电池工作时OH-向负极迁移【答案】 B【解析】以K2FeO4和Zn为电极材料,KOH溶液为电解质溶液的电池中,Zn为负极,发生反应:Zn-2e-+2OH-===Zn(OH)2,K2FeO4为正极,发生反应:FeO2-4+4H2O+3e-===Fe(OH)3+5OH-,放电过程中有OH-生成,则电解质溶液的浓度增大,OH-向负极迁移,故A、C、D正确,B错误。
第二节化学电源●课标要求通过查阅资料了解常见化学电源的种类及其工作原理,认识化学能与电能转化的实际意义及其应用。
●课标解读1.了解几种常见化学电源,一次、二次、燃料电池的工作原理。
2.正确书写有关电池的电极反应和电池反应。
●教学地位化学电池是依据原电池原理开发的具有很强的实用性和广阔的应用范围的技术产品。
本节的教学是理论知识在实践中的延伸和拓展,将抽象的理论和学生在日常生活中积累的感性体验联系起来,帮助学生进一步的深入认识化学电池。
简介了三种电池的基本构造,工作原理,性能和适用范围。
同时向学生渗透绿色环保的意识。
●新课导入建议当一个人的心脏跳动过慢时,医生会建议他安装一个心脏起搏器,借助化学反应产生的电流来延长生命。
该用什么材料制作这样的电池呢?经过科学家的长期研究,发明的这种电池叫做锂电池。
那除了这种电池外,还有其他的一些电池。
让我们一起来了解化学电源的多样性吧!●教学流程设计课前预习安排:(1)看教材P74页,填写【课前自主导学】中的“知识1,化学电池”。
(2)看教材P75~77页,填写【课前自主导学】中的“知识2,几种常见的化学电池”,并完成【思考交流】。
⇒步骤1:导入新课、本课时的教材地位分析。
⇒步骤2:建议对【思考交流】多提问几个学生,使80%以上的学生都能掌握该内容,以利于下一步对该重点知识的探究。
步骤6:先让学生自主总结本课时学习的主要知识,然后对照【课堂小结】以明确掌握已学的内容、安排学生课下完成【课后知能检测】。
⇐步骤5:在老师指导下完成【变式训练】和【当堂双基达标】中的题目,验证学生对探究点的理解掌握情况。
⇐步骤4:教师通过【例题】和教材P55~57页讲解研析对“探究”中的电极反应进行总结。
⇐步骤3:师生互动完成探究点“化学电源中电极反应式的书写”可利用【问题导思】设置的问题由浅入深地进行。
建议教师除【例1】外,使用【教师备课资源】中例题,以拓展学生的思路。
课标解读重点难点1.了解电池的分类、特点及适用范围。
2.了解几类化学电池的构造、原理。
3.了解化学电源的广泛应用及废旧电池的危害。
1.一次、二次、燃料电池的构造及工作原理。
(重点)2.原电池电极反应式的书写。
(重难点)化学电池1.概念:是将化学能直接转化为电能的装置。
化学电池的主要部分是电解质溶液和浸在溶液中的正极和负极,使用时将两极用导线接通,就有电流产生,因而获得电能。
2.类型⎩⎪⎨⎪⎧ ①一次电池 如普通锌锰电池——干电池 ②二次电池 如铅蓄电池③燃料电池 如氢氧燃料电池 几种常见化学电池1.一次电池(碱性锌锰电池)(1)构成:负极Zn ,正极MnO2,电解质KOH 。
(2)电极反应:负极:Zn +2OH --2e -===Zn(OH)2正极:2MnO2+2H2O +2e -===2MnOOH +2OH -总反应:Zn +2MnO2+2H2O===2MnOOH +Zn(OH)22.二次电池(蓄电池)(1)构成:负极Pb 、正极PbO2,电解质H2SO4溶液(2)工作原理①放电:负极:Pb(s)+SO2-4(aq)-2e -===PbSO4(s)正极:PbO2(s)+4H +(aq)+SO2-4(aq)+2e -===PbSO4(s)+2H2O(l)总反应:Pb(s)+PbO2(s)+2H2SO4(aq)===2PbSO4(s)+2H2O(l)②充电时铅蓄电池的充电反应是放电反应的逆过程。
阴极:PbSO4(s)+2e -===Pb(s)+SO2-4(aq);阳极:PbSO4(s)+2H2O(l)-2e -===PbO2(s)+4H +(aq)+SO2-4(aq);总反应:2PbSO4(s)+2H2O(l)===Pb(s)+PbO2(s)+2H2SO4(aq)。
上述充放电反应可写成一个可逆反应方程式:Pb(s)+PbO2(s)+2H2SO4(aq)放电充电2PbSO4(s)+2H2O(l)。
3.燃料电池(1)工作原理①连续地将燃料(如氢气、烃、肼、甲醇、氨、煤气等液体或气体)和氧化剂的化学能直接转换成电能。
②电极材料本身不发生氧化还原反应。
③工作时,燃料和氧化剂连续地由外部供给,在电极上不断地进行反应,生成物不断地被排除。
(2)氢氧燃料电池①电极材料Pt ,酸性电解质。
②电极反应:负极:H2-2e -===2H +正极:12O2+2H ++2e -===H2O总反应:H2+12O2===H2O若把氢氧燃料电池中的酸性介质换成碱性介质,其电极反应式怎样写?【提示】 负极:2H2-4e -+4OH -===4H2O正极:O2+2H2O +4e -===4OH -总反应:2H2+O2===2H2O化学电源中电极反应式的书写【问题导思】①化学电源中正、负极是什么物质得、失电子?【提示】正极:阳离子得到电子生成单质或O2得电子。
负极:活泼金属或H2失去电子。
②氢氧燃料电池在酸性电解质和碱性电解质中的总反应实质相同吗?【提示】相同,都为2H2+O2===2H2O1.根据装置书写电极反应式(1)先分析题目给定的图示装置,确定原电池正、负极上的反应物,并标出相同数目电子的得失。
(2)电极反应式的书写。
负极:活泼金属或H2失去电子生成阳离子,若电解质溶液中的阴离子与生成的阳离子不共4-2e-===PbSO4。
存,则该阴离子应写入负极反应式。
如铅蓄电池,负极:Pb+SO2-正极:阳离子得到电子生成单质,或O2得到电子。
若反应物是O2,则:电解质是碱性或中性溶液:O2+2H2O+4e-===4OH-。
电解质是酸性溶液:O2+4H++4e-===2H2O。
(3)正、负电极反应式相加得到电池反应的总反应方程式。
2.给出总反应式,写电极反应式分析反应中的氧化反应或还原反应(即分析有关元素的化合价变化情况)→选择一个简单的变化情况去写电极反应式→另一极的电极反应直接写出或将各反应式看作数学中的代数式,用总反应式减去已写出的电极反应式,即得结果以2H2+O2===2H2O为例,当电解质溶液为KOH溶液时的电极反应式的书写步骤如下:(1)根据总反应方程式分析有关元素化合价的变化情况,确定2 mol H2失掉4 mol电子,初步确定负极反应式为2H2-4e-===4H+。
(2)根据电解质溶液为碱性,与H+不能共存,反应生成水,推出OH-应写入负极反应式中,故负极反应式为2H2+4OH--4e-===4H2O。
(3)用总反应式2H2+O2===2H2O减去负极反应式得正极反应式:2H2O+O2+4e-===4OH -。
3.可充电电池电极反应式的书写在书写可充电电池电极反应式时,要明确电池和电极,放电为原电池,充电为电解池。
(1)原电池的负极与电解池的阳极发生氧化反应,对应元素化合价升高。
(2)原电池的正极与电解池的阴极发生还原反应,对应元素化合价降低。
书写电极反应式应注意电解质溶液的影响。
(1)中性溶液反应物中无H+或OH-。
(2)酸性溶液反应物,生成物均无OH-。
(3)碱性溶液反应物,生成物中均无H+。
(4)水溶液不能出现O2-。
(1)今有2H2+O2KOH,2H2O反应,构成燃料电池,则负极通的应是________,正极通的应是______,电极反应式分别为______________、______________。
(2)如把KOH改为稀H2SO4作电解质溶液,则电极反应式为__________________、_____________________。
(1)和(2)的电解液不同,反应进行后,其溶液的pH各有何变化?_______________________________。
(3)如把H2改为甲烷、KOH作导电物质,则电极反应式为:________________、__________________。
【解析】根据电池反应式可知H2在反应中被氧化,O2被还原,因此H2应在负极上反应,O2应在正极上反应。
又因为是碱性溶液,此时应考虑不可能有H+参加或生成,故负极反应为:2H2+4OH--4e-===4H2O,正极反应为:O2+2H2O+4e-===4OH-。
若将导电物质换成酸性溶液,此时应考虑不可能有OH-参加或生成,故负极:2H2-4e-===4H+,正极:O2+4H++4e-===2H2O。
由于前者在碱性条件下反应KOH量不变,但工作时H2O 增多故溶液变稀碱性变小,pH将变小。
而后者为酸溶液,H2SO4量不变,水增多,溶液酸性变小,故pH将变大。
如把H2改为甲烷用KOH作导电物质,根据反应CH4+2O2===CO2+2H2O,则负极为发生氧化反应的CH4,正极为发生还原反应的O2,由于有KOH存在,此时不会有CO2放出。
【答案】(1)H2O2负极:2H2+4OH--4e-===4H2O正极:O2+2H2O+4e-===4OH-(2)负极:2H2-4e-===4H+正极:O2+4H++4e-===2H2O(1)变小,(2)变大3+7H2O(3)负极:CH4+10OH--8e-===CO2-正极:2O2+4H2O+8e-===8OH-常见燃料电池的电极反应在燃料电池中,电解质溶液参与电极反应,电解质酸碱性的改变,引起电极反应的变化,但不影响燃料及O2的性质。
电极反应在遵守质量守恒定律、电荷守恒、电子得失守恒的同时,还要特别考虑电解质溶液是否参与反应。
(1)甲烷燃料电池。
电解质:KOH正极(通O2):2O2+4H2O+8e-===8OH-3+7H2O负极(通CH4):CH4+10OH--8e-===CO2-总反应:CH4+2O2+2KOH===K2CO3+3H2O(2)甲醇燃料电池。
电解质:KOH正极:3O2+6H2O+12e-===12OH-3+12H2O负极:2CH3OH+16OH--12e-===2CO2-总反应:2CH3OH+3O2+4KOH===2K2CO3+6H2O(3)肼燃料电池。
电解质:KOH正极:O2+2H2O+4e-===4OH-负极:N2H4+4OH--4e-===N2↑+4H2O总反应:N2H4+O2===N2+2H2O(4)熔融盐燃料电池。
熔融盐燃料电池具有较高的发电效率,因而受到重视。
可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO 为负极燃气,空气与CO2的混合气为正极燃气,制得在650 ℃下工作的燃料电池。
有关的电池反应式为:正极:O2+2CO2+4e -===2CO2-3负极:2CO +2CO2-3-4e -===4CO2总反应:2CO +O2===2CO2固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的。
它以固体氧化锆一氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。
该电池的工作原理如图所示,其中多孔电极a 、b 均不参与电极反应。