酸碱溶液的腐蚀性
- 格式:doc
- 大小:39.00 KB
- 文档页数:4

盐酸的性质和用途一、什么是盐酸?盐酸(hydrochloric acid)是氯化氢(HCl)的水溶液,工业用途广泛。
盐酸的性状为无色透明的液体,有强烈的刺鼻气味,具有较高的腐蚀性。
浓盐酸(质量分数约为37%)具有极强的挥发性,因此盛有浓盐酸的容器打开后氯化氢气体会挥发,与空气中的水蒸气结合产生盐酸小液滴,使瓶口上方出现酸雾。
盐酸是胃酸的主要成分,它能够促进食物消化、抵御微生物感染。
二、盐酸的性质与用途1、性质1)物理性质:无色液体,易挥发,刺激性气味。
2)化学性质:浓盐酸有挥发性。
工业生产的盐酸偏黄,是因为含有Fe3+,可用蒸馏法提纯。
打开浓盐酸的瓶塞,会有白雾出现,是因为:挥发的氯化氢气体极易溶于水,挥发时氯化氢气体与空气中的水蒸气结合形成了小液滴。
2、生活用途:1)生物用途人类和其他动物的胃壁上有一种特殊的腺体,能把吃下去的食盐变成盐酸。
盐酸是胃液的一种成分(浓度约为0.5%),它能使胃液保持激活胃蛋白酶所需要的最适合的pH值,它还能使食物中的蛋白质变性而易于水解,以及杀死随食物进入胃里的细菌的作用。
此外,盐酸进入小肠后,可促进胰液、肠液的分泌以及胆汁的分泌和排放,酸性环境还有助于小肠内铁和钙的吸收。
2)日常用途利用盐酸可以与难溶性碱反应的性质,制取洁厕灵、除锈剂等日用品。
3)工业用途:盐酸是一种无机强酸溶液,在工业加工中有着广泛的应用,例如金属的精炼。
盐酸往往能够决定产品的质量。
4)分析化学在分析化学中,用酸来测定碱的浓度时,一般都用盐酸来滴定。
用强酸溶液滴定可使终点更明显,从而得到的结果更精确。
在1标准大气压下,20.2%的盐酸可组成恒沸溶液,常用作一定气压下定量分析中的基准物。
其恒沸时的浓度会随着气压的改变而改变。
盐酸常用于溶解固体样品以便进一步分析,包括溶解部分金属与碳酸钙或氧化铜等生成易溶的物质来方便分析。
5)酸洗钢材盐酸一个最重要的用途是酸洗钢材。
在后续处理铁或钢材(挤压、轧制、镀锌等)之前,可用盐酸反应掉表面的锈或铁氧化物。


碱液(氢氧化钠)储罐腐蚀原理及推荐方案一、碱液(氢氧化钠)腐蚀原理分析储存氢氧化钠(NaOH)的储罐,通常不大,直径1. 2m,高1. 4m,由碳钢制作。
为了保持氢氧化钠溶液的温度,筒体外焊有夹套,用于通人热水。
氢氧化钠对碳钢的腐蚀速率一般小于0.2mm/a,其主要问题是低碳钢的应力腐蚀开裂,腐蚀的部位通常是碳钢容器的焊缝、锅炉炉管胀口处等。
碳钢在氢氧化钠溶液中受OH-的钝化而形成表面钝化膜,但是钝化膜易受损破口,破口处的热浓氢氧化钠对碳钢会产生强烈的腐蚀,部分氢原子渗人钢材内部还会引起脆化,导致裂纹扩展。
反应式如下:Fe十4OH-→Fe022-+2H2O+2e2Fe022-+3H2O→Fe2O3+40H-+H2几乎2%以上氢氧化钠的全部浓度范围内,都可产生应力腐蚀开裂。
随着浓度的上升,碳钢产生应力腐蚀开裂温度相应下降。
碳钢设备经焊后应力消除,可以提高设备的使用温度。
在北方.由于气温很低.有些工厂向夹套内通入蒸汽(0.2MPa)来取代热水,结果罐底很快就出现罐底碱液出口管周围有放射状裂纹导致泄漏。
如果是从上面的管口通人蒸汽.则会在夹套与筒体焊接处很快发生裂纹。
这种腐蚀是典型的碱脆.即受应力的金属材料在氢氧化钠溶液中发生的应力腐蚀破裂。
北京泽马涂料通过大量的实验和生产应用总结出,碳钢在30%的氢氧化钠溶液中,当温度超过55℃,就可能会使碳钢在应力的集中处,比红蒸汽人口处的焊接部位发生碱脆。
北京泽马涂料试验氢氧化钠(NaOH)溶液中的使用温度上限二、北京泽马涂料推荐方案:应用方案涂料名称厚度×遍数涂布率方案一ZM99-01A21耐酸碱防腐涂料100μm×2 2.5㎡/kg方案二ZM99-01A21耐氢氟酸防腐涂料100μm×2 2.5㎡/kg应用范围碳钢、不锈钢氢氧化钠储罐、池槽、管道等应用业绩安徽奇瑞汽车有限公司;混凝土池、槽防腐山东天阳炭素有限公司;设备、钢结构、池槽秦皇岛发电有限责任公司;排渣管道、进厂桥河南省新郑炭素厂;管道、储罐防腐福建黎阳环保股份有限公司;钢结构、混凝土水池青岛鲁海业实业有限公司;化学品罐、钢结构防腐三、施工方案:1、基体处理钢材基体涂装作业前,应去除基体表面的油污、残锈、氧化皮等。

酸碱与中性溶液的区别在化学中,溶液可以分为酸性溶液、碱性溶液和中性溶液。
本文将讨论酸碱溶液和中性溶液的区别。
一、酸碱溶液的特点酸性溶液具有以下特点:1. 酸性溶液的pH值小于7。
pH值是衡量溶液酸碱性的指标,小于7表示酸性,数值越小则酸性越强。
2. 酸性溶液呈酸性反应。
酸性溶液会与碱反应,产生酸碱中和反应,同时释放出氢离子(H+)。
3. 酸性溶液具有腐蚀性。
酸性溶液能腐蚀金属、灼伤皮肤,因此需要注意安全。
碱性溶液具有以下特点:1. 碱性溶液的pH值大于7。
pH值大于7表示碱性,数值越大则碱性越强。
2. 碱性溶液呈碱性反应。
碱性溶液会与酸反应,产生酸碱中和反应,同时释放出氢氧根离子(OH-)。
3. 碱性溶液具有腐蚀性。
碱性溶液也能腐蚀金属、灼伤皮肤,同样需要注意安全。
二、中性溶液的特点中性溶液的特点与酸碱溶液有所不同:1. 中性溶液的pH值等于7。
pH值为7表示中性,中性溶液不具有酸性和碱性的特点。
2. 中性溶液不呈现酸碱反应。
中性溶液不会与酸或碱反应,不产生酸碱中和反应。
3. 中性溶液对大部分物质不具有腐蚀性。
中性溶液对大部分金属和物质的腐蚀性较小。
三、酸碱溶液和中性溶液的应用领域酸碱溶液和中性溶液在生活和工业中有不同的应用:1. 酸性溶液的应用:酸性溶液常用于清洁剂、脱垢剂、电池液等领域。
它们能够有效去除污垢、溶解物质等。
2. 碱性溶液的应用:碱性溶液常用于清洁剂、肥皂、洗衣液等领域。
它们能够中和酸性物质,起到清洁作用。
3. 中性溶液的应用:中性溶液常用于日常生活中的饮用水、清洁水等领域。
它们不会对物质产生腐蚀作用。
四、总结通过对酸碱溶液和中性溶液的特点和应用进行比较,可以得出以下结论:1. 酸碱溶液的区分是基于pH值,酸性溶液的pH值小于7,碱性溶液的pH值大于7,中性溶液的pH值等于7。
2. 酸碱溶液具有腐蚀性,而中性溶液对物质的腐蚀性较小。
3. 酸碱溶液和中性溶液在应用上有所区别,常用于不同的领域。


稀盐酸化学-概述说明以及解释1.引言1.1 概述稀盐酸,也称为盐酸溶液,是一种常见的无机酸。
它是由氯气和水反应而成的溶液,化学式为HCl。
稀盐酸具有强酸性和腐蚀性,并在许多化学实验和工业过程中被广泛应用。
稀盐酸的特点之一是其溶解能力强。
它能够与许多金属、氧化物、碱等物质发生反应,并溶解它们,从而产生相应的化合物。
由于其强酸性特征,稀盐酸对许多物质具有腐蚀性,因此在使用过程中需要注意安全。
除了在实验室中常用作溶解剂外,稀盐酸还在许多领域中发挥着重要的作用。
在化学工业中,稀盐酸常被用于酸洗、金属清洗和腐蚀试验等。
此外,稀盐酸还被用作酸催化剂,在有机合成和制药工业中广泛应用。
稀盐酸的制备方法主要有两种,一种是利用氢氯酸气体溶解于水中,得到稀盐酸溶液;另一种是通过氯化碳和氢气的反应制备。
这些制备方法能够生产高纯度的稀盐酸,以满足不同领域的需求。
研究稀盐酸在化学领域的应用和性质对于理解和推动科学发展具有重要意义。
在未来,随着科技的不断进步和工业的发展,稀盐酸的应用将继续扩大,并在更多领域发挥作用。
因此,对稀盐酸的深入研究和利用将会对人类的生活和社会发展带来更多积极的影响。
总之,稀盐酸是一种重要的无机酸,具有强酸性和腐蚀性。
它的溶解能力强,在化学实验和工业生产中被广泛应用。
随着科技和工业的不断进步,稀盐酸的应用领域将进一步拓展,对人类社会的发展具有积极的促进作用。
1.2 文章结构本文将按照以下结构进行撰写:1. 引言:介绍本文所要探讨的主题——稀盐酸化学,并对整篇文章的结构和目的进行说明。
2. 正文:分为三个部分分别介绍稀盐酸的定义和性质、稀盐酸的制备方法以及稀盐酸在各个应用领域中的作用和影响。
2.1 稀盐酸的定义和性质:本部分将介绍稀盐酸的化学结构、物理性质以及与其他物质的反应特性,包括其酸性、腐蚀性等方面的特点。
2.2 稀盐酸的制备方法:本部分将详细介绍稀盐酸的制备方法,包括工业上的生产过程以及实验室中的常用制备方法,并对不同制备方法的优缺点进行比较。

酸碱浓度对金属电化学腐蚀的影响金属电化学腐蚀是指金属在电解质溶液中发生的一种化学反应,即金属表面被溶解或氧化的过程。
酸碱浓度是影响金属电化学腐蚀的重要因素之一。
本文将探讨酸碱浓度对金属电化学腐蚀的影响,并分析其中的机理。
酸碱溶液中的离子浓度与电导率密切相关。
当酸碱溶液的离子浓度增加时,电导率也会随之增加。
这是因为酸碱溶液中的离子可以通过导电作用来传递电荷。
当金属浸泡在酸碱溶液中时,溶液中的离子会与金属表面发生反应,从而引发电化学腐蚀。
因此,酸碱浓度的增加会加剧金属的电化学腐蚀。
在酸性溶液中,金属表面会释放出电子,形成阳极反应。
同时,溶液中的氢离子会参与阴极反应。
当酸性溶液的浓度增加时,溶液中的氢离子浓度也会增加,从而加速金属的电化学腐蚀过程。
此外,酸性溶液中还可能存在其他氧化剂,如氧气、硝酸根离子等,它们也会进一步促进金属的腐蚀。
与酸性溶液相反,碱性溶液中金属的腐蚀过程主要受到氧气的影响。
在碱性溶液中,金属表面会释放出电子,形成阳极反应。
溶液中的氢氧根离子会参与阴极反应。
当碱性溶液的浓度增加时,溶液中的氢氧根离子浓度也会增加,从而加速金属的电化学腐蚀过程。
此外,碱性溶液中的氧气浓度也会影响金属的腐蚀速率。
氧气是一种强氧化剂,它能与金属表面的电子发生反应,导致金属的氧化。
除了溶液中的离子浓度和氧气浓度,酸碱溶液的pH值也会对金属的电化学腐蚀产生影响。
pH值是衡量溶液酸碱性的指标,其数值越小表示溶液越酸性,数值越大表示溶液越碱性。
在酸性溶液中,pH值的降低会增加溶液中的氢离子浓度,从而加速金属的腐蚀。
而在碱性溶液中,pH值的升高会增加溶液中的氢氧根离子浓度,也会加速金属的腐蚀。
总之,酸碱浓度对金属电化学腐蚀有着明显的影响。
酸碱溶液中的离子浓度、氧气浓度以及溶液的pH值都会影响金属的电化学腐蚀速率。
因此,在工业生产和日常生活中,我们需要根据具体情况来选择合适的酸碱浓度,以降低金属的腐蚀风险。
此外,还有一些其他因素也会影响金属的电化学腐蚀,如温度、金属的表面状态、溶液中的杂质等。

酸和碱的区别是什么酸和碱是化学中常见的概念,它们在性质上有着显著的差异。
本文将详细介绍酸和碱的区别,包括定义、性质、化学反应以及常见应用等方面。
一、酸的定义和性质酸是能够产生氢离子(H+)的化合物,它可以与碱反应生成盐和水。
常见的酸包括盐酸、硫酸、醋酸等。
酸的性质主要有以下几个方面:1.酸味:酸具有酸味,例如柠檬汁和醋都有酸酸的味道。
2.酸性:酸溶液呈酸性,可以改变染料的颜色,如酸性溶液可以使蓝色石蕊试纸变红。
3.腐蚀性:酸具有腐蚀性,可以与金属反应生成氢气,也可以腐蚀有机物和无机物。
4.电离性:酸在水中可以电离产生氢离子(H+)。
二、碱的定义和性质碱是能够产生氢氧根离子(OH-)的化合物,它可以与酸反应生成盐和水。
常见的碱包括氢氧化钠、氢氧化钾、氨水等。
碱的性质主要有以下几个方面:1.苦味:碱味苦,如苦胆(氢氧化铝)等。
2.碱性:碱溶液呈碱性,可以改变染料的颜色,如碱性溶液可以使红色石蕊试纸变蓝。
3.腐蚀性:碱具有腐蚀性,可以腐蚀有机物和无机物。
4.电离性:碱在水中可以电离产生氢氧根离子(OH-)。
三、酸碱反应酸和碱可以发生中和反应,生成盐和水。
中和反应是一种重要的化学反应,在实际生活和工业生产中有着广泛的应用。
酸碱中和反应的一般化学方程式如下:酸 + 碱→ 盐 + 水例子:盐酸 + 氢氧化钠→ 氯化钠 + 水四、酸碱指示剂酸碱指示剂可以通过颜色的变化来判断溶液的酸碱性。
常见的酸碱指示剂有酚酞、甲基橙、溴蓝等。
不同的酸碱指示剂在不同pH值范围内会呈现不同的颜色,通过对颜色的观察可以确定溶液的酸碱性。
五、酸碱的应用酸和碱在生活和工业中具有广泛的应用,下面列举几个常见的应用场景:1.饮食:醋、柠檬汁等酸性物质可以增加食物的口感,而小苏打、牙膏等碱性物质可以中和口腔中的酸性物质。
2.清洁剂:许多清洁剂在成分中含有酸碱物质,可以去除沉淀、清洁污渍。
3.农业:调节土壤pH值,使其更适合植物生长。
4.制药工业:酸碱催化反应是许多药物合成的关键步骤。


为什么溶液的酸碱性会影响金属的腐蚀溶液的酸碱性是指溶液中酸性物质和碱性物质的含量及其相对浓度的度量。
溶液的酸碱性对金属的腐蚀有着重要的影响。
本文将探讨为什么溶液的酸碱性会影响金属的腐蚀,并进一步说明酸碱性对金属腐蚀速度和形式的影响。
首先,酸性溶液对金属的腐蚀具有较大的影响。
酸性溶液中存在丰富的氢离子,这些氢离子能够与金属表面的金属离子发生还原反应。
具体而言,氢离子能够将金属离子还原成金属原子,同时自身被还原为氢气。
这个过程被称为金属的电极反应。
在这个过程中,金属原子形成腐蚀产物,而同时产生的氢气则会逃逸到溶液中。
然而,对于碱性溶液而言,其对某些金属的腐蚀性较小。
碱性溶液中含有较少的氢离子,缺乏足够的还原剂与金属表面的金属离子反应。
因此,碱性溶液中金属的腐蚀速度相对较慢。
此外,碱性溶液中的氢氧根离子还会与金属离子进行复合反应,使得金属形成稳定的氢氧化物或碱金属盐类。
这些腐蚀产物通常具有一层致密的保护膜,能够减慢金属的腐蚀速率。
除了对腐蚀速度的影响外,溶液的酸碱性还会对金属的腐蚀方式产生影响。
酸性溶液中金属的腐蚀往往呈现出局部腐蚀的特点,即表面的某些部位比其他部位更易受到腐蚀。
这是因为在酸性溶液中,金属表面可能存在着微小的破损或缺陷,这些破损会成为局部腐蚀的起始点。
与之相反,在碱性溶液中,金属的腐蚀往往更加均匀。
这是因为碱性溶液中金属表面的氧气浓度较高,能够使金属更容易被氧化。
总结起来,溶液的酸碱性对金属的腐蚀有重要影响。
酸性溶液中丰富的氢离子会加速金属的腐蚀,并导致局部腐蚀的发生。
而碱性溶液中相对较少的氢离子和较高的氧气浓度会减慢金属的腐蚀速度,并使其更趋于均匀。
因此,了解溶液的酸碱性及其对金属腐蚀的影响,对于正确选择材料和合理设计使用环境至关重要。
酸碱盐的性质一、酸的性质酸是指能够产生酸性溶液的物质。
酸的性质包括以下几个方面:1. 酸味酸具有特殊的酸味,如柠檬和醋都有酸味。
但不是所有有酸味的物质都是酸,因为有些物质具有酸性但不具有酸味,如硫酸和盐酸。
2. 酸性溶液酸溶液具有酸性质,可以改变指示剂的颜色,如酸溶液会将蓝色的石蕊指示剂变成红色。
酸溶液也可以与金属反应,释放出氢气。
例如,盐酸和锌发生反应会产生氢气。
3. 中和反应酸与碱进行中和反应时,会生成盐和水。
这是因为酸可以释放出氢离子(H+),而碱可以释放出氢氧根离子(OH-),两者结合后形成水分子。
例如,硫酸和氢氧化钠反应会生成硫酸钠和水。
二、碱的性质碱是指能够产生碱性溶液的物质。
碱的性质包括以下几个方面:1. 碱味碱具有苦味和涩味,如氢氧化钠和氢氧化钾都有碱味。
但并不是所有具有苦味或涩味的物质都是碱,因为有些物质具有碱性但不具有碱味,如氨气和氧化钙。
2. 碱性溶液碱溶液具有碱性质,可以改变指示剂的颜色,如碱溶液会将红色的酚酞指示剂变成黄色。
碱溶液也可以与酸反应,发生中和反应。
例如,氢氧化钠和盐酸反应会生成氯化钠和水。
3. 腐蚀性碱对肌肤有腐蚀性,可以引起灼伤或刺激。
因此,在使用碱性溶液时需要注意安全。
三、盐的性质盐是由酸和碱中和反应生成的物质,具有以下几个性质:1. 导电性盐溶液具有良好的导电性,可以导通电流。
这是因为盐在水中会解离成阳离子和阴离子,而离子具有带电性质,可以导电。
2. 不挥发性盐是不挥发的固体,在常温下不会挥发成气体。
这是因为盐的离子结构比较稳定,不容易分解。
3. 不溶性一些盐不溶于水,如氯化银和碘化铅。
这是因为这些盐的溶解度较低,无法溶解于水中。
四、酸碱盐的反应类型酸碱盐之间可以发生多种反应,常见的有:1. 酸与碱的中和反应当酸与碱进行中和反应时,会生成盐和水。
反应式为:酸 + 碱→ 盐 + 水。
2. 酸与金属的反应酸可以与金属反应,释放出氢气。
反应式为:酸 + 金属→ 相应的盐 + 氢气。
总复习:常见的酸和碱及其通性〔提高〕责编:熊亚军【考纲要求】1.掌握常见的酸及酸的通性,了解浓盐酸、浓硫酸的特性以及浓硫酸的稀释方法。
2.掌握常见的碱及碱的通性,重点掌握氢氧化钠和氢氧化钙的性质。
3.会用酸碱指示剂检验溶液的酸碱性。
【知识网络】浓盐酸:是无色有刺激性气味的液体,有挥发性和腐蚀性物理性质浓硫酸:是无色粘稠油状液体,有吸水性,易溶于水,溶化时放出大量热,有强烈的腐蚀性①紫色石蕊试液遇酸变红色,无色酚酞试液遇酸不变色②与生动 Zn+H2SO4=ZnSO4+H2↑金属反响 Fe+2HCl=FeCl2+H2↑化学性质③与金属 Fe2O3+6HCl=2FeCl3+3H2O氧化物反响 CuO+H2SO4=CuSO4+H2O常见的酸④与碱 NaOH+HCl=NaCl+H2O反响 Ca(OH)2+H2SO4=CaSO4+2H2O⑤与某些 HCl+AgNO3=AgCl↓+HNO3盐反响 H2SO4+BaCl2=BaSO4↓+2HCl浓硫酸特性:吸水性、脱水性、强氧化性浓硫酸稀释方法:肯定要把浓硫酸沿着器壁渐渐地注入水里,并不断地用玻璃棒搅拌用盐酸:除锈,制造其他化工产品,胃液中的主要成分,援助消化途硫酸:枯燥剂,广泛用于生产化肥、农药、X、染料及金属除锈1.酸碱指示剂与酸或碱的溶液作用时,变色的是指示剂,而不是酸或碱。
指示剂与酸或碱的作用是化学变化。
2.碱只有溶于水后才能使指示剂变色,固态碱或不溶于水的碱不能使指示剂变色,因为使指示剂变色的是能自由运动的OH-。
考点二、几种常见的酸和碱1.盐酸、硫酸的物理性质及用途:2.浓盐酸的特性:挥发性。
翻开盛装浓盐酸的试剂瓶盖,会在瓶口出现白雾,这是浓盐酸中挥发出的氯化氢气体与空气中的水蒸气结合形成盐酸小液滴产生的现象,并不是白烟。
3.浓硫酸的特性:吸水性、脱水性和腐蚀性。
吸水性是浓硫酸的物理性质,脱水性是浓硫酸的化学性质。
脱水性是浓硫酸将由C,H,O等元素组成的化合物〔一般是有机物〕里的H,O元素的原子数以2∶1的比例从化合物中夺取出来,使化合物脱水而发生碳化现象。
碱液(氢氧化钠)储罐腐蚀原理及推荐方案一、碱液(氢氧化钠)腐蚀原理分析储存氢氧化钠(NaOH)的储罐,通常不大,直径1. 2m,高1. 4m,由碳钢制作。
为了保持氢氧化钠溶液的温度,筒体外焊有夹套,用于通人热水。
氢氧化钠对碳钢的腐蚀速率一般小于0.2mm/a,其主要问题是低碳钢的应力腐蚀开裂,腐蚀的部位通常是碳钢容器的焊缝、锅炉炉管胀口处等。
碳钢在氢氧化钠溶液中受OH-的钝化而形成表面钝化膜,但是钝化膜易受损破口,破口处的热浓氢氧化钠对碳钢会产生强烈的腐蚀,部分氢原子渗人钢材内部还会引起脆化,导致裂纹扩展。
反应式如下:Fe十4OH-→Fe022-+2H2O+2e2Fe022-+3H2O→Fe2O3+40H-+H2几乎2%以上氢氧化钠的全部浓度范围内,都可产生应力腐蚀开裂。
随着浓度的上升,碳钢产生应力腐蚀开裂温度相应下降。
碳钢设备经焊后应力消除,可以提高设备的使用温度。
在北方.由于气温很低.有些工厂向夹套内通入蒸汽(0.2MPa)来取代热水,结果罐底很快就出现罐底碱液出口管周围有放射状裂纹导致泄漏。
如果是从上面的管口通人蒸汽.则会在夹套与筒体焊接处很快发生裂纹。
这种腐蚀是典型的碱脆.即受应力的金属材料在氢氧化钠溶液中发生的应力腐蚀破裂。
北京泽马涂料通过大量的实验和生产应用总结出,碳钢在30%的氢氧化钠溶液中,当温度超过55℃,就可能会使碳钢在应力的集中处,比红蒸汽人口处的焊接部位发生碱脆。
北京泽马涂料试验氢氧化钠(NaOH)溶液中的使用温度上限二、北京泽马涂料推荐方案:应用方案涂料名称厚度×遍数涂布率方案一ZM99-01A21耐酸碱防腐涂料100μm×2 2.5㎡/kg方案二ZM99-01A21耐氢氟酸防腐涂料100μm×2 2.5㎡/kg应用范围碳钢、不锈钢氢氧化钠储罐、池槽、管道等应用业绩安徽奇瑞汽车有限公司;混凝土池、槽防腐山东天阳炭素有限公司;设备、钢结构、池槽秦皇岛发电有限责任公司;排渣管道、进厂桥河南省新郑炭素厂;管道、储罐防腐福建黎阳环保股份有限公司;钢结构、混凝土水池青岛鲁海业实业有限公司;化学品罐、钢结构防腐三、施工方案:1、基体处理钢材基体涂装作业前,应去除基体表面的油污、残锈、氧化皮等。
酸碱盐的通性酸的通性:有腐蚀性,溶液呈酸性,能与活泼金属,碱,某些盐和金属氧化物反应与排在氢之前的活泼金属反应生成盐和氢气,与指示剂反应碱的通性:有腐蚀性,溶液呈碱性,能与某些金属,酸,某些盐和非金属氧化物反应,与指示剂反应盐的通性:有些盐有微弱的腐蚀性,溶液的酸碱度根据盐的性质判定,能与某些酸,碱,盐反应还能和其他某些化合物反应酸碱盐溶解性口诀酸+碱=盐+水即:中和反应。
反应条件:无反应类型:中和反应例:H2SO4(酸)+Mg(OH)2(碱)= MgSO4(盐)+ 2H2O(水)酸+盐=新酸+新盐反应条件:有气体或者水或者沉淀生成才能反应反应类型复分解例:2HCL(酸)+Na2CO3(盐)= H2CO3(新酸)+ 2NaCl(新盐)但是碳酸不稳定:H2CO3=H2O+CO2↑这样就有气体和水生成了酸+活泼金属=盐+氢气反应条件:金属是活泼金属反应类型:置换例:2HCl(盐酸)+Fe(活泼金属)= FeCl2(盐)+H2↑(氢气)酸+金属氧化物=盐+水反应条件:无反应类型:复分解例:H2SO4(酸)+CuO(金属氧化物)= CuSO4(盐)+H2O(水)酸碱盐的常见反应方程式(1)金属单质+ 酸-------- 盐+ 氢气(置换反应)26. 锌和稀硫酸Zn + H2SO4==== ZnSO4 + H2↑27. 铁和稀硫酸Fe + H2SO4 ====FeSO4 + H2↑28. 镁和稀硫酸Mg + H2SO4 ==== MgSO4 + H2↑29. 铝和稀硫酸2Al +3H2SO4 ==== Al2(SO4)3 +3H2↑30. 锌和稀盐酸Zn + 2HCl ====ZnCl2 + H2↑31. 铁和稀盐酸Fe + 2HCl ====FeCl2 + H2↑32. 镁和稀盐酸Mg+ 2HCl ==== MgCl2 + H2↑33. 铝和稀盐酸2Al + 6HCl ====2AlCl 3+ 3H2↑(2)金属单质+ 盐(溶液)------- 另一种金属+ 另一种盐34. 铁和硫酸铜溶液反应:Fe + CuSO4 ==== FeSO4 + Cu35. 锌和硫酸铜溶液反应:Zn + CuSO4 ==== ZnSO4 + Cu36. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2==== Cu(NO3)2 + Hg(3)碱性氧化物+酸-------- 盐+ 水37. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl==== 2FeCl3 + 3H2O38. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4==== Fe2(SO4)3 + 3H2O39. 氧化铜和稀盐酸反应:CuO + 2HCl ==== CuCl2 + H2O40. 氧化铜和稀硫酸反应:CuO + H2SO4 ==== CuSO4+ H2O41. 氧化镁和稀硫酸反应:MgO + H2SO4==== MgSO4 + H2O42. 氧化钙和稀盐酸反应:CaO + 2HCl ==== CaCl2 + H2O(4)酸性氧化物+碱-------- 盐+ 水43.苛性钠暴露在空气中变质:2NaOH + CO2 ====Na2CO3 + H2O 44.苛性钠吸收二氧化硫气体:2NaOH + SO2 ==== Na2SO3 + H2O 45.苛性钠吸收三氧化硫气体:2NaOH + SO3 ====Na2SO4 + H2O 46.消石灰放在空气中变质:Ca(OH)2 + CO2 ==== CaCO3 ↓+ H2O 47. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 ==== CaSO3 ↓+ H2O (5)酸+ 碱-------- 盐+ 水48.盐酸和烧碱起反应:HCl + NaOH ==== NaCl +H2O49. 盐酸和氢氧化钾反应:HCl + KOH ==== KCl +H2O50.盐酸和氢氧化铜反应:2HCl + Cu(OH)2==== CuCl2 + 2H2O51. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 ==== CaCl2 + 2H2O52. 盐酸和氢氧化铁反应:3HCl + Fe(OH)3 ====FeCl3 + 3H2O53.氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 ==== AlCl3 + 3H2O54.硫酸和烧碱反应:H2SO4 + 2NaOH==== Na2SO4 + 2H2O55.硫酸和氢氧化钾反应:H2SO4 + 2KOH ====K2SO4 + 2H2O56.硫酸和氢氧化铜反应:H2SO4 + Cu(OH)2 ====CuSO4 + 2H2O57. 硫酸和氢氧化铁反应:3H2SO4 + 2Fe(OH)3==== Fe2(SO4)3 + 6H2O58. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O(6)酸+ 盐-------- 另一种酸+ 另一种盐59.大理石与稀盐酸反应:CaCO3 + 2HC l ==== CaCl2 + H2O + CO2↑ 60.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑ 61.碳酸镁与稀盐酸反应: MgCO3 + 2HCl === MgCl2 + H2O + CO2↑ 62.盐酸和硝酸银溶液反应:HCl + AgNO3 === AgCl↓ + HNO363.硫酸和碳酸钠反应:Na2CO3 + H2SO4 === Na2SO4 + H2O + CO2↑64.硫酸和氯化钡溶液反应:H2SO4 + BaCl2 ==== BaSO4 ↓+ 2HCl(7)碱+ 盐-------- 另一种碱+ 另一种盐65.氢氧化钠与硫酸铜:2NaOH + CuSO4 ==== Cu(OH)2↓ + Na2SO4 66.氢氧化钠与氯化铁:3NaOH + FeCl3 ==== Fe(OH)3↓ + 3NaCl 67.氢氧化钠与氯化镁:2NaOH + MgCl2 ==== Mg(OH)2↓ + 2NaCl68. 氢氧化钠与氯化铜:2NaOH + CuCl2 ==== Cu(OH)2↓ + 2NaCl69. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 === CaCO3↓+ 2NaOH。
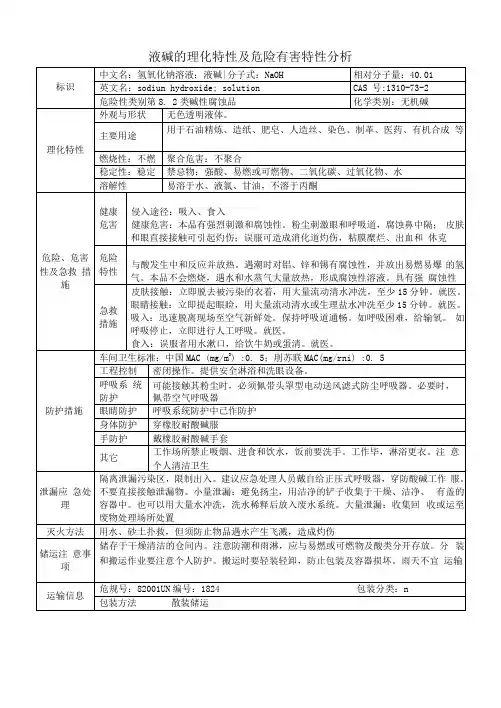
酸碱溶液的腐蚀性
一、教学目标
知识和技能:知道稀酸与金属的反应;
知道酸的腐蚀性;
知道酸对建材的腐蚀作用;
掌握稀酸与碳酸钙进行反应的基本操作。
过程、方法和能力:体会对未知气体(金属与稀酸反应)的猜测和验证方法;
通过观察稀酸与金属反应的现象,培养学生归纳能力与继续
发现问题的能力;
利用酸的腐蚀性解决日常生活中的问题;
利用不同的途径寻找相关资源,对资源进行有效的筛选。
态度与价值观:认真对待科学猜测;
诚实记录实验现象,培养实事求是的科学态度;
培养学生对自然界中的一些特殊现象产生兴趣;
提高学生之间的互相协作能力。
二、教学重点
稀酸与金属的反应。
酸对建材的腐蚀作用。
三、教学难点
稀酸与金属的反应。
稀酸与碳酸钙进行反应的操作。
四、教学类型
新知识传授课。
五、教学方法
实验法、讲授法、讨论法等。
六、教学过程。