氯化氢
- 格式:doc
- 大小:66.50 KB
- 文档页数:4

氯化氢知识点总结一、氯化氢的性质1. 物理性质氯化氢是一种无色的、有刺激性气味的气体,其气味类似于盐酸。
在标准大气压下,氯化氢的沸点为-85.05°C,熔点为-114.22°C。
其蒸气密度相对于空气的密度为1.27。
2. 化学性质氯化氢在水中可溶,形成盐酸溶液,是一种强酸。
它具有腐蚀性,可与金属反应生成氯化物盐,并且与碱反应生成盐和水。
此外,氯化氢还是一种重要的中间体化学品,可用于合成氯化合物、氯代烃和有机氯。
在高温下,氯化氢可与氧气反应生成氯气和水。
此外,氯化氢还是一种重要的中间体化学品,可用于合成氯代烃、氯代醇和氯代酪醇等。
二、氯化氢的制备1. 盐酸与硫酸反应氯化氢可通过盐酸与硫酸反应得到。
具体过程为:将盐酸和硫酸按一定的化学当量比例混合,然后加热至适当的温度,反应生成氯化氢气体,并通过冷凝收集制备氯化氢。
2. 氯化铵和硫酸反应氯化铵和硫酸的反应也可以制备氯化氢。
具体过程为:将氯化铵和硫酸按一定的化学当量比例混合,然后加热至适当的温度,反应生成氯化氢气体,并通过冷凝收集制备氯化氢。
3. 碳酸钠和盐酸反应碳酸钠和盐酸的反应也可以制备氯化氢。
具体过程为:将碳酸钠和盐酸按一定的化学当量比例混合,然后加热至适当的温度,反应生成氯化氢气体,并通过冷凝收集制备氯化氢。
三、氯化氢的应用1. 工业上的应用氯化氢是许多化工生产中的重要原料之一,主要用于制造氯化物、氯代烃、氯化石蜡、盐酸、氯化苯等化学品。
此外,氯化氢还被广泛应用于铜冶炼、纸浆漂白和染料工业中。
2. 医药上的应用氯化氢被用于制造盐酸药品,例如氯化氢氨基葡萄糖和盐酸肾上腺素等。
此外,氯化氢还被用于合成药物、调节酸度和水解反应。
3. 实验室中的应用氯化氢可用于实验室中的化学反应,例如水合氯化铝的制备、橡胶和塑料的制备以及有机反应的催化剂。
四、氯化氢的危害1. 对人体的危害氯化氢具有刺激性气味,吸入高浓度氯化氢可引起呼吸系统和胃肠道的损害,严重时可能导致呼吸困难、窒息甚至死亡。

氯化氢成本氯化氢,化学式为HCl,是一种无色、刺激性的气体。
它是化学工业中重要的原料之一,广泛应用于石化、冶金、医药、电子等领域。
在这篇文章中,我们将讨论氯化氢的成本。
首先,氯化氢的生产方法有两种:直接合成和间接合成。
直接合成是指通过盐酸酸化金属氯化物来制取氯化氢,而间接合成则是先通过电解食盐水制取氢气,再与氯气反应得到氯化氢。
两种方法的成本会有所不同。
首先来讨论直接合成的成本。
这种方法需要使用金属氯化物作为原料,常用的有氯化钠、氯化钾等。
这些金属氯化物的价格会根据市场供求情况而波动,但通常较为稳定。
此外,还需要用到大量的盐酸作为酸化剂。
盐酸是一种常见的化工产品,市场上有多个品牌和规格可选择。
其价格也会随着市场供需的变化而波动。
除了原料成本,生产设备的投资也是直接合成成本的一部分。
例如,用于反应的反应釜、蒸发器、冷却器等设备需要购买和维护,这些成本也会计入到氯化氢的成本当中。
相比之下,间接合成的成本要高一些。
首先,电解食盐水需要大量的电力供应,因此电费成为了生产成本的一个重要部分。
此外,电解设备的投资和维护也需要考虑在内。
在与氯气反应得到氯化氢的过程中,还需要用到吸收剂和洗涤剂,以去除其中的杂质和余氯,这也需要一定的投入。
除了生产成本,氯化氢的运输成本也是需要考虑的。
氯化氢在常温下是一种易挥发的气体,而且具有一定的腐蚀性,因此在运输过程中需要采取特殊的措施来确保安全。
一般来说,氯化氢会储存在压力钢瓶中,运输成本包括瓶体和装运的费用。
此外,为了确保运输过程中的安全,还需要购买相关的保险和遵循相关法规。
经过以上的分析可知,氯化氢的成本受到多方面因素的影响。
原料价格、生产设备投资、电费、吸收剂和洗涤剂、瓶体及装运等都是成本的组成部分。
此外,市场供需的变化和法规的变更也会对成本造成影响。
了解这些成本因素,可以帮助相关企业做出合理的定价和经营决策。
总结起来,氯化氢的成本是一个复杂的问题。
不仅涉及到生产过程中的原料和设备投资,还包括运输和安全等方面的因素。

氯化氢的知识点总结氯化氢的性质氯化氢是一种具有刺激性气味的无色气体,它可以溶解在水中形成盐酸。
在常温下,氯化氢是一种不稳定的气体,很容易与空气中的水分反应形成盐酸雾。
氯化氢的化学性质非常活泼,它可以和多种不同的化合物发生反应,具有较强的腐蚀性。
氯化氢可以与碱、金属、非金属等多种物质反应,产生不同的化合物。
氯化氢的制备氯化氢的主要制备方法有两种,一种是通过氯气和氢气在催化剂的作用下直接反应生成氯化氢气体,这是工业上常用的制备方法;另一种是通过盐酸和硫酸等酸性物质的蒸发浓缩制备氯化氢气体。
在实际应用中,通常采用工业原料的氯化氢气体用于多种化工生产中。
氯化氢的用途氯化氢是一种非常重要的化工原料,广泛应用于化工、医药、冶金、印染、橡胶等众多领域。
在化工生产中,氯化氢主要用于制备氯化物、盐酸、氯代烷烃、氯化胆碱等多种化工产品。
在医药行业,氯化氢也有一定的应用,可以用于制备氯胺素、磺胺药物等。
此外,氯化氢还可以用作焊接、炼铜、印染等工业中的助焊剂、脱硫剂等。
氯化氢的危害氯化氢是一种具有强烈刺激性气味的有毒气体,其危害主要体现在以下几个方面。
首先,氯化氢对人体呼吸系统和粘膜有强烈的刺激作用,长时间暴露在高浓度氯化氢环境中会导致鼻、喉、气管等部位的炎症和损害。
其次,氯化氢对皮肤和眼睛也有较强的刺激作用,会导致灼伤和炎症。
另外,氯化氢还具有较强的腐蚀性,可以与皮肤和黏膜组织发生化学反应,导致组织损伤和溃烂。
另外,高浓度的氯化氢气体还具有一定的致命性,长时间暴露在高浓度氯化氢气体环境中会导致呼吸困难、休克甚至死亡。
氯化氢的安全防护为了有效预防氯化氢对人体和环境造成危害,必须采取相应的安全防护措施。
首先,要严格遵守相关的操作规程和标准,使用氯化氢气体时需要配备相应的防护装备,包括呼吸器、防护眼镜、防护服等。
其次,在氯化氢的生产和使用过程中,需要对氯化氢气体进行严格的监测和控制,确保氯化氢环境浓度在安全范围内。
此外,在氯化氢的储存和运输过程中,需使用专门的储罐和容器,并采取防泄漏、防爆破等安全措施。

氯化氢溶于水的电离方程式氯化氢是一种无机化合物,化学式为HCl。
当氯化氢溶解于水中时,会发生电离反应,生成氢离子(H+)和氯离子(Cl-)。
电离方程式可以用化学方程式表示,如下所示:HCl + H2O → H3O+ + Cl-在这个方程式中,HCl代表氯化氢,H2O代表水,H3O+代表氢离子,Cl-代表氯离子。
这个方程式描述了氯化氢溶于水时发生的化学反应过程。
在电离方程式中,右边的化学物质表示产物,左边的化学物质表示反应物。
HCl和H2O是反应物,H3O+和Cl-是产物。
这意味着氯化氢和水反应后生成了氢离子和氯离子。
氢离子和氯离子是电解质,它们在水中可以自由移动。
当氯化氢溶解于水中时,会形成一个电解质溶液。
这意味着溶液中含有可以传导电流的离子。
电离方程式的符号和化学式可以帮助我们理解溶液中离子的生成过程。
HCl中的氯原子和氢原子在溶解过程中被水分子分离。
氢原子与水分子中的氧原子结合形成氢氧根离子(OH-),而氯原子与水分子中的氢原子结合形成氯离子(Cl-)。
在电离方程式中,右边的H3O+代表氢离子。
这是因为在水中,氢离子会与水分子结合形成氢氧根离子。
H3O+和OH-是水的自离子化产物,它们的生成与氯化氢溶解于水中的电离反应密切相关。
电离方程式的描述不仅有助于我们理解溶液中离子的生成过程,还有助于我们研究溶液的酸碱性质。
氯化氢溶解于水中生成的氢离子使溶液呈酸性,而氯离子并不对溶液的酸碱性质产生显著影响。
总结起来,氯化氢溶于水时会发生电离反应,生成氢离子和氯离子。
这个反应可以用电离方程式来描述。
电离方程式中的化学式和符号有助于我们理解溶液中离子的生成过程和溶液的酸碱性质。
通过研究电离方程式,我们可以更好地理解氯化氢溶于水的化学性质。

hcl气体浓度对人体的危害
氯化氢又叫盐酸,是一种挥发性酸,人体皮肤、黏膜接触氯化氢,可导致化学烧伤,通过呼吸道吸入氯化氢气体也可导致呼吸道黏膜发生化学性烧伤,出现支气管炎或肺炎。
氯化氢具有很强的腐蚀性,人体皮肤、黏膜接触氯化氢,可导致皮肤、黏膜出现化学性烧伤,烧伤皮肤后如果没有正规、及时地治疗,可继发感染、败血症;烧伤口腔及食管黏膜后,患者甚至无法正常进食。
如果不慎接触了氯化氢后出现疑似化学性烧伤,建议立即就医,请医生予以规范处置。

氯化氢气体分子量
氯化氢气体分子量是指氯化氢气体的摩尔质量,单位为克/摩尔(g/mol)。
在化学中,分子量是一个非常重要的参数,可以用来确定物质的相对质量和在化学反应中的用量。
氯化氢(HCl)的分子量是由其组成原子的原子量和原子个数计算得出的。
氯化氢由一个氯原子和一个氢原子组成,氯原子的原子量是35.9997,氢原子的原子量是1.00794。
因此,氯化氢的分子量是35.9997 + 1.00794 = 36.46 g/mol。
氯化氢气体是一种无色气体,具有刺激性气味,是工业上常用的酸之一。
它是一种非常重要的化学物质,被广泛应用于化学实验室和工业生产中。
氯化氢气体的分子量是36.46 g/mol,这意味着每摩尔氯化氢气体的质量是36.46克。
在化学反应中,氯化氢气体作为反应物参与反应时,其用量可以通过分子量进行计算。
例如,如果要制备100克纯氯化氢气体,需要多少摩尔的氯化氢气体呢?根据分子量的计算,需要约27.4摩尔的氯化氢气体,因为每摩尔氯化氢气体的质量是36.46克。
此外,氯化氢气体的分子量也是其物理性质和化学性质的重要参数。
例如,氯化氢气体的密度、溶解度、反应活性等都与其分子量有关。
因此,正确测定和计算氯化氢气体的分子量对于其在工业生产和科学研究中的应用具有重要意义。


氯化氢气体分离
《氯化氢气体分离》
氯化氢是一种无色有刺激性气味的气体,常用于工业生产和实验室研究中。
在许多场合中,需要将氯化氢气体与其他气体分离,以便进行单独的使用或处理。
氯化氢气体分离的方法有多种,以下是其中一些常见的方法:
1. 使用物理方法分离:物理方法包括冷却、凝固和压缩等。
通过降低氯化氢气体的温度,将其冷凝成液体,再通过蒸馏分离其他气体。
也可以利用气体的压缩性质,将氯化氢气体与其他气体分离。
2. 使用化学方法分离:化学方法包括化合物的反应分解和吸附分离等。
例如,利用氨和氯化氢气体的反应生成氯化铵,再通过加热分解氯化铵,即可得到纯净的氯化氢气体。
此外,也可以利用固体吸附剂吸附氯化氢气体,再通过脱附得到分离后的气体。
3. 使用膜分离技术:膜分离技术是将气体通过半透膜,利用其分子大小或亲疏水性质的差异,使氯化氢气体与其他气体分离。
这种方法在工业上得到了广泛应用,特别是在石油化工和天然气加工行业。
氯化氢气体分离的方法多种多样,选择适合自身需求的方法进行分离,不仅可以有效分离氯化氢气体,还能为工业生产和实验研究提供更多选择和便利。

空气中氯化氢浓度标准
氯化氢是一种常见的实验室试剂,其浓度标准对于实验安全和室内空气质量具有重要意义。
本文将介绍氯化氢的浓度标准,包括实验室常用浓度、室内空气质量标准中的允许浓度以及氯化氢水溶液的最高浓度等方面。
1.实验室常用浓盐酸浓度为38%,相对密度为1.19。
这是由于该浓度的氯化
氢具有较好的稳定性和较高的浓度,适合用于大多数实验室实验。
此外,该浓度的氯化氢相对较为安全,不会对实验人员造成严重的伤害。
2.室内空气质量标准中,氯化氢的允许浓度不应超过0.08mg/m³。
这是根据
GB/T 18883-2002《室内空气质量标准》规定而来,该标准适用于居住、办公等室内环境。
如果室内空气中氯化氢浓度超过该标准,可能会对人体健康造成一定影响,如引起头痛、恶心等症状。
3.氯化氢的水溶液称为盐酸,最高浓度为43.4%。
这是因为氯化氢易溶于水,
形成盐酸溶液。
通常情况下,工业上使用的盐酸溶液浓度为38%左右,很少有超过这个范围的。
此外,根据《工作场所有害因素职业接触限值第1部分:化学有害因素》(GBZ2.1-2007),生产过程中可接触的氯化氢最高容许浓度为10mg/m³(时间加权平均值),这一标准也是基于长期接触不会对人体健康造成严重影响而制定的。

氯化氢HCl氯化氢在常温常压下为具有刺激性臭味的无色有毒气体。
盐酸为氯化氢的水溶液,是无色或微黄色的液体。
空气中不燃烧,热稳定,到约1500℃才分解。
与氟激烈反应,与许多金属反应生成氯化物和氢,与氨激烈反应生成氯化铵白烟,与乙烯混合形成爆炸性气体。
1.别名·英文名无水盐酸;Hydrogen chloride、Hydrochloride.2.用途电池、药品、染料、化肥、玻璃加工、金属清洗、有机合成、腐蚀照像、陶器制造、食品处理、无机氯化物制造、橡胶、催化剂、电子气、标准气、外延、扩散、氧化、蚀刻、化学气相淀积、发光二极管。
3.制法(1)食盐电解。
NaCl+H2O—→NaOH+HCl(2)氢气和氯气直接合成。
(3)在加热的情况下浓硫酸与食盐反应。
2NaCl+H2SO4—→2HCl+Na2SO44.理化性质分子量:36.461熔点:-114.2℃沸点(101.325kPa):-85.0℃液体密度(-85.1℃,101.325kPa):1191kg/m3气体密度(25℃,101.325kPa),1.500kg/m3相对密度(气体,空气=1,25℃,101.325kPa):1.267比容(21.1℃,101.325kPa):0.66t7m3/kg气液容积比(15℃,100kPa):772L/L临界温度:51.4℃临界压力:8258kPa临界密度:420kg/m3压缩系数:熔化热(-114.24℃,14.0kPa):54.64kJ/kg气化热(-85.1℃,101.325kPa):443.38J/kg比热容(气体,15℃,101.325kPa):Cp=811.17J/(kg·K) Cv=575.30J/(kg·K)比热比(气体,15℃,101.325kPa):Cp/Cv=1.41蒸气压(-20℃):1469kPa(0℃):2584kPa(20℃):4215kPa粘度(101.325kPa,0℃):0.0132mPa·s表面张力(-92.9℃):24.718mN/m导热系数(101.325kPa,0C):0.01541w/(m·K)折射率(气体,15℃,100kPa):1.0004456(气体,25℃,101.325kPa):1.000408毒性级别:3易燃性级别:0易爆性级别:0氯化氢在常温常压下为具有刺激性臭味的无色有毒气体。
不是,HCl是共价化合物。
氯化氢,化学式为HCl,一个氯化氢分子是由一个氯原子和一个氢原子构成的,是无色有刺激性气味的气体。
其水溶液俗称盐酸,学名氢氯酸。
氯化氢极易溶于水,在0℃时,1体积的水大约能溶解500体积的氯化氢。
化学性质
氯化氢,腐蚀性的不燃烧气体,与水不反应但易溶于水,空气中常以盐酸烟雾的形式存在。
易溶于乙醇和醚,也能溶于其它多种有机物;易溶于水,在25℃和1大气压下,1体积水可溶解503体积的氯化氢气体。
干燥氯化氢的化学性质很不活泼。
碱金属和碱土金属在氯化氢中可燃烧,钠燃烧时发出亮黄色的火焰。
氯化氢的水溶液为盐酸。
工业用盐酸常成微黄色,主要是因为三氯化铁的存在。
常用氨水来检验盐酸的存在,氨水会与氯化氢反应生成白色的氯化铵微粒。
氯化氢有强烈的偶极,与其他偶极产生氢键。
制备氯化氢所用试剂的原理
制备氯化氢主要有以下几种方法:
1. 氢气和氯气直接反应:利用氢气和氯气直接在适当的条件下反应生成氯化氢。
反应方程式为:H2 + Cl2 →2HCl。
该反应需要在紫外光的照射下进行。
反应条件一般为高温(至少200)和适当的压力。
2. 金属和盐酸反应:利用金属与盐酸反应生成氯化氢。
常用的金属有锌、铁、铝等。
反应方程式为:Zn + 2HCl →ZnCl2 + H2。
该方法是实验室中常用的制备氯化氢的方法。
3. 硫酸和氯化钠反应:利用硫酸与氯化钠反应生成氯化氢。
反应方程式为:
2NaCl + H2SO4 →Na2SO4 + 2HCl。
该方法一般会伴随生成硫酸钠。
4. 氯化钙和硫酸反应:利用氯化钙与硫酸反应生成氯化氢。
反应方程式为:CaCl2 + H2SO4 →CaSO4 + 2HCl。
该方法一般适用于生产规模较大的工业制备。
这些方法主要利用了氢气和氯气的化学反应,或是利用酸和盐的反应来制备氯化氢。
不同的方法适用于不同的应用场景,选择合适的方法可以高效、经济地制备氯化氢。
氯化氢的理化性质及危险特性
氯化氢(HCl)是一种无机化合物,具有一系列的理化性质和危险特性。
本文将介绍氯化氢的相关信息。
理化性质
1. 外观:氯化氢是一种无色气体,具有刺激性气味。
2. 熔点和沸点:氯化氢的熔点为-114.2℃,沸点为-85.1℃。
它在常温下以气体的形式存在。
3. 密度:氯化氢气体的密度较大,为1.49 g/L。
它比空气重,会聚集在低洼地区。
4. 溶解性:氯化氢是高度溶于水的,与水反应生成盐酸。
5. 酸性:氯化氢被认为是典型的强酸,它能与碱反应生成盐。
危险特性
1. 腐蚀性:氯化氢是一种剧烈腐蚀性物质,能腐蚀皮肤、眼睛和呼吸道。
暴露于高浓度氯化氢会造成严重的灼伤和伤害。
2. 毒性:氯化氢对生物体具有一定的毒性。
吸入高浓度氯化氢可引起呼吸道刺激、喉头水肿和窒息。
3. 燃烧性:氯化氢本身是不可燃物质,但可以加剧其他物质的燃烧,导致火灾或爆炸。
要注意的是,以上只是氯化氢的一些常见理化性质和危险特性的简要介绍。
在处理氯化氢时,需要严格遵守相关安全操作规程,并采取适当的个人防护措施,以确保安全。
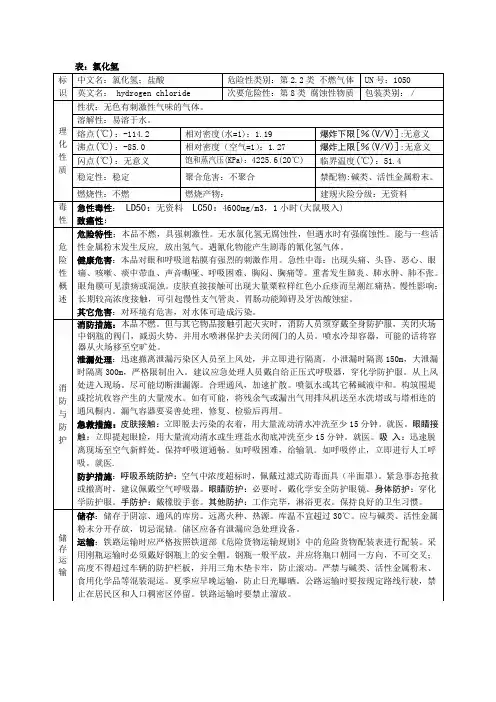
氯化氢(1)标识中文名称:氯化氢英文名称:hydrogen chlorideCAS No.:7647-01-0分子式:HCl分子量:36.46(2)成分/组成信息有害成分:氯化氢浓度≥(3)危险性概述危险性类别:第2.2 类不燃气体侵入途径:吸入、食入、经皮吸收。
健康危害:本品对眼和呼吸道粘膜有强烈的刺激作用。
急性中毒:出现头痛、头昏、恶心、眼痛、咳嗽、痰中带血、声音嘶哑、呼吸困难、胸闷、胸痛等。
重者发生肺炎、肺水肿、肺不张。
眼角膜可见溃疡或混浊。
皮肤直接接触可出现大量粟粒样红色小丘疹而呈潮红痛热。
慢性影响:长期较高浓度接触,可引起慢性支气管炎、胃肠功能障碍及牙齿酸蚀症。
环境危害:对环境有危害,对水体可造成污染。
燃爆危险:本品不燃,具强刺激性。
(4)急救措施皮肤接触:立即脱去污染的衣着,用大量流动清水冲洗至少15分钟。
就医。
眼睛接触:立即提起眼睑,用大量流动清水或生理盐水彻底冲洗至少15分钟。
就医。
吸入:迅速脱离现场至空气新鲜处。
保持呼吸道通畅。
如呼吸困难,给输氧。
如呼吸停止,立即进行人工呼吸。
就医。
食入:(5)消防措施危险特性:无水氯化氢无腐蚀性,但遇水时有强腐蚀性。
能与一些活性金属粉末发生反应, 放出氢气。
遇氰化物能产生剧毒的氰化氢气体。
有害燃烧产物:灭火方法:本品不燃。
但与其它物品接触引起火灾时,消防人员须穿戴全身防护服,关闭火场中钢瓶的阀门,减弱火势,并用水喷淋保护去关闭阀门的人员。
喷水冷却容器,可能的话将容器从火场移至空旷处。
(6)泄漏应急处理应急处理:迅速撤离泄漏污染区人员至上风处,并立即进行隔离,小泄漏时隔离150m,大泄漏时隔离300m,严格限制出入。
建议应急处理人员戴自给正压式呼吸器,穿化学防护服。
从上风处进入现场。
尽可能切断泄漏源。
合理通风,加速扩散。
喷氨水或其它稀碱液中和。
构筑围堤或挖坑收容产生的大量废水。
如有可能,将残余气或漏出气用排风机送至水洗塔或与塔相连的通风橱内。
漏气容器要妥善处理,修复、检验后再用。
氯化氢
简介
氯化氢气体对呼吸系统有刺激作用,并能使牙齿患病。
空气中可允许的氯化氢最高浓度为0.01毫克/升。
氯化氢的水溶液称盐酸,最高浓度可达43.4%;实验室常用浓盐酸的浓度为38%,相对密度1.19。
含氯化氢20.24%的水溶液在110℃沸腾时组成不变,是共沸混合物。
盐酸是强酸,具有酸的通性,还具有还原性:MnO2+4HCl─→MnCl2+Cl2+2H2O盐酸在工业上是除硫酸以外的最重要的酸,用于制造金属氯化物、染料和多种化学药品;并用于镀锌、镀锡和搪瓷工业中;盐酸还是一种重要的化学试剂
强酸性,和碱反应生成氯化物和水,例如:
HCl + NaOH = NaCl + H2O
能与碳酸盐反应,生成二氧化碳,
K2CO3 + 2HCl = 2K Cl+ CO2↑ + H2O
Na2CO3+2HCl=2NaCl+H2O+CO2↑
能与活泼金属单质反应,生成氢气(实验室常用Zn与HCl(或H2SO4)反应制取H2,不用金属活动顺序中Zn之前的是因为反应过于剧烈且放大量热。
)
『金属活动顺序(由强到弱):Cs(铯)K(钾)Ca(钙)Na(钠)Mg(镁)Al (铝)Zn(锌)Fe(铁)Sn(锡)Pb(铅)(H) Cu(铜) Hg(汞) Ag(银)Pt(铂)Au(金)』
Fe+2HCl=FeCl2+H2↑
Zn+ 2HCl =ZnCl2+ H2↑
能与金属氧化物反应,生成盐和水
MgO+2HCl=MgCl2+H2O
实验室常用盐酸于制取二氧化碳的方法
CaCO3(石灰石或大理石最好)+2HCl=CaCl2+H2O+CO2↑(不用Na2CO3因为反应速率过快)
能用来制取弱酸
CH3COONa+HCl=CH3COOH+NaCl
也是人类胃酸的主要成分(浓度很低)。
理化特性
主要成分:纯品
外观与性状:无色有刺激性气味的气体。
熔点(℃): -114.2
沸点(℃): -85.0
相对密度(水=1): 1.19
相对蒸气密度(空气=1): 1.27
饱和蒸气压(kPa):4225.6(20℃)
燃烧热(kJ/mol):无意义
临界温度(℃): 51.4
临界压力(MPa): 8.26
闪点(℃):无意义
引燃温度(℃):无意义
爆炸上限%(V/V):无意义
爆炸下限%(V/V):无意义
溶解性:极易溶于水(在常温、常压下,1体积的水可以溶解约500体积的HCl 气体)
主要用途:制染料、香料、药物、各种氯化物及腐蚀抑制剂。
毒理学资料
急性毒性: LD50:
LC50:4600mg/m3,1小时(大鼠吸入)
亚急性和慢性毒性:
刺激性:
致敏性:
致突变性:
致畸性:
致癌性:
危险性概述
燃爆危险:
急救措施
皮肤接触:立即脱去污染的衣着,用大量流动清水冲洗至少15分钟。
就医。
眼睛接触:立即提起眼睑,用大量流动清水或生理盐水彻底冲洗至少15分钟。
就医。
吸入:迅速脱离现场至空气新鲜处。
保持呼吸道通畅。
如呼吸困难,给输氧。
如呼吸停止,立即进行人工呼吸。
就医。
消防措施
灭火方法:本品不燃。
但与其它物品接触引起火灾时,消防人员须穿戴全身防护服,关闭火场中钢瓶的阀门,减弱火势,并用水喷淋保护去关闭阀门的人员。
喷水冷却容器,可能的话将容器从火场移至空旷处
泄漏应急处理
接触控制/个体防护
职业接触限值,工作时须穿戴胶手套、高腰胶靴、橡胶围裙、防护眼镜、供气面罩等,工作场所要充分通风,保持环境空气新鲜干燥。
气体要用钢瓶贮装。
气瓶须存放在阴凉干燥通风良好的室外或强制通风的室内,要远离氧化物和火源。
严防容器碰撞。
要定期检漏,可用肥皂液或氨水探漏。
干燥状态的氯化氢,对金属没有腐蚀性,可以使用钢、不锈钢等通用金属材料,但是,有水分时它腐蚀各种金属。
金、白金、钽能耐潮湿氯化氢的腐蚀,耐盐酸镍基合金也有较好的耐蚀性。
可以使用聚四氟乙烯、聚三氟氯化乙烯聚合体、聚氯乙烯、聚乙烯、酚醛树指、天然橡胶、石墨等。
所有使用氯化氢的设备、管道、阀门等应在使用前烘烤抽真空,以保持其无水和密封状态。
当装置暂时不用时.应把HCl放出来,并充入干燥的惰性气体。
漏气时,用聚乙烯罩、尼龙软管等套泄漏部应.把气体导入水中吸收,再用消石灰中和。
漏液时,要用大量水充分吸收。
气体大量喷出时,从远处喷雾状水吸收。
废水要用水吸收后,用苛性钠、碳酸氢钠、苏打灰、消石灰等碱性物质中和。
中国MAC(mg/m3): 15
前苏联TLVTN: OSHA 5ppm,7.5[上限值]
TLVWN: ACGIH 5ppm,7.5mg/m3
监测方法:硫氰酸汞比色法
工程控制:严加密闭,提供充分的局部排风和全面通风。
呼吸系统防护:空气中浓度超标时,佩戴过滤式防毒面具(半面罩)。
紧急事态抢救或撤离时,建议佩戴空气呼吸器。
眼睛防护:必要时,戴化学安全防护眼镜。
身体防护:穿化学防护服。
手防护:戴橡胶手套。
其他防护:工作完毕,淋浴更衣。
保持良好的卫生习惯。