(完整版)有机化学反应机理
- 格式:ppt
- 大小:2.13 MB
- 文档页数:143

化学有机化学重要反应机理总结一、加成反应(Addition Reactions)1. 羰基加成反应(Carbonyl Addition Reactions)羰基化合物是有机化学中最常见的官能团之一,其重要的加成反应包括以下几种机理:a) 醛、酮的加成反应:醛、酮与亲核试剂(如Grignard试剂、氰化物等)发生加成反应,形成相应醇或醇酮产物。
b) 羰基氧化性加成反应:醛、酮被氧化剂(如过氧化氢、氯化亚铜等)氧化,发生加成反应生成酮酸类产物。
c) 羰基的羧酸衍化反应:醛、酮通过偶联反应与二元N-氯酰亚胺形成羧酸产物。
2. 烯烃的加成反应(Alkene Addition Reactions)烯烃作为另一种重要的有机官能团,也可以发生多种加成反应,包括以下几种机理:a) 烯烃与溴水的加成反应:烯烃与溴水加成生成溴代醇产物,其中水攻击烯烃双键。
b) 烯烃与氢卤酸的加成反应:烯烃与氢卤酸发生加成,生成相应卤代烷产物。
c) 烯烃与水的加成反应:烯烃与水加成生成醇产物,通常需要酸性催化剂存在。
3. 炔烃的加成反应(Alkyne Addition Reactions)炔烃是另一类重要的亲电烯烃,其加成反应机理包括以下几种:a) 炔烃与氢卤酸的加成反应:炔烃与氢卤酸反应生成相应的卤代炔烃产物。
b) 炔烃的亲电型加成反应:炔烃与亲电试剂如卤代烷、单质溴反应,形成相应加成产物。
c) 炔烃的亲核型加成反应:炔烃与亲核试剂如氨、一元胺等反应,形成相应加成产物。
二、消除反应(Elimination Reactions)1. 酸性条件下的β-消除反应(Acidic β-Elimination)酸性条件下的β-消除反应主要是在具有酸性质的化合物中发生,一般包括以下几种机理:a) 酸催化的醇脱水反应:醇在酸性条件下发生脱水反应,生成相应的烯烃醚类产物。
b) 酸催化的脱卤反应:卤代烷在酸性条件下发生脱卤反应,生成相应的烯烃产物。
2. 碱性条件下的β-消除反应(Basic β-Elimination)碱性条件下的β-消除反应主要是在碱性质的化合物中发生,包括以下几种机理:a) 钠乙醇合成反应:醇与钠反应生成相应的醇盐,经过酸性条件下水解,生成烯醇产物。


有机化学中的反应机理一、有机化学反应机理概述有机化学反应机理是指化学反应过程中,反应物分子如何通过相互作用转化为产物分子的具体过程。
了解有机化学反应机理对于掌握有机化学的基本概念、预测化学反应的方向和产物以及设计合成路线具有重要意义。
二、有机化学反应类型1.加成反应:两个或多个分子结合成一个分子的反应。
2.消除反应:一个分子中的两个原子或基团离开分子,生成双键或三键的反应。
3.取代反应:一个原子或基团被另一个原子或基团替换的反应。
4.氧化还原反应:涉及电子转移的反应。
5.缩合反应:两个或多个分子结合成一个较大分子的反应。
6.水解反应:化合物与水反应,分解成两个或多个分子的反应。
三、有机化学反应机理的基本步骤1.进攻:反应物分子中的活性基团识别并接近目标分子。
2.结合:活性基团与目标分子形成中间产物。
3.重排:中间产物中的原子或基团重新排列,形成过渡态。
4.断裂:反应物分子中的化学键断裂。
5.生成:新的化学键形成,生成产物分子。
6.离去:反应过程中产生的不稳定基团或分子离开体系。
四、有机化学反应机理的研究方法1.实验观察:通过实验现象,推断反应机理。
2.结构分析:利用光谱、核磁共振等技术分析反应物和产物结构,推测反应过程。
3.计算化学:运用计算机模拟、量子化学计算等方法研究反应机理。
4.动力学分析:研究反应速率与反应物浓度之间的关系,推断反应机理。
五、有机化学反应机理的意义1.预测反应方向和产物:了解反应机理有助于预测化学反应的可能产物,为有机合成提供理论依据。
2.设计合成路线:通过分析反应机理,可以设计出更高效、更经济的有机合成路线。
3.优化反应条件:掌握反应机理有助于优化反应条件,提高反应产率和选择性。
4.指导工业生产:有机化学反应机理的研究成果可为相关行业的工艺改进和技术创新提供支持。
六、中学生发展相关的知识点1.认识有机化学反应类型及其特点。
2.了解有机化学反应机理的基本概念和步骤。
3.掌握有机化学反应机理的研究方法和意义。
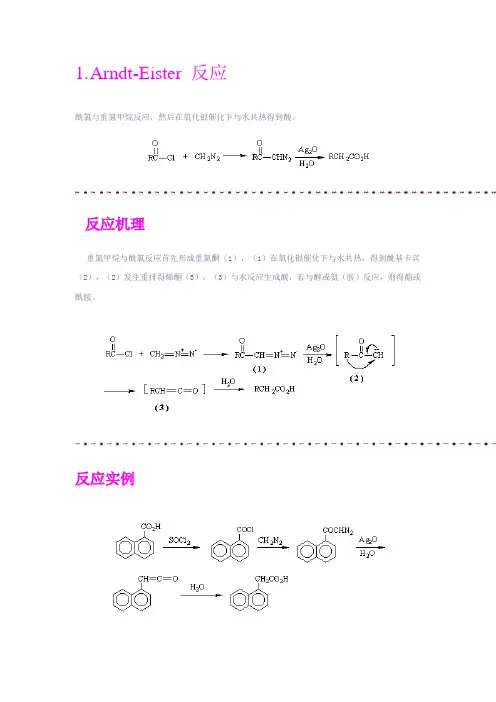
1.A rndt-Eister 反应酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。
反应机理重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。
反应实例2.Baeyer----Villiger 反应反应机理过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。
反应实例酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在羰基旁边插入一个氧原子生成相应的酯,其中三氟过氧乙酸是最好的氧化剂。
这类氧化剂的特点是反应速率快,反应温度一般在10~40℃之间,产率高。
3.Beckmann 重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反应机理在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:反应实例4.Birch还原芳香化合物用碱金属(钠、钾或锂)在液氨与醇(乙醇、异丙醇或仲丁醇)的混合液中还原,苯环可被还原成非共轭的1,4-环己二烯化合物。
反应机理首先是钠和液氨作用生成溶剂化点子,然后苯得到一个电子生成自由基负离子(Ⅰ),这是苯环的л电子体系中有7个电子,加到苯环上那个电子处在苯环分子轨道的反键轨道上,自由基负离子仍是个环状共轭体系,(Ⅰ)表示的是部分共振式。




有机化学反应机理总结有机化学反应机理是有机化学研究的重要内容之一,它揭示了有机化合物在反应过程中的分子结构变化和反应速率规律。
通过对有机反应机理的研究,我们可以更好地理解和预测有机化学反应的发生过程,为有机合成化学和药物设计提供理论依据。
下面我们将对常见的有机化学反应机理进行总结和归纳。
1. 加成反应。
加成反应是有机化学中最基本的反应类型之一,它是指两个或多个单体分子中的双键或三键断裂,然后原子或原子团以共价键的方式结合形成新的分子。
加成反应可分为电子亲和性和电子排斥性两种机理。
电子亲和性加成反应是指亲电试剂攻击双键或三键,形成中间离子,最后被亲核试剂攻击生成产物。
电子排斥性加成反应是指亲核试剂攻击双键或三键,生成中间离子,然后被亲电试剂攻击生成产物。
2. 消除反应。
消除反应是有机化学中另一种重要的反应类型,它是指有机分子中的两个邻近原子或原子团通过共价键的方式脱离分子,生成双键或三键。
消除反应可分为β-消除、α-消除和γ-消除等不同机理,其中最常见的是β-消除反应。
β-消除反应是指邻位原子或原子团与相邻的氢原子脱离,生成双键或三键。
3. 取代反应。
取代反应是有机化学中最常见的反应类型之一,它是指有机分子中的一个原子或原子团被另一个原子或原子团取代。
取代反应可分为亲核取代和亲电取代两种机理。
亲核取代是指亲核试剂攻击有机分子中的一个原子或原子团,将其取代生成新的产物。
亲电取代是指亲电试剂攻击有机分子中的一个原子或原子团,将其取代生成新的产物。
4. 加成-消除反应。
加成-消除反应是一种复合反应类型,它是指有机分子中的双键或三键发生加成反应生成中间产物,然后再发生消除反应生成最终产物。
加成-消除反应的机理比较复杂,通常需要通过实验数据和理论计算来揭示其反应过程和产物结构。
总的来说,有机化学反应机理的研究对于我们理解和掌握有机反应规律具有重要意义。
通过深入学习和掌握有机反应机理,我们可以更好地设计和优化有机合成路线,提高有机合成的效率和选择性,为新药物的研发和合成提供理论指导。

(完美版)高中有机化学反应机理总结
简介
有机化学是化学的一个重要分支,涉及到有机物的结构、性质和反应等方面。
了解有机化学反应机理对深入理解有机化学的本质非常关键。
本文将总结高中有机化学反应的机理,帮助读者更好地理解这一领域。
反应机理的基本概念
- 反应中的化学键的形成和断裂
- 反应中的电子转移过程
- 亲核试剂和电子试剂的作用机制
常见的高中有机化学反应机理
1. 取代反应机理
- 亲电取代反应机理(电子亲和力大的亲电试剂与亲核试剂反应)
- 亲核取代反应机理(互相排斥的亲核试剂之间的竞争)
- 反应中的亲电和亲核中心的变化
2. 加成反应机理
- 亲电加成反应机理(亲电试剂与π电子体系结合)
- 亲核加成反应机理(亲核试剂与亲电试剂结合)
3. 酯化和醇化反应机理
- 酯化反应机理(酸与醇反应)
- 醇化反应机理(醛酮与醇反应)
4. 缩合反应机理
- 醛酮缩合反应机理(醛酮官能团之间的缩合反应)
- 酯缩合反应机理(醇和羧酸之间的缩合反应)
5. 脱水反应机理
- 脱水(即水的去除)
结论
通过理解高中有机化学反应的基本机理,我们可以更好地把握有机化学的核心思想和规律。
掌握这些机理有助于我们在实验中的实际操作和解释反应结果。
希望本文对读者理解有机化学反应机理有所帮助。

Arbuzov 反应亚磷酸三烷基酯作为亲核试剂与卤代烷作用,生成烷基膦酸二烷基酯和一个新的卤代烷:卤代烷反应时,其活性次序为:R'I >R'Br >R'Cl。
除了卤代烷外,烯丙型或炔丙型卤化物、a-卤代醚、a- 或 b-卤代酸酯、对甲苯磺酸酯等也可以进行反应。
当亚酸三烷基酯中三个烷基各不相同时,总是先脱除含碳原子数最少的基团。
本反应是由醇制备卤代烷的很好方法,因为亚磷酸三烷基酯可以由醇与三氯化磷反应制得:如果反应所用的卤代烷 R'X 的烷基和亚磷酸三烷基酯 (RO)3P 的烷基相同(即 R' = R),则 Arbuzov 反应如下:这是制备烷基膦酸酯的常用方法。
除了亚磷酸三烷基酯外,亚膦酸酯 RP(OR')2和次亚膦酸酯 R2POR' 也能发生该类反应,例如:反应机理一般认为是按 SN2 进行的分子内重排反应:反应实例Arndt-Eister 反应酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。
反应机理重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。
反应实例Baeyer----Villiger 反应反应机理过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。
反应实例酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在羰基旁边插入一个氧原子生成相应的酯,其中三氟过氧乙酸是最好的氧化剂。

有机化学反应机理+范例+原理1. Arndt-Eister 反应酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。
反应机理重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。
反应实例2.Baeyer----Villiger 反应反应机理过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。
反应实例酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在羰基旁边插入一个氧原子生成相应的酯,其中三氟过氧乙酸是最好的氧化剂。
这类氧化剂的特点是反应速率快,反应温度一般在10~40℃之间,产率高。
3.Beckmann 重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反应机理在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:反应实例4.Birch 还原芳香化合物用碱金属(钠、钾或锂)在液氨与醇(乙醇、异丙醇或仲丁醇)的混合液中还原,苯环可被还原成非共轭的1,4-环己二烯化合物。
反应机理首先是钠和液氨作用生成溶剂化点子,然后苯得到一个电子生成自由基负离子(Ⅰ),这是苯环的л电子体系中有7个电子,加到苯环上那个电子处在苯环分子轨道的反键轨道上,自由基负离子仍是个环状共轭体系,(Ⅰ)表示的是部分共振式。
化学有机化学重要反应机理归纳化学中,有机化学是一个重要的分支领域,涉及到有机物的构造、合成和变化等方面。
而有机化学的重要反应机理也是学习有机化学的关键所在。
本文将对有机化学中的一些重要反应机理进行归纳和讨论。
一、亲核取代反应机理亲核取代反应是有机化学中常见的反应类型,其机理通常由亲核试剂与底物发生取代反应而引起。
最常见的机理是亲核试剂攻击底物中的部分正离子,形成一个烷基或烯基化合物。
这种反应在有机合成中广泛应用,常用于功能团的引入和官能团的转化。
例如,在醇的酸催化下,亲核试剂氯化氢(HCl)可以取代醇中的羟基,生成相应的氯代烷。
2.亲电取代反应机理亲电取代反应是有机化学中另一种常见的反应类型,涉及到亲电试剂与底物之间的电子转移。
亲电试剂通常是带有亲电性的分子,如卤代烷、酸或碱等。
在亲电取代反应机理中,亲电试剂攻击底物中的亲电中心,生成一个新的化学键。
例如,溴代烷和氢氧根离子之间的反应是一个典型的亲电取代反应。
在这个反应中,溴离子攻击了溴代烷中的溴原子,形成醇和氢溴酸。
3.自由基取代反应机理自由基取代反应是一类基于自由基的反应机理。
在这种反应中,自由基反应物首先通过光或热能输入得到激发,然后断裂键,生成具有活性的自由基。
这些自由基会与其他分子发生反应,以使反应系统达到稳定状态。
一个典型的自由基取代反应是溴代烃的氢(H)取代反应。
在紫外光的照射下,溴代烃被激发成溴自由基,然后溴自由基与氢气反应生成氢溴酸。
4.加成反应机理加成反应是一种常见的有机反应类型,涉及到底物中的多个亲核中心或亲电中心与试剂发生加成反应,形成一个新的化学键。
例如,烯烃和氢气之间的加成反应是合成烷烃的一种重要方法。
在该反应中,烯烃中的双键被氢气加成,生成相应的烷烃。
5.消除反应机理消除反应是一种将底物中的两个官能团除去并形成新的双键或多键的反应类型。
它涉及到一个亲核试剂和一个酸或碱试剂。
例如,醇与酸发生消除反应时,醇中的羟基与酸反应,失去一个分子的水并形成双键。
一、Arbuzow反应(重排)亚磷酸三烷基酯作为亲核试剂与卤代烷作用,生成烷基膦酸二烷基酯和一个新的卤代烷:卤代烷反应时,其活性次序为:R'I >R'Br >R'Cl。
除了卤代烷外,烯丙型或炔丙型卤化物、a-卤代醚、a- 或 b-卤代酸酯、对甲苯磺酸酯等也可以进行反应。
当亚酸三烷基酯中三个烷基各不相同时,总是先脱除含碳原子数最少的基团。
本反应是由醇制备卤代烷的很好方法,因为亚磷酸三烷基酯可以由醇与三氯化磷反应制得:如果反应所用的卤代烷 R'X 的烷基和亚磷酸三烷基酯 (RO)3P 的烷基相同(即 R' = R),则Arbuzow反应如下:这是制备烷基膦酸酯的常用方法。
除了亚磷酸三烷基酯外,亚膦酸酯 RP(OR')2和次亚膦酸酯 R2POR' 也能发生该类反应,例如:反应机理一般认为是按 S N2 进行的分子内重排反应:反应实例二、Arndt-Eister 反应酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。
反应机理重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。
反应实例三、Baeyer----Villiger 反应反应机理过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。
反应实例酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在羰基旁边插入一个氧原子生成相应的酯,其中三氟过氧乙酸是最好的氧化剂。
1.Arbuzov 反应卤代烷反应时,其活性次序为:R'I >R'Br >R'Cl。
除了卤代烷外,烯丙型或炔丙型卤化物、a-卤代醚、a- 或 b-卤代酸酯、对甲苯磺酸酯等也可以进行反应。
当亚酸三烷基酯中三个烷基各不相同时,总是先脱除含碳原子数最少的基团。
本反应是由醇制备卤代烷的很好方法,因为亚磷酸三烷基酯可以由醇与三氯化磷反应制得:一般认为是按 S N2 进行的分子内重排反应:2.Arndt-Eister 反应酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。
重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。
3.Baeyer----Villiger 反应过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:4.Beckmann 重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变。
5.Bouveault---Blanc 还原脂肪族羧酸酯可用金属钠和醇还原得一级醇。
α,β-不饱和羧酸酯还原得相应的饱和醇。
芳香酸酯也可进行本反应,但收率较低。
本法在氢化锂铝还原酯的方法发现以前,广泛地被使用,非共轭的双键可不受影响。
有机化学反应机理总结(较全)有机化学反应机理总结 (完整版)本文总结了几种常见的有机化学反应的机理,并提供了相关的示意图。
以期帮助读者更好地理解有机化学反应的机理和反应过程。
1. 反应类型1: 取代反应取代反应是有机化学中最基本的反应类型之一。
它涉及到一个分子或它的一部分被另一个原子或基团取代的过程。
以下是一个典型的取代反应的机理示意图:机理步骤:1. 亲核试剂与底物发生反应,亲核试剂攻击底物的部分阳离子或电子不足的原子。
2. 形成一个中间体,中间体中的某个基团离开。
3. 离开基团被亲核试剂取代,形成最终产物。
2. 反应类型2: 加成反应加成反应发生在两个分子之间,它们在反应中结合形成一个新的分子。
加成反应的机理示意图如下所示:机理步骤:1. 两个反应物中的亲核试剂和电荷不足的物种发生相互作用。
2. 形成一个键合物中间体。
3. 中间体通过质子转移或亲核试剂攻击等步骤,产生最终产物。
3. 反应类型3: 消除反应消除反应是一种从底物中除去一些原子或基团的反应,生成了双键或环。
以下是消除反应的机理示意图:机理步骤:1. 底物中的一个基团被移除,形成一个中间体。
2. 中间体中的某个原子或基团与另一个原子或基团形成新的共价键。
3. 生成最终产物。
以上是几种常见有机化学反应的机理总结。
希望本文能对读者理解有机化学反应的机理和反应过程有所帮助。
参考文献:请注意,以上内容仅供参考,具体反应机理可能会因具体情况而有所不同。