放线菌的筛选
- 格式:ppt
- 大小:1.39 MB
- 文档页数:16

拮抗香蕉枯萎病放线菌的筛选与AM2041菌株的鉴定本实验从海南各地采集土壤样本,从中筛选出具有对foc4拮抗作用明显的1株放线菌,并对其进行形态、生理生化、16s rdna序列及系统发育分析等方面的监督。
一、材料与方法1.供试菌株的分离菌株的分离采用高氏一号合成培养基。
在海南省海口、儋州、临高等地的8个香蕉种植园,选择香蕉枯萎病发病症状明显的香蕉树,在根系地表采集约20g土壤作为样本。
样本去除大块固体,放置在通风橱中风干10天。
每个样本称取1g,加入9ml无菌水,28℃、200r/min摇床上恒温培养一天,制成悬浮液。
静置1h后分别取上清100μl,进行101、102、103、104梯度的稀释。
稀释液分别取100μl进行涂板,每瓶重复3次。
培养皿28℃培养3天,挑取单菌落于平板上进行划线纯化,5天后进行观察。
2.拮抗菌株的筛选以本实验室所保存的菌液浓度约为109个/ml的foc4培养液作为检测样本,以琼脂挖块法进行初筛:pda平板上接种foc4培养液0.1ml,涂布均匀。
将分离得到的单菌落接种到新的pda平板上,28℃恒温培育2天,用5mm孔径的打孔器打孔,挑取带菌琼脂块放置于有foc4培养液涂布的pda平板上,每个菌株重复3次,28℃恒温培养36小时。
观察抑菌圈的情况。
筛选出的抗性作用明显且生长状况良好的菌株进行复筛。
将抗性菌株接种于snb培养液[11]中进行发酵,28℃、200 r/min摇床上恒温培养一天,室温静置1小时。
在pda平板上均匀涂布0.1ml foc4培养液后,将无菌的直径5mm滤纸贴在平板上。
取10μl抗性菌株的发酵液上清滴于滤纸中心,每个菌株重复3次,28℃培养1天。
观察菌落生长状况。
3.抗性菌株的分类鉴定形态学鉴定:将选出的抗性菌株分别接种于高氏一号合成培养基、甘油天门冬素培养基、土豆琼脂培养基、酵母粉葡萄糖培养基、燕麦汁培养基,28℃培养7天,观察记录菌株气生菌丝、基生菌丝的颜色及有无可溶性色素产生。

放线菌筛选的一般方法1.放线菌样本的收集:可以从自然环境中收集土壤、植物、水体等样本,也可以从实验室中保存的菌种库中选取菌种作为筛选对象。
2.放线菌的分离:将收集到的样本通过稀释涂布、均匀涂布等方法进行分离。
将分离出的放线菌菌落定植于选择性培养基上,利用差异营养需求、抗生素抑制等原理,筛选出纯培养基。
3.放线菌培养:将分离出的纯净菌株接种到适宜的培养基上进行培养,包括液体培养和固体培养。
液体培养可以用于代谢产物的筛选,固体培养主要用于菌株保存和鉴定。
4.代谢产物的筛选:通过对放线菌培养液或菌体提取物的分离、纯化和结构鉴定,筛选出具有生物活性的代谢产物。
常用的筛选方法包括生物测定法、波谱分析法等。
其中,生物测定法是通过对目标活性的生物测定,如抗菌活性、抗肿瘤活性、抗炎活性等,筛选出具有生物活性的化合物。
5.进一步筛选与优化:在获得具有初步生物活性的代谢产物后,可以进一步对其进行筛选与优化。
可以通过改变培养条件(如培养基、温度、pH值等)、发酵工艺等方式提高活性代谢产物的产量和纯度。
6.结构鉴定:对优选的生物活性代谢产物进行结构鉴定,通常使用核磁共振谱、质谱、红外光谱等波谱技术进行分析。
结构鉴定有助于揭示生物活性物质的药理作用机制,为后续研究提供基础。
7.生产量扩大与优化:当获得了具有潜在药用价值的放线菌菌株和代谢产物后,可以进行大规模的发酵生产以提高产量。
在此过程中,需要不断优化发酵工艺、培养基成分和培养条件,以提高产量和纯度。
综上所述,放线菌筛选的一般方法包括放线菌样本的收集、放线菌的分离、放线菌培养、代谢产物的筛选、进一步筛选与优化、结构鉴定和生产量扩大与优化。
这些方法的应用能够帮助科学家发现新的放线菌菌株和生物活性化合物,并为新药研发提供重要的基础信息。

如何在丝状放线菌中进行高通量筛选引言丝状放线菌是一类广泛分布在自然界中的细菌,具有丰富的次级代谢产物,如抗生素、抗肿瘤药物和其他活性物质,是重要的工业和医药微生物资源。
为了提高丝状放线菌的产物合成能力和多样性,需要对其进行基因工程改造,引入或调控相关的基因或代谢途径。
然而,由于丝状放线菌的基因组复杂、转化效率低、表达调控复杂等原因,传统的基因工程方法往往效率低下、耗时耗力。
因此,需要开发高通量筛选方法,快速寻找优良的菌株或基因,从而提高丝状放线菌的菌种改良和产物开发效率。
高通量筛选方法的概述高通量筛选是一种快速处理大量样品,并从中筛选出最佳候选者的方法。
在丝状放线菌中进行高通量筛选,主要有以下几个步骤:•菌株的构建:利用不同的基因编辑技术,如同源重组、CRISPR-Cas9等,对丝状放线菌的基因组进行改造,引入或敲除相关的基因或代谢途径。
•菌株的培养:利用不同的培养条件和诱导剂,对构建好的菌株进行培养,使其表达或合成目标产物。
•菌株的分析:利用不同的检测方法,如紫外吸收法、荧光法、色谱法等,对培养好的菌株进行分析,评估其产物的含量或活性。
•菌株的分选:利用不同的分选方法,如微孔板培养分析法、生物测定法、抗生素生存筛选法、荧光激活细胞分选法(FACS)、荧光激活液滴分选法(FADS)等,从大量的菌株中筛选出最佳的候选者。
高通量筛选方法的比较不同的高通量筛选方法有各自的特点和适用场景,以下对比了五种常用的高通量筛选方法:•微孔板培养分析法:这种方法是利用微孔板进行菌株的培养和产物的分析,可以同时处理多个样品,提高筛选效率。
微孔板的每个孔都可以作为一个微型反应器,可以加入不同的菌株、培养基和诱导剂,进行不同条件下的菌株培养。
培养结束后,可以利用不同的分析方法,如紫外吸收法、荧光法、色谱法等,对微孔板中的产物进行定性或定量的检测,从而评估菌株的产物含量或活性。
这种方法的优点是可以同时处理多个样品,节省时间和空间,且可以利用现有的仪器和耗材,无需特殊的设计和制作。


酱香白酒酿造过程放线菌的筛选与风味研究酱香型白酒酿造历史悠久,工艺独特,开放式的固态发酵造就了复杂而又特殊的酿酒微生态系统,最终形成酱香型白酒独一无二的酒体风格。
酱香型白酒酿造体系微生态系统研究是科学认识酱香型白酒发酵中所蕴藏生物学问题的关键之一。
放线菌作为酱酒酿造中的主要微生物之一,既有风味特征作用又有微生态功能作用。
放线菌与产酱香功能细菌之间的微生态研究及风味影响机制分析,有利于深入研究酱香型白酒发酵机理,促进酱香型白酒进一步发展。
本研究从产异味的放线菌出发,以探究白色链霉菌亚种(Streptomyces albus subsp.)(编号A22)与产酱香功能解淀粉芽孢杆菌(Bacillus amyloliquefaciens)(编号B6)发酵体系中风味影响机制为目的。
通过对产异味放线菌的筛选及鉴定、酿造环境胁迫条件耐受性、特征代谢产物以及对产酱香功能细菌特征代谢风味成分影响等方面进行了研究,取得了如下的结果:(1)通过对酱香型白酒酿造过程中放线菌初筛得到30株,再通过固态发酵感官闻香,筛选到一株产异味突出的菌株(编号A22),经多相分类鉴定为白色链霉菌亚种(Streptomyces albus subsp.)。
(2)对A22菌株进行主要酿造环境胁迫条件耐受性进行分析,结果表明:A22菌株能耐45℃高温、4%vol乙醇、pH4.0环境,其对主要酿造环境胁迫条件适应性较好。
(3)通过HS-SPME和GC-MS对B6、A22、A22B6固态发酵代谢产特征性风味成分进行定性定量分析,结果表明:A22代谢所产土臭素是发酵醅中异味的主要来源,为关键特征性成分;功能细菌B6代谢所产吡嗪类物质是酱酒中的健康功能成分,高温有利吡嗪类总量和种类的增加;混菌发酵时,B6抑制A22产土臭素,发酵醅异味得到调节,风味得到改善,正常酿造条件调节减少酒醅异味;混菌发酵时,A22抑制B6产吡嗪类总量,从风味角度来说A22对B6吡嗪代谢具有一定的调节作用。


放线菌的分离和鉴定放线菌的分离和鉴定实验器材:1.⼟壤材料 5 ---10cm 处⼟壤,放于采集袋中带回实验室。
2.培养基淀粉琼脂培养基(⾼⽒Ⅰ号培养基( w /v))可溶性淀粉2%,KNO3 0. 1%,NaCL 0. 05%,K2HP04 0. 05%,MgSO4 0. 05%,FeSO4 0. 001%,琼脂2% 3.溶液和试剂(1) 20% ⽢油( 2) 0. 1%美蓝 A 液: 美蓝0. 3g ,95% ⼄醇300ml;B 液: 0. 01% KOH 100ml 混合A 和B 液即成⾰兰⽒染液3( 1) 结晶紫染⾊液: 甲液结晶紫2g,95% ⼄醇20ml;⼄液草酸铵0. 8g,蒸馏⽔80ml。
甲⼄液先分别溶解,然后混合在⼀起,过滤除去残渣后装⼊滴瓶中备⽤。
( 2) 碘液: 碘1g,碘化钾2 个,蒸馏⽔100ml 先取少量蒸馏⽔加⼊碘和碘化钾,使碘完全溶解后再加⼊全部蒸馏⽔,分装于滴瓶中备⽤。
( 3) 复红酒精溶液: 碱性复红0. 4g,95%⼄醇100ml,溶解装⼊滴瓶备⽤。
4.仪器和其他⽤品⽆菌纸、带玻璃珠的三⾓烧瓶、1ml⽆菌吸管、⽆菌试管、⽆菌培养⽫⼀.⽬的要求:1. 掌握倒平板的⽅法和常⽤分离纯化微⽣物的基本操作。
2. 初步观察⼟壤中放线菌菌落形态。
3. 初步了解掌握微⽣物分类的基本⽅法。
⼆.实验原理:放线菌在⾃然界中主要⽣存于陆地和淡⽔中,⼟壤为这类微⽣物的主要习居场所,⽆论在种类和数量上都⽐其他地⽅繁多。
在中性或偏碱性的⼟壤和有机质等丰富的⼟壤中较多。
放线菌以孢⼦和菌丝⽚段的形式存在于⼟壤,每克⼟壤内含有数万、数⼗万的孢⼦。
放线菌的⽣活史和形态特征放线菌的孢⼦和孢囊孢⼦在适宜的环境下吸收⽔分,膨胀萌发,⽣出芽管1 -3 个,芽管伸长长出分枝,分枝越来越多,形态菌丝体。
因其菌丝体在培养基内,即基内菌丝或称营养菌丝体。
基内菌丝体⼀般没有横隔,由于菌丝体长⼊培养基内和培养基表⾯,并纠缠在⼀起形成密集的菌落,所以⽤接种针将整个菌落培养基挑起⽽不破裂。

放线菌的分离与筛选方法放线菌介于细菌和丝状真菌的一类丝状原核生物,多为腐生,少数寄生。
腐生型在自然界物质循环中起着重要作用。
放线菌突出特性产生抗菌素,常以孢子或菌丝状态存在,以土壤最多,常存在肥土农田土中性或偏碱性土壤中。
1.拮抗放线菌的筛选方法:1.1平板划线法:待测菌株与检测病原菌通用培养基制成平板,在平板中央划线接种待测菌株,28-30℃ 3-5d,将病原菌垂直方向划线于待测菌生长线的两侧,不能与待测菌相连,在37℃ 24h取出观察。
如果待测菌株对病原菌有抑制活性,病原菌靠近待测菌的一端生长会受到待测菌抑制产生抑菌带。
可根据抑菌带的长短来判断待测菌活性强弱。
选择抑制活性强的复筛。
1.2抑菌圈法或十字交叉法:常用的初筛方法将待测菌接种于平板,长出成熟菌落后,用打孔器将供试病原菌苔打成直径5-6mm小菌块,并将其移入到病原菌平板培养基中,将待测菌与病原菌呈十字交叉排列,即病原菌在中央,待测菌置于病原菌的四周,培养3-4d。
若有抑菌活性在待测菌周围形成一个没有生长病原菌抑菌圈。
若菌块厚度大小一致的,抑菌圈的大小可直观反应待测菌抑菌活性的强弱。
1.3纸片法或生长速率法:主要测定发酵液的抑菌活性,即将相同灭菌后的圆形滤纸片放于待测发酵液中,取出并黏贴在接种有病原菌的平板培养基,培养后观察有无抑菌圈或抑菌圈的大小。
2.放线菌分离与筛选.2.1培养基;2.1.1改良高1号:可溶性淀粉20g/L KH2PO40.5g/L NaC10.5g/L MgSO40.2-0.5g/L KNO3 1g/L FeSO40.01g/L 重铬酸钾(3%)3.3mL/L PH7.2-7.4(分离保存用)每100ml培养基加入1ml0.1℅的FeSO4溶液。
2.1.2淀粉培养基和秸秆腐解物培养基2.1.3拮抗试验培养基:高1号牛蛋 PDA改良培养基加3g牛肉膏2.2抑菌剂的选择:有效降低细菌真菌的数量,细菌扩散真菌蔓延速度迅速。

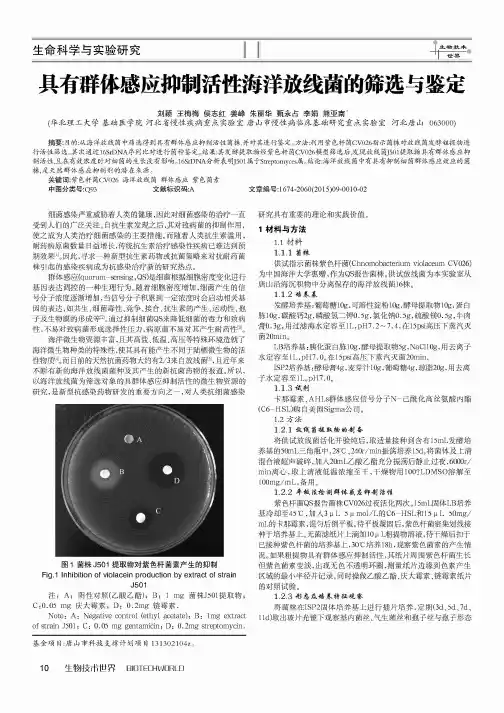
生命科学与实验研究生物技术^世界具有群体感应抑制活性海洋放线菌的筛选与鉴定刘颖王梅梅侯志红姜峰朱丽华甄永占李娟熊亚南*(华北理工大学基础医学院河北省慢性疾病重点实验室唐山市慢性病临床基础研究重点实验室河北唐山063000)摘要:目的:从海洋放线菌中筛选得到具有群体感应抑制活性菌株,并对其进行鉴定。
方法:利用紫色杆菌C V 026指示菌株对放线菌发酵粗提物进行活性筛选。
其次通过16SrD N A 序列比对进行菌种鉴定。
结果:其发酵提取物经紫色杆菌C V 026模型筛选后,发现放线菌J 501提取物具有群体感应抑 制活性,且在有效浓度时对细菌的生长没有影响。
16SrD N A 分析表明J 501属于Streptomyces 属。
结论:海洋放线菌中有具有抑制细菌群体感应效应的菌 株,是天然群体感应抑制剂的潜在来源。
关键词:紫色杆菌C V 026海洋放线菌群体感应紫色菌素中图分类号:Q 93 文献标识码:A文章编号:1674-2060(2015)09-0010-02细菌感染严重威胁着人类的健康,因此对细菌感染的治疗一直 受到人们的广泛关注。
自抗生素发现之后,其对致病菌的抑制作用, 使之成为人类治疗细菌感染的主要措施。
而随着人类抗生素滥用, 耐药病原菌数量日益增长,传统抗生素治疗感染性疾病已难达到预 期效果[1]。
因此,寻求一种新型抗生素药物或抗菌策略来对抗耐药菌 株引起的感染疾病成为抗感染治疗新的研究热点。
群体感应(quomm -sensing ,QS )是细菌根据细胞密度变化进行 基因表达调控的一种生理行为。
随着细胞密度增加,细菌产生的信 号分子浓度逐渐增加,当信号分子积累到一定浓度时会启动相关基 因的表达,如共生、细菌毒性、竞争、接合、抗生素的产生、运动性、孢 子及生物膜的形成等[2]。
通过抑制细菌QS 来降低细菌的毒力和致病 性,不易对致病菌形成选择性压力,病原菌不易对其产生耐药性[3]。
海洋微生物资源丰富,且其高盐、低温、高压等特殊环境造就了 海洋微生物种类的特殊性,使其具有能产生不同于陆栖微生物的活 性物质[4]。

抗FOC4香蕉内生放线菌的筛选及菌株NJQG—3A1鉴定1材料与方法1.1材料1.1.1病原菌尖孢镰刀菌4号生理小种,由中国热带农业科学院生物技术研究所曾会才实验室提供。
1.1.2主要培养基内生放线菌分离培养基采用改良高氏(Gauses)1号培养基(GS)、1/10 ATCC 合成培养基、葡萄糖天门冬酸培养基(GA)、腐殖酸培养基(HV)、改良高氏2号培养基(GPT)和改良淀粉酪素培养基(SIM)[14-18],为抑制杂菌生长,在各分离培养基中均加入终浓度为75 mg/L的重铬酸钾、100 mg/L的制霉菌素和20 mg/L的萘啶酮酸;放线菌纯化培养保存采用YE培养基;抑菌试验采用马铃薯琼脂培养基(PDA);液体发酵采用淀粉-大豆粉液体培养基;形态特征观察采用国际链霉菌计划(ISP)推荐的培养基,参考Shirling等的方法[19-20 ]进行配制。
1.1.3样品采集与处理2012年11月3日从海南省临高南宝蕉园(19°47′1″N,109°51′17″E)和皇桐蕉园(19°49′58″N,109°50″E)采集香蕉植株样品(表1)。
每个品种随机采集香蕉植株10株,混匀。
表1样品采集信息采集地点根部土壤pH值香蕉植株采集植株部位皇桐美台蕉园4.35农科健康植株(NK)根、球茎、假茎、叶临高南宝蕉园4.17南天健康植株(NJ)根、球茎、假茎、叶临高南宝蕉园5.54南天感病植株(NB)根、球茎、假茎、叶临高南宝蕉园4.17巴西健康植株(BJ)根、球茎、假茎、叶临高南宝蕉园5.54巴西感病植株(BB)根、球茎、假茎、叶1.2方法1.2.1内生放线菌的分离参考阮继生分离弗兰克氏菌的方法对样品进行表面消毒,采用组织块匀浆法进行内生放线菌分离。
1.2.2香蕉枯萎病内生拮抗放线菌筛选以尖孢镰刀菌4号生理小种(FOC4)为靶标菌,采用平板对峙法进行初筛;对初筛有活性的菌株用平板对峙法进行复筛,计算抑菌率,公式为:抑菌率=[(对照组菌落半径-处理组菌落半径)/对照组菌落半径]×100%。
土壤拮抗放线菌的分离与筛选效果研究刘炳源;周晶【摘要】针对青海地区不同类型的土壤进行放线菌的分离、筛选。
结果表明,10-3倍土壤稀释浓度为分离放线菌的最佳土壤稀释浓度;重铬酸钾是一种高效、方便、廉价的杂菌抑制剂,共筛得102株形态各异的放线菌,有32株菌分别对9种指示菌有较强的拮抗性,26株对不同细菌有较强抑菌活性,6株对真菌有抑菌活性,其中第24号放线菌对不同的指示菌的拮抗性最好。
%Actinomycetes in different types of soil from Qinghai Area were isolated and screened. The results showed that the best soil diluted concentration for separating Actinomyces was 10-3 times. Heavy chromic acid potassium was a kind of high efficient,convenient,inexpensive,mixed bacteria inhibitors,and 102 strains Actinomycetes with different morphology were screened,in which32 strains had stronger mineralocorticoid resistance on 9 indication bacteria respectively ,26 strains had a inhibitor on different bacteria ,6 strains had antibacterial activity on fungus ,the mineralocorticoid resistance of 24th Actinomycetes was the best for different instructions.【期刊名称】《现代农业科技》【年(卷),期】2013(000)017【总页数】3页(P225-226,228)【关键词】放线菌;分离;拮抗性;筛选【作者】刘炳源;周晶【作者单位】曲阜师范大学生命科学学院,山东曲阜 273165;曲阜师范大学生命科学学院,山东曲阜 273165【正文语种】中文【中图分类】Q939.13+2农用抗生素作为生物农药,以其高效、低毒、无残留等优点在农作物病虫害防治中发挥着重要作用[1-2]。
红豆杉内生放线菌的分离及活性菌株的筛选与鉴定张曼1,解修超h2,陈文强1”,邓百万“”,张晓伟1,孔亚男1 (1.陕西理工学院生物科学与T程学院,陕西汉中723001;2.陕西省食药用菌T程技术研究中心,陕西汉中723001)摘要:通过组织匀浆法分离红豆杉(T a xus chi nensi s)根、茎、叶3个部位的内生放线茵。
采用滤纸片法初步研究了内生放线茵发酵液的抑茵活性,并时抑茵活性明显的茵株进行了分子鉴定。
结果表明,分离纯化得到内生放线菌55株,抑菌活性试验中共有2l株表现出了不同程度的拮抗作用,占全部分离菌株的38.2%,其中4株具有明显的抑菌活性。
经16S r D N A序列分析,初步鉴定3株为链霉菌属(St r e pt om yces sp.),1株为小单孢茵属(M i cr om onospor a s p.)。
关键词:红豆杉;内生放线茵;分离;筛选;鉴定中图分类号:Q939.9文献标志码:A文章编号:1673—1689(2012)05--0549—06I sol at i on,S cr eeni ng a nd I dent i f i ca t i on of E ndophyt i cA ct i nom ycet s f r om T axus C hi nens i sZ H A N G M anl,X I E X i u—cha01”,C H E N W en-qi an91~,D E N G B ai—w aT l’1“,Z H A N G X i a o—w ei l。
K o N Gy&一l l aY l l(1.S chool ot Biologic al Sci ence and E ngi neer i ng,Shaanxi U ni vers i t y of T e chn ol og y,H anz hon g723001,C hi naf2.Shaanxi E n—gi neef i ng R esea r ch C ent er of Edi b l e and M ed i cat ed F u ng i H an zh ong723001C hi na)A bs t r act:I n t hi s m anus c r i pt,endop hyt i c act i nom ycet es w er e i s ol at e d f r om t he r oot,s t em andl eaf of T a39U$chi nens i s by t he m e t hod of t i s sue hom o genat e.A nt i m i cr ob i al ac t i vi t i e s of endo—phyt i c act i nom ycet es f er m en t at i on br ot h w e r e det er m i n ed w i t h f i l t er pap er and m ol ecul ar i den—t i f i ca t i on of s of t i e pot ent i al s t r ai ns w er e al s o c ar ri ed out.The re s ul t i ndi ca t ed t ha t55st ra i ns of endop hyt i c act i nom ycet es w e r e i sol at e d,21of t hem ha ve var i ed ant i m i cr obi al ac t i vi t y,acc ount。
放线菌筛选的一般方法放线菌筛选是一种从大自然中寻找新的抗生素和其他有用化合物的方法。
放线菌是一类革兰氏阳性细菌,与其他细菌存在显著区别,它们具有许多生物活性代谢产物的天然合成能力。
因此,放线菌筛选被广泛应用于寻找新的抗生素和其他有活性的化合物。
1.采集样本:首先,需要在大自然环境中采集到放线菌的样本。
放线菌广泛分布于土壤、水体、植物等各种环境中,因此可以从这些环境中采集到样本用于筛选。
样本的采集可以通过在目标环境中收集土壤或其他样品,并将其置于合适的容器中保存。
2.预处理:采集到的样本通常含有大量不同种类的微生物,因此需要进行预处理步骤。
预处理的目的是去除其他微生物,只留下放线菌。
常用的预处理方法包括加热处理、酸碱处理、稀释等。
3. 筛选培养基的选择:放线菌的生长需要适宜的培养基,因此在筛选之前需要选择合适的培养基。
常用的培养基包括Mannitol-Soya agar (MSA)、Glycerol Yale agar(GYA)、Starch Casitone-Nitrate agar (SCN)等。
4.筛选培养条件的优化:放线菌的生长条件可以通过培养条件的优化来改善。
常用的优化参数包括温度、pH、培养时间和培养基成分等。
优化培养条件可以提高放线菌生长的速度和产生生物活性物质的能力。
5.放线菌分离:在筛选培养基上,可以观察到放线菌的集落。
这些集落可以单独分离,得到纯种的放线菌菌株。
分离放线菌的常用方法包括传代分离和扩散板法等。
6.放线菌菌株的筛选:得到纯种的放线菌菌株后,可以进行生物活性物质的筛选。
常用的筛选方法包括抗菌活性测定、抗肿瘤活性测定和酶活性测定等。
这些方法可以通过测量抑菌圈直径、细胞生存率和酶催化能力来评估放线菌菌株的活性。
7.活性物质的提取和纯化:经过筛选得到有活性的放线菌菌株后,还需要将其产生的活性物质进行提取和纯化。
常用的提取方法包括溶剂提取法、胶体微滤法和萃取法等。
而纯化方法则包括柱层析、薄层层析和高效液相层析等。
放线菌的分离与筛选方法放线菌(Actinomycetes)是一类革兰氏阳性细菌,常见于土壤和水体中。
由于其多样的形态和代谢特性,放线菌具有广泛的生物学和工业应用价值。
分离和筛选放线菌的方法是研究和利用其功能的基础,本文将介绍几种常用的方法。
一、分离方法:1.稀释和均匀涂布法:首先,将环境样品(如土壤、水样)进行适当稀释,并在培养基平板上平均涂布样品。
随着放线菌的生长,单个菌落会形成,然后可以通过挑选单个菌落进行分离纯化。
2.稀释和涂布法:方法类似于前者,但将初步培养得到的单菌落拖线在新的培养基平板上进行再次分离,以获得更纯的放线菌。
3.祛除污染菌法:样品前处理的关键是去除非放线菌细菌的干扰。
常见的处理方法有在分离培养基中加入抗生素、改变pH值等。
4.冷冻-融化法:利用放线菌对低温和高温的耐受性不同,将样品进行多次冻结-融化处理,可以选择性地分离出放线菌。
二、筛选方法:1.对抗菌活性筛选:放线菌具有对其他菌株的抗菌活性,可以使用对抗菌活性筛选方法,通过将待测分离物与感兴趣的致病菌共同培养,观察是否产生抑菌圈来筛选放线菌。
2.抗真菌筛选:放线菌不仅对细菌有抑制作用,也能抑制真菌的生长。
可以通过共培养放线菌和待测真菌,并观察是否产生抑菌圈来筛选放线菌。
3.溶磷筛选:放线菌具有溶解磷酸盐的能力,可以利用Na-P亚硝酸盐琼脂平板培养基来筛选放线菌。
4.产生生物活性化合物筛选:放线菌可以生成一系列生物活性化合物,如抗生素、酶、生物胺等。
可以根据需要设计相应的试剂盒,进行营养检测、酶活性测定或染色方法进行筛选。
5.双层平板筛选法:放线菌在液体培养基上生长一段时间后,将其转移到固体上层培养基上继续培养。
这种方法可以筛选出产生生物活性化合物的放线菌。
以上介绍的方法只是一小部分常用的放线菌分离和筛选方法,随着技术的不断发展,还有更多新的方法被提出。
分离和筛选放线菌是一个复杂且耗时的过程,需要根据具体的研究目的和条件来选择适合的方法。