金属的电化学腐蚀与防护-高考化学专题
- 格式:doc
- 大小:1.93 MB
- 文档页数:13


考点36 金属的电化学腐蚀与防护
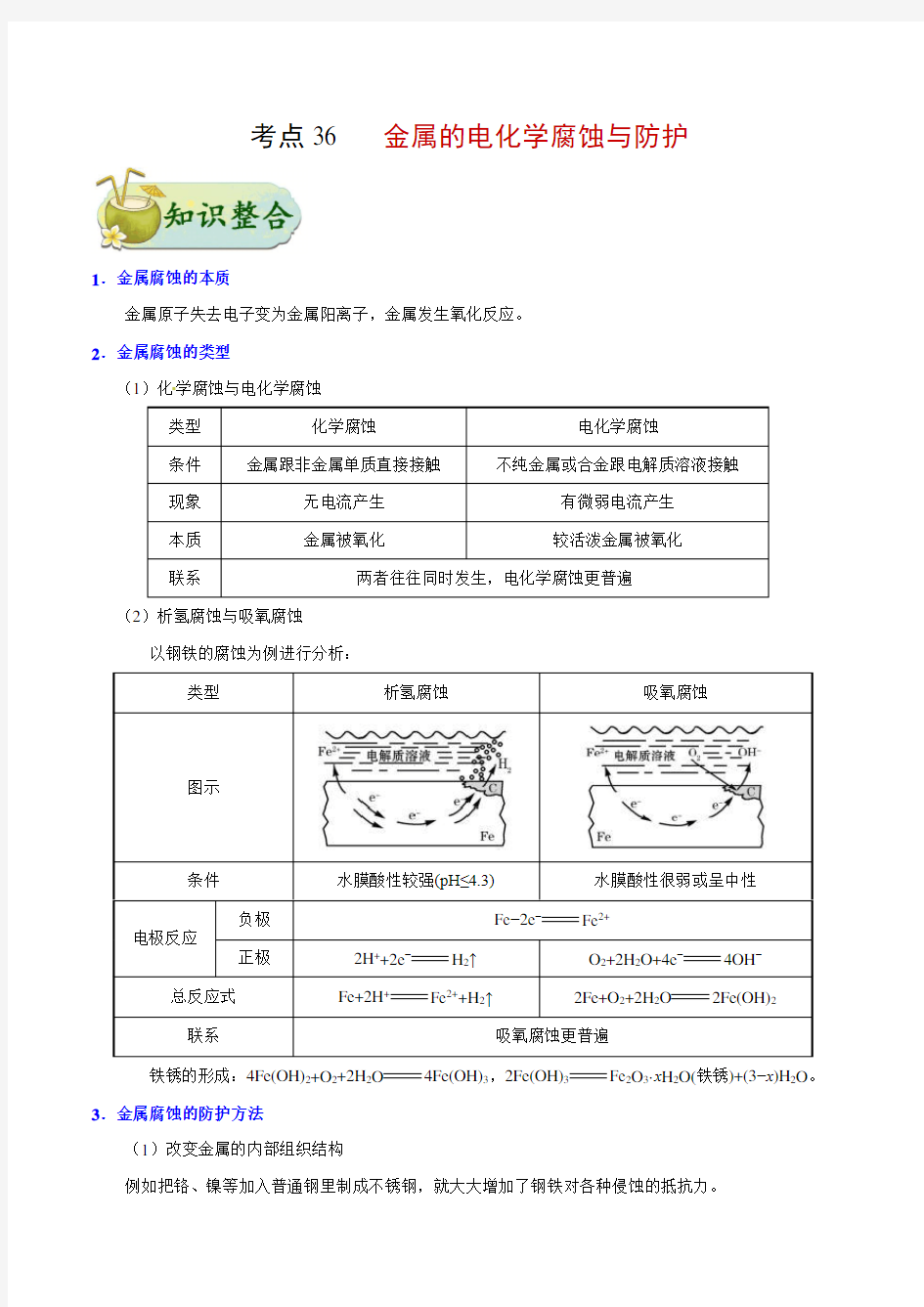
1.金属腐蚀的本质
金属原子失去电子变为金属阳离子,金属发生氧化反应。
2.金属腐蚀的类型
(1)化学腐蚀与电化学腐蚀
类型化学腐蚀电化学腐蚀
条件金属跟非金属单质直接接触不纯金属或合金跟电解质溶液接触
现象无电流产生有微弱电流产生
本质金属被氧化较活泼金属被氧化
联系两者往往同时发生,电化学腐蚀更普遍
(2)析氢腐蚀与吸氧腐蚀
以钢铁的腐蚀为例进行分析:
类型析氢腐蚀吸氧腐蚀
图示
条件水膜酸性较强(pH≤4.3)水膜酸性很弱或呈中性
负极Fe−2e−Fe2+
电极反应
正极2H++2e−H 2↑O2+2H2O+4e−4OH−总反应式Fe+2H+Fe2++H 2↑2Fe+O2+2H2O2Fe(OH)2
联系吸氧腐蚀更普遍
铁锈的形成:4Fe(OH)2+O2+2H2O4Fe(OH)3,2Fe(OH)3Fe2O3·x H2O(铁锈)+(3−x)H2O。3.金属腐蚀的防护方法
(1)改变金属的内部组织结构
例如把铬、镍等加入普通钢里制成不锈钢,就大大增加了钢铁对各种侵蚀的抵抗力。
(2)在金属表面覆盖保护层
在金属表面覆盖致密的保护层,从而使金属制品跟周围物质隔离开来,这是一种普遍采用的防护方法。
(3)电化学防护法
牺牲阳极的阴极保护法外加电流的阴极保护法
依据原电池原理电解原理
原理形成原电池时,被保护金属作正极
(阴极),不反应受到保护;活泼金属
作负极(阳极),发生反应受到腐蚀,
阳极要定期予以更换
将被保护的金属与另一附加电极作为电解池的
两个极,使被保护金属作阴极,在外加直流电
的作用下使阴极得到保护
应用
保护一些钢铁设备,如锅炉内壁、
船体外壳等装上镁合金或锌片
保护土壤、海水及水中的金属设备
实例
示意图
考向一金属的腐蚀快慢与防护方法的比较
典例1为延长舰船服役寿命可采用的电化学防腐的方法有①舰体与直流电源相连;②舰体上镶嵌某种金属块。下列有关说法正确的是
A.方法①中舰体应连电源的正极
B.方法②中镶嵌金属块可以是锌
C.方法①为牺牲阳极的阴极保护法
D.方法②为外加电流的阴极保护法
【解析】方法①舰体做阴极,应连电源的负极,故A错误;方法②为牺牲阳极的阴极保护法,镶嵌金属块作原电池的负极,其活泼性需要大于Fe,可以是锌,故B正确;方法①利用电解原理,为外加电流的
阴极保护法,故C错误;方法②利用原电池原理,为牺牲阳极的阴极保护法,故D错误。
【答案】B
1.利用如图装置探究铁在海水中的电化学防护,下列说法不正确的是
A.若X为锌棒,开关K置于M处,可减缓铁的腐蚀
B.若X为锌棒,开关K置于M处,铁电极的反应:Fe−2e−Fe2+
C.若X为碳棒,开关K置于N处,可减缓铁的腐蚀
D.若X为碳棒,开关K置于N处,铁电极的反应:2H++2e−H 2↑
过关秘籍
(1)判断金属腐蚀快慢的规律
①对同一电解质溶液来说,腐蚀速率的快慢:电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防腐措施的腐蚀。
②对同一金属来说,在不同溶液中腐蚀速率的快慢:强电解质溶液中>弱电解质溶液中>非电解质溶液中。
③活动性不同的两种金属,活动性差别越大,腐蚀速率越快。
④对同一种电解质溶液来说,电解质浓度越大,金属腐蚀越快。
(2)两种保护方法的比较
外加电流的阴极保护法保护效果大于牺牲阳极的阴极保护法。
考向二析氢腐蚀和吸氧腐蚀
典例1一定条件下,碳钢腐蚀与溶液pH的关系如下:
pH 2 4 6 6.5 8 13.5 14
腐蚀快慢较快慢较快
FeO
主要产物Fe2+Fe3O4Fe2O3
2
下列说法不正确的是
A.在pH<4溶液中,碳钢主要发生析氢腐蚀
B.在pH>6溶液中,碳钢主要发生吸氧腐蚀
C.在pH>14溶液中,碳钢腐蚀的正极反应为O2+4H++4e-2H2O
D.在煮沸除氧气的碱性溶液中,碳钢腐蚀速率会减缓
【解析】pH<4为强酸性,发生析氢腐蚀,A正确;pH>6的溶液,氧气得电子,发生吸氧腐蚀,B正确;pH>14的溶液,氧气与水反应得电子:O2+2H2O+4e-4OH-,C错误;煮沸后除去了氧气,碳钢的腐蚀速率会减缓,D正确。
【答案】C
2.假设图中原电池产生的电压、电流强度均能满足电解、电镀要求,即为理想化。①~⑧为各装置中的电极编号。下列说法错误的是
A.当K闭合时,A装置发生吸氧腐蚀,在电路中作电源
B.当K断开时,B装置锌片溶解,有氢气产生
C.当K闭合后,整个电路中电子的流动方向为③→②;①→⑧;⑦→⑥;⑤→④
D.当K闭合后,A、B装置中pH变大,C装置中pH不变
1.如图所示,各烧杯中盛海水,铁在其中被腐蚀的速度由快到慢的顺序为
A.②①③④⑤⑥B.⑤④③①②⑥
C.⑤④②①③⑥D.⑤③②④①⑥
2.下列有关金属腐蚀与防护的说法不正确的是
A.钢铁在弱碱性条件下发生电化学腐蚀的正极反应是O2+2H2O+4e-===4OH-
B.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用
C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
D.可将地下输油钢管与外加直流电源的负极相连以保护它不受腐蚀
3.我国多条高压直流电线路的瓷绝缘子出现铁帽腐蚀现象,在铁帽上加锌环能有效防止铁帽的腐蚀,防护原理如图所示。下列说法错误的是
A.通电时,锌环是阳极,发生氧化反应
B.通电时,阴极上的电极反应为2H2O+2e-===H2↑+2OH-
C.断电时,锌环上的电极反应为Zn2++2e-===Zn
D.断电时,仍能防止铁帽被腐蚀
4.将两根铁钉分别缠绕铜丝和铝条,放入滴有混合溶液的容器中,如图所示,下列叙述错误的是
A.a中铁钉附近呈现蓝色沉淀
B.b中发生吸氧腐蚀
C.b中铁钉附近呈现红色