肾细胞癌 MRI 表现病理分型 VS 鉴别诊断
- 格式:ppt
- 大小:14.43 MB
- 文档页数:103


肾透明细胞癌病理诊断标准全文共四篇示例,供读者参考第一篇示例:肾透明细胞癌(Renal clear cell carcinoma)是肾细胞癌的一种,属于肾上皮性肿瘤的一种。
其病理诊断标准主要包括临床症状、影像学检查、组织学检查和免疫组化检查等多个方面。
下面将详细介绍肾透明细胞癌的病理诊断标准。
一、临床症状肾透明细胞癌的临床症状并不特异,常见的症状包括腰部疼痛、腹部肿块、血尿、腹部不适等。
部分患者还可能出现发热、乏力、消瘦等全身症状。
需要强调的是,上述症状并非一定全部出现,而且有些症状可能与其他疾病相似,因此需要结合其他检查结果进行综合分析。
二、影像学检查影像学检查对于肾透明细胞癌的诊断至关重要。
常用的影像学检查包括B超、CT、MRI等,通过这些检查可以清晰地观察肾脏的形态、大小、脏器间的关系以及肿瘤的部位、大小、边界等。
肾透明细胞癌常表现为单发、边界清晰、不规则形状的肿块,密度均匀或有出血、坏死表现。
在进行影像学检查时,需注意与其他类型的肾细胞癌进行鉴别,以确定最佳治疗方案。
三、组织学检查组织学检查是确诊肾透明细胞癌的金标准。
通过肾脏穿刺活检或手术切除标本,观察组织形态学特点,才能明确诊断。
肾透明细胞癌的组织学特点包括肿瘤细胞大小不等、质地软、细胞核呈圆形或椭圆形、细胞浆清晰透明,并且核分裂象较多。
还需排除肾透明细胞癌的其他亚型,如肾乳头状肾细胞癌、肾实质肾透明细胞癌等。
四、免疫组化检查免疫组化检查在肾透明细胞癌的诊断中具有重要价值。
通过染色技术可以检测肿瘤细胞的免疫组织化学标记物,常用的标记物包括CK7、CK20、VIM、CD10、CA9等。
肾透明细胞癌通常表现为CK7强阳性、CK20阴性、VIM强阳性、CD10弱阳性、CA9强阳性等特征。
免疫组化检查可以帮助鉴别肾透明细胞癌与其他类型的肾细胞癌,并指导进一步的治疗方案选择。
肾透明细胞癌的病理诊断标准主要包括临床症状、影像学检查、组织学检查和免疫组化检查等多个方面。







肾透明细胞癌少见影像学表现与病理对照[摘要]目的:分析肾透明细胞(renal clear cell carcinoma , rccc)的少见影像学表现,探讨其与病理的关系及临床意义,以提高诊断准确性。
资料与方法:搜集经手术病理证实的非典型rccc38例患者资料。
均行多层螺旋ct平扫、皮髓交界和实质期增强扫描,6例行mri平扫和增强扫描。
复习影像及临床资料并与手术病理对照分析。
结果: 38例rccc共40个肾脏病灶。
38例表现为少血供14例;囊性10例;多发性eccc2例,其中2例合并动静脉瘘。
结论: rccc少见影像学表现包括:肿瘤为少血供,囊性,多发病灶,合并肾外肿瘤,肿瘤致侧支循环及动静脉瘘等。
认识这些少见影像学表现有利于提高rccc诊断的准确性,减少误诊。
关键词:肾透明细胞癌;体层摄影术;x线计算机;磁共振成像中图分类号: r445 文献标识码:b文章编号:1004-7484(2012)06-0205-04肾透明细胞癌是肾细胞癌最常见的组织亚型,倍增时间明显快于乳头状肾细胞癌和嫌色细胞癌,5年生存率也明显低于后者。
有关rccc的报道多为典型、常见表现,血液动力学及其病理基础研究少见。
笔者搜集我院近5年间38例不典型rccc病例资料,结合临床及手术病理结果,探讨其影像学表现及病理基础,以提高对不典型rccc的诊断和鉴别诊断水平。
1 资料与方法本组38例,均经手术病理证实,其中男24例,女14例,年龄31~72岁,平均56..8岁。
18例无明显症状,体检发现,12例腰痛,6例血尿,2例因外伤就诊。
所有病例术前均行ct扫描。
采用ge lightspeed 16排螺旋ct扫描仪,扫描层厚5~10mm,分别行平扫、皮髓交界期(对比剂注射后19~20s)和实质期(注射后80s)扫描,选用非离子型对比剂优维显与肘前静脉注射,剂量1.5~2.0ml/kg体重,注射流率3~4ml/s。
3例行mri,采用ge1.0 t signa mr扫描仪,对比剂为gd-dtpa,剂量12~20ml或0.15~0.20mmol/kg体重,注射流率1.5~2.0ml/s。
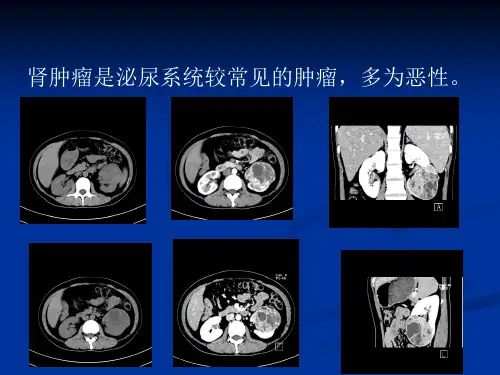
肾肿瘤如何鉴别诊断?不同种类肾肿瘤临床表现各异,诊断应依据其具体症状、体征进行鉴别。
此外,必要的医学检查在各类肾肿瘤的诊断和鉴别中有重要作用。
肾肿瘤分肾实质和肾盂肿瘤两类。
(1)肾实质:恶性:肾细胞癌,肾母细胞瘤,肉瘤。
良性:血管平滑肌脂肪瘤,血管瘤,纤维瘤,平滑肌瘤,脂肪瘤和腺瘤。
(2)肾盂:肾盂癌。
一、肾实质恶性肿瘤:肾细胞癌:发生在任何年龄,以60—70岁多见。
男性高于女性2倍。
多发生一侧,早期不出现症状,无痛性血尿是最早信号,生长在肾边缘或向外生长的血尿出现晚或不出现。
(一)病理类型:按细胞成分:1、透明细胞癌;2、颗粒细胞癌;3、未分化癌;依据癌细胞的排列构型:1、肾腺癌(腺管状结构为主);2、肾乳头状腺癌(乳头状构型为主)robson,tnm分期:1期:肿瘤局限于肾包膜内;2期:肿瘤侵犯脂肪囊,局限在筋膜内;3期:肿瘤侵犯肾静脉或局部淋巴结,有无下腔静脉.肾周围脂肪受累;4期:远隔脏器转移或侵犯邻近脏器;(二)肾癌声像图:肾内出现占位性病灶、园型、椭圆型,的良好的球体感,小肿瘤边清、大肿瘤边欠清呈分叶状。
内部回声多变:2~3cm直径小肿瘤呈高回声;2~4cm中等肿瘤呈低回声;巨大肿瘤内部出血,液化,坏死,钙化呈不规则回声。
肿瘤位于肾脏表面有局部隆起,向内推挤或侵犯肾盂。
要点:1、低回声光团内有多个结节,结节边缘低于结节中心区。
隐约呈环状,出现所谓的瘤中之瘤。
2、也有一部分肾细胞癌的周边有低回声晕圈,晕圈有窄有宽,窄者仅1mm,宽2~3mm。
肾细胞癌的不同类型的超声表现:1、透明细胞癌:肾肿瘤中多见占60%。
病理改变:体积较大,包膜清晰,胞浆充满透明脂肪,染色阳性。
(1)圆形、球形、椭圆形,有假包膜;(2)多有出血或坏死,囊性变;(3)肿瘤内部为囊和囊隔,囊腔呈无回声或漂浮低回声,伴有扩张实质性结节;(4)瘤体较大,恶性度较低;(5)多血流改变。
2、颗粒细胞癌:病理改变:直径约为透明细胞癌的一半,胞浆少,包膜可清或不清,内充满嗜酸颗粒。
肾脏罕少见良性肿瘤的CT㊁MRI表现及病理学特征戴玲玲1ꎬ童明敏2ꎬ于㊀洋1ꎬ柯㊀俊11.苏州大学附属第一医院放射科㊀江苏㊀苏州㊀215000ꎻ2.江苏省苏州市立医院东区放射科㊀江苏㊀苏州㊀215000㊀㊀ʌ摘㊀要ɔ㊀目的㊀探讨肾脏罕少见良性肿瘤的CT㊁MRI表现及其病理学基础ꎮ方法㊀选取16例经手术及病理证实的肾脏罕少见良性肿瘤的CT及MRI影像学资料ꎬ对其影像特征进行分析ꎮ结果㊀后肾腺瘤呈囊实性或实性肿块ꎬ边界清ꎬDWI呈高信号ꎬADC呈低信号ꎬ实性成分增强扫描呈轻中度渐进性强化㊁强化程度低于正常肾皮质ꎻ肾嗜酸细胞腺瘤CT平扫呈等或稍高密度ꎬ增强后明显强化ꎬ中央瘢痕伴轮辐状强化㊁反转强化可见ꎻ平滑肌瘤CT平扫呈稍高密度ꎬ钙化常见ꎬ增强扫描呈均匀延迟强化ꎻ囊性肾瘤CT平扫为边界清楚的多房囊性肿块ꎬ囊壁及分隔厚度均匀无附壁结节ꎬ增强扫描囊壁及分隔均匀强化ꎬ囊性成分无强化ꎻ孤立性纤维瘤CT增强扫描皮质期肿块呈明显不均匀强化ꎬ并可见粗大供血动脉影ꎬ实质期强化更明显ꎬ呈渐进性㊁持续性强化ꎮ结论㊀肾脏罕少见良性肿瘤具有一定的CT㊁MRI影像学特征ꎬ准确的术前诊断对指导临床治疗方式的选择有重要价值ꎮʌ关键词ɔ㊀肾肿瘤ꎻ良性ꎻ体层摄影术ꎬX线计算机ꎻ磁共振成像中图分类号:R737.11ꎻR445.2㊀㊀㊀文献标识码:A㊀㊀㊀文章编号:1006 ̄9011(2020)12 ̄2258 ̄05CTandMRIimagingfeaturesofrenalrarebenigntumorsinrelationtopathologicalfindingsDAILingling1ꎬTONGMingmin2ꎬYUYang1ꎬKEJun11.DepartmentofRadiologyꎬTheFirstAffiliatedHospitalofSoochowUniversityꎬSuzhou215000ꎬP.R.China2.DepartmentofRadiologyꎬTheEastDistrictofSuzhouMunicipalHospitalꎬSuzhou215000ꎬP.R.ChinaʌAbstractɔ㊀Objective㊀ToinvestigatetheCTandMRIimagingfeaturesofrenalrarebenigntumorsinrelationtoclinicalandpathologicalfindings.Methods㊀CTandMRIimagingdataof16rarerenalbenigntumorsconfirmedbysurgeryandpathologywereretrospectivelyanalyzedꎬincluding4casesofmetanephricadenomaꎬ6casesofoncocytomaꎬ3casesofleiomyomaꎬ2casesofcystnephromaꎬand1caseofsolitaryfibroma.SixteencasesunderwentenhancedCTandtwounderwentenhancedMRI.Re ̄sults㊀Themetanephricadenomashowedasacystic ̄solidorsolidmasswithclearbordersꎬhighandlowsignalonDWIandADCmapsrespectivelyꎬshowingmildtomoderateprogressiveenhancementinthesolidcomponentwhichwaslowerthannormalrenalcortex.TheoncocytomadisplayedequalorslightlyhigherdensityonCTꎬenhancedsignificantlyandcentralscarmaybevisualizedwithradialandinvertedenhancement.TheleiomyomasshowedslightlyhigherintensityonCTwithcalcificationcommonlyseenꎬandwerecharacterizedbyhomogeneouslydelayedenhancement.Thecysticnephromaappearedasawellcircumscribedmulti ̄chamberedcysticmassꎬwiththecystwallandpartitionhavinguniformthicknesswithoutmuralnodules.Enhancementcanbede ̄tectedinthecystwallandpartitionbutcannotbeseeninthecysticcomponents.Solitaryfibroidsexhibitedprogressiveandcontin ̄uousenhancementꎬnamelyobviousheterogeneousenhancementevenwithlargevisiblesupplyingarteriesinthecorticalphaseandmoreremarkableenhancementintheparenchymaphase.Conclusion㊀RenalrarebenigntumorsdisplaysomeCTandMRIima ̄gingcharacteristicsꎬandaccuratepreoperativediagnosisisofgreatvalueinguidingthechoiceofclinicaltreatment.ʌKeywordsɔ㊀RenalneoplasmꎻBenignꎻTomographyꎬX ̄raycomputerꎻMagneticresonanceimaging㊀㊀肾脏罕少见良性肿瘤术前易误诊为肾癌ꎬ而肾脏良恶性肿瘤的治疗方法及预后完全不同ꎬ因此术前准确鉴别肾脏肿瘤的良恶性至关重要ꎮ本文回顾性分析我院2014年1月~2020年1月16例经手术基金项目:国家自然科学基金青年项目(编号:81701669)ꎻ江苏省自然科学基金青年项目(编号:BK20170368)作者简介:戴玲玲(1989 ̄)ꎬ女ꎬ江苏盐城人ꎬ医学硕士ꎬ主治医师ꎬ主要从事医学影像学诊断工作通信作者:柯俊㊀主治医师㊀E ̄mail:fmrikej@126.com病理证实的肾脏罕少见良性肿瘤患者的临床及CT㊁MRI影像资料ꎬ结合文献分析ꎬ提高对肾良性肿瘤的认识ꎮ1㊀资料与方法1.1㊀一般资料本组16例患者中ꎬ男性9例ꎬ女性7例ꎬ年龄19~83岁ꎬ平均年龄(46.7ʃ15.8)岁ꎮ其中后肾腺瘤8522(metanephricadenomaꎬMA)4例ꎬ嗜酸细胞腺瘤(re ̄naloncocytomaꎬRO)6例ꎬ平滑肌瘤(renalleiomyo ̄maꎬRL)3例ꎬ囊性肾瘤(cysticnephromaꎬCN)2例及孤立性纤维瘤(solitaryfibroustumorꎬSFT)1例ꎮ临床表现为腰部不适ꎬ血尿ꎮ本文经医院伦理委员会审核通过ꎮ1.2㊀检查方法CT检查采用多层螺旋CT(SiemensSomatomSensation64andDualSourceCT)多期扫描ꎬ包括平扫㊁皮质期和实质期增强扫描ꎮ经肘静脉注射非离子型碘对比剂碘海醇(300mgI/ml)80~100mlꎬ注射速率4ml/sꎬ分别于25~35s(皮质期)和80~100s(实质期)进行扫描ꎬ扫描范围自膈顶至双肾下极ꎮMRI检查采用SiemensSensation3.0TMR仪进行扫描ꎬ行常规T1WI㊁T2WI㊁DWI㊁抑脂序列及增强扫描ꎮ增强扫描经静脉注射钆喷酸葡胺(Gd ̄DT ̄PA)0.1mmol/kgꎬ注射速率为3.0ml/sꎮ1.3㊀图像分析将原始图像传至工作站ꎬ行MPR㊁CPR及MIP等处理ꎮ由2名高年资影像诊断医师采用盲法共同阅片ꎬ意见不同时经协商达成一致ꎮ2㊀结果㊀㊀本组MA4例ꎬ右肾1例ꎬ左肾3例ꎻ呈类圆形或椭圆形㊁境界清楚ꎻ病灶最大径约0.5~8cmꎻCT表现:1例呈以囊性为主的囊实性肿块ꎬ其内可见多发分隔ꎻ3例肿块呈实性ꎬ其中1例实性肿块中可见多发斑点状钙化ꎻ增强扫描4例肿块实性成分呈轻中度渐进性强化ꎬ囊变区无强化ꎮMRI表现:本组2例行MRI检查ꎬ1例病灶以囊性为主的囊实性肿块ꎬT1WI呈低信号ꎬT2WI呈高信号ꎬ并可见多发分隔ꎻ1例病灶信号强度均匀ꎬT1WI呈稍高信号ꎬT2WI呈稍低信号(图1Aꎬ1B)ꎮ2例病灶DWI均呈高信号ꎬADC为低信号(图1Cꎬ1D)ꎻ增强扫描强化方式与CT相似ꎬ表现为渐进性强化ꎬ病灶各期信号强度均低于肾皮质(图1Eꎬ1G)ꎮ本组RO6例ꎬ位于右肾4例ꎬ左肾2例ꎻ呈圆形或类圆形㊁境界清楚ꎻ病灶最大径约2.5~9 3cmꎻCT平扫密度欠均匀ꎬ呈等密度4例ꎬ稍高密度2例ꎬ其中2例较大病灶内见中央瘢痕ꎻ6例病灶中均未见囊变㊁坏死㊁出血和钙化ꎻ增强扫描皮质期明显强化ꎬ3例病灶强化程度高于肾皮质ꎬ3例低于肾皮质ꎬ其中1例病灶内见中心血管影㊁2例较大病灶内见中央瘢痕及轮辐状强化(图2A~2C)ꎻ4例病灶在实质期强化程度有所减低ꎬ另2例病灶边缘皮质期呈结节状㊁斑片状强化ꎬ实质期病灶内部强化较皮质期明显ꎻ2例中央瘢痕在实质期可见轻度强化ꎮ本组RL3例ꎬ右肾2例ꎬ左肾1例ꎻ2例呈圆形㊁1例呈椭圆形ꎬ境界清楚ꎻ病灶最大径约2.5~5 8cmꎻCT平扫呈稍高密度㊁密度均匀ꎬ其中1例肿块内可见斑点状钙化ꎻ增强扫描皮质期呈明显强化㊁2例肿块内可见多发迂曲血管影ꎬ实质期2例肿块强化范围增大且趋向均匀㊁强化程度未见减退ꎬ另1例肿块强化稍减低㊁但密度趋向均匀ꎮ本组CN2例ꎬ均位于右肾上极ꎬ1例呈圆形㊁1例呈椭圆形ꎬ境界清楚ꎻ病灶最大径约5.1~9 4cmꎻCT平扫表现为肾实质内囊性病灶ꎬ其内可见多发分隔呈多囊状ꎬ邻近肾组织受压ꎻ增强扫描2例肿块囊壁及囊内分隔可见轻度强化ꎬ分隔均匀㊁光整ꎬ无明显壁结节ꎬ囊性成分未见强化(图3A~3C)ꎬ其中1例肿块在皮质期可见迂曲小血管影ꎮ本组SFT1例ꎬ位于右肾盂ꎬ最大径5.2cmꎬCT平扫呈等密度均匀肿块ꎬ增强扫描皮质期肿块呈中度不均匀强化ꎬ肿块内可见多发迂曲血管影ꎬ实质期肿块强化程度增加㊁且趋向均匀ꎻ右肾盂无明显积水扩张ꎮ3㊀讨论3.1㊀后肾腺瘤(MA)MA是一种起源于后肾胚基的肾脏罕见良性肿瘤ꎬ任何年龄均可发病ꎬ但发病高峰年龄为50~60岁ꎬ以女性多见ꎮMA通常无明显临床症状ꎬ多为偶然发现ꎬ部分患者可出现腹痛及血尿等症状[1]ꎬ少数患者可出现相对特征性的红细胞增多症ꎮ本组仅1例患者尿隐血阳性ꎬ其余为无症状体检发现ꎮ大体病理:肿瘤多位于皮质区ꎬ呈圆形或类圆形ꎬ边界清ꎻ切面为灰白或棕黄色ꎬ质较软或韧ꎬ可伴有囊变㊁坏死㊁局灶性出血及钙化等ꎻ光镜下肿瘤细胞均匀一致ꎬ胞浆少而异形性不明显ꎬ核分裂像罕见ꎬ其中肿瘤细胞排列呈 花蕾 状或肾小球样结构较具特征性[2]ꎮ免疫组织化学WT1㊁Vim㊁CD57㊁AE1/AE3㊁CK7多呈阳性ꎬCD10㊁NSE㊁CD56多呈阴性ꎮ本组4例大体病理(图1H)㊁免疫组织化学与文献报道一致ꎬ病理学表现符合典型MA表现ꎮMA主要影像表现有:1)CT平扫表现为单侧肾脏受累ꎬ边缘清晰ꎬ呈类圆形或椭圆形ꎬ呈等㊁稍低或稍高密度ꎬ密度均匀或不均匀ꎬ可见出血㊁坏死㊁囊变及钙化ꎻ2)MRI9522图1㊀女ꎬ43岁ꎮ左肾后肾腺瘤ꎮ图1A~1DMRI(图1AT1WIꎮ图1BT2WIꎮ图1CDWIꎮ图1DADC):病灶信号均匀ꎬT1WI呈稍高信号ꎬT2WI呈等稍低信号ꎬDWI呈均一高信号ꎬADC值低ꎬ提示肿瘤细胞密集ꎬ水分子弥散受限ꎮ图1E~1GCT平扫+增强:病灶为实性肿块ꎬ平扫呈等密度ꎬ密度均匀ꎬ增强后边界清楚ꎬ呈渐进性均匀强化ꎬ各期密度均低于正常肾皮质ꎮ图1H镜下肿瘤细胞小㊁致密排列ꎬ呈腺泡状㊁乳头状排列ꎬ局部伴出芽生长(HE)㊀图2㊀男ꎬ58岁ꎮ右肾嗜酸细胞腺瘤ꎮ图2A平扫病灶呈等密度㊁CT值40HUꎬ中央见低密度疤痕ꎮ图2B增强后皮质期明显不均匀强化㊁CT值105HUꎬ中央瘢痕(白箭头)未见明显强化ꎮ图2C实质期病灶强化程度稍减低㊁密度趋向均匀ꎬCT值96HUꎬ可见轮辐状强化ꎬ中央瘢痕呈轻度强化ꎮ图2D镜下肿瘤细胞形态一致ꎬ胞浆内充满嗜酸性颗粒ꎬ瘤细胞呈腺泡状及腺管状ꎬ中央可见纤维化瘢痕(HE)㊀图3㊀女ꎬ66岁ꎮ右肾囊性肾瘤ꎮ图3A平扫病灶呈低密度ꎬ内可见多发分隔ꎮ图3B~3C增强扫描皮质期㊁实质期病灶囊壁及囊内分隔呈轻度强化ꎬ囊性部分无明显强化ꎮ图3D镜下见多个扩张囊腔ꎬ囊腔内衬扁平㊁立方及鞋钉样上皮ꎬ纤维间隔中见类似卵巢间质的细胞ꎬ局部可见簇状分布的肾小管(HE)平扫:肿块T1WI多呈等㊁低或稍高信号ꎬT2WI上呈等㊁稍低或稍高信号ꎬ肿块信号不均ꎬ囊变㊁坏死区呈更长T1㊁更长T2信号ꎬ出血呈短T1信号ꎬ低信号假包膜可见ꎻ3)DWI病灶呈高信号ꎬADC值低ꎬ这与MA肿瘤细胞较小且紧密排列相关ꎬ在一定程度上反映了其病理基础[3]ꎻ4)CT和MRI增强扫描实性部分呈持续性或渐进性轻中度强化ꎬ囊性部分无强化ꎻ本组4例增强扫描实性成分呈渐进性强化ꎬ与文献报道一致ꎮ3.2㊀嗜酸细胞腺瘤(RO)RO是一种起源于肾集合管上皮闰细胞的少见良性肿瘤ꎻ发病年龄多在60岁以上ꎬ男性较女性多见ꎻ通常无临床症状ꎬ少数患者可表现为有腰痛㊁血尿或腹部包块ꎻRO约95%为单发ꎬ5%为多发ꎬ少数可合并血管平滑肌脂肪瘤㊁肾癌等其他肿瘤ꎬ本组病例平均年龄52.8岁ꎬ绝大多数以无症状体检偶然发现ꎬ均为单侧单发病灶ꎬ均未合并其他肾脏肿瘤ꎮRO大体标本边界清楚ꎬ切面红褐色或褐色ꎮ光镜下肿瘤由大量形态一致的细胞构成ꎬ瘤细胞具有丰富的嗜酸性颗粒ꎬ核分裂相罕见(图2D)ꎻ肿瘤细胞呈巢状或实片状ꎬ而不是多见于肾细胞癌的乳头状和肉瘤状结构ꎮ总结分析本组RO的CT表现如下:1)病灶多位于肾皮质ꎬ突出肾轮廓之外㊁边界清楚ꎻCT平扫多呈等或略高密度ꎬ较大肿瘤中央可见不规0622则低密度区ꎻ2)RO是富血供肿瘤ꎬ刘禄明等[4]认为RO增强扫描皮质期可明显强化ꎬ强化幅度可进一步增加持续至肾实质期ꎬ也可于肾实质期减低ꎻ本组6例病灶在皮质期明显强化ꎬ其中4例在肾实质期强化程度减低ꎬ但仍高于肾髓质ꎻ另2例表现出渐进性强化特点ꎻ3)增强扫描较大的病灶中可见中央瘢痕及特征性轮辐状强化ꎻ本组2例病灶增强后出现轮辐状强化ꎬ且在病理大体标本均可见中央瘢痕ꎬ直径均大于4cmꎻ4)反转强化ꎬ有关文献[5 ̄6]指出增强后病灶内低密度区或中央瘢痕在实质期出现强化翻转ꎬ本组4例病灶出现此征象ꎬ其病理基础可能是高或等密度区为肿瘤细胞丰富区ꎬ低密度区为黏液伴纤维血管增生区ꎬ故随着时间延长ꎬ低密度区可出现强化ꎬ导致强化翻转ꎮ3.3㊀平滑肌瘤(RL)RL是一种罕见的肾脏良性肿瘤ꎬ占所有肾肿瘤的0.18%ꎬ好发于女性ꎬ发病年龄40~45岁[7]ꎮRL起源于肾脏内含有平滑肌组织细胞的部位ꎬ但文献报道肾包膜下来源约占53%ꎬ包膜来源37%ꎬ肾盂来源10%ꎻ患者多无临床症状ꎬ偶见瘤体较大时ꎬ可触及包块ꎬ有腰痛㊁血尿等[8]ꎮ本组3例均为女性ꎬ平均年龄43.6岁ꎬ无症状体检发现ꎮRL大体标本呈边界清楚的实性肿块ꎬ切面呈灰白或灰红色ꎬ质韧ꎬ包膜或假包膜完整ꎻ可见囊变及钙化ꎮ光镜下见平滑肌瘤细胞呈梭形ꎬ胞浆红ꎬ细胞核呈梭形ꎬ少分裂相ꎬ多呈交错束状排列排列ꎮ免疫组织化学多表现为Vim㊁SMA及平滑肌抗体阳性ꎬS ̄100蛋白㊁细胞角蛋白阴性ꎮRL的主要CT表现如下:1)平扫肿块呈均匀稍高密度为RL较有特征性的表现[9]ꎻ本组中3例肿块呈稍高密度ꎬ可能与肿瘤细胞排列紧密及肿瘤内的纤维间质有关ꎻ2)肿瘤钙化常见ꎬ本组有2例肿块内可见斑点状钙化ꎻ3)有文献[10]报道ꎬRL增强扫描呈均匀延迟强化ꎬ但各期强化程度均低于正常肾皮质ꎻ本组3例肿块在皮质期明显强化ꎬ其中2例肿块实质期进一步持续强化ꎬ另1例肿块实质期强化稍减低㊁但密度趋向均匀ꎬ与文献报道不一致ꎬ考虑为本病例相对少见ꎬ统计学差异所致ꎮ3.4㊀囊性肾瘤(CN)CN是一种少见的肾良性囊肿性病变ꎬ占原发性肾肿瘤的2.4%ꎮ目前多认为是由肾集合小管先天性发育不全和肾小管囊性扩张所致ꎮ该病以40~60岁女性多见ꎮ临床多无特异性症状ꎬ多数是在常规体检中发现或出现泌尿系感染㊁血尿等症状就诊ꎮCN切面呈单发多房囊性肿块ꎬ有局限性完整包膜ꎬ多个大小不一㊁互不相通的囊腔聚集ꎻ囊壁薄㊁局部壁可稍厚ꎻ囊内含浆液性液体ꎻ囊内间隔厚薄较一致ꎬ为成熟的纤维组织ꎬ纤维间隔成分类似于卵巢间质(图3D)ꎬ可呈水肿或黏液样ꎮCN的CT主要表现如下:1)发生于单侧肾脏ꎬ肿块多位于肾上极ꎬ平扫为边界清楚的多房囊性肿块ꎬ囊壁及分隔厚度较均匀㊁光整ꎬ未见壁结节ꎻ2)少数CN患者的肿块可有钙化[11]ꎬ本组有l例肿块可见点状钙化ꎻ3)文献报道ꎬCN囊壁及分隔均呈轻度至中度强化ꎬ随着时间的延迟强化程度逐渐增加ꎬ而囊性部分始终无强化[12 ̄13]ꎬ本组2例肿块强化方式与文献报道一致ꎻ其中1例肿块内可见迂曲小血管ꎬ术后病理证实为肿块供血动脉ꎬ此表现文献报道少见ꎮ3.5㊀孤立性纤维瘤(SFT)SFT是一种罕见的梭形细胞肿瘤ꎬ起源于一种CD34阳性的树突状间叶细胞ꎬ生物学特征为良性或低度恶性ꎮSFT可发生于任何年龄ꎬ发病高峰年龄为40~60岁ꎬ无明显性别差异ꎮ发生于肾脏的SFT缺乏特异性临床表现ꎬ肿瘤较大时以腰痛伴肉眼血尿多见ꎮ肾SFT的大体标本一般为圆形或类圆形ꎬ边界清楚ꎬ大部分可见包膜ꎬ切面呈灰白或灰黄色ꎬ常有编织状㊁漩涡状外观ꎮ镜下瘤细胞境界清晰ꎬ主要为梭形ꎬ细胞密集区和细胞稀疏区交替或混杂排列ꎬ稀疏区见大量胶原纤维ꎬ其内可见大量薄壁血管及黏液样变ꎮ免疫组化对确诊SFT极为重要ꎬ主要标志物为CD34㊁Vim㊁CD99㊁Bcl ̄2阳性ꎬ而S ̄100㊁CK一般为阴性ꎮ肾SFT的CT表现如下:1)平扫多为孤立性㊁境界清楚㊁圆形或椭圆形的等密度肿块ꎻ2)肿瘤内部密度均匀或不均匀ꎬ较大肿块内部可见坏死ꎬ可能是由于肿瘤细胞及间质的排列方式相对致密ꎬ肿块中心供血不足而发生坏死ꎻ3)CT增强扫描皮质期肿块明显不均匀强化ꎬ其内常可见粗大的供血血管ꎬ实质期肿块进一步持续强化㊁密度趋向均匀ꎮ本组1例CT平扫见右肾盂区椭圆形㊁边界清楚㊁等密度软组织肿块影ꎻ增强扫描肿块皮质期呈明显均匀强化ꎬ可见粗大的肾动脉供血ꎬ实质期肿块进一步强化ꎬ与文献报道一致ꎮ综上所述ꎬ肾脏罕少见良性肿瘤有一些特征性的CT㊁MRI表现ꎬ术前需认真分析影像资料可以帮助临床医师选择合适的手术方式ꎬ从避免不必要的肾脏根治性切除ꎮ参考文献:1622[1]ZhuQꎬZhuWꎬWuJꎬetal.TheclinicalandCTimagingfea ̄turesofmetanephricadenoma[J].ActaRadiolꎬ2014ꎬ55(2):231 ̄238.[2]TorricelliFCMꎬMarchiniGSꎬCamposRSMꎬetal.MetanephricAdenoma:clinicalꎬimagingꎬandHistologicalfindings[J].Clinicsꎬ2011ꎬ66(2):359 ̄361.[3]刘君凤ꎬ张煊赫ꎬ王海屹ꎬ等.成人后肾腺瘤的MRI特征[J].中华放射学杂志ꎬ2017ꎬ51(9):673 ̄676. [4]刘禄明ꎬ刘芳ꎬ郑雷ꎬ等.肾嗜酸细胞腺瘤的CTꎬMRI表现[J].医学影像学杂志ꎬ2016ꎬ26(9):1659 ̄1662. [5]段娜ꎬ李庆祝ꎬ周长玉ꎬ等.肾嗜酸细胞腺瘤和肾嫌色细胞癌的MRI特征及鉴别诊断[J].医学影像学杂志ꎬ2018ꎬ28(2):263 ̄266.[6]KimJIꎬChoJYꎬMoonKCꎬetal.Segmentalenhancementinver ̄sionatbiphasicmultidetectorCT:characteristicfindingofsmallrenaloncocytoma[J].Radiologyꎬ2009ꎬ252(2):441 ̄448. [7]GuptaSꎬJimenezREꎬFolpeALꎬetal.RenalLeiomyomaandLeiomyosarcoma[J].AmJSurgPatholꎬ2016ꎬ40(11):1557 ̄1563.[8]GorenMRꎬErbayGꎬOzerCꎬetal.Bilateralrenalleiomyomawith5yearfollow ̄up:Casereport[J].CanUrolAssocJꎬ2015ꎬ9(9 ̄10):734.[9]OnurMRꎬAkinMMandOnurAR.Renalleiomyoma:Ultra ̄sonographyandcomputedtomographyfeatureswithhistopatholog ̄iccorrelation[J].EurasianJMedꎬ2013ꎬ45(3):214 ̄217. [10]丛振杰ꎬ殷薇薇ꎬ姜茂竹ꎬ等.肾平滑肌瘤六例的影像学表现[J].中华解剖与临床杂志ꎬ2018ꎬ23(1):33 ̄38. [11]BagleyJEꎬBerryJLandMcMurrianK.Casereport:Multimodal ̄ityimagingofacysticnephroma[J].RadiolTechnolꎬ2013ꎬ84(6):559 ̄566.[12]郑吟诗.MSCT对囊性肾瘤的诊断价值[J].实用放射学杂志ꎬ2016ꎬ32(12):1909 ̄1911.[13]赵金坤ꎬ叶兆祥ꎬ白人驹ꎬ等.囊性肾瘤和多房囊性肾癌的CT鉴别诊断[J].中华肿瘤杂志ꎬ2015ꎬ37(11):845 ̄849.(收稿日期:2020 ̄03 ̄10)(上接2247页)[6]ShirabeKꎬAishimaSꎬTaketomiAꎬetal.Prognosticimportanceofthegrossclassificationofhepatocellularcarcinomainlivingdo ̄nor ̄relatedlivertransplantation.[J].BritishJournalofSurgeryꎬ2011ꎬ98(2):261 ̄267.[7]LimSꎬKimYKꎬParkHJꎬetal.Infiltrativehepatocellularcarci ̄nomaongadoxeticacid ̄enhancedanddiffusion ̄weightedMRIat3.0T[J].JMagnResonImagingꎬ2014ꎬ39(5):1238 ̄1245. [8]LeeYJꎬLeeJMꎬLeeJSꎬetal.Hepatocellularcarcinoma:diag ̄nosticperformanceofmultidetectorCTandMRimaging ̄asystem ̄aticreviewandmeta ̄analysis[J].Radiologyꎬ2015ꎬ275(1):97 ̄109.[9]KieransASꎬKangSKꎬRosenkrantzAB.Thediagnosticperform ̄anceofdynamiccontrast ̄enhancedMRimagingforcetectionofsmallhepatocellularcarcinomameasuringupto2cm:ameta ̄a ̄nalysis[J].Radiologyꎬ2015ꎬ278(1):82 ̄86.[10]中华医学会放射学分会腹部学组.肝胆特异性MRI对比剂钆塞酸二钠临床应用专家共识[J].中华放射学杂志ꎬ2016ꎬ50(9):641 ̄646.[11]梁波.普美显在肝局灶性结节增生与肝细胞肝癌鉴别诊断中的价值[J].医学影像学杂志ꎬ2015ꎬ25(12):2175 ̄2179. [12]曹迪ꎬ黄仲奎ꎬ李涛ꎬ等.钆塞酸二钠肝脏MRI多期增强扫描各期相图像质量的对比研究[J].实用放射学杂志ꎬ2016ꎬ32(11):1785 ̄1788.[13]黄召弟ꎬ向颖ꎬ孟祥水ꎬ等.肝细胞癌MRI延迟强化特征与纤维组织分布的关系[J].中华放射学杂志ꎬ2017ꎬ51(3):183 ̄187.[14]LimSꎬKimYKꎬParkHJꎬetal.Infiltrativehepatocellularcarci ̄nomaongadoxeticacid ̄enhancedanddiffusion ̄weightedMRIat3.0T[J].JMagnResonImagingꎬ2014ꎬ39(5):1238 ̄1245. [15]许永生ꎬ刘海峰ꎬ黎金葵ꎬ等.Gd ̄EOB ̄DTPA增强MRI鉴别肝脏良恶性病灶的临床应用价值[J].磁共振成像ꎬ2018ꎬ9(7):506 ̄511.(收稿日期:2019 ̄11 ̄20)2622。
影像组学在良恶性肾肿瘤鉴别诊断、病理分级及治疗反应预测中的应用进展陈波,左毅刚,王海峰,付什,谭智勇,李宁昆明医科大学第二附属医院泌尿外科,昆明650101摘要:影像组学利用人工智能将传统影像学图像进行数据化处理,以此获得更深层次的信息。
影像组学在肿瘤的诊断、治疗及预后方面发挥了较大优势,促进了精准医疗的发展。
影像组学可用于肾肿瘤良恶性的鉴别、预测病理分级和预测肾恶性肿瘤药物治疗效果。
影像组学不仅在肾嗜酸细胞瘤和乏脂肪血管平滑肌脂肪瘤与肾细胞癌的鉴别有很好的区分准确度,而且能利用术前图像预测肾恶性肿瘤病理分级,以及利用影像组学评估对药物的治疗反应,这些对疾病的诊疗有重要意义。
关键词:影像组学;人工智能;机器学习;纹理特征;肾肿瘤doi:10.3969/j.issn.1002-266X.2023.14.026中图分类号:R737.1 文献标志码:A 文章编号:1002-266X(2023)14-0106-04肾恶性肿瘤是泌尿系统病死率最高的肿瘤,一般位置较深,不易被发现,早期诊断是治疗成功的关键。
目前尚缺乏精准、无创、高效的方法来进行诊断和预测。
影像组学是指从CT、MRI等影像学资料的断层图像中高通量地提取定量特征,包括病灶大小、形状、纹理、边缘和功能等信息,将其转化为计算机可处理的信息,加以数学算法从而获得更深层次、更多元化的数据[1]。
影像组学的流程包括影像数据的获取、肿瘤区域的标定、肿瘤区域的分割、特征的提取和量化、分类和预测5个主要步骤[2],其核心是提取影像深层次的数据用于定量分析感兴趣区(ROI)的属性特征,并用各种数学方法提供信息,从而量化肿瘤异质性。
影像组学能将肉眼无法看见的影像信息提取并呈现,从而降低漏诊、误诊率,还能够辅助优化诊疗方案,在多种肿瘤的诊疗和预后预测方面均有良好的效果。
现将影像组学在肾肿瘤良恶性鉴别、病理分级预测以及治疗反应预测中的应用进展综述如下,旨在为临床诊断和治疗提供参考。