滴定分析的计算
- 格式:ppt
- 大小:1.68 MB
- 文档页数:17





.6 滴定分析的计算4.6.1 原料药含量测定结果计算原料药含量一般用百分含量(g/g)来表示。
例如:对氨基水杨酸钠含量测定取样品约0.4g,精密称定,用水18ml和盐酸溶液(1→2)15ml溶解,用亚硝酸钠标准液(L)滴定,每1ml的亚硝酸钠标准液(L)相当于的无水对氨基水杨酸钠。
假设取样量0.4326g,亚硝酸钠标准液浓度为L,终点时消耗,计算其含量(干燥失重%)。
实验测得的量含量=───────×100%供试品量已知,实验测得的量=VFT 供试品的量=W/N标准为终点时消耗标准液的体积(ml)其中V标准W 为称样量F 为浓度因数T 为滴定度N 为稀释倍数稀释倍数的意义为:第一次取样量为最后测定用供试品量的倍数。
原料药中一般为1。
原料药含量计算公式V标准×F×T×N V标准×C实际×T×N含量=────────×100%= ──────────×100%W W×C理论一般原料药含量是以干品计算,则原料药含量计算公式为:V标准×C实际×T×N含量=─────────────────×100%W×C理论×(1-干燥失重百分数)×××1则对氨基水杨酸钠含量=─────────────×100%=%。
××(1-%)4.6.2 液体制剂的含量测定结果计算液体制剂含量一般以相当于标示量的百分数表示。
标示量对固体制剂,即每一个单元制剂中所含药品的规定量;对液体制剂,最常用的表示方法为:每1ml中含有药物的规定量,或者本制剂的规定浓度。
例如:氯化钾注射液,规格为10ml:1g,它的标示量为0.1g或10%。
其含量测定方法;精密量取本品10ml,置100ml量瓶中,加水至刻度,摇匀,精密量取10ml,加水40ml,加糊精溶液(1→50)5ml,与指示剂5~8滴,用硝酸银标准液(L)滴定即得。




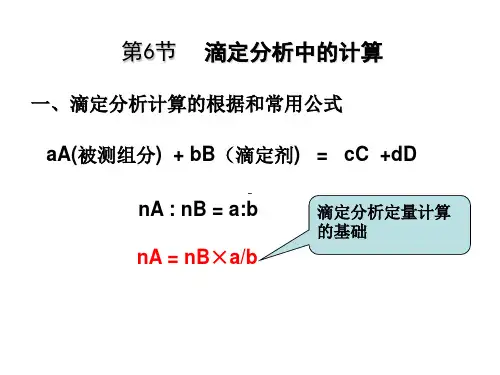
滴定分析中的计算一、滴定分析计算的依据设标准溶液(滴定剂)中的溶质B与被滴定物质(被测组分)A之间的化学反应为:aA + bB = cC + dD反应定量完成后达到计量点时,b mol的B物质恰与a mol的A物质完全作用,生成了c mol的C物质和d mol的D物质。
完全反应反应前和反应后物质的量相等。
溶液稀释前后,其中溶质的物质的量不会改变C浓V浓=C稀V稀二、滴定分析法计算实例1.标准溶液的配制(直接法)、稀释与增浓的计算基本公式:例一已知浓盐酸的密度为1.19g.mL-1,其中HCl含量约为37%。
计算:(1) 每升浓盐酸中所含HCl的物质的量和浓盐酸的浓度。
(2) 欲配制浓度为0.10mol. L-1的稀盐酸5000mL,需量取上述浓盐酸多少毫升?已知:M HCl=36.46 g.mol-1C 浓⨯V 浓=C 稀⨯V 稀12⨯ V 浓=0.10⨯5000V 浓=41,67ml例2:现有HCl 液(0.09760mol.L -1)4800mL, 欲使其浓度为0.1000mol.L -1,问应加入HCl 液(0.5000mol.L -1)多少?(C 原⨯4800)+0.5000⨯V 加=0.1000⨯(4800+V 加)V 加=28.8ml2. 标定溶液浓度的有关计算基本公式:例1:用Na2CO3标定用25mL 左右滴定液,问应称取基准Na2CO3多少克?已知: M (Na2CO3)=106.02/2=53.01g.mol-12HCl + Na2CO3 = 2 NaCl +CO2 +H2OC HCl⨯V/1000=m/M(Na2CO3)称取邻苯二甲酸氢钾(KHP)基准物质0.4925克,标定NaOH溶液,终点时用去NaOH溶液23.50mL,求NaOH溶液的浓度。
M例2:要求在标定时用去0.10 mol.L-1 NaOH溶液20~25mL,问应称取基准试剂邻苯二甲酸氢钾(KHP)多少克?,如果改用草酸(H2C2O4.2H2O)作基准物质,又应称取多少克?从计算结果能看出什么结论?已知:M(KHP)=204.22 g.mol-1,M(H2C2O4.2H2O)=126.07 /2=63.035g.mol-1解:以邻苯二甲酸氢钾(KHP)为基准物质,其滴定反应为:KHP + NaOH = KNaP + H2O即C NaOH⨯V/1000=m/M(KHP)M= C NaOH⨯V ⨯M(KHP)/1000=0.10⨯20⨯204.22=0.408 V=20 m KHP=0.10 ⨯20⨯204.22 /1000=0.40gV=25 m KHP=0.10 ⨯25⨯204.22/1000 =0.50g因此,以邻苯二甲酸氢钾(KHP)的称量范围为0.40~0.50g若改用草酸(H2C2O4.2H2O)为基准物质,此时的滴定反应为:H2C2O4 + 2NaOH = Na2C2O4 + 2H2O即V=20 m H2C2O4.2H2O =.10 ⨯20⨯126.07/2000=0.13gV=25 m H2C2O4.2H2O =0.10 ⨯25⨯126.07/21000=0.16g因此,草酸(H2C2O4.2H2O)的称量范围为0. 13~0.16g结论由于邻苯二甲酸氢钾(KHP)的摩尔质量较大,草酸(H2C2O4.2H2O)的摩尔质量较小,且又是二元酸,所以在标定同一浓度的NaOH溶液时,后者的称量范围要小得多。