(全程复习方略)(浙江专用)版高考化学 课时提能演练十三 51原子结构 原子核外电子排布-2019年教学文档
- 格式:doc
- 大小:69.01 KB
- 文档页数:8

(全程复习方略)(浙江专用)版高考化学课时提能演练十四52元素周期律元素周期表〔45分钟 100分〕一、选择题(此题包括10小题,每题6分,共60分)1.元素在周期表中的位置,反映了元素的原子结构和元素的性质,以下说法正确的选项是( )A.同一元素不能够既表现金属性,又表现非金属性B.第3周期元素的最高正化合价等于它所处的主族序数C.短周期元素构成离子后,最外层电子都到达8电子动摇结构D.同一主族的元素的原子,最外层电子数相反,化学性质完全相反2.(2021·天津高考)以下有关原子结构及元素周期律的表达正确的选项是( )A.第ⅠA族元素铯的两种同位素137Cs比133Cs多4个质子B.同周期元素(除0族元素外)从左到右,原子半径逐渐减小C.第ⅦA族元素从上到下,其氢化物的动摇性逐渐增强D.同主族元素从上到下,单质的熔点逐渐降低3.(2021·福建高考)依据元素周期表及元素周期律,以下推断正确的选项是( )A.H3BO3的酸性比H2CO3的强B.Mg(OH)2的碱性比Be(OH)2的强C.HCl、HBr、 HI的热动摇性依次增强D.假定M+和R2-的核外电子层结构相反,那么原子序数:R>M4.(2021·舟山模拟)室内污染已成为危害人们身体安康的一大要素,我国规则,居室装修用石材的放射性元素含量用226 88Ra作为规范。
以下有关表达中不正确的选项是( )A.Ra元素位于元素周期表中第6周期B.元素Ra与元素Ca为同族元素C.一个226 88Ra原子中含有138个中子D.元素Ra应为金属元素5.(易错题)以下判别中一定正确的选项是( )A.假定A2+2D-===2A-+D2,那么恢复性:D->A-B.假定R2+和M+的电子层结构相反,那么碱性:ROH>MOHC.假定X2、Y2都是气态单质,且酸性HX>HY,那么非金属性X>YD.假定M、N是同主族元素,且原子序数:M>N,那么非金属性:M>N6.A、B、C为三种短周期元素,A、B在同周期,A、C的最低价离子区分为A2-和C-,B2+和C-具有相反的电子层结构。
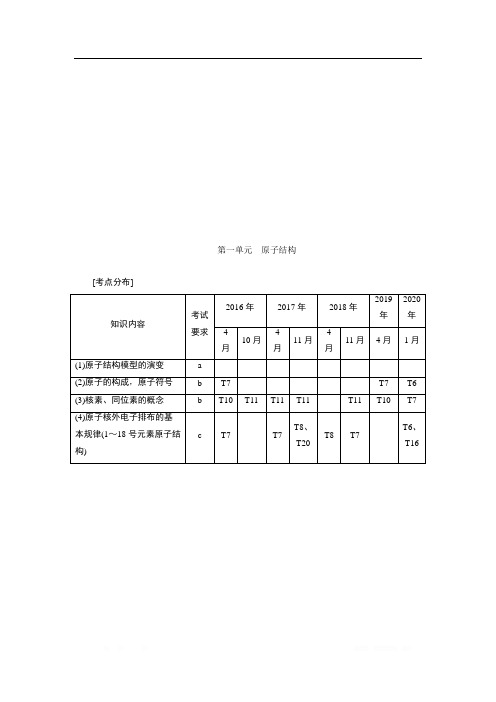
第一单元原子结构[考点分布]知识内容考试要求2016年2017年2018年2019年2020年4月10月4月11月4月11月4月1月(1)原子结构模型的演变 a(2)原子的构成,原子符号 b T7 T7 T6(3)核素、同位素的概念 b T10 T11 T11 T11 T11 T10 T7(4)原子核外电子排布的基本规律(1~18号元素原子结构) c T7 T7T8、T20T8 T7T6、T16原子结构 原子核外电子排布一、原子结构1.原子结构模型的演变道尔顿原子结构模型→汤姆生原子结构模型→卢瑟福原子结构模型→玻尔原子结构模型→电子云模型2.构成原子的微粒及作用原子(A Z X)⎩⎪⎨⎪⎧原子核⎩⎪⎨⎪⎧质子(Z 个)——决定元素的种类中子[(A -Z )个]——在质子数确定后决定原子种类,即同位素种类核外电子(Z 个)——最外层电子数决定元素 的化学性质3.微粒之间的关系(1)质子数(Z )=核电荷数=核外电子数。
(2)质量数(A )=质子数(Z )+中子数(N )。
(3)阳离子的核外电子数=质子数-阳离子所带的电荷数。
(4)阴离子的核外电子数=质子数+阴离子所带的电荷数。
4.一个信息丰富的符号规避4个易失分点(1)任何微粒中,质量数=质子数+中子数,但质子数与电子数不一定相等,如阴、阳离子中。
(2)有质子的微粒不一定有中子,如1H;有质子的微粒不一定有电子,如H+。
(3)质子数相同的微粒不一定属于同一种元素,如F与OH-。
(4)核外电子数相同的微粒,其质子数不一定相同,如Al3+与Na+、F-,NH+4与OH-等。
二、原子核外电子排布1.电子层的表示方法及能量变化2.核外电子排布规律(1)能量最低原则核外电子总是先排布在能量最低的电子层里,然后再按照由里向外的顺序依次排布在能量逐渐升高的电子层里。
(2)分层排布原则①每层最多容纳的电子数为2n2个。
②最外层不超过8个(K层为最外层时不超过2个)。

(全程复习方略)(浙江专用)版高考化学综合评估检测三专题1~13〔90分钟 100分〕第一卷(选择题共48分)一、选择题(此题包括16小题,每题3分,共48分)1.(2021·金华模拟)以N A表示阿伏加德罗常数,以下说法中正确的选项是( )①58.5 g氯化钠固体中含有N A个氯化钠分子;②5.6 g铁粉与酸反响失掉的电子数一定为0.3 N A;③4.5 g SiO2晶体中含有的共价键数为0.3 N A;④规范状况下,11.2 L SO3所含的分子数为0.5 N A;⑤1 mol Fe Cl3完全水解转化为氢氧化铁胶体后生成N A个胶粒;⑥常温下,42 g C2H4和C4H8的混合物中含有的碳原子数为3 N AA.⑤⑥B.④⑤⑥C.③⑥D.①②③2.以下各组物质仅用蒸馏水不能鉴别出的是( )A.苯、酒精、四氯化碳B.食盐、烧碱、硝酸铵C.蔗糖、硫酸铜粉末、碳酸钙粉末D.氧化铜、二氧化锰、活性炭3.(2021·宁波模拟)以下表达中正确的选项是( )A.稀有气体的晶体中不存在分子间作用力B.次氯酸分子的结构式为H—O—ClC.Na2O和Na2O2所含化学键类型完全相反D.Br2蒸气被木炭吸附时共价键被破坏4.以下各组离子,在指定的环境中一定能少量共存的是( )A.常温下,在c(H+)/c(OH-)=1×1012的溶液中:I-、Cl-、NO-3、Na+B.在能使石蕊变白色的溶液中:Na+、S2-、SO2-4、CO2-3C.在参与铝粉能发生H2的溶液中:NH+4、Na+、NO-3、Cl-D.常温下由水电离出的c(H+)=1×10-12mol·L-1的溶液中:K+、Cl-、NO-3、Na+5.将一定量的钠铝合金置于水中,合金全部溶解,失掉20 mL pH =14 的溶液。
然后用1 mol·L -1的盐酸滴定至沉淀量最大时,消耗盐酸40 mL 。

(全程复习方略)(浙江专用)版高考化学课时提能演练三十一 121生命活动的物质基础④用纯碱(Na2CO3)热溶液洗涤餐具上的油污;⑤氯水使红墨水褪色原理和CH2===CH2使溴的四氯化碳溶液褪色原理相同;⑥压缩天然气和液化石油气的主要成分均属于碳氢化合物。
A.①②③B.②③④⑥C.②④⑤⑥D.③④⑤4.下列有机物在酸性催化条件下发生水解反应,生成两种相对分子质量不同的有机物的是( )A.蔗糖B.麦芽糖C.丙酸乙酯5.(2019·浙江高考样题)下列说法正确的是( )A.油脂、淀粉、蔗糖和葡萄糖在一定条件下都能发生水解反应B.蛋白质是结构复杂的高分子化合物,蛋白质分子中都含有C、H、O、N四种元素C.棉、麻、蚕丝、羊毛及合成纤维完全燃烧都只生成CO2和H2OD.根据分散质粒子的直径大小,分散系可分为溶液、浊液和胶体,浊液的分散质粒子大小介于溶液与胶体之间6.如图是某只含有C、H、O、N的有机物简易球棍模型。
下列关于该有机物的说法错误的是( )A.该有机物的分子式为C3H7O2NB.该有机物名称为α-氨基丙酸C.该有机物能发生加成反应D.该有机物能发生酯化反应7.下列物质中,全部不能与Ag(NH3)2OH溶液发生银镜反应的一组是( )①福尔马林②蚁酸③甲酸乙酯④乙酸甲酯⑤甲酸钠⑥醋酸⑦葡萄糖⑧蔗糖⑨麦芽糖⑩果糖A.①②③④B.④⑥⑧C.⑧⑨⑩D.⑤⑥⑦⑧8.(2019·金华模拟)阿斯巴甜具有清爽的甜味,甜度约为蔗糖的200倍,其结构为:下列有关说法不正确的是( )A.阿斯巴甜属于高分子化合物B.阿斯巴甜可与Na2CO3溶液反应产生CO2C.阿斯巴甜水解产物有两种氨基酸D.阿斯巴甜具有两性9.(易错题)据《自然》杂志报道,在300~400 ℃的高温下,将砂糖(主要成分为蔗糖)等碳水化合物用加热的方法使其形成焦糖与碳之间的“半成品碳”状态,再放进硫酸溶液中高温加热,生成了一种叫“焦糖烯”的物质,其分子式为C36H50O25。

(浙江专用)版高考化学总复习第九单元原子结构与元素周期律训练第九单元原子结构与元素周期律1.原子结构模型的演变:①道尔顿实心球式原子模型②卢瑟福行星运转式原子模型③汤姆生葡萄干面包式原子模型④近代量子力学原子模型⑤玻尔轨道式原子模型。
下列符合历史演变顺序的一组排列是( ) A.①③②⑤④ B.③⑤④②① C.①⑤③②④ D.①③⑤④②解析①19世纪初,英国科学家道尔顿提出近代原子学说,他认为原子是微小的不可分割的实心球体;③1897年,英国科学家汤姆生发现了电子,1904年提出“葡萄干面包式”的原子结构模型;②1911年英国物理学家卢瑟福(汤姆生的学生)提出了带核的原子结构模型;⑤1913年丹麦物理学家波尔(卢瑟福的学生)引入量子论观点,提出电子在一定轨道上运动的原子结构模型;④奥地利物理学家薛定谔提出电子云模型(几率说),为近代量子力学原子模型。
故A项正确。
答案 A 13132. 6C-NMR 可以用于含碳化合物的结构分析。
6C所表示的碳原子( ) A.核外有13个电子B.核内有6个质子,核外有7个电子C.质量数为13,核外电子数为6,核内有7个质子 D.质量数为13,核外电子数为6,核内有7个中子解析元素符号左下角的数字代表原子核内的质子数或者电中性时原子核外的电子数,而左上角的数字则代表原子质量数,而质量数=质子数+中子数,故此题正确选项为D项。
答案 D3.(金华联考)在化学反应中,会发生变化的是( ) A.质子数 B.中子数C.电子数 D.质量数解析元素的性质与原子的最外层电子排布密切相关,发生化学变化时会发生电子的得失或偏移。
答案 C4.下列说法正确的是( )A.原子核都是由质子和中子构成的 B.不同种元素原子的质量数必定不同1617C. 8O和 8O是同种元素的不同核素D.互为同位素的原子,质量数一定相同1解析 1H原子核内就只有一个质子而无中子,故A项错误;不同种元素原子的质子数不1617同,但由于中子数也可能不同,而质量数可能相同,故B项错误; 8O和 8O质子数相同而中子数不同,属于同种氧元素的不同核素,故C项正确;互为同位素的原子,质子数一定相同,而质量数一定不同,故D项错误。

第13讲原子结构化学键1.掌握元素、核素、同位素、相对原子质量、相对分子质量、原子构成、原子核外电子排布的含义。
2.掌握原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。
3.掌握1~18号元素的原子结构示意图的表示方法。
4.了解化学键的定义。
5.了解离子键、共价键的形成。
6.掌握电子式的表示方法。
本部分内容是高考的常考点,高考中常以选择题型出题。
考查原子(离子)的结构及微粒间的数量关系,也常考查对元素、核素、同位素概念的理解以及结合元素周期表的推断等。
【核心素养分析】1.宏观辨识与微观探析:能从离子或原子结构示意图等不同层次认识原子的结构以及核外电子的排布规律,能从宏观和微观相结合的视角分析原子结构与元素性质的关系。
能从不同层次认识分子的构型,并对共价键进行分类,能从宏观和微观相结合的视角分析与解决实际问题。
2.证据推理与模型认知:能运用原子结构模型解释化学现象,揭示现象的本质与规律。
能运用构造原理和能量最低原理揭示元素原子核外电子排布规律。
认识共价键的本质及类型,能多角度、动态地分析分子的空间结构及性质,并运用相关理论解决实际问题。
3.科学态度与社会责任:具有可持续发展意识和绿色化学观念,能对与原子结构有关的社会热点问题做出正确的价值判断。
知识点一原子结构、同位素1.原子结构(1)原子的构成粒子原子A ZZ个——决定元素的种类(A-Z)个在质子数确定后决定原子种类同位素Z个——最外层电子数决定元素的化学性质(2)构成原子或离子的微粒间的数量关系①原子中:质子数(Z)=核电荷数=核外电子数。
②质量数(A)=质子数(Z)+中子数(N)。
③阳离子的核外电子数=质子数-阳离子所带电荷数。
如Mg2+的核外电子数是10。
④阴离子的核外电子数=质子数+阴离子所带电荷数。
如Cl-的核外电子数是18。
(3)一个信息丰富的符号【特别提醒】①原子中不一定都含有中子,如11H中没有中子。
②电子排布完全相同的原子不一定是同一种原子,如互为同位素的各原子。
(全程复习方略)(浙江专用)版高考化学课时提能演练三十112醛羧酸A.CH3COOD,C2H5ODB.CH3COONa,C2H5OD,HDOC.CH3COONa,C2H5OH,HDOD.CH3COONa,C2H5OD,H2O5.(易错题)烯烃与CO和H2在催化剂作用下生成醛的反应叫烯烃的醛化反应。
乙烯的醛化反应为:CH2===CH2+CO+H2―→CH3CH2CHO ,由分子式为C4H8的烯烃进行醛化反应,得到醛的同分异构体数目为( ) A.2种 B.3种 C.4种D.5种6.(2019·宁波模拟)有机物在不同条件下至少可能发生7种不同类型的反应:①取代②加成③消去④氧化⑤酯化⑥加聚⑦缩聚,其中由于分子结构中含有“—OH”而可能发生的反应是( )A.②④⑥⑦B.③④⑤⑥C.②③④⑤D.①③④⑤⑦7.被誉为中国“新四大发明”之一的复方蒿甲醚是第一个由中国发现的全新化学结构的药品,也是目前在国际上获得广泛认可的中国原创药品。
其主要成分是青蒿素(一种从青蒿中分离得到的具有新型化学结构的抗疟药),其结构简式如图所示。
下列有关该有机物的叙述正确的是( )A.该有机物的分子式为C16H22O5B.该有机物不能与NaOH溶液反应C.该有机物分子中含有过氧键,一定条件下具有氧化性D.该有机物易溶于水8.(易错题)某芳香族酯类化合物甲的分子式为C14H10O5,1 mol甲水解后只生成一种产物乙,其物质的量为2 mol,下列说法正确的是( )A.符合上述条件的甲共有3种B.1 mol甲最多可以和3 mol NaOH反应C.乙不能和溴水发生反应D.2 mol乙最多可以和1 mol Na2CO3反应9.(2019·湖州模拟)某有机物甲经氧化后得乙(分子式为C2H3O2Cl),而甲经水解可得丙。
1 mol丙和2 mol乙反应得一种含氯的酯(C6H8O4Cl2),由此推断甲的结构简式为( )C.CH2ClCHO D. HOCH2CH2OH10.(2019·江苏高考)β-紫罗兰酮是存在于玫瑰花、番茄等中的一种天然香料,它经多步反应可合成维生素A1。
浙江2019版化学复习方略 课时提能演练(十三) 5.1原子结构 原子核外电子排布(苏教版)(45分钟 100分)一、选择题(本题包括10小题,每小题6分,共60分)1.(2019·海南高考)13153I 是常规核裂变产物之一,可以通过测定大气或水中 13153I 的含量变化来检测核电站是否发生放射性物质泄漏。
下列有关131 53I 的叙述中错误的是( )A.13153I 的化学性质与12753I 相同 B.13153I 的原子序数为53 C.13153I 的原子核外电子数为78 D.13153I 的原子核内中子数多于质子数2.据国外媒体报道,“火星快车”号和“金星快车”号探测器日前分别在火星和金星大气层中发现了一种非常特殊的气态化合物。
这种化合物的存在不但会导致金星上的温室效应被成倍的放大,而且可能会在火星上也诱发温室效应的产生。
它的结构式为:16O===C===18O 。
下列说法正确的是( )A.16O 与18O 为同种核素B.16O===C===18O 与16O===C===16O 互为同位素C.16O===C===18O 的化学性质与16O===C===16O 的几乎相同D.用16O===C===18O 与Na 162O 2反应生成的氧气中含18O3.下列有关化学用语的表示正确的是( )A.(2019·江苏高考)S 2-的结构示意图为:B.(2019·江苏高考)质子数为53、中子数为78的碘原子:131 53IC. F -的结构示意图:D.由含有2个中子的氢原子与10个中子的氧原子形成的水分子的化学式可表示为:21H 2188O4.最近医学界通过用14C 标记的C 60发现一种C 60的羧酸衍生物,在特定条件下可以通过断裂DNA 抑制艾滋病毒的繁殖,则有关14C 的叙述正确的是( )A.与12C 60的碳原子化学性质不同B.与14N含的中子数相同C.是12C60的同素异形体D.与12C、13C互为同位素5.He可以作为核聚变材料,科学家已经探明月球上有大量的3He存在,以下关于3He的说法正确的是( )①比4He少一个电子②比4He少一个质子③与4He互为同素异形体④3He的质量数为3,所以He元素的相对原子质量为3⑤体积相同、密度相同的3He与HD具有相同的中子数⑥是4He的同位素A.①③B.③⑤C.④⑥D.⑤⑥6.已知X为第3周期元素的原子,该原子要达到8电子稳定结构,则需要的电子数小于其次外层和最内层的电子数之差,且等于最内层电子数的整数倍。
专题七原子结构元素周期律考点过关练考点1原子结构1.(2024浙江1月选考,3,3分)下列表示不正确...的是( )A.中子数为10的氧原子:818OB.SO2的价层电子对互斥(VSEPR)模型:C.用电子式表示KCl的形成过程:D.的名称:2-甲基-4-乙基戊烷答案 D2.(2023浙江1月选考,3,3分)下列化学用语表示正确的是( )A.中子数为18的氯原子:1737ClB.碳的基态原子轨道表示式:C.BF3的空间结构:(平面三角形)D.HCl的形成过程:答案 C3.(2023辽宁,2,3分)下列化学用语或表述正确的是( )A.BeCl2的空间结构:V形B.P4中的共价键类型:非极性键C.基态Ni原子价电子排布式:3d10D.顺-2-丁烯的结构简式:答案 B4.(2023北京,2,3分)下列化学用语或图示表达正确的是( )A.NaCl 的电子式为Na :Cl ····: B.NH 3的VSEPR 模型为C.2p z 电子云图为D.基态24Cr 原子的价层电子轨道表示式为答案 C5.(2023湖南,2,3分)下列化学用语表述错误的是 ( )A.HClO 的电子式:H :O·· ··:Cl ·· ··:B.中子数为10的氧原子:818OC.NH 3分子的VSEPR 模型:D.基态N 原子的价层电子排布图:答案 C 6.(2022浙江6月选考,5,2分)下列表示正确的是 ( )A.乙醛的结构简式:CH 3COHB.2-丁烯的键线式:C.S 2-的结构示意图:D.过氧化钠的电子式:Na +[:O ····:O ····:]2−Na +答案 D7.(2022浙江1月选考,5,2分)下列表示不正确的是 ( )A.乙炔的结构简式:B.KOH 的电子式:K +[:O····:H]- C.乙烷的球棍模型:D.氯离子的结构示意图:答案 C考点2元素周期表与元素周期律8.(2022天津,2,3分)嫦娥5号月球探测器带回的月壤样品的元素分析结果如图,下列有关含量前六位元素的说法正确的是( )A.原子半径:Al<SiB.第一电离能:Mg<CaC.Fe位于元素周期表的p区D.这六种元素中,电负性最大的是O答案 D9.(2022湖北,10,3分)Be2+和Al3+的电荷与半径之比相近,导致两元素性质相似。
(教师用书)化学高考总复习【配套题库】课时提能演练 5-3 化学键(45分钟 100分)一、选择题(本题包括10小题,每小题6分,共60分)1.从化学键的观点看,化学反应的实质是“旧键的断裂,新键的形成”,据此你认为下列变化属于化学变化的是( )①对空气进行降温加压②金刚石变成石墨③NaCl熔化④碘溶于CCl4中⑤HCl溶于水电离出H+和Cl-⑥电解熔融的Al2O3制取AlA.②③⑤B.②⑤⑥C.②⑥D.②③⑤⑥2.短周期元素X、Y、Z所在的周期数依次增大,它们的原子序数之和为20,且Y2-与Z+核外电子层的结构相同。
下列化合物中同时存在极性共价键和非极性共价键的是( )A.Z2YB.X2Y2C.Z2Y2D.ZYX3.下列说法中正确的是( )A.在离子化合物NaOH中,既存在离子键,也存在非极性共价键B.非极性键只存在于双原子的单质分子(如Cl2)中C.原子序数为11与9的元素能够形成离子化合物,该化合物中存在离子键D.NH4HCO3加热时闻到刺激性的气味,在此过程中,只有共价键被破坏4.(2012·南昌模拟)二氯化二硫(S 2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示。
常温下,S2Cl2遇水易水解,并产生能使品红褪色的气体。
下列说法错误的是( )A.S2Cl2为共价化合物B.S2Cl2只含有极性共价键C.S2Cl2与水反应时S—S键和S—Cl键都断裂D.S2Cl2分子中S—S键和S—Cl键是通过共用电子对的相互作用形成的5.固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的电子层结构,电子式如图所示:,下列说法正确的是( )A.NH5属于离子化合物B.NH5属于共价化合物C.NH5只含有离子键D.NH5只含有共价键6.下列化学用语正确的是( )A.I-131:7853IB.Cl-的结构示意图:C.Na2S的电子式:D.乙烯的结构式:CH2=CH27.下列物质按只含离子键、只含共价键、既含离子键又含共价键的顺序排列的是( )A.氯气二氧化碳氢氧化钠B.氯化钠过氧化氢氯化铵C.氯化钠过氧化钠氯化铵D.氯化钠氦气氢氧化钠8.X、Y为两种短周期元素,其原子的最外层电子数分别是1和6,则X、Y两种元素形成的常见化合物或者离子不可能是( )A.只含极性键的共价化合物B.含非极性键的共价化合物C.阴阳离子个数之比为1∶1的离子化合物D.可形成双核离子或者四核离子9.(2012·银川模拟)X、Y、Z、W为四种短周期主族元素,它们在周期表中的位置如图所示。
浙江2019版化学复习方略 课时提能演练(十三) 5.1原子结构 原子核外电子排布(苏教版)(45分钟 100分)一、选择题(本题包括10小题,每小题6分,共60分)1.(2019·海南高考)13153I 是常规核裂变产物之一,可以通过测定大气或水中 13153I 的含量变化来检测核电站是否发生放射性物质泄漏。
下列有关131 53I 的叙述中错误的是( )A.13153I 的化学性质与12753I 相同B.13153I 的原子序数为53C.13153I 的原子核外电子数为78D.13153I 的原子核内中子数多于质子数2.据国外媒体报道,“火星快车”号和“金星快车”号探测器日前分别在火星和金星大气层中发现了一种非常特殊的气态化合物。
这种化合物的存在不但会导致金星上的温室效应被成倍的放大,而且可能会在火星上也诱发温室效应的产生。
它的结构式为:16O===C===18O 。
下列说法正确的是( )A.16O 与18O 为同种核素B.16O===C===18O 与16O===C===16O 互为同位素C.16O===C===18O 的化学性质与16O===C===16O 的几乎相同D.用16O===C===18O 与Na 162O 2反应生成的氧气中含18O3.下列有关化学用语的表示正确的是( )A.(2019·江苏高考)S 2-的结构示意图为:B.(2019·江苏高考)质子数为53、中子数为78的碘原子:131 53IC. F -的结构示意图:D.由含有2个中子的氢原子与10个中子的氧原子形成的水分子的化学式可表示为:21H 2188O4.最近医学界通过用14C 标记的C 60发现一种C 60的羧酸衍生物,在特定条件下可以通过断裂DNA 抑制艾滋病毒的繁殖,则有关14C 的叙述正确的是( )A.与12C 60的碳原子化学性质不同B.与14N含的中子数相同C.是12C60的同素异形体D.与12C、13C互为同位素5.He可以作为核聚变材料,科学家已经探明月球上有大量的3He存在,以下关于3He的说法正确的是( )①比4He少一个电子②比4He少一个质子③与4He互为同素异形体④3He的质量数为3,所以He元素的相对原子质量为3⑤体积相同、密度相同的3He与HD具有相同的中子数⑥是4He的同位素A.①③B.③⑤C.④⑥D.⑤⑥6.已知X为第3周期元素的原子,该原子要达到8电子稳定结构,则需要的电子数小于其次外层和最内层的电子数之差,且等于最内层电子数的整数倍。
下列说法正确的是( )A.X元素最高价氧化物对应的水化物一定是强酸B.X元素的氢化物的化学式一定为H2XC.X的单质一定是良好的半导体材料D.X元素的氧化物一定能与烧碱反应7.(2019·宝鸡模拟)下列叙述中正确的是( )A.两种微粒,若核外电子排布完全相同,则其化学性质一定相同B.凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布C.两原子如果核外电子排布相同,则一定属于同种元素D.阴离子的核外电子排布一定与上一周期稀有气体元素原子的核外电子排布相同8.(易错题)从宏观方面看物质是由元素组成的,从微观方面看物质是由粒子构成的,下列有关说法不正确的是( )A.元素原子的多样性是由构成原子的质子和中子数目引起的B.元素的化学性质主要取决于元素原子的最外层电子数C.只由一种分子构成的物质一定是纯净物D.质子数等于电子数的微粒,可能是一种分子和一种离子9.(2019·嘉兴模拟)简单原子的原子结构可用如图形象地表示:其中·表示质子或电子,表示中子,则下列有关①②③的叙述中正确的组合是a.①②③互为同位素b.①②③互为同素异形体c.①②③是三种化学性质不同的粒子d.①②③具有相同的质量数e.①②③具有相同的质量f.①②③是三种不同的原子A.a、fB.b、cC.d、eD.e、f10.(2019·金华模拟)科学家从化肥厂生产的(NH4)2SO4中检验出组成为N4H4(SO4)2的物质,经测定,该物质易溶于水,在水中以SO2-4和N4H4+4两种离子形式存在,植物的根系极易吸收N4H4+4,但它遇到碱时,会生成一种形似白磷的N4分子。
N4分子不能被植物吸收。
下列有关说法不正确的是( )A.N4和N2互为同素异形体B.14N与14C互为同位素C.N4H4(SO4)2不能与草木灰混合使用D.8NH3+4C5OH===N4+4C5NH2+6H2+4H2O,此反应中每生成5.6 g N4时转移1.2 mol电子二、非选择题(本题包括3小题,共40分)11.(14分)A、B、C、D、E五种短周期元素的原子序数依次增大。
元素A的负一价离子具有和稀有气体He 一样的结构,元素B的最外层电子数是内层电子总数的2倍,元素C是短周期元素中原子半径最大的主族元素,元素D在地壳中的含量位于第二位,元素E与元素B可形成具有正四面体结构的物质。
请回答下列问题:(1)在周期表中,元素B位于第___ 周期第___ 族;A与C形成的离子化合物的化学式为______________;A与C形成的离子化合物与水反应的化学方程式为______________________。
(2)C形成的简单离子的离子结构示意图为______________。
(3)D、E元素形成的化合物可与水反应生成一种沉淀和一种气体,试写出该反应的化学方程式:__________________________________。
(4)单质B与水反应是将B充分利用的措施之一,试写出该反应的化学方程式:____________________________________。
12.(14分)(预测题)A、B、C、D、E、F、G七种短周期主族元素的原子序数依次增大。
A和E最外层电子数相同,短周期主族元素的原子中,E原子的半径最大;B、C和F在周期表中相邻,B、C同周期,C、F同主族,F原子的质子数是C原子质子数的2倍;A和C可形成两种常见的液态化合物X和Y(相对分子质量X<Y);D形成的分子为双原子分子。
回答问题:(1)D元素的名称为____ , F形成的离子的结构示意图为__________。
(2)写出液态化合物Y的一种用途______________________________。
(3)用某种金属易拉罐与A、C、E组成的化合物的水溶液反应,产生的气体可充填气球,请写出该反应的离子方程式____________________________________,使用这种气球存在的隐患是________________________________。
(4)P和Q两种物质都是由A、C、E、F四种元素组成的盐,其水溶液都显酸性,等物质的量的P和Q恰好完全反应。
写出该反应的离子方程式:____________。
(5)A、B、G三种元素两两组合形成的化合物在空气中相遇形成白烟,反应的化学方程式为_________________________________。
13.(12分)(探究题)短周期元素A、B、C、D原子序数依次增大,且C元素最高价氧化物对应的水化物能电离出电子数相等的阴、阳离子。
A、C位于同一主族,A为非金属元素,B的最外层电子数是次外层电子数的3倍,B、C的最外层电子数之和与D的最外层电子数相等。
E单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏。
请回答下列问题:(1)C的最高价氧化物对应水化物的化学式为_____________________________,其中含有的化学键类型为_________________________。
(2)由上述A、B、C、D四种元素中的三种组成某种盐,水溶液显碱性,是家用消毒剂的主要成分。
将该盐溶液滴入KI淀粉溶液中,溶液变为蓝色,则反应的离子方程式为_________________________。
(3)E元素与D元素可形成ED2和ED3两种化合物,下列说法正确的是___ (填序号)。
①保存ED2溶液时,需向溶液中加入少量E单质②ED2只能通过置换反应生成,ED3只能通过化合反应生成③铜片、碳棒和ED3溶液组成原电池,电子由铜片沿导线流向碳棒④向淀粉碘化钾溶液和苯酚溶液中分别滴加几滴ED3的浓溶液,原无色溶液都变成紫色答案解析1.【解析】选C。
13153I表示的是质子数为53,质量数为131的碘原子,其原子序数和核外电子数都为53,中子数=131-53=78,所以中子数多于质子数。
131 53I和12753I互为同位素,其化学性质相同。
2.【解析】选C。
一种原子就是一种核素,16O与18O属于不同的原子,故不属于同种核素,A错;质子数相同而中子数不同的原子互称同位素,故B错;原子的化学性质取决于最外层电子数,即同种元素的原子化学性质相同,16O===C===18O的化学性质与16O===C===16O的几乎相同,C正确;Na2O2与CO2反应时,Na2O2既是氧化剂又是还原剂,所生成的氧气中只含16O,D错。
3.【解析】选B。
S2-的最外层应该有8个电子,A错;质子数为53、中子数为78的碘原子质量数为131,B对;F-的最外层应该为8个电子,C错;含有2个中子的氢原子质量数为3,D错。
4.【解析】选D。
14C与12C60的碳原子化学性质相似,A错;14C的中子数为8,14N的中子数为7,B错;14C为原子,12C60为单质,C错;14C 、12C、13C互为同位素,D对。
5.【解析】选D。
3He与4He的质子数相同,核外电子数相同,中子数不同,①、②错;3He与4He互为同位素关系,不是同素异形体,③错、⑥对;根据3He只能确定3He的质量数为3,不能确定He元素的相对原子质量,④错;3He与HD的摩尔质量相同,相同体积、相同密度的两种气体,物质的量相同,1 mol 3He 与HD中都含有1 mol中子,⑤对,D项正确。
6.【解析】选D。
第3周期元素的次外层有8个电子,最内层有2个电子,二者之差为6。
因为该原子达到8电子稳定结构需要的电子数小于6,则需要的电子数为2或4。
若为2,则X为S;若为4,则X为Si,硅酸为弱酸,A错;硅的氢化物为 SiH4,B错;S单质不能作半导体材料,C错;SO2、SO3和SiO2都能与烧碱反应,D正确。
7.【解析】选C。
Na+、Mg2+、Al3+、F-、O2-、Ne的核外电子排布均相同,但化学性质不同,A不正确;单原子形成的离子如H+、Fe2+、Fe3+等均不具有稀有气体元素原子的核外电子排布,B不正确;阴离子的核外电子排布与同周期稀有气体元素原子的核外电子排布相同,而主族元素阳离子的核外电子排布才与上一周期稀有气体元素原子的核外电子排布相同,D不正确。