云南省昭通市2018届高三五校联合测试卷 高三化学
- 格式:docx
- 大小:222.14 KB
- 文档页数:11

2018年云南省高中毕业生复习统一检测理科综合能力测试(化学)可能用到的相对原子质量H:1 C:12 N:14 O:16 S:32 Fe:56 Ba:1377.党的十九大报告中多次提到“生态文明”,下列做法不符合生态文明理念的是A.发展新能源汽车,实现低碳出行B.用氯乙烯生产快餐盒,降低白色污染C.用地沟油制生物柴油,回收利用资源D.科学开发利用自然资源,维护生态平衡8.下列关于有机物的说法错误的是A.C(CH3)4的名称为新戊烷B.CH3-CH=C H-C≡CH分子中最多有9个原子共面C.石油裂解和油脂皂化都是高分子化合物生成小分子化合物的过程D.甲苯分子中苯环上的一个氢原子被一C2H4Cl取代后可得6种同分异构体9.N A为阿伏加德罗常数的值。
下列说法正确的是A.1.4gC2H4、C3H6的混合气体中,所含碳原子总数为0.lN AB.在0.1 mo l·L Na2S溶液中,S2-、HS-、H2S微粒总数为0.1N AC.标准状况下,22.4LC2H6中所含极性共价键的数目为7N AD.50mL l2mo l·L的浓盐酸与足量MnO2反应,转移电子总数为0.3N A10.实验是探究化学过程的重要途径,有关下列各实验装置图的叙述正确的是A.图I可用于探究NaHCO3固体的热稳定性B.图Ⅱ用于从氯化钠溶液中获得晶体C.图III中b口进气可收集Cl2、CO2等气体D.图Ⅳ中若X为NaOH溶液,则可完成SO2的喷泉实验11.短周期元素W、X、Y、Z在元素周期表中的相对位置如下图所示,其中W的最高正价和最低负价的代数和为2。
下列判断正确的是A.最高价氧化物对应水化物的酸性:Y>WB.最简单气态氢化物的稳定性:Z>YC.元素W 与元素Y 形成的化合物Y 3W 4是一种新型有机材料D.X 的单质能与W 的最高价氧化物对应水化物的浓溶液反应产生氢气12.科学家研发出了一种新材料,其工作原理如下图所示。

绝密★启用前云南省昭通市2018届高三五校联合测试卷(七)高三理综化学一、单选题(共7小题,每小题6.0分,共42分)1.碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间的转化关系如图所示。
下列说法中不正确的是 ()A.用淀粉-KI试纸和食醋检验加碘盐时淀粉-KI试纸会变蓝B.足量Cl2能使湿润的、已变蓝的淀粉-KI试纸褪色的原因可能是5Cl2+I2+6H2O===2HIO3+10HClC.由图可知氧化性的强弱顺序为Cl2>I2>IOD.途径Ⅱ中若生成1 mol I2,则反应中转移的电子数为10N A2.关于下列各装置图的叙述中,不正确的是()A.装置①中,d为阳极、c为阴极B.装置②可用于收集H2,NH3,CO2,Cl2,NO2等气体C.装置③中X若为四氯化碳,可用于吸收氨气,并防止倒吸D.装置④可用于干燥、收集氨气,并吸收多余的氨气3.某航空站安装了一台燃料电池,该电池可同时提供电和水蒸气。
所用燃料为氢气,电解质为熔融的碳酸钾。
已知该电池的总反应为2H2+O2===2H2O,正极反应为O2+2CO2+4e-===2CO,则下列推断正确的是()A.负极反应为H2+2OH--2e-===2H2OB.该电池可在常温或高温时进行工作,对环境具有较强的适应性C.该电池供应2 mol水蒸气,同时转移2 mol电子D.放电时负极有CO2生成4.新型NaBH4/H2O2燃料电池(DBFC)的结构如图所示,(已知硼氢化钠中氢为﹣1价),有关该电池的说法正确的是()A.电极B材料中含MnO2层,MnO2可增强导电性B.电池负极区的电极反应:BH4﹣+8OH﹣﹣8e﹣═BO2﹣+6H2OC.放电过程中,Na+从正极区向负极区迁移D.在电池反应中,每消耗1L 6mol/L H2O2溶液,理论上流过电路中的电子为6N A个5.已知K sp(AgCl)=1.56×10-10,K sp(AgBr)=7.7×10-13,K sp(Ag2CrO4)=9.0×10-12。
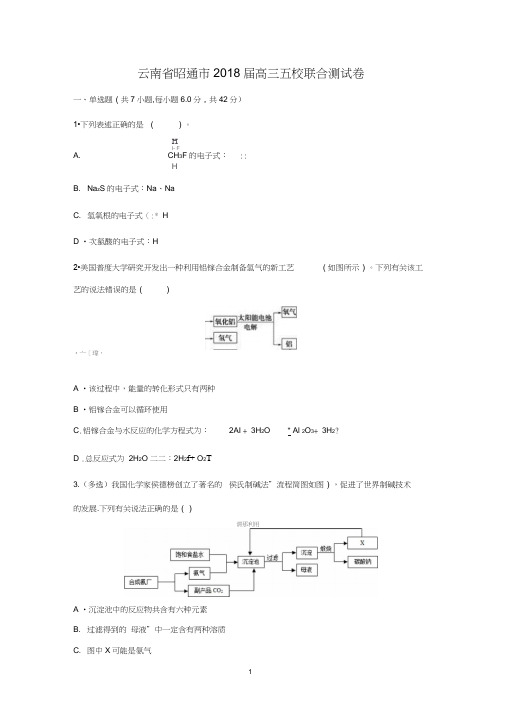
云南省昭通市2018届高三五校联合测试卷一、单选题(共7小题,每小题6.0分,共42分)1•下列表述正确的是()。
HI- FA. CH3F的电子式:::HB. Na z S的电子式:Na、NaC. 氢氧根的电子式(:* HD •次氯酸的电子式:H2•美国普度大学研究开发出一种利用铝镓合金制备氢气的新工艺(如图所示)。
下列有关该工艺的说法错误的是()•亠[瑋,A •该过程中,能量的转化形式只有两种B •铝镓合金可以循环使用C.铝镓合金与水反应的化学方程式为:2AI + 3H2O * Al 2O3+ 3H2?D .总反应式为2H2O 二二:2H2f+ O2T3.(多选)我国化学家侯德榜创立了著名的侯氏制碱法”流程简图如图),促进了世界制碱技术的发展.下列有关说法正确的是()谓那利用A •沉淀池中的反应物共含有六种元素B. 过滤得到的母液”中一定含有两种溶质C. 图中X可能是氨气D •通入氨气的作用是使溶液呈碱性,促进二氧化碳的吸收,更多地析出沉淀4•已知室温下,AI(OH) 3的K sp或溶解度远大于Fe(0H)3。
向浓度均为0.1mol?L-1的Fe(NO3)3和AI(NO 3)3混合溶液中,逐滴加入NaOH溶液。
下列示意图表示生成AI(OH) 3的物质的量5•在常压和500C条件下,等物质的量的Ag2O, Fe(OH)3, NH4HCO3, NaHCO?完全分解,所得气体体积依次是V i、V2、V3、V4体积大小顺序正确的是()A . V3>V2> V4> V i B. V3>V4> V2> V iC. V3>V2> V i> V4D. V2 >V3> V i> V46.W、X、Y、Z是短周期中的常见元素,其部分性质如下表,下列说法不正确的是()A . Y、X、W的原子半径依次减小,X、Y、W单核离子的半径依次增大B . W、X、Y的最高价氧化物的水化物之间可以两两反应C. Y的氧化物与Z的最高价氧化物反应一定是氧化还原反应D . W、Z、X、Y的最高正价依次降低7•某同学用下列装置制备并检验CI2的性质。

绝密★启用前云南省昭通市2018届高三五校联合测试卷(八)高三理综化学一、单选题(共7小题,每小题6.0分,共42分)1.下列事实与胶体性质无关的是()A.土壤中离子的吸附和交换过程,有保肥作用B.由肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗C.水泥厂和冶金厂常用高压直流电除去大量烟尘,减少对空气的污染D.明矾可用作净水剂E.臭氧、Cl2均可用于水的消毒净化2.下列各组有机物只用一种试剂无法鉴别的是( )A.乙醇,甲苯,硝基苯 B.苯,苯酚,己烯C.苯,甲苯,环己烷 D.甲酸,乙醛,乙酸3.在水溶液中能大量共存的一组是( )A. Fe2+、Na+、ClO-、Cl- B. Al3+、Mg2+、SO42-、CO32-C. H+、Ca2+、Cl-、NO3- D. AlO2-、Cl-、H+、K+4.设N A表示阿伏加德罗常数的值,下列叙述正确的是()A. 100 g 63%的浓硝酸中含氧原子个数为3N AB. 5.6 g铁与硫蒸气完全反应,转移的电子数为0.3N AC.标准状况下,CO和C2H4的混合气体22.4 L,其质量为28 gD. 58.5 g NaCl晶体中含有NaCl分子数为N A5.已知:25℃时某些弱酸的电离平衡常数。
下面图像表示常温下稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化,下列说法中正确的是()A.相同浓度CH3COONa和NaClO的混合液中,各离子浓度大小关系为:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)B.向NaClO溶液中通少量CO2的离子方程式为: 2ClO-+CO2+H2O===2HClO+COC.图像中a、c两点处的溶液中相等(HR代表CH3COOH或HClO)D.图像中a点酸的总浓度等于b点酸的总浓度6.锂锰电池的体积小、性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4.溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.下列有关说法正确的是()A.外电路的电流方向是由a极流向b极B.电池正极反应式为MnO2+e﹣+Li+=LiMnO2C.可用水代替电池中的混合有机溶剂D.每转移0.1mol电子,理论上消耗Li的质量为3.5g7.已知反应:① 2C(s)+O2(g)===2CO(g) ΔH=-221 kJ·mol-1②稀溶液中,H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1下列结论正确的是( )A.碳的燃烧热为ΔH=-110.5 kJ·mol-1B.反应①的ΔH<0,ΔS>0,则ΔG<0,在任意温度下反应可自发进行C.反应①中反应物的总键能大于生成物的总键能D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出热量大于57.3 kJ分卷II二、非选择题部分8.)随着大气污染的日趋严重,国家拟于“十二”五期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%。

云南省昭通市2018届高三五校联合测试卷(二)1.有关实验的叙述,正确的是( )A.将固体加入容量瓶中溶解并稀释至刻度,配制成一定物质的量浓度的溶液B.用玻璃棒蘸取溶液,点在湿润的pH试纸上测定其pHC.用NaOH溶液洗涤并灼烧铂丝后,再进行焰色反应D.读取滴定管内液体的体积,俯视读数导致读数偏小2.图为两种途径制备硫酸的过程,反应条件略.下列说法不正确的是()A.含l mol H2SO4的浓溶液与足量NaOH反应,放出的热量即为中和热B.途径②增大O2浓度可提高SO2转化率C.途径②中SO2和SO3均属于酸性氧化物D.若△H l<△H2+△H3,则2H2O2(aq)=2H2O(1)+O2(g)为放热反应3.北京大学和中国科学院的化学工作者已成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质属于离子化合物,具有良好的超导性。
下列有关分析正确的是()A.K3C60中只有离子键B.K3C60中不含共价键C.该晶体在熔融状态下能导电D.C60与12C互为同素异形体4.实验室常用于保存钠的液体是()A.煤油B.水C.汽油D.四氯化碳5.下列有关热化学方程式的叙述正确的是()A.已知C(石墨,s)=C(金刚石,s)△H>O,则金刚石比石墨稳定B.已知2H2(g)+O2(g)═2H2O(1)△H=﹣571.6kJ•mol﹣1,则氢气的燃烧热为﹣285.8kJ•mol ﹣1C.含20.0 gNaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该条件下稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)═H3COOHNa(aq)+H2O(l)H=﹣57.4kJ•mol﹣1D.已知2C(s)+2O2(g)=2CO2(g)△H1:2C(s)+O2(g)═2CO(g)△H2则△H1>△H26.下列说法正确的是()A.已知a g乙烯气体充分燃烧时生成1 mol CO2和液态水,放出b kJ的热量,则表示乙烯燃烧热的热化学方程式为2C2H4(g)+6O2(g)===4CO2(g)+4H2O(l)ΔH=-4b kJ·mol-1 B.已知:H2(g)+F2(g)===2HF(g)ΔH=-270 kJ·mol-1,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJC.500 ℃,30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)2NH3(g)ΔH=-38.6 kJ·mol-1 D.已知:①C(s,石墨)+O2(g)===CO2(g)ΔH=-393.5 kJ·mol-1,②C(s,金刚石)+O2(g)===CO2(g)ΔH=-395.0 kJ·mol-1,则C(s,金刚石)===C(s,石墨)ΔH=-1.5 kJ·mol -17.有人设计将两根Pt丝作电极插入KOH溶液中,然后向两极上分别通入甲烷和氧气而构成燃料电池.该电池中反应的化学方程式:CH4+2O2+2KOH═K2CO3+3H2O,则关于此燃料电池的下列说法正确的是(一个电子带电量为1.6×10﹣19C)()A.通入甲烷的电极为电池的正极,通入氧气的电极为负极B.在标准状况下,每消耗5.6 L O2,可向外提供8.3×104C的电量C.通入甲烷电极的电极反应为:CH4+10OH﹣﹣8e﹣═CO32﹣+7H2OD.放电一段时间后,溶液pH升高8.在热的稀硫酸中溶解了11.4 g FeSO4固体,当加入50 mL 0.5 mol·L-1KNO3溶液时,其中的Fe2+全部转化成Fe3+,KNO3也完全反应并放出N x O y气体。
绝密★启用前云南省昭通市2018届高三五校联合测试卷高三理综化学一、单选题(共7小题,每小题6.0分,共42分)1.下列表述正确的是 ()。
A.CH3F的电子式:B.Na 2S的电子式:Na NaC.氢氧根的电子式HD.次氯酸的电子式:H2.美国普度大学研究开发出一种利用铝镓合金制备氢气的新工艺(如图所示)。
下列有关该工艺的说法错误的是()A.该过程中,能量的转化形式只有两种B.铝镓合金可以循环使用C.铝镓合金与水反应的化学方程式为:2Al+3H2O Al2O3+3H2↑D.总反应式为2H2O2H2↑+O2↑3.(多选)我国化学家侯德榜创立了著名的“侯氏制碱法”(流程简图如图),促进了世界制碱技术的发展.下列有关说法正确的是( )A.沉淀池中的反应物共含有六种元素B.过滤得到的“母液”中一定含有两种溶质C.图中X可能是氨气D.通入氨气的作用是使溶液呈碱性,促进二氧化碳的吸收,更多地析出沉淀4.已知室温下,Al(OH)3的K sp或溶解度远大于Fe(OH)3。
向浓度均为0.1mol•L-1的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH 溶液。
下列示意图表示生成Al(OH)3的物质的量与加入NaOH溶液的体积的关系。
合理的是( )A. B.C. D.5.在常压和500℃条件下,等物质的量的Ag2O,Fe(OH)3,NH4HCO3,NaHCO3完全分解,所得气体体积依次是V1、V2、V3、V4体积大小顺序正确的是( )A.V3>V2>V4>V1 B.V3>V4>V2>V1C.V3>V2>V1>V4 D.V2>V3>V1>V46.W、X、Y、Z是短周期中的常见元素,其部分性质如下表,下列说法不正确的是 ( )A.Y、X、W的原子半径依次减小,X、Y、W单核离子的半径依次增大B.W、X、Y的最高价氧化物的水化物之间可以两两反应C.Y的氧化物与Z的最高价氧化物反应一定是氧化还原反应D.W、Z、X、Y的最高正价依次降低7.某同学用下列装置制备并检验Cl2的性质。
下列说法正确的是()A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部被消耗B.Ⅱ图中:量筒中发生了加成反应C.Ⅲ图中:生成蓝色的烟D.Ⅳ图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成分卷II8.用于金属焊接的某种焊条,其药皮由大理石、水泥、硅铁等配制而成。
(1)Al的原子结构示意图为____________;Al与NaOH溶液反应的离子方程式为______ ______。
(2)30Si的原子的中子数为________________________。
(3)Al3+与Y n-的电子数相同,Y所在族各元素的氢化物的水溶液均显酸性,则该族氢化物中沸点最低的是____________________________________。
(4)焊接过程中,药皮在高温下产生了熔渣和使金属不被氧化的气体,该气体是____________。
(5)经处理后的熔渣36.0 g(仅含Fe2O3、Al2O3、SiO2),加入足量稀盐酸,分离得到11.0 g固体;滤液中加入过量NaOH溶液,分离得到21.4 g固体;则此熔渣中Al2O3的质量分数为____________。
9.为了证明一氧化碳具有还原性,有人设计了下列实验:(1)装置B中最适宜的试剂是。
(2)装置D中发生反应的化学方程式是。
(3)必须用装置C吸收除去气体中水蒸气的理由。
(4)若根据F中石灰水变浑浊的现象也能确定CO具有还原性,应在上图中装置________与之间连接下列装置中的(填序号)。
10.卤素单质及其化合物在生产和生活中有广泛应用。
Ⅰ.氟化钠主要用作农作物杀菌剂、杀虫剂、木材防腐剂。
实验室以氟硅酸()等物质为原料、通过下图所示的流程制取较纯净的氟化钠,并得到副产品氯化铵:已知:20℃时氯化铵的溶解度为37.2 g,氟化钠的溶解度为4 g,Na2SiF6微溶于水。
请回答下列有关问题:(1)完成并配平上述流程中①、②的化学反应方程式:②。
(2)操作Ⅲ分为两步,其顺序是(填写所选序号)。
a.过滤 b.加热浓缩c.冷却结晶d.洗涤操作Ⅱ是洗涤、干燥,其目的是,在操作Ⅰ~V中与之相同的操作步骤是。
(3)流程①中NH4HCO3必须过量,其原因是。
Ⅱ.紫菜与海带类似,是一种富含生物碘的海洋植物,可用于食用补碘。
以下为某兴趣小组模拟从紫菜中提取碘的过程:已知:商品紫菜轻薄松脆,比海带更易被焙烧成灰(此时碘转化为碘化物无机盐)。
(4)将焙烧所得的紫菜灰与足量的双氧水和稀硫酸作用,写出反应的离子方程式:。
(5)操作①中涉及两步操作,名称是,所用的主要玻璃仪器为,所用试剂A最好选用表格中的(填试剂名称)。
(6)将下列装置图中缺少的必要仪器补画出来,以最终将单质碘与试剂A分离:11.[化学——选修3:物质结构与性质](15分)氮化硼(BN)是一种重要的功能陶瓷材料,以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:请回答下列问题:(1)由B2O3制备BF3、BN的化学方程式依次是_____________、_______________;(2)基态B原子的电子排布式为_________;B和N相比,电负性较大的是_________,BN中B元素的化合价为_________;(3)在BF3分子中,F—B—F的键角是_______,B原子的杂化轨道类型为_______,BF3和过量NaF 作用可生成NaBF4,BF4-的立体结构为_______;(4)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为________;(5)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼晶胞中含有______个氮原子、________个硼原子,立方氮化硼的密度是_______g·cm-3(只要求列算式,不必计算出数值。
阿伏伽德罗常数为NA)。
12.[化学——选修5:有机化学基础](15分)姜黄素具有抗突变和预防肿瘤的作用,其合成路线如下:已知:i.1mol G最多能消耗Na、NaOH、NaHCO3的物质的量分别为:3mol、2mol、1molii.iii.(R1、R2、R3为烃基或氢原子)请回答:(1)B→C的反应类型是;(2)C→D反应的化学方程式是;(3)E的核磁共振氢谱中有两个峰,E中含有的官能团名称是,E→G反应的化学方程式是;(4)下列有关香兰醛的叙述不正确的是;a.香兰醛能与NaHCO3溶液反应b.香兰醛能与浓溴水发生取代反应c.1mol香兰醛最多能与3molH2发生加成反应(5)写出一种符合下列条件的香兰醛的同分异构体的结构简式;①苯环上的一硝基取代物有2种②1mol该物质水解,最多消耗3molNaOH(6)姜黄素的分子中有2个甲基,其结构简式是;(7)可采用电解氧化法由G生产有机物 J,则电解时的阳极反应式是。
答案解析1.【答案】D【解析】A项中F原子的未成键电子没有表示出来,错误;B项中Na2S是离子化合物,电子式书写错误;C项中OH-的电子式应为[H]-,错误。
2.【答案】A【解析】铝镓合金与水反应的过程中必然伴随着能量变化,主要是化学能转化为热能;太阳能电池工作时,太阳能转化为电能;电解过程中电能又转化为化学能。
因此,上述过程中能量的转化形式有三种,故A错误。
根据题意可知B,C,D均正确。
3.【答案】AD【解析】沉淀池中发生的反应的反应物是氯化钠、氨气、二氧化碳和水,所以含有钠、氯、氮、氢、碳、氧六种元素,故A正确;过滤得到的“母液”中含有的溶质有碳酸氢钠、氯化铵,还有可能含有过量的氯化钠,故B错;碳酸氢钠分解生成碳酸钠、水、二氧化碳,所以X是二氧化碳,故C 错;氨气的水溶液显碱性,能更好的吸收二氧化碳,使反应物浓度大,反应速度快,故D正确。
4.【答案】B【解析】浓度均为0.1 mol•L-1的Fe(NO3)3和Al(NO3)3混合溶液中,溶液中Fe3+,Al3+的浓度相同为0.1 mol/L,Al(OH)3的K sp或溶解度远大于Fe(OH)3,故向混合溶液逐滴加入NaOH溶液,Fe3+首先转化为Fe(OH)3沉淀,当Fe3+完全沉淀,Al3+再转化为Al(OH)3沉淀,当Al3+沉淀完全,再加入氢氧化钠,Al(OH)3溶解,沉淀的质量减少,由于Fe(OH)3不溶于碱,故沉淀减少到一定值不再变化,为Fe(OH)3的物质的量,选择B。
5.【答案】A【解析】常压和500 ℃条件下,水是气体,等物质的量的Ag2O,Fe(OH)3,NH4HCO3,NaHCO3完全分解,各物质分解的方程式分别为:①2Ag2O4Ag+O2↑,2mol氧化银产生1mol氧气;②2Fe(OH)3Fe2O3+3H2O↑,2mol氢氧化铁产生3mol水蒸气;③NH4HCO3NH3↑+H2O↑+CO2↑,2mol碳酸氢铵产生6mol气体;④2NaHCO3Na2CO3+CO2↑+H2O↑,2mol碳酸氢钠产生2mol气体;故各取2mol在500℃条件下加热完全分解,生成的气体体积大小顺序为V3>V2>V4>V1。
6.【答案】C【解析】首先可以推出W为S,X为Al,Y为Na,Z为C,A、根据同周期的元素原子半径随核电荷数的增大而减小得Y、X、W的原子半径依次减小,核外电子排布相同的离子半径随核电荷数的增大而减小,即X、Y、W单核离子的半径依次增大,正确;B,W、X、Y的最高价氧化物的水化物分别为H2SO4、Al(OH)3、NaOH,它们之间可以两两反应,正确;C,Y的氧化物是NaO或Na2O2,Z的最高价氧化物是CO2,反应不一定是氧化还原反应,错误;D,W、Z、X、Y的最高正价分别为:+6、+4、+3、+1,依次降低,正确。
7.【答案】D。
【解析】A项浓盐酸变稀后,反应停止,故浓盐酸不可能全部被消耗;B项发生取代反应;C项生成棕黄色的烟;D项Cl2能使湿润的有色布条褪色,滴入硫酸溶液后发生反应Cl-+ClO-+2H+===Cl2↑+H2O。
8.【答案】(1) 2Al+2OH-+2H2O====+3H2↑(2)16 (3)HCl(4)CO2(5)25%【解析】(1)Al原子核外有3个电子层,最外层有3个电子;Al与NaOH溶液反应生成偏铝酸钠和氢气;(2)中子数=质量数-质子数;(3)根据Y所在族各元素的氢化物的水溶液均显酸性,可推知Y为F,回答沸点时要考虑到HF中含有氢键;(4)根据药皮的成分在高温下的反应,推导所得气体;(5)在熔渣中加入盐酸,发生的反应为:Fe2O3+6HCl====2FeCl3+3H2O,Al2O3+6HCl====2AlCl3+3H2O,11.0 g为SiO2的质量。