视频导学
学习探究
2. 实验原理分析
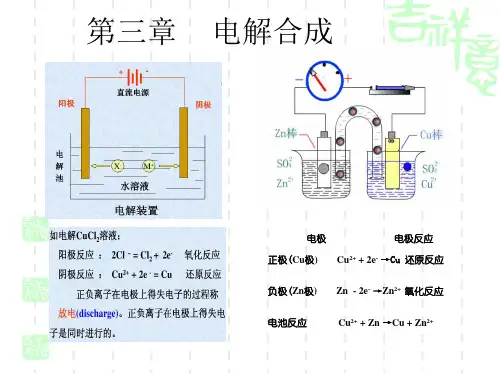
(1)氯化铜溶液中的电离过程有① CuCl2==Cu2++2Cl- ,
② H2O
H++OH-;溶液中存在的离子有 Cu2+、
Cl-_、__H__+_、__O__H_-_,通电前,这些离子在溶液中做自由移动。
(2)通电时,在电场的作用下,溶液中的离子 做 Cl-、OH-,即 Cu2+、H+ 趋向a极, 定向移动 趋
(√ ) (× ) (√ ) (√ ) (×)
知识回顾
温故追本溯源·推陈方可知新
3. 右图为电解水的实验装置图。根据图示回答下列问题:
(1)A端为电源的 正 极,C试管中收集到的气体是 O2 , D试管中收集到的气体是H2 。 (2)写出电解水的化学方程式:2H2O==电=解==2H2↑+O2↑。
高中化学精品课件 • 选修 4
第三节 电解池
第 1 课时 电解原理
本节知识目录
电解原理
目标定位 知识回顾 学习探究 自我检测
探究点一 电解原理 探究点二 酸、碱、盐溶液的电解规律
学习目标定位 1.会描述电解池的工作原理,能正确书写电解池的电极反应式和总反应方程式。 2.熟悉电解规律和电解产物的判断方法。
电解物质 H2O
pH变化 减小 增大 不变
复原方法 加入H2O
HCl
增大 加入HCl
CuCl2
NaCl、 H2O
CuSO4、 H2O
增大 减小
加入CuCl2
加入HCl
加入CuO 或CuCO3
学习探究 归纳总结
基础自学落实·重点互动探究
1.分析电解问题的基本方法思路
(1)通电前:电解质溶液中含有哪些阴、阳离子(包括水电离出的H+和OH-)。 (2)通电时:阴离子移向阳极,阳离子移向阴极,结合放电顺序分析谁优先 放电(注意活泼金属作阳极时优先放电)。 (3)正确书写电极反应式,要注意原子数、电荷数是否守恒。 (4)能结合题目要求分析电解时的各种变化情况,如两极现象、水的电 离平衡移动、离子浓度的变化、pH变化等。