线粒体 裂解液
- 格式:pdf
- 大小:106.69 KB
- 文档页数:4

裂解液配制方法 The document was finally revised on 20211、红细胞裂解液(去除红细胞)配制试剂所需材料:1. Ammonium Chloride x10 Lysing Concentrate Solutiona) NH4Cl (1.5 M) 80 gb) KHCO3 (100 nM) 10 gc) Na4EDTA (10 nM) 3.7 gd) Distilled H2O 1000 mL2. 1N HCl or 1N NaOH(调节pH值用)配制步骤:1. 将以上a、b、c试剂溶于900ml 去离子水中;2.调节溶液pH值到,加去离子水定容到1000ml;3.在制备工作液时,将此储存液稀释10倍后使用。
保存:储存液储存于2-8°C不能超过半年(六个月);2.在使用前,工作液每天都应该新鲜配制放置于室温,当日用不完的弃掉。
2、ripa裂解液NP-40 or Triton-100 1%TrisHCl (pH 50mmol/LNaCl 150mmol/LPMSF(苯甲基磺酰氟) L(100μg/ml)Pepstatin(胃蛋白酶抑制剂) 1 μmol/Lμg/ml)Leupeptin(亮抑制肽) mlAprotinin(抑蛋白酶肽)μmol/L(1μg/ml)(注:PMSF 贮存液:100mmol/L即ml于异丙醇中;Aprotinin 贮存液:10mg/ml溶于LHEPES;Leupeptin 贮存液:10mg/ml溶于水中;Pepstatin 贮存液 10mg/ml于甲醇液中.均于-20℃保存)3、细胞裂解液(Tris-HCL)1.1M Tris 溶液的配置取Tris242.2g,加ddH2O至1600ml,加热溶解。
2.1M Tris-HCL Ph=溶液的配置取 1M Tris 溶液160ml用分析纯盐酸调至Ph=(需浓盐酸约),加ddH2O定容至200ml,高压灭菌备用。

不同亚细胞定位的蛋白提取蛋白质是维持细胞生命活动所必需的重要分子,在细胞内扮演着重要的角色,如酶催化、信号传导、结构支撑等。
在细胞内,蛋白质不仅分布在不同的细胞区域,而且还可能会发生分子构象的改变,从而确保其功能的实现。
因此,如何从细胞定位的角度对蛋白质进行有效提取,是现代细胞生物学研究的重要问题之一。
一、前处理在进行细胞蛋白提取之前,需要进行一些前处理,如细胞破碎、裂解和去除细胞碎片等。
破碎方法可以采用机械破碎、超声破碎、高压破碎等方法。
机械破碎法是将细胞置于磨碎器中,通过高速旋转产生剪切力和冲击力,使细胞破碎。
超声破碎法则是利用超声波的高能量,产生强烈的物理震荡,将细胞破碎。
高压破碎法则是将样品置于高压设备中,通过高压力将细胞压碎。
另外,裂解液的选择也是影响细胞蛋白提取的重要因素。
裂解液可以针对特定的亚细胞定位,选择不同的配方,如核裂解液、线粒体裂解液、质膜裂解液等。
1. 全细胞蛋白提取全细胞蛋白提取即将裂解过的细胞全体蛋白完整提取出来,是最为常见的蛋白质提取方法之一。
全细胞蛋白可以用于一些基础生物学研究,如基因表达、蛋白结构和功能等的研究。
全细胞蛋白提取液中含有细胞质和核蛋白,因此在分离某些亚细胞定位蛋白时,需要选择其他的蛋白质提取方法。
质膜是细胞内重要的亚细胞结构之一,它可以分隔细胞与外界,并调节物质的进出。
因此,许多药物和生物活性分子靶向作用于细胞质膜上的蛋白质。
质膜蛋白的提取相对比较困难,需要一定的技术手段。
通常,使用含有蛋白酶抑制剂的裂解液,并加入口袋磷脂或三十烷基硫酸钠(SDS)等表面活性剂来同化质膜层,以便使质膜蛋白直接暴露于裂解液中。
3. 内质网蛋白提取内质网是负责调查和处理细胞内蛋白的网络系统之一。
去除胞外环境中的复杂蛋白质干扰,可以更好地分离和富集内质网蛋白。
内质网膜靠近核膜并与高基质质粒相连,因此内质网膜的提取通常称为核内微粒体蛋白提取,包括内质网膜和高基质质粒。
内质网膜可使用胰酶、DNase等酶来裂解,并在液体中添加10%的蔗糖,可以加速内质网膜的沉淀,并放置在4°C下进行长时间离心。

线粒体分离试剂盒说明PMSF一定要在线粒体分离试剂或线粒体裂解液加入到样品中前2-3分钟内加入,以免PMSF 在水溶液中很快失效。
分离线粒体的所有步骤均需在冰上或4℃进行,所用溶液需冰浴或4℃预冷。
1 准备溶液:室温融解试剂盒中的各种溶液,溶解后立即置于冰上并混匀。
第一次使用时,把1.5ml PMSF(溶剂)加入到PMSF(晶体)中,溶解并混匀,即得到1.5ml 100mM PMSF。
配制好的100mM PMSF溶液-20℃保存。
如果最终目的是制备线粒体蛋白样品,根据样品数量,取适量线粒体分离试剂备用,在线粒体分离试剂加入到细胞样品中前数分钟内加入PMSF,使PMSF的最终浓度为1mM。
取适量线粒体裂解液备用,在线粒体裂解液加入到线粒体样品中前数分钟内加入PMSF,使PMSF的最终浓度为1mM。
2 对于贴壁细胞:用PBS洗一遍,用胰酶细胞消化液(Trypsin-EDTA Solution)消化细胞,离心收集细胞。
3 洗涤细胞:用冰浴预冷的PBS轻轻重悬细胞沉淀,取少量细胞用于计数,剩余细胞600g,4℃离心5分钟沉淀细胞。
弃上清。
4 预处理:加入1-2.5ml临用前添加了PMSF的线粒体分离试剂至2000-5000万细胞中,轻轻悬浮细胞,冰浴放置10-15分钟。
5.匀浆:把细胞悬液转移到一适当大小的玻璃匀浆器中,匀浆10-30下左右。
6 匀浆效果的鉴定:不同细胞不同匀浆器所需的匀浆次数有所不同,需自行优化。
通常可以在匀浆10次后取约2微升细胞匀浆,加入30-50 微升台盼蓝染色液,混匀后显微镜下观察台盼蓝染色阳性( 蓝色) 细胞的比例。
如果阳性细胞比例不足50%,增加5次匀浆。
随后再同前取样进行台盼蓝染色鉴定。
当阳性比例超过50%时即可停止匀浆进入下一步。
请勿过度匀浆,过度匀浆会导致线粒体的机械损伤。
同时记录对于该细胞的匀浆次数,通常在后续实验时不必再摸索匀浆次数。
7.把细胞匀浆在600g,4℃离心10分钟。


裂解液配制方法 The manuscript was revised on the evening of 20211、红细胞裂解液(去除红细胞)配制试剂所需材料:1. Ammonium Chloride x10 Lysing Concentrate Solutiona) NH4Cl (1.5 M) 80 gb) KHCO3 (100 nM) 10 gc) Na4EDTA (10 nM) 3.7 gd) Distilled H2O 1000 mL2. 1N HCl or 1N NaOH(调节pH值用)配制步骤:1. 将以上a、b、c试剂溶于900ml 去离子水中;2.调节溶液pH值到,加去离子水定容到1000ml;3.在制备工作液时,将此储存液稀释10倍后使用。
保存:储存液储存于2-8°C不能超过半年(六个月);2.在使用前,工作液每天都应该新鲜配制放置于室温,当日用不完的弃掉。
2、ripa裂解液NP-40 or Triton-100 1%TrisHCl (pH 50mmol/LNaCl 150mmol/LPMSF(苯甲基磺酰氟) L(100μg/ml)Pepstatin(胃蛋白酶抑制剂) 1 μmol/Lμg/ml)Leupeptin(亮抑制肽) mlAprotinin(抑蛋白酶肽)μmol/L(1μg/ml)(注:PMSF 贮存液:100mmol/L即ml于异丙醇中;Aprotinin 贮存液:10mg/ml溶于LHEPES;Leupeptin 贮存液:10mg/ml溶于水中;Pepstatin 贮存液 10mg/ml于甲醇液中.均于-20℃保存)3、细胞裂解液(Tris-HCL)1.1M Tris 溶液的配置取Tris242.2g,加ddH2O至1600ml,加热溶解。
2.1M Tris-HCL Ph=溶液的配置取 1M Tris 溶液160ml用分析纯盐酸调至Ph=(需浓盐酸约),加ddH2O定容至200ml,高压灭菌备用。

线粒体dna分离试剂盒原理全文共四篇示例,供读者参考第一篇示例:线粒体DNA(mtDNA)是细胞内的一种特殊DNA,主要存在于细胞的线粒体中。
它是由母亲遗传给子代的,与细胞核DNA有着不同的特征和功能。
线粒体DNA在细胞的能量产生过程中起到关键作用,因此对其进行研究对于理解细胞功能和疾病的发生具有重要意义。
为了研究线粒体DNA,需要将其从细胞中分离出来。
而线粒体DNA分离试剂盒就是为了这个目的而设计的。
它包含了借助化学试剂和特殊操作步骤将线粒体DNA从细胞中提取出来的各种试剂和工具。
线粒体DNA分离试剂盒的原理主要可以分为以下几个步骤:第一步:细胞裂解细胞裂解是线粒体DNA分离过程中的第一步。
通过加入裂解缓冲液和蛋白酶,使细胞膜和细胞核膜失去完整性,从而释放出细胞内的线粒体和线粒体DNA。
第二步:线粒体分离在细胞裂解后,线粒体需要从细胞中分离出来。
这一步通常需要使用离心过程,通过调节不同离心速度和时间来沉淀线粒体,从而与其他细胞器分离。
第三步:DNA提取在成功分离出纯净的线粒体后,就需要进行DNA提取。
通过加入相应的试剂和离心操作,将线粒体DNA从线粒体中提取出来。
这一步需要注意避免DNA的降解和污染。
第四步:DNA纯化提取出的线粒体DNA可能还含有其他杂质,需要进行纯化操作。
通过加入适当的试剂和离心操作,将线粒体DNA纯化成较纯的形式,以便后续的实验操作。
线粒体DNA分离试剂盒的原理就是通过上述步骤将线粒体DNA 从细胞中提取出来,并经过分离、提取和纯化等操作得到纯净的线粒体DNA样品,以供进一步的实验研究。
线粒体DNA在人类疾病的研究中具有重要的应用价值。
许多遗传性疾病和退行性疾病都与线粒体DNA的突变和功能异常有关,因此通过研究线粒体DNA可以更好地理解这些疾病的发生机制,并为临床诊断和治疗提供新的思路和方法。
总的来说,线粒体DNA分离试剂盒的原理是通过一系列化学试剂和操作步骤将线粒体DNA从细胞中提取出来并进行纯化,为线粒体DNA的研究提供了重要的技术支持和工具。

裂解液和保存液成分及作用以裂解液和保存液成分及作用为标题,本文将介绍裂解液和保存液的成分和作用。
一、裂解液的成分及作用裂解液是一种常用的实验试剂,用于提取细胞或组织中的细胞器、蛋白质、核酸等生物分子。
它的主要成分包括缓冲溶液、蛋白裂解酶、蛋白质稳定剂等。
1.缓冲溶液缓冲溶液是裂解液中的主要成分之一,其作用是维持溶液的pH值稳定,使细胞或组织中的生物分子在裂解过程中不受pH值的影响而发生变性。
常用的缓冲溶液有磷酸盐缓冲液、Tris缓冲液等。
2.蛋白裂解酶蛋白裂解酶是裂解液中的关键成分之一,它能够降解细胞或组织中的蛋白质,使其分解为氨基酸。
常用的蛋白裂解酶有胰蛋白酶、Trypsin等。
3.蛋白质稳定剂蛋白质稳定剂是裂解液中的一种辅助成分,它能够保护裂解液中的蛋白质不受蛋白酶的降解,从而保持蛋白质的完整性和稳定性。
常用的蛋白质稳定剂有BSA(牛血清白蛋白)、EDTA等。
裂解液的作用是通过破坏细胞膜和细胞壁,释放细胞内的生物分子。
缓冲溶液维持溶液的pH值稳定,使裂解过程中的生物分子不受pH 值的影响。
蛋白裂解酶降解细胞内的蛋白质,使其分解为氨基酸,从而方便后续的分析和测定。
蛋白质稳定剂保护裂解液中的蛋白质不受蛋白酶的降解,保持蛋白质的完整性和稳定性。
二、保存液的成分及作用保存液是一种用于保存生物样品的液体,它的主要成分包括缓冲溶液、防腐剂等。
1.缓冲溶液保存液中的缓冲溶液起到维持液体pH值稳定的作用,防止生物样品在保存过程中发生腐败和分解。
常用的缓冲溶液有磷酸盐缓冲液、PBS缓冲液等。
2.防腐剂防腐剂是保存液中的重要成分,它能够抑制细菌和其他微生物的生长繁殖,防止生物样品的腐败和变质。
常用的防腐剂有甲醛、氯化汞等。
保存液的作用是保持生物样品的原始状态,防止其在保存过程中发生腐败和变质。
缓冲溶液维持液体的pH值稳定,防止生物样品的分解和腐败。
防腐剂抑制微生物的生长,保持生物样品的完整性和稳定性。
裂解液和保存液在生物实验中起着重要作用。
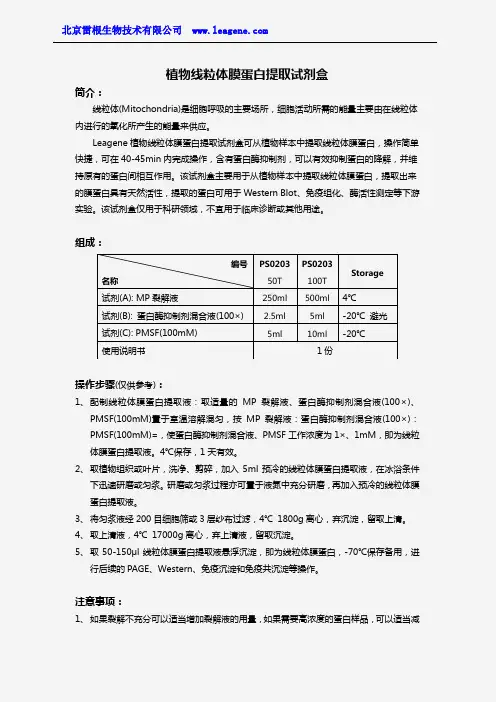
植物线粒体膜蛋白提取试剂盒简介:线粒体(Mitochondria)是细胞呼吸的主要场所,细胞活动所需的能量主要由在线粒体内进行的氧化所产生的能量来供应。
Leagene 植物线粒体膜蛋白提取试剂盒可从植物样本中提取线粒体膜蛋白,操作简单快捷,可在40-45min 内完成操作,含有蛋白酶抑制剂,可以有效抑制蛋白的降解,并维持原有的蛋白间相互作用。
该试剂盒主要用于从植物样本中提取线粒体膜蛋白,提取出来的膜蛋白具有天然活性,提取的蛋白可用于Western Blot 、免疫组化、酶活性测定等下游实验。
该试剂盒仅用于科研领域,不宜用于临床诊断或其他用途。
组成:操作步骤(仅供参考):1、 配制线粒体膜蛋白提取液:取适量的MP 裂解液、蛋白酶抑制剂混合液(100×)、PMSF(100mM)置于室温溶解混匀,按MP 裂解液:蛋白酶抑制剂混合液(100×):PMSF(100mM)=,使蛋白酶抑制剂混合液、PMSF 工作浓度为1×、1mM ,即为线粒体膜蛋白提取液。
4℃保存,1天有效。
2、 取植物组织或叶片,洗净、剪碎,加入5ml 预冷的线粒体膜蛋白提取液,在冰浴条件下迅速研磨或匀浆。
研磨或匀浆过程亦可置于液氮中充分研磨,再加入预冷的线粒体膜蛋白提取液。
3、 将匀浆液经200目细胞筛或3层纱布过滤,4℃ 1800g 离心,弃沉淀,留取上清。
4、 取上清液,4℃ 17000g 离心,弃上清液,留取沉淀。
5、 取50-150μl 线粒体膜蛋白提取液悬浮沉淀,即为线粒体膜蛋白,-70℃保存备用,进行后续的PAGE 、Western 、免疫沉淀和免疫共沉淀等操作。
注意事项:1、 如果裂解不充分可以适当增加裂解液的用量,如果需要高浓度的蛋白样品,可以适当减编号 名称PS0203 50T PS0203 100T Storage试剂(A): MP 裂解液250ml 500ml 4℃ 试剂(B): 蛋白酶抑制剂混合液(100×) 2.5ml 5ml -20℃ 避光 试剂(C): PMSF(100mM) 5ml10ml-20℃使用说明书1份少裂解液的用量。

线粒体dna分离试剂盒原理全文共四篇示例,供读者参考第一篇示例:线粒体DNA分离试剂盒原理是通过一系列化学反应和物理方法将细胞中的线粒体成功分离出来,进而提取其中的DNA。
线粒体DNA是细胞中的一个重要组成部分,它负责细胞能量代谢的调控,对细胞的正常功能发挥起着至关重要的作用。
分离线粒体DNA对于研究细胞的功能及疾病的发生机制具有重要意义。
线粒体DNA分离试剂盒原理主要包括以下几个步骤:细胞溶解。
在进行线粒体DNA的分离之前,首先需要将细胞溶解,使得线粒体能够从细胞内部被释放出来。
通常使用含有细胞膜破裂酶的缓冲液进行细胞溶解,破坏细胞膜结构,释放出细胞内的线粒体。
线粒体富集。
在细胞溶解后,线粒体和其他细胞器混合在一起,需要通过质量差异将线粒体富集起来。
这一步可以利用超速离心对细胞提取物进行离心分离,线粒体在特定离心速度下沉降速度比较快,因此可以富集到下沉的沉淀物中。
然后,DNA提取。
在线粒体获得富集后,接下来需要进行DNA的提取。
通过添加蛋白酶、盐溶液等进行线粒体膜的破裂,释放出线粒体内的DNA。
然后使用乙醇沉淀法或硅胶柱法将DNA分离出来,并通过离心将DNA沉淀下来。
纯化和检测。
分离出的线粒体DNA往往还会存在一定程度的杂质,需要进行纯化处理。
通过特定的柱式层析或凝胶电泳等方法进行DNA 的纯化,去除掉余留的蛋白质、RNA等杂质。
通过比色法或荧光定量等方法检测DNA的浓度和纯度,以确保获得的线粒体DNA能够用于后续的实验研究或分析。
线粒体DNA分离试剂盒原理是通过一系列化学反应和物理方法将细胞中的线粒体成功分离出来,提取其中的DNA,并进行纯化和检测,为后续的研究工作提供可靠的实验材料。
通过这一技术手段,研究人员可以更加深入地了解细胞内线粒体的功能及其在疾病发生中的作用,为疾病的诊断和治疗提供更多的理论依据。
【2000字】第二篇示例:线粒体DNA(mitochondrial DNA,简称mtDNA)是线粒体内含有的一种特殊的DNA,其具有独特的特性和功能。

线粒体dna分离试剂盒原理
线粒体DNA(mtDNA)分离试剂盒是一种用于从细胞提取中分离纯化线粒体DNA的工具。
线粒体是细胞的能量产生中心,其DNA在许多生物学研究中具有重要作用。
分离线粒体DNA的原理基于细胞裂解、质粒DNA和细胞核DNA的去除,从而提取纯化的线粒体DNA。
该试剂盒通常包含以下主要组分:
1. 细胞裂解缓冲液:含有特殊成分,能够破坏细胞膜,释放细胞质和线粒体。
2. 离心管:用于离心样本,分离纯化的线粒体DNA。
3. 膜过滤器:对细胞裂解液进行过滤,去除细胞碎片和其他杂质。
4. 乙醇:用于沉淀线粒体DNA。
线粒体DNA分离试剂盒的操作步骤如下:
1. 将待分离线粒体DNA的细胞样本收集并进行离心,去除培养介质。
2. 加入适量的细胞裂解缓冲液,将样本溶解,并破坏细胞膜,释放线粒体。
3. 通过离心步骤进行细胞碎片和大颗粒物质的去除。
将细胞裂解液转移到膜过
滤器中,离心滤去杂质。
4. 丢弃上清液,保留细胞裂解液中的纯化线粒体。
5. 加入乙醇,使线粒体DNA沉淀。
6. 进行离心步骤以沉淀线粒体DNA。
7. 弃上清液并使用适量的缓冲液洗涤线粒体DNA的沉淀物。
8. 最后,将纯化的线粒体DNA溶于适当的溶剂中,以备后续分子生物学研究
使用。
线粒体DNA分离试剂盒利用细胞裂解和离心技术,可以高效地提取纯化的线
粒体DNA,且能够去除细胞核DNA和其他污染物质。
这种纯化的线粒体DNA可
以用于许多应用,包括线粒体功能研究、群体遗传学、线粒体疾病相关研究等。
一步裂解法全血基因组DNA/线粒体DNA提取试剂使用说明本试剂盒由复合裂解液、蛋白沉淀液以及DNA溶解液组成。
可从全血中提取人基因组DNA/线粒体DNA(mtDNA)。
整个提取过程不超过45分钟。
提取过程包括:1裂解红细胞/白细胞核/线粒体。
2盐析沉淀蛋白,分离DNA。
3异丙醇沉淀脱盐并浓缩。
4 70%乙醇清洗,晾干并用DNA溶解液溶解。
本试剂盒采用复合裂解液,省去了第一代提取试剂的红细胞裂解的步骤,其中含有抑制DNA酶的成分,在加热(65°C)状态下,可保证完整的人基因组DNA、线粒体DNA(mtDNA)的充分裂解释放,异丙醇沉淀时,罕见浑浊的蛋白质杂质的共沉淀。
提取的基因组DNA长度大于20kb, 可用于PCR扩增、内切酶消化以及膜杂交等。
一、试剂盒组成(本试剂盒提供的组份, 至少可提取100份100ul全血样本的DNA,每种组份均有足够的富余量)1.复合裂解液:30ml×1瓶。
2.蛋白沉淀液:25ml×1瓶。
3.DNA溶解液:20ml×1瓶。
4.操作说明书一份。
二、本试剂盒未提供,须用户自备的试剂为:异丙醇,70%乙醇(国产分析纯)。
三、全血基因组/线粒体DNA提取操作准备:1.样本要求:用于DNA提取的全血应为抗凝血(EDTA, 肝素或柠檬酸钠抗凝),抗凝血在-20°C存放一个月以内,避免反复冻融。
4°C存放7天以内,均能纯化出高质量的DNA。
-80°C条件下,样本至少可存放2年。
2.全血需求量:根据需要,本试剂盒的复合裂解液,每300ul可以一次提取20-100ul全血。
如果按照每份提取全血/血清100ul来计算,总共可以提取100份全血/血清,提取试剂各组份用量与全血/血清提取量的对应关系见下面表格。
四、提取操作:以下按照提取100ul全血DNA来说明:1.将复合裂解液置65°C水浴加热,使结晶成分溶解,准备1.5-2ml离心管,每个离心管中分装加入300ul的复合裂解液。
纯化线粒体肿胀光度法概述纯化线粒体肿胀光度法是一种用于评估线粒体膨胀的实验方法。
线粒体是细胞内的重要器官,其功能异常与多种疾病的发生密切相关。
线粒体膨胀是一种线粒体损伤的早期指标,通过测量线粒体的膨胀程度可以评估细胞内的损伤程度。
实验步骤1. 提取线粒体1.1 采集适当数量的细胞,如肌肉组织或细胞培养物。
1.2 用低速离心将细胞分离。
1.3 用断头裂解缓冲液(Lysis Buffer)裂解细胞膜。
Lysis Buffer的配方通常包括0.1 M Tris-HCl(pH 7.4)、糖、盐和蛋白酶抑制剂。
1.4 通过离心将裂解的细胞离析为细胞裂解液和细胞残渣。
1.5 取得细胞裂解液,再次离心。
1.6 收集上清液,富集线粒体。
2. 纯化线粒体2.1 使用密度梯度离心法纯化线粒体。
2.2 准备线粒体纯化梯度液:将载有0.3 M 硫酸钾和0.225 M 蔗糖的离心管装满,再用上清液轻轻涂在底部。
2.3 加入适量的上清液,接着轻轻将细胞裂解液小心地倒入离心管上方。
2.4 进行高速离心,使线粒体在离心管中沉淀。
2.5 将沉淀的线粒体收集起来,用缓冲液洗涤。
2.6 用缓冲液重新悬浮线粒体。
3. 测定线粒体膨胀3.1 准备测定线粒体膨胀所需的试剂和设备,包括线粒体悬液、膨胀缓冲液和光度计。
3.2 在膨胀缓冲液中加入试剂,如脂质过氧化物诱导剂等。
3.3 加入线粒体悬液。
3.4 在一定的温度下,如37°C,孵育一段时间。
3.5 使用光度计测定线粒体的吸光度。
线粒体膨胀程度与吸光度强度呈正相关关系。
结果解读通过测定线粒体的吸光度,可以确定线粒体的膨胀程度。
吸光度越高,说明线粒体的膨胀程度越大,细胞内的损伤程度可能越严重。
应用领域纯化线粒体肿胀光度法被广泛应用于细胞生物学和药理学研究。
它可以用于评估药物对线粒体的影响,以及研究细胞损伤和死亡的机制。
此外,线粒体膨胀的评估也可作为相关疾病的诊断指标,如心肌缺血、中风等疾病。
胞浆线粒体蛋白抽提
试剂:胞浆线粒体分离试剂盒,碧云天,产品编号C3601,负20°冰箱分装保持。
步骤:1.收集细胞,并用冰PBS洗1-2次。
2.预处理:每1⨯ 106个细胞加50μl(这个是最多加50,否则提出的蛋白可能会太稀)线粒体分离剂(临用前在线粒体分离剂中加入100:1的PMSF),轻轻(必须轻,以免损坏线粒体膜)悬浮细胞,冰浴放置10-15min。
3.匀浆:用1ml注射器反复快速抽吸置于1.5mlEP管中的细胞,约10次。
(注:目的是刚好损坏细胞膜,而不损坏线粒体膜,可以取2μl细胞匀浆与5μl台盼蓝于玻片上,混匀后取小半片盖玻片盖住,显微镜观察刚好使大部分细胞台盼蓝染色即可,我的经验是10次的样子)
4.离心,600g,4℃,10min,弃沉淀(此沉淀为细胞核)
5.上清离心,11000g,4℃,10min
6.离心后小心吸出上清即为胞浆。
(每50μl约得到20μl的胞浆2-3μg/μL浓度)
7.沉淀再次离心吸去上清,每1⨯ 106个细胞加入10μl线粒体裂解液(临用前在线粒体裂解液中加入100:1的PMSF)即为线粒体蛋白。
我只做过胞浆细胞色素C检测,由于线粒体蛋白需要细胞量较大,没做线粒体蛋白细胞色素C检测。
线粒体蛋白提取1.线粒体蛋白抽取液配方(pH7.4):250mM蔗糖,20mM HEPES,10mM KCl,1.5mM MgCl2,1mM EDTA,1mM EGTA,1mM DTT, 17ug/mL PMSF, 8ug/mL aprotinin, 2ug/mL leupeptin;-20℃保存。
2.步骤:(1)收集5X10E7细胞,并用PBS洗细胞;(2)往细胞沉淀加入2mL上述抽取液,并混匀,可以采用超声或匀浆器方法破膜,程度至苔盼兰染色约90%的细胞为蓝色。
(3)750g,4℃离心5分钟,收集上清,此时沉淀即为细胞膜成分。
(4)13000rpm,4℃离心30分钟, 弃上清,此时沉淀即为线粒体成分。
(5)用100uL列解液重悬沉淀,-80℃保存备用.培养悬浮细胞全蛋白裂解的方法1.细胞裂解液(pH8.0)的配方:20mM Tris-Cl,1% NP-40, 137mM NaCl, 20mM DTT,2mM Sodium Vanadate,1ug/mL Aprotinin, 1ug/mL leupetin, 1mM PMSF;配好后分装-20℃保存,其中PMSF和蛋白酶抑制剂量使用时现加。
2.裂解方法:按1X106细胞/100uL的比例加细胞裂解液,混匀后冰浴30分钟, 12,000rpm, 4℃,离心10min, 实验时取25uL的上清加5uL 6X上样缓冲液煮沸5分钟使蛋白变性后,12000rpm离心5分钟,取上清和预染Marker加样电泳。
或-80℃保存备用。
细胞核蛋白质的提取2009-04-28 21:28一、试剂准备缓冲液A 缓冲液B10mmol/L HEPES-KOH pH7.9 20mmol/L HEPES-KOH pH7.91.5mmol/L MgCL2 1.5mmol/L MgCL210mmol/L KCL 420mmol/L NaCL0.5mmol/L DTT 0.2mmol/L EDTA0.2mmol/L PMSF 25% Glycerol0.5mmol/L DTT0.2mmol/L PMSF二、操作步骤1.去细胞培养液,用PBS(含0.05mmol/LPMSF)洗两次,用刮板将细胞刮下,计数细胞,收集于适当体积离心管,用少量PBS冲洗平皿一并吸入离心管。
蛋白质的定位与蛋白质裂解液的选择:全细胞:NP-40或RIPA细胞质(可溶):Tris-HCl细胞质(细胞骨架):Tris-Triton细胞膜:NP-40或RIPA细胞核:RIPA线粒体:RIPARIPA裂解液配方1ml RIPA buffer contains 35μl proteinase inhibitor and 10μl phosphatase inhibitorAprotinin 10μg/μl ;用10mM HEPES-KOH(PH8.0)溶解,备用。
●Nonidet P-40简称NP-40,乙基苯基聚乙二醇,常用非离子性去垢剂。
●Na-deoxycholale,脱氧胆酸钠,离子型去垢剂。
离子型去垢剂主要作用有:裂解细胞;溶解蛋白,尤其是可以溶解一些难溶于水的蛋白,如膜蛋白等;很适合做WB,但在Co-IP中使用,需要谨慎。
●亮抑霉肽(Leupeptin):抑制丝氨酸蛋白酶包括胰蛋白酶、纤溶酶、猪胰激肽原酶)和半胱氨酸蛋白酶(包括木瓜蛋白酶和组织蛋白酶B)●抑肽素A(Pepstatin A)抑制各种天门冬氨酸蛋白酶,例如组织蛋白酶D、肾素、胃蛋白酶、细菌天门冬氨酸蛋白酶和HIV蛋白酶;●胰凝乳蛋白酶抑制剂(Chymostatin)抑制具有糜蛋白酶类特异性丝氨酸蛋白酶(包括糜蛋白酶、胃促胰酶、组织蛋白酶G)和大多数丝氨酸蛋白酶(包括组织蛋白酶B,H,L)●抗木瓜蛋白酶(Antipain)抑制木瓜蛋白酶、胰蛋白酶和纤溶酶。
●氟化钠抑制酸性磷酸酶●正钒酸钠:抑制碱性磷酸酶和酪氨酸磷酸酶(tyrosine phosphatase)●焦磷酸钠(sodium pyrophosphate):抑制丝氨酸-苏氨酸磷酸酶(serine-threonine phosphatase)。
在与蛋白相关的检测中,首先最关键的一步便是蛋白质的提取。
蛋白质的提取过程中,我们要经常加和蛋白酶抑制剂以防止蛋白质的降解。
另外在磷酸化蛋白的研究过程中,磷酸酶抑制剂也是必不可少的,本文总结了常用的蛋白酶抑制剂PMSF,Leupeptin 亮肽素,Aprotinin 抑肽酶,Pepstatin胃蛋白酶抑制剂,EDTA-Na2等以及磷酸酶抑制剂NaF氟化钠,Na3VO4 原矾酸钠,BETA-glycerophosphate 甘油磷酸钠,Na2P2O4 焦磷酸钠等。