江西省新建二中高二化学上学期周练(13)(实验班)
- 格式:doc
- 大小:185.01 KB
- 文档页数:6

新建二中2013-2014学年上学期高三化学实验班周练(16)一、选择题(每题只有1个正确答案,每小题3分,共48分) 1. 下列说法中正确的是( )① Fe(OH)3胶体和CuSO 4溶液都是混合物;② BaSO 4是一种难溶于水的强电解质;③ 冰醋酸、纯碱、小苏打分别属于酸、碱、盐;④ 煤的干馏、煤的汽化和液化都属于化学变化; ⑤ 置换反应都属于离子反应;⑥ 根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体; ⑦ C 60、C 70、C 540互称为同素异形体,微粒中的化学键只有非极性共价键。
A .①②④⑦B .①②⑤⑥C .②③④⑥D .③④⑤⑦2.向一无色透明的溶液中滴加稀硫酸时有沉淀生成,且所得沉淀量与所加硫酸的关系如下图所示,则原溶液可能是( )A .Na 2SiO 3与Na 2CO 3的混合溶液B .Na 2S 和Na 2SO 3的混合溶液C .NaAlO 2与Na 2SiO 3的混合溶液D .Na 2SO 3与Na 2SiO 3的混合溶液 3.下列各组离子在指定的溶液中不能大量共存的是( )A .滴入KSCN 溶液显红色的溶液中:K +、Fe 2+、SO 42-、Cl -B .1 mol·L -1的烧碱溶液中:S 2-、SO 32-、SO 42-、K+C .使淀粉碘化钾试纸变蓝的溶液:Cs +、Ba 2+、S 2-、Cl -D .含有大量H C的澄清透明溶液中:K +、N 2-- 4. 2012年6 月24日午间,神九与天宫一号顺利完成了我国首次手控交会对接, 神九火箭中使用的燃料是偏二甲肼(CH 3-NH -NH -CH 3)和四氧化二氮(N 2O 4)。
在火箭升空过程中,燃料发生反应:CH 3-NH -NH -CH 3+2N 2O 4→2CO 2+3N 2+ 4H 2O 提供能量。
下列有关叙述正确的是( ) A .该燃料绿色环保,在燃烧过程中不会造成任何环境污染 B .该反应中N 2O 4是氧化剂,偏二甲肼是还原剂 C .CO 2是氧化产物,N 2是还原产物 D .每有0.6 mol N 2生成,转移电子数目为2.4NA5.下面是4种有机弱酸,强弱顺序为:下列说法中不正确的是( ) A .等浓度等体积的4种酸中和碱的能力: B .等浓度的4种酸溶液中水电离出的c 水(H +):>CH 2ClCOOH > >CHCl 2COOHC .反应+ 2CH 2ClCOO-+2CH 2ClCOOH 一定能够发生 D .由题中信息可推知酸性:CH 2FCOOH >CH 2ClCOOH 6.根据表中信息判断,下列选项不正确的是( )A .第①组反应的其余产物为 H 2O 和O 2B .第②组反应中Cl 2与FeBr 2的物质的量之比为1:2C .第③组反应中生成1molCl 2 转移电子2molD .氧化性由强到弱的顺序为MnO 4->Cl 2>Fe 3+>Br 2 7.下列溶液中微粒的物质的量浓度关系正确的是( )① pH 相同的CH 3COONa 溶液、C 6H 5ONa 溶液、Na 2CO 3溶液的浓度关系: c (CH 3COONa)<c (Na 2CO 3)< c (C 6H 5ONa)②0.2mol·L -1CH 3COONa 溶液和0.1mol·L -1HCl 溶液等体积混合后的溶液中:c (Na +)>c (Cl -)>c (CH 3COO -)>c (H +)>c (OH -)③0.1 mol·L -1某一元弱酸溶液中:c (H +)2=c (H +)·c (A 一)+K W④0.1 mol·L -1Na 2CO 3溶液与0.1 mol·L -1NaHCO 3溶液等体积混合c(C O 32-)+2c (O H -)=c(H C )+3c (H 2CO 3)+2c (H +)⑤等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数大小:N 前>N 后 ⑥0.1 mol·L -1Na 2S 溶液中:2c (Na +)=c (S 2-)+c (HS -)+c (H 2S) ⑦用某浓度的NaOH 标准溶液滴定未知浓度的HA 溶液滴定过程中,溶液中的离子浓度可能满足下列关系:c(A -)>c(Na +)>c(H +)>c(OH -) A .3个 B.4个 C.5个 D.6个 8.在体积为V L 的恒容密闭容器中盛有一定量H 2,通入Br 2(g)发生反应:H 2(g)+Br 2(g) 2HBr(g)△H<0。

江西省南昌市新建二中2024学年化学高二上期末达标检测模拟试题注意事项:1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案标号。
回答非选择题时,将答案写在答题卡上,写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
一、选择题(每题只有一个选项符合题意)1、下列微粒间的关系正确的是A.相同物质的量浓度的①NH4Cl 溶液、②(NH4)2SO4溶液、③NH4HSO4溶液、④(NH4)2SO3溶液,c(NH+):④>②>③>①4B.盐酸和稀NH4Cl溶液pH 都等于4,则c水(H+)前者与后者之比为1∶106C.向1 L 1 mol/L CH3COONa 中加入等体积等浓度的醋酸,溶液中c(CH3COO-)+c(CH3COOH)=2 mol/L D.0.01 mol/L Na2CO3溶液中,c(OH-)=c(HCO3-)+c(H2CO3)+c(H+)2、用N A表示阿佛加德罗常数,下列说法正确的是A.22.4L H2的物质的量约为1molB.标准状况下,11.2L H2O的物质的量约为0.5 molC.1 L 1mol/L的MgCl2溶液中Cl-的物质的量浓度为 2mol/LD.0.1mol铁与足量的盐酸完全反应,铁失去的电子数为0.3N A3、已知:H2(g)+F2(g)=2HF(g) ΔH=-270kJ·mol-1,下列说法正确的是:A.氟化氢气体分解生成氢气和氟气的反应是放热反应B.1mol H2与1mol F2反应生成2mol液态HF放出的热量小于270kJC.在相同条件下,1mol H2与1mol F2的能量总和小于2mol HF气体的能量D.该反应中的能量变化可用如图来表示4、下列关于化学反应速率的说法正确的是①有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子数目,从而使反应速率增大。
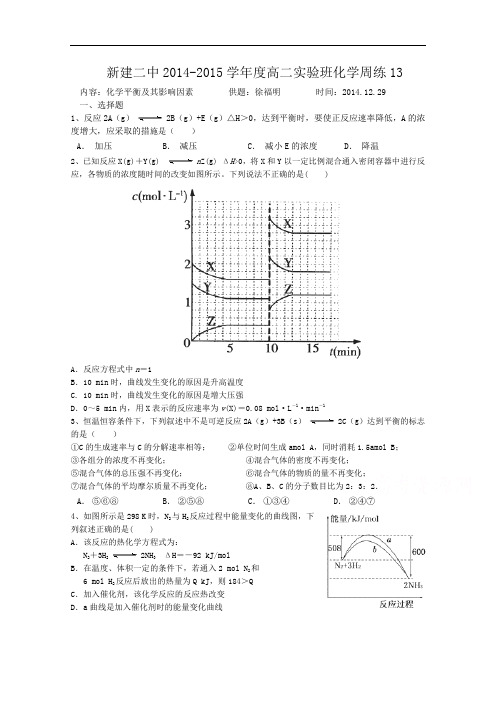
新建二中2014-2015学年度高二实验班化学周练13内容:化学平衡及其影响因素供题:徐福明时间:2014.12.29一、选择题1、反应2A(g)2B(g)+E(g)△H>0,达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是()2、已知反应X(g)+Y(g) n Z(g) ΔH>0,将X和Y以一定比例混合通入密闭容器中进行反应,各物质的浓度随时间的改变如图所示。
下列说法不正确的是( )A.反应方程式中n=1B.10 min时,曲线发生变化的原因是升高温度C. 10 min时,曲线发生变化的原因是增大压强D.0~5 min内,用X表示的反应速率为v(X)=0.08 mol·L-1·min-13、恒温恒容条件下,下列叙述中不是可逆反应2A(g)+3B(s)2C(g)达到平衡的标志的是()①C的生成速率与C的分解速率相等;②单位时间生成amol A,同时消耗1.5amol B;③各组分的浓度不再变化;④混合气体的密度不再变化;⑤混合气体的总压强不再变化;⑥混合气体的物质的量不再变化;⑦混合气体的平均摩尔质量不再变化;⑧A、B、C的分子数目比为2:3:2.4、如图所示是298 K时,N2与H2反应过程中能量变化的曲线图,下列叙述正确的是( )A.该反应的热化学方程式为:N2+3H22NH3ΔH=-92 kJ/molB.在温度、体积一定的条件下,若通入2 mol N2和6 mol H2反应后放出的热量为Q kJ,则184>QC.加入催化剂,该化学反应的反应热改变D.a曲线是加入催化剂时的能量变化曲线5、在容积不变的密闭容器中,在一定条件下发生反应:2A(?) B (g)+C(s),且达到平衡,当升高温度时,容器内气体的密度变大,则下列判断错误的是A.若正反应为吸热反应,则A为非气态B.若正反应为放热反应,则A为气态C.若在平衡体系中加入少量C,则该平衡不移动D.压强对该平衡的移动无影响6、已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确的是①生成物的百分含量一定增加②生成物的产量一定增加③反应物的转化率一定增大④反应物浓度一定降低⑤正反应速率一定大于逆反应速率⑥使用了合适催化剂A.①② B.②⑤ C.③⑤D.④⑥7、将相等物质的量的CO和H2O(g)混合,在一定条件下反应:CO(g)+ H2O(g)CO2(g)+ H2(g),达到平衡后CO的转化率为25%,平衡混合气体的密度是相同条件下氢气的倍数是A.46 B.23 C.11.5 D.5.758、一定温度下,向容积恒定的密闭容器中投入2molA和1molB,发生如下可逆反应:2A(g)+B(g)C(g)+D(s)。

新建二中2013-2014学年度高三化学实验班周练(10)一、选择题1.下列有关化学用语表示正确的是()A.四氯化碳分子比例模型: B.次氯酸的结构式为 H-Cl-OC.COS的电子式是S C OD. 18 8O2-离子结构示意图:2.下列说法正确的是( )①非金属元素构成的单质中一定存在共价键;②非金属之间形成的化合物一定是共价化合物;③非金属的气态氢化物中一定存在极性共价键;④离子化合物中一定含有离子键;⑤金属元素和非金属元素形成的化合物一定是离子化合物;⑥在一种化合物中只能存在一种类型的化学键;⑦含共价键的化合物不一定是共价化合物;⑧含离子键的化合物一定是离子化合物;⑨氯化钠和HCl溶于水都发生电离,克服粒子间作用力的类型相同A.③④⑦⑧B.①③④⑦⑧C.②⑤⑥⑧⑨ D.①④⑦⑨3.下列图中的大黑点代表原子序数从1~18号元素的原子实(原子实是原子除最外层电子后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表共价键。
下列各图4.下列表示对应化学反应的离子方程式错误的是()A.NaOH溶液与SO2反应,当n(NaOH):n(SO2) = 4:3时,4OH-+3SO2 =SO32-+2HSO3-+H2OB.在溴化亚铁溶液中通入过量的氯气:2Cl2+2Fe2++2Br-=2Fe3++4Cl-+Br2C.将SO2通入酸性KMnO4溶液中:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+D.向苯酚钠溶液中通入少量CO2:C6H5O-+CO2+H2O=C6H5OH+HCO3-5.短周期元素X、Y、Z、R、W五种元素原子序数依次增大,其中X与Z、Y与W分别为同族元素。
原子半径X<Y< W< R<Z,W原子的最外层电子数比内层电子总数少4,Z、R的核外电子数之和与Y、W核外电子数之和相等。
下列说法不正确的是()A.Y、Z、R的简单离子具有相同的电子层结构B.X2Y分子间存在氢键,故X2Y比X2W稳定C.X、Z分别与Y均可形成A2B与A2B2型化合物,且A2B2均有较强的氧化性D.由X、Y、Z形成的化合物能与X、Y、R形成的化合物发生反应6.现有A、B、C、D四种短周期非金属元素,原子最外层电子数之和为19。

2021年高二化学上学期周练(13)(实验班)内容:化学平衡及其影响因素时间:xx.12.29一、选择题1、反应2A(g)2B(g)+E(g)△H>0,达到平衡时,要使正反应速率降低,A 的浓度增大,应采取的措施是()B.减压C.减小E的浓度D.降温A.加压2、已知反应X(g)+Y(g) n Z(g) ΔH>0,将X和Y以一定比例混合通入密闭容器中进行反应,各物质的浓度随时间的改变如图所示。
下列说法不正确的是( )A.反应方程式中n=1B.10 min时,曲线发生变化的原因是升高温度C. 10 min时,曲线发生变化的原因是增大压强D.0~5 min内,用X表示的反应速率为v(X)=0.08 mol·L-1·min-13、恒温恒容条件下,下列叙述中不是可逆反应2A(g)+3B(s)2C(g)达到平衡的标志的是()①C的生成速率与C的分解速率相等;②单位时间生成amol A,同时消耗1.5amol B;③各组分的浓度不再变化;④混合气体的密度不再变化;⑤混合气体的总压强不再变化;⑥混合气体的物质的量不再变化;⑦混合气体的平均摩尔质量不再变化;⑧A、B、C的分子数目比为2:3:2.A.⑤⑥⑧B.②⑤⑧C.①③④D.②④⑦4、如图所示是298 K时,N2与H2反应过程中能量变化的曲线图,下列叙述正确的是( )A.该反应的热化学方程式为:N2+3H22NH3ΔH=-92 kJ/molB.在温度、体积一定的条件下,若通入2 mol N2和6 mol H2反应后放出的热量为Q kJ,则184>QC.加入催化剂,该化学反应的反应热改变D.a曲线是加入催化剂时的能量变化曲线5、在容积不变的密闭容器中,在一定条件下发生反应:2A(?)B (g)+C(s),且达到平衡,当升高温度时,容器内气体的密度变大,则下列判断错误的是A.若正反应为吸热反应,则A为非气态B.若正反应为放热反应,则A为气态C.若在平衡体系中加入少量C,则该平衡不移动D.压强对该平衡的移动无影响6、已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确的是①生成物的百分含量一定增加②生成物的产量一定增加③反应物的转化率一定增大④反应物浓度一定降低⑤正反应速率一定大于逆反应速率⑥使用了合适催化剂A.①② B.②⑤ C.③⑤D.④⑥7、将相等物质的量的CO和H2O(g)混合,在一定条件下反应:CO(g)+ H2O(g)CO2(g)+ H2(g),达到平衡后CO的转化率为25%,平衡混合气体的密度是相同条件下氢气的倍数是A.46 B.23 C.11.5 D.5.758、一定温度下,向容积恒定的密闭容器中投入2molA和1molB,发生如下可逆反应:2A(g)+B(g) C(g)+D(s)。

新建二中2013-2014届高三实验班化学周练五一、选择题(本题包括16小题,每小题3分,共48分,每小题只有一个选项符合题意) 1.SO2是常见的大气污染物之一,下列措施中能够减少SO2排放量的是( )①用天然气代替煤炭作民用燃料②使用水煤气或干馏煤气作燃料③硫酸厂使用V2O5作催化剂,加快SO2的转化速率④将块状煤粉碎,提高其燃烧效率⑤在煤中加入生石灰后燃用⑥循环处理吸收塔放出的尾气A.①②③④⑤ B.①③⑤⑥ C.①②⑤⑥ D.②③④⑥2.化学反应经常伴随着颜色变化,下列关于颜色的叙述正确的是()①淀粉溶液遇碘化钾——蓝色②FeSO4溶液中加入KSCN——红色③溴化银见光分解——白色④FeCl3溶液中加入铁粉——无色⑤新制氯水久置后——无色⑥过氧化钠在空气中久置——淡黄色⑦Fe(OH)2遇空气——红褐色⑧石蕊试液中通二氧化硫气体——无色⑨无水硫酸铜吸收水蒸气——浅绿色⑩含有酚酞的NaOH溶液中通入Cl2—红色A.2个B.3个C.4个D.5个3.下列说法中不正确的有()①氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂;②光照氯水有气泡逸出,该气体是Cl2;③燃煤时加入适量石灰石,可减少废气中SO2的量;④pH在5.6~7.0之间的降水通常称为酸雨;⑤室温下浓硫酸与铜片不会发生剧烈的化学反应,原因是铜被钝化。
⑥氯气易液化,液氯可以保存在钢瓶中;⑦常温下浓硫酸可以用铝制容器盛放;⑧分解高锰酸钾制氧气后,残留在试管内壁上的黑色物质可用稀盐酸洗涤A.2个B.3个C.4个D.5个4.按如图实验,反应后可能出现的现象是()A.a装置中有白色固体B.b装置中产生白色沉淀C.c装置中溶液先变红后褪色D.d装置中溶液变蓝色5.下列实验能证明某无色气体一定为SO2的是()①能使澄清石灰水变浑浊②能使湿润的蓝色石蕊试纸变红③能使品红试液褪色,加热后又显红色④通入足量NaOH溶液中,再滴加BaCl2溶液,有白色沉淀产生,该沉淀溶于稀盐酸⑤能使溴水褪色,再滴加酸化的BaCl2溶液有白色沉淀产生A.都能证明B.都不能证明C.③⑤D.③④⑤6.标准状况下,某同学向100 mLH2S饱和溶液中通入SO2,所得溶液pH变化如图所示,下列分析中正确的是( )A.ab段反应是:SO2+2H2S===3S↓+2H2OB.亚硫酸是比氢硫酸更弱的酸C.原H2S溶液的物质的量浓度为0.05 mol/LD.b点对应的溶液导电性最强7.下列除杂方法正确的是( )①Cl2(HCl):将混合气体通过碱石灰中;②HCl(C l2)将混合气体通入四氯化碳中;③H2S(HCl):将混合气体通入饱和硫化钠溶液中;④SO2(SO3):将混合气体通入98.3%的浓硫酸中;⑤CO2(SO2): 将混合气体通入硝酸钡溶液中;⑥CO2(CO):混合气体点燃即可;⑦SO2(SO3):将混合气体通入饱和亚硫酸氢钠溶液中。
新建二中2014-2015学年度高二实验班化学周练13内容:化学平衡及其影响因素供题:徐福明时间:2014.12.29一、选择题1、反应2A(g)2B(g)+E(g)△H>0,达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是()2、已知反应X(g)+Y(g) n Z(g) ΔH>0,将X和Y以一定比例混合通入密闭容器中进行反应,各物质的浓度随时间的改变如图所示。
下列说法不正确的是( )A.反应方程式中n=1B.10 min时,曲线发生变化的原因是升高温度C. 10 min时,曲线发生变化的原因是增大压强D.0~5 min内,用X表示的反应速率为v(X)=0.08 mol·L-1·min-13、恒温恒容条件下,下列叙述中不是可逆反应2A(g)+3B(s)2C(g)达到平衡的标志的是()①C的生成速率与C的分解速率相等;②单位时间生成amol A,同时消耗1.5amol B;③各组分的浓度不再变化;④混合气体的密度不再变化;⑤混合气体的总压强不再变化;⑥混合气体的物质的量不再变化;⑦混合气体的平均摩尔质量不再变化;⑧A、B、C的分子数目比为2:3:2.4、如图所示是298 K时,N2与H2反应过程中能量变化的曲线图,下列叙述正确的是( )A.该反应的热化学方程式为:N2+3H22NH3ΔH=-92 kJ/molB.在温度、体积一定的条件下,若通入2 mol N2和6 mol H2反应后放出的热量为Q kJ,则184>QC.加入催化剂,该化学反应的反应热改变D.a曲线是加入催化剂时的能量变化曲线5、在容积不变的密闭容器中,在一定条件下发生反应:2A(?) B (g)+C(s),且达到平衡,当升高温度时,容器内气体的密度变大,则下列判断错误的是A.若正反应为吸热反应,则A为非气态B.若正反应为放热反应,则A为气态C.若在平衡体系中加入少量C,则该平衡不移动D.压强对该平衡的移动无影响6、已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确的是①生成物的百分含量一定增加②生成物的产量一定增加③反应物的转化率一定增大④反应物浓度一定降低⑤正反应速率一定大于逆反应速率⑥使用了合适催化剂A.①② B.②⑤ C.③⑤D.④⑥7、将相等物质的量的CO和H2O(g)混合,在一定条件下反应:CO(g)+ H2O(g)CO2(g)+ H2(g),达到平衡后CO的转化率为25%,平衡混合气体的密度是相同条件下氢气的倍数是A.46 B.23 C.11.5 D.5.758、一定温度下,向容积恒定的密闭容器中投入2molA和1molB,发生如下可逆反应:2A(g)+B(g)C(g)+D(s)。
新建二中2013-2014学年上学期高三化学实验班周练(15)一、选择题1.以下说法:①福尔马林和纯盐酸都是混合物; ②沼气和核能都是可再生能源; ③冰和干冰既是纯净物又是化合物; ④不锈钢和建筑用螺纹钢都是合金; ⑤臭氧层的破坏和空气液化制取氮气都是发生物理变化; ⑥氯水使红墨水褪色原理和NH 4HSO 3溶液使KMnO 4溶液褪色原理相同; ⑦豆浆和雾都是胶体。
上述说法正确的是( ) A .①②③④B .①②⑤⑥C .③⑤⑥⑦D .①③④⑦2.下列有关叙述正确的是( )A .AlCl 3、FeCl 3、NaHCO 3固体均不能采用将溶液直接蒸干的方法制备B .澄清石灰水与过量小苏打溶液混合的离子方程式为:Ca 2++ OH -+HCO 3-= CaCO 3↓ + H 2OC .用氨水和硫酸不能鉴别AgNO 3、BaCl 2、K 2SO 3和Mg(NO 3)2四种溶液(不考虑它们间的相互反应)D .Al+NaOH+H 2O→NaAlO 2+H 2↑,Br 2+SO 2+H 2O→H 2SO 4+HBr 反应中水的作用相同 3.设N A 为阿佛加德罗常,下列叙述正确的是( )A .在100mL0.5mol/LCH 3COOH 溶液中CH 3COOH 分子数等于0.05N AB .在标况下,22.4L 辛烷含共价键数为25N AC .已知PbI 2的K SP =7.0×10-9,将1.0×10-2mol/L 的KI 与Pb(NO 3)2溶液等体积混合,则生成PbI 2沉淀所需Pb(NO 3)2溶液的最小浓度为5.6×10-4mol/L D .25℃时,1LpH=13的Ba (OH )2溶液中含有OH -数目为0.2N A 4.下列各组离子在指定溶液中能大量共存的是( )①常温下,c (H +)/c (OH 一)=1×10-12的溶液:K +、AlO 2—、CO 32—、Na +②加入苯酚显紫色的溶液:K +、NH 4+、Cl —、I 一③使甲基橙变红的溶液中:Fe 3+、Al 3+、NO 3—、SO 42—④使pH 试纸变蓝的溶液中:Al 3+、Na +、SO 42—、Cl 一⑤无色溶液中:K +、Al 3+、NO 3—、HCO 3—⑥常温条件下,()Kw c H=0.1 mol/L 的溶液:Na +、K +、SiO 32-、CO 32-A .②③B .①③⑥C .①③⑤D .①④⑤ 5.玻璃棒是化学实验中常用的仪器,其作用是用于搅拌、过滤或转移液体时引流。
2022-2021学年江西省南昌市新建二中高三(上)周练化学试卷(4)(试验班)一、选择题(共16小题,每小题3分,满分48分)1.(3分)(2021秋•龙泉驿区校级月考)硅被誉为无机非金属材料的主角.据2001年12月的《参考消息》报道,有科学家提出硅是“21世纪的能源”“将来的石油”.下列有关说法正确的是()A.地壳中硅的含量居其次位,在地球上有丰富的单质硅资源,如石英、水晶、玛瑙的主要成分都是单质硅B.硅相对于氢气便于运输、贮存,从平安角度考虑,硅是有开发价值的燃料C.常见的易溶硅酸盐是硅酸钠,硅酸钠是制备硅胶和木材防火剂的重要原料,试验室存放硅酸钠溶液的试剂瓶应用细口玻璃瓶并配磨口玻璃塞D.硅是一种良好的半导体材料,也是制造光导纤维的一种基本原料2.(3分)(2021秋•湖州期末)歌曲《青花瓷》中所描绘的“瓶身描绘的牡丹一如你初妆”、“色白花青的锦鲤跃然于碗底”等图案让人赏心悦目,但古瓷中所用颜料成分始终是个谜,近年来科学家才得知大多为硅酸盐,如蓝紫色的硅酸铜钡(BaCuSi2O x,铜的化合价为+2),下列关于硅酸铜钡的说法不正确的是()A.可用氧化物形式表示为BaO•CuO•2SiO2B.性质稳定,不易脱色C.易溶于强酸和强碱D.x等于63.(3分)(2022•南京模拟)二氧化硅(SiO2)又称硅石,是制备硅及其化合物的重要原料(如图所示).下列说法正确的是()A.S iO2既能与HF反应,又能与NaOH反应,属于两性氧化物B.盛放Na2CO3溶液的试剂瓶不能用玻璃塞C.硅胶吸水后不能重复使用D.图中所示转化反应都是氧化还原反应4.(3分)(2022•安庆二模)化学家Seidel指出Si与NaOH溶液的反应,首先是Si与OH﹣反应,生成Si044﹣,然后Si044﹣快速水解生成H4Si04,下列有关说法正确的是()A.原硅酸钠(Na4Si04)能快速水解,且水解后呈碱性,故Na4Si04为弱电解质B.石英玻璃、一般玻璃、陶瓷及水泥均属于硅酸盐产品C.2HCl+Na2Si03═H2Si03↓+2NaCl说明Cl的非金属性大于Si D.半导体工业所说的“从沙滩到家庭”是指:将二氧化硅制成晶体硅5.(3分)用4种溶液进行试验,下表中“操作及现象”与“溶液”对应关系错误的是()选项操作及现象溶液A 通入CO2,溶液变浑浊.再上升至65℃以上,溶液变澄清.C6H5ONa溶液B 通入CO2,溶液变浑浊.连续通CO2至过量,浑浊消逝.Na2SiO3溶液C 通入CO2,溶液变浑浊.再加入品红溶液,红色褪去.Ca(ClO)2溶液D 通入CO2,溶液变浑浊.连续通CO2至过量,浑浊消逝.再加入足量NaOH溶液,又变浑浊.Ca(OH)2溶液A.A B.B C.C D.D6.(3分)下列离子方程式书写错误的是()A.漂白粉溶液中加氯化铁溶液产生大量红褐色沉淀:Fe3++3ClO﹣+3H2O═Fe(OH)3↓+3HClOB.C l2通入FeBr2溶液中,Cl2与FeBr2物质的量之比4:5:10Fe2++6Br﹣+8Cl2═10Fe3++3Br2+16Cl﹣C.次氯酸钙溶液中通入过量的二氧化硫气体:ClO﹣+H2O+SO2═HSO3﹣+HClOD.将确定量的KAl(SO4)2溶液和确定量的Ba(OH)2溶液混合,沉淀的质量恰好达到最大时:Al3++2SO42﹣+4OH﹣+2Ba2+═2BaSO4↓+AlO2﹣+2H2O7.(3分)(2010•泰州二模)向碘酸钠(NaIO3)的碱性溶液中通入氯气,可以得到高碘酸钠(Na2H3IO6).下列有关该反应的说法中错误的是()A.在该反应中碘酸钠作还原剂B.碱性条件下,氯气的氧化性强于高碘酸钠的C.反应中生成1 mol Na2H3IO6转移2 mol电子D.反应中氧化产物与还原产物的物质的量之比为2:18.(3分)(2022•江苏)在探究新制饱和氯水成分的试验中,下列依据试验现象得出的结论不正确的是()A.氯水的颜色呈浅黄绿色,说明氯水中含有Cl2B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl﹣C.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+D.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO9.(3分)(2022•上海)图所示是验证氯气性质的微型试验,a、b、d、e是浸有相关溶液的滤纸.向KMnO4晶体滴加一滴浓盐酸后,马上用另一培育皿扣在上面.已知:2KMnO4+16HCl→2KCl+5Cl2↑+2MnCl2+8H2O 对试验现象的“解释或结论”正确的是()选项试验现象解释或结论A a处变蓝,b处变红棕色氧化性:Cl2>Br2>I2B c处先变红,后褪色氯气与水生成了酸性物质C d处马上褪色氯气与水生成了漂白性物质D e处变红色还原性:Fe2+>Cl﹣A.A B.B C.C D.D10.(3分)(2022秋•金乡县校级期末)下列各组物质依次满足如图所示转化关系的是(图中箭头表示一步转化)()a b c d①Si SiO2H2SiO3Na2SiO3②Al AlCl3NaAlO2Al(OH)3③Cu CuO Cu(OH)2CuSO4④Na NaOH Na2CO3NaHCO3A.①②B.②③C.③④D.②④11.(3分)(2022秋•杭州校级期中)Cl2、HCl的混合气体通入足量的氢氧化钠溶液,充分反应后分析产物溶液中除大量OH﹣外,还有Cl﹣、ClO﹣、ClO3﹣,并知这三种离子的物质的量比为9:2:1.试问原混合气体中Cl2与HCl体积比为()A.2:5 B.3:1 C.5:2 D.1:112.(3分)(2021秋•上高县校级月考)某无色溶液中含有:①K+、②Ba2+、③Cl﹣、④Br﹣、⑤SO、⑥CO、⑦SO中的一种或几种,依次进行下列试验,且每步所加试剂均过量,观看到的现象如下:步骤操作现象①用pH试纸检验溶液的pH大于7②向溶液中滴加氯水,再加入CCl4振荡,静置CCl4层呈橙色③向②所得溶液中加入Ba(NO3)2溶液和稀HNO3有白色沉淀产生④过滤,向滤液中加入AgNO3溶液和稀HNO3有白色沉淀产生下列结论正确的是()A.可能含有的离子是①②⑦B.确定没有的离子是②⑤⑥C.不能确定的离子是①③⑦D.确定含有的离子是①④13.(3分)(2022•朝阳区校级四模)在确定条件下,等物质的量的氯气与碘单质反应,得到一种红棕色液体ICl,ICl有很强的氧化性.现有下列两个反应:①2ICl+2Zn=ZnCl2+ZnI2②ICl+H2O=HCl+HIO下列叙述正确的是()A.C l2与I2生成IC1是非氧化还原反应B.反应①中,ZnI2只是氧化产物C.反应①中,当转移0.4mol电子时生成13.6gZnCl2D.反应②中,IC1既是氧化剂又是还原剂14.(3分)(2021•湖州模拟)依据图海水综合利用的工业流程图,推断下列说法正确的是()已知:MgCl2•6H2O受热生成Mg(OH)Cl和HCl气体等.A.过程①的提纯是物理过程,过程②通过氧化还原反应可产生2种单质B.在过程③中将MgCl2•6H2O灼烧即可制得无水MgCl2C.在过程④、⑥反应中每氧化0.2 mol Br﹣需消耗0.1mol Cl2D.过程⑤在生产中无需解决其对金属设备的腐蚀问题15.(3分)(2021•上饶模拟)将确定量的氯气通入30mL浓度为10.00mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系.下列推断正确的是()A.与NaOH反应的氯气确定为0.3 molB.n(Na+):n(Cl﹣)可能为7:3C.若反应中转移的电子为n mol,则0.15<n<0.25D.n(NaCl):n(NaClO):n(NaClO3)可能为11:2:116.(3分)(2022•大连模拟)氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:a HClO3=bO2↑+c Cl2↑+d HClO4+e H2O.下列有关说法不正确的是()A.由反应可确定:氧化性HClO3>O2B.由非金属性Cl>S,可推知酸性HClO3>H2SO4C.若氯酸分解所得混合气体,lmol混合气体质量为45g,则反应方程式可表示为:3HClO3=2O2↑+Cl2↑+HClO4+H2OD.若化学计量数a=8,b=3,则该反应转移电子数为20e﹣二、解答题(共5小题,满分0分)17.(2022春•嵊泗县校级月考)无论是从在国民经济中的地位来看,还是从科学进展的角度来看,硅都发挥着重要的作用.(1)人类使用硅酸盐产品(陶瓷等)的历史已经快一万年了,但在1823年才获得单质硅,瑞典化学家贝采尼乌斯用金属钾还原SiF4获得单质硅,写出化学方程式.(2)由于制取方法和条件的不同,得到的单质硅形态不同,其性质也不同.①用铝热法还原氟硅酸钾制得较纯洁的晶体硅:4Al+3K2SiF 63Si+2KAlF4+2K2AlF5,关于该反应的说法正确的是(填序号).A.Al是还原剂B.氧化产物只有KAlF4C.每转移6N A电子,得到42g Si D.Al元素在KAlF4和K2AlF5中化合价不同②用白砂子与镁粉混合在高温条件下得到无定形硅,反应的化学方程式为.(3)在野外,为了快速得到氢气,用硅粉与干燥的Ca(OH)2和NaOH混合,并加强热,即可快速得到H2、Na2SiO3、CaO.这种混合物叫做生氢剂.请写出该反应的化学方程式.18.(2021•丹东一模)晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:①高温下用碳还原二氧化硅制得粗硅②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl SiHCl3+H2③SiHCl3与过量H2在1100℃反应制得纯硅,已知SiHCl3能与H2O猛烈反应,在空气中易自燃.请回答下列问题:(1)第①步制备粗硅的化学反应方程式为.(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl (沸点﹣84.7℃),提纯SiHCl3接受的方法为.(3)用SiHCl3与过量H2反应制备纯硅的装置如图(热源及夹持装置略去):①装置B中的试剂是.装置C中的烧瓶需要加热,其目的是.②反应一段时间后,装置D中观看到的现象是,装置D中发生反应的化学方程式为.③为保证制备纯硅试验的成功,操作的关键是检查试验装置的气密性,把握好反应温度以及.④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是.a.碘水b.氯水c.NaOH溶液d.KSCN溶液e.Na2SO3溶液.19.A、B、C、D均为中学化学常见的纯洁物,A是单质.它们之间有如图的反应关系:(1)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体.写④反应离子方程式.(2)若A是太阳能电池用的光伏材料.C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性.写出②反应的化学方程式.D的化学式是.(3)若A是应用最广泛的金属.④反应用到A,②⑤反应均用到同一种非金属单质.C的溶液用于蚀刻印刷铜电路板,写出该反应的离子方程式.20.(2021•太原二模)如图是试验室制备氯气并进行一系列相关试验的装置(夹持设备已略).(1)制备氯气选用的药品为:漂粉精固体和浓盐酸,相关的化学反应方程式为:.(2)装置B中饱和食盐水的作用是;同时装置B亦是平安瓶,监测试验进行时C中是否发生堵塞,请写动身生堵塞时B中的现象.(3)装置C的试验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入.a b c dI 干燥的有色布条干燥的有色布条潮湿的有色布条潮湿的有色布条II 碱石灰硅胶浓硫酸无水氯化钙III 潮湿的有色布条潮湿的有色布条干燥的有色布条干燥的有色布条(4)设计装置D、E的目的是比较氯、溴、碘的非金属性.当向D中缓缓通入确定量氯气时,可以看到无色溶液渐渐变为色,说明氯的非金属性大于溴.(5)打开活塞,将装置D中少量溶液加入装置E中,振荡.观看到的现象是.(6)有人提出,装置F中可改用足量的NaHSO3溶液吸取余氯,试写出相应的离子反应方程式:,推断改用NaHSO3溶液是否可行(填“是”或“否”).21.某化学活动小组设计如图所示(部分夹持装置已略去)试验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质的成分.(1)写出装置A中发生反应的离子方程式:..(2)向C装置中通入确定量的氯气后,测得只生成一种气体(常温下为红黄色,且为氯的氧化物).可以确定的是C得到的固体最多含有三种物质,含有氯元素的盐只有一种,且确定含有NaHCO3,现对C中得到的固体成分进行猜想和验证.①提出合理猜想:确定含有NaHCO3和;可能含有剩余的Na2CO3.②设计方案,进行成分检验:请完成试验步骤3、4以及预期现象和结论并将答案填入下表的相应空格内.限选试验试剂:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、品红、稀盐酸.实验步骤预期现象和结论步骤1:取C中的少量固体样品于试管中,加入蒸馏水至固体溶解,然后各取1~2mL所得溶液分别置于得到无色溶液甲、乙两支试管中.步骤2:向甲试管中加入过量的BaCl2溶液,静置.若溶液变浑浊,证明固体中含有.步骤3:取甲试管中上层清液少许于另一只试管中,滴加少量,充分振荡.若,证明固体中含有NaHCO3.步骤4:向乙试管中.若;证明固体中含有.(3)完成C中反应的化学方程式:2Cl2+2Na2CO3+H2O═.。
江西省新建二中2014-2015学年高二化学上学期周练(13)(实验班)内容:化学平衡及其影响因素时间:2014.12.29一、选择题1、反应2A(g)2B(g)+E(g)△H>0,达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是()A.加压B.减压C.减小E的浓度D.降温2、已知反应X(g)+Y(g) n Z(g) ΔH>0,将X和Y以一定比例混合通入密闭容器中进行反应,各物质的浓度随时间的改变如图所示。
下列说法不正确的是( )A.反应方程式中n=1B.10 min时,曲线发生变化的原因是升高温度C. 10 min时,曲线发生变化的原因是增大压强D.0~5 min内,用X表示的反应速率为v(X)=0.08 mol·L-1·min-13、恒温恒容条件下,下列叙述中不是可逆反应2A(g)+3B(s)2C(g)达到平衡的标志的是()①C的生成速率与C的分解速率相等;②单位时间生成amol A,同时消耗1.5amol B;③各组分的浓度不再变化;④混合气体的密度不再变化;⑤混合气体的总压强不再变化;⑥混合气体的物质的量不再变化;⑦混合气体的平均摩尔质量不再变化;⑧A、B、C的分子数目比为2:3:2.A.⑤⑥⑧B.②⑤⑧C.①③④D.②④⑦4、如图所示是298 K时,N2与H2反应过程中能量变化的曲线图,下列叙述正确的是( )A.该反应的热化学方程式为:N2+3H22NH3ΔH=-92 kJ/molB.在温度、体积一定的条件下,若通入2 mol N2和6 mol H2反应后放出的热量为Q kJ,则184>QC.加入催化剂,该化学反应的反应热改变D.a曲线是加入催化剂时的能量变化曲线5、在容积不变的密闭容器中,在一定条件下发生反应:2A(?) B (g)+C(s),且达到平衡,当升高温度时,容器内气体的密度变大,则下列判断错误的是A.若正反应为吸热反应,则A为非气态B.若正反应为放热反应,则A为气态C.若在平衡体系中加入少量C,则该平衡不移动D.压强对该平衡的移动无影响6、已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确的是①生成物的百分含量一定增加②生成物的产量一定增加③反应物的转化率一定增大④反应物浓度一定降低⑤正反应速率一定大于逆反应速率⑥使用了合适催化剂A.①② B.②⑤ C.③⑤D.④⑥7、将相等物质的量的CO和H2O(g)混合,在一定条件下反应:CO(g)+ H2O(g)CO2(g)+ H2(g),达到平衡后CO的转化率为25%,平衡混合气体的密度是相同条件下氢气的倍数是A.46 B.23 C.11.5 D.5.758、一定温度下,向容积恒定的密闭容器中投入2molA和1molB,发生如下可逆反应:2A(g)+B(g)C(g)+D(s)。
达到平衡时,测得压强为原压强的。
则A的转化率为A.25% B.40% C.50% D .75%9、(实)已知工业上真空炼铷的原理如下:2RbCl+Mg MgCl2+2Rb(g),对于此反应的进行能给予正确解释的是 ( )A.铷的金属活动性不如镁强,故镁可置换铷B.铷的沸点比镁低,把铷蒸气抽出时,平衡右移C.MgCl2的热稳定性不如Rb强D.铷的单质状态较化合态更稳定10、(实)一定条件下的密闭容器中有如下反应:4NH3(g)+5O2(g)4NO(g)+6H2O(g)△H=﹣905.9kJ•mol﹣1,下列叙述正确的是()A.4 mol NH3和5 mol O2反应,达到平衡时放出热量为905.9 kJB.平衡时5v正(O2)=4 v逆(NO)C.平衡后减小压强,混合气体平均摩尔质量增小D.达到化学平衡时,若增大容器体积,则正反应速率减小,逆反应速率增大11、(实)下图所示的直型石英玻璃封管中充有CO气体,左端放置不纯的镍(Ni)粉。
在一定条件下,Ni可以与 CO(g)发生如下反应:但Ni粉中的杂质不与CO(g)发生反应。
玻璃管内左右两端的温度分别稳定在350K和470K,经过足够长时间后,右端的主要物质是A.纯Ni(s)和Ni(CO)4(g) B.纯Ni(s)和CO(g)C.不纯Ni(s)和CO(g) D.不纯Ni(s)和Ni(CO)4(g)二、填空题12、在一密闭容器中发生反应N 2+3H22NH3,ΔH<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:回答下列问题:(1)处于平衡状态的时间段是__________(填选项)。
A.t0~t1 B.t1~t2 C.t2~t3D.t3~t4 E.t4~t5 F.t5~t6(2)t1、t3、t4时刻分别改变的一个条件是(填选项),t1时刻________; t4时刻________。
A.增大压强 B.减小压强 C.升高温度D.降低温度 E.加催化剂 F.充入氮气(3)依据(2)中的结论,下列时间段中,氨的百分含量最高的是__________(填选项)。
A.t0~t1 B.t2~t3 C. t3~t4 D.t5~t6 (4)一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20%,则反应后与反应前的混合气体体积之比为__________。
13、800℃时,在2L密闭容器中发生2NO(g)+O 2(g)2NO2(g),测得n(NO)随时间的变化如下表:时间(s) 0 1 2 3 4 5n(NO)(mol) 0.20 0.10 0.08 0.07 0.07 0.07(1)用O2表示2s时该反应的平均速率v =__________________。
(3)能说明该反应已经达到平衡状态的是___________。
A.v(NO2)=2v(O2) B.容器内压强保持不变C.v逆(NO)=2v正(O2) D.容器内气体的密度保持不变(3)下列操作中,能使该反应的反应速率增大,且平衡向正反应方向移动的是_______。
A.及时分离出NO2气体 B.适当升高温度C.增大O2的浓度 D.选择高效的催化剂(4)下图中的曲线表示的是其他条件一定时,反应:2NO(g)+O2(g)2NO2(g)中NO的平衡转化率与温度的关系。
图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是() 。
A.a点B.b点C.c点D.d点14、容积的相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2(g)+O2(g)2SO3(g),并达到平衡状态。
在这个过程中,甲容器保持压强不变,乙容器保持容积不变。
(1)起始时:甲容器中SO2的速率___________乙容器中SO2的速率(填:“>”“<”或“=”) 反应开始后:甲容器中SO2的速率___________乙容器中SO2的速率(填:“>”“<”或“=”) (2)达到平衡所需的时间:甲容器___________乙容器(填:“>”“<”或“=”)(3)若甲容器中SO2的平衡转化率为P%,则乙容器中SO2的平衡转化率 _______P%(填:“>”“<”或“=”)15.在100 ℃和200 kPa的条件下,反应aA(g)bB(g)+cC(g)建立平衡后,在不加入任何物质的条件下逐步增大体系的压强(维持温度不变),下表列出的不同压强下反应建立平衡时物压强(kPa) 200 500 1 000B的浓度(mol·L-1) 0.04 0.1 0.27(1)压强从200 kPa增加到500 kPa时,平衡移动(填“正向”“逆向”或“不”),理由是。
(2)压强从500 kPa增加到1 000 kPa时,平衡转移(填“正向”“逆向”或“不”),其原因可能是。
新建二中2014-2015学年度高二实验班化学周练13 班级:姓名:学号:得分:题号 1 2 3 4 5 6 7 8 9 10 11选项12、(1)___________(2)______________ ________________(3)________________(4)________________13、(1)_________________________(2)_____________________________(3)__________________________(4)____________________________14(1)____________ _____________(2)__________________________(3)___________________________15.(1)_____________ ___________________________________________(2)___________ _____________________________________实验班周练13参考答案题号 1 2 3 4 5 6 7 8 9 10 11 选项 D B A B D B C A B C B12、13、(9分,每个答案2分)(1)1.5×10-2mol·L-1·s-1 或0.015 mol·L-1·s-1 ;(1分)14.= > < <15. (1)不浓度增加的倍数等于体积减小的倍数(2)正向c液化了实验班周练13参考答案题号 1 2 3 4 5 6 7 8 9 10 11 选项 D B A B D B C A B C B12、13、(9分,每个答案2分)(1)1.5×10-2mol·L-1·s-1 或0.015 mol·L-1·s-1 ;(1分)14.= > < <15. (1)不浓度增加的倍数等于体积减小的倍数(2)正向c液化了。