高二化学导学案:2.2 分子的立体构型(第2课时)(新人教版选修三).pdf
- 格式:pdf
- 大小:381.12 KB
- 文档页数:6

2.2 分子的立体构型导学案导(3分钟)回顾共价键的有关知识。
[学习目标]1、会分析价层电子对,掌握价层电子对互斥理论;2、理解杂化轨道理论;3、理解配合物理论。
[教学重点] 1.根据价层电子对理论判断分子的立体构型。
2.会判断杂化类型,分析配合物的组成。
[教学难点]分子的立体构型的判断。
思一、价层电子对互斥理论要点:①中心原子的价层电子对数决定分子或离子的立体构型。
②价层电子对尽可能彼此远离,使它们之间斥力最小。
③价层电子对指的是形成σ键的电子对和孤电子对。
④孤电子对的存在,增加了电子对间的排斥力,影响了分子中的键角,会改变分子构型的基本类型。
二、推测步骤:(对于AB n型分子或离子)1.确定中心原子(A)的价层电子对数:中心原子的价层电子对数=σ键的电子对数+孤电子对数。
①确定σ键的电子对数:A、B两原子以共价键结合时,不论是通过单键、双键还是三键相连接,都有σ键,所以σ键的电子对数就是与中心原子连接的原子数,即B原子的数目,所以σ键的电子对数=n.②确定中心原子的孤电子对数:中心原子A 上的孤电子对数=12(a-xb )其中: a 当为分子时a 为____________________________ 当为阳离子时a 为____________ 当为阴离子时a 为________________________b 指的是_____________________x 指的是_____________________________。
2.确定价层电子对的空间构型:由于价层电子对之间的相互排斥作用,它们趋向于尽可能彼此远离。
明确价层电子对的空间构型(VSEPR 模型)与价层电子对数目之间的关系(2对——直线形、3对——平面正三角形、4对——正四面体形)。
3.分子或离子空间构型的确定:如果分子或离子中没有孤电子对,价层电子对构型就是分子或离子的空间构型; 若有孤电子对,略去孤电子对就是分子或离子的空间构型。

《第二节分子的立体构型》教学设计一、教材分析本节课是选修3的第二章第二节内容,是在必修2已介绍共价键的知识基础上,介绍分子的立体结构。
本节内容对空间想象能力要求较高,但不必讲解太深,能根据价层电子对互斥理论对简单共价分子结构的多样性和复杂性进行解释即可。
二、学情分析学生的空间想象思维较弱,相关知识的链接不够,在教学中需要细致把握。
但另一方面本节知识属于化学理论教学和已有知识关联度较少,通过设计引导能取得很好教学效果。
三、考纲要求:1、认识共价分子的多样性和复杂性2、初步认识价层电子对互斥模型;3、能用VSEPR模型预测简单分子或离子的立体结构四、教学目标知识与技能1、使学生正确理解价层电子对互斥理论2、学会分析分子的立体构型能力培养1、通过价层电子对互斥理论的教学,提升学生化学理论素养。
2、通过探究分子的立体构型,培养学生空间想象能力,自学能力。
情感价值观的培养通过学习培养学生独立思考、积极进取的精神,用数学的思想解决化学问题的能力。
切身感悟化学学科的奇妙,体验探究中的困惑、顿悟、喜悦;在质疑、体会、反思中提升自身素质。
五、重点难点1、分子的立体构型2、价层电子对互斥理论六、教学方法探究式教学法,模型构造,学生自主学习,多媒体。
七、教学过程[复习回顾]σ键成键方式“头碰头”,呈轴对称1.共价键的类型π键成键方式“肩并肩”,呈镜像对称2.判断规律共价单键是σ键,共价双键中一个是σ键,另一个是π键,共价三键中一个是σ键,另两个为π键键能衡量化学键稳定性键参数键长键角描述分子的立体结构的重要因素[板书] 第二节分子的立体构型[提问] 什么是分子的立体构型?[学生回答] 分子的立体构型是指多原子分子构成的分子中原子的空间位置关系。
[追问] 双原子分子存在立体结构吗?[过渡] 多原子分子的立体结构是什么构型呢?[板书] 一.形形色色的分子[学生活动] 看大屏幕1、双原子分子:直线形O2HCl2、三原子分子立体结构(直线形CO2和V形H2O)3、四原子分子立体结构(直线形C2H2、平面三角形CH2O、三角锥形NH3、正四面体P4)4、五原子分子立体结构(最常见的是正四面体CH4)5、其他[问题导入] 1、同为三原子分子,CO2和H2O 分子的空间结构却不同,为什么?同为四原子分子,CH2O与NH3分子的空间结构也不同,为什么?2、立体结构是由什么决定的?分子的立体结构如何测得?并请学生阅读课本P37-P38二。
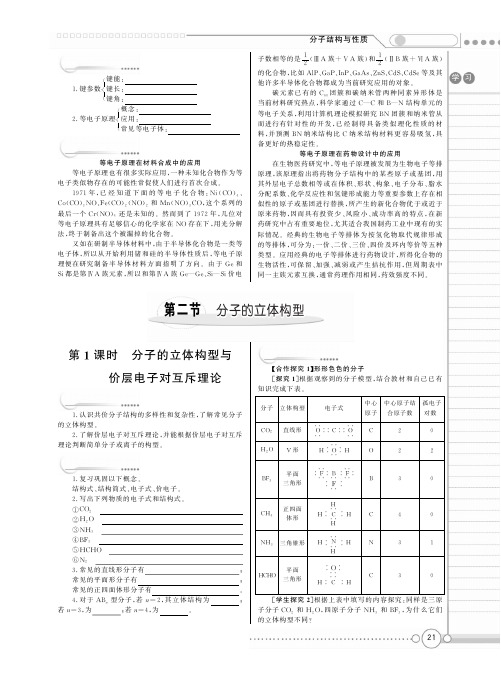

第二課時教學目標1、認識雜化軌道理論的要點2、進一步瞭解有機化合物中碳的成鍵特徵3、能根據雜化軌道理論判斷簡單分子或離子的構型4、採用圖表、比較、討論、歸納、綜合的方法進行教學5、培養學生分析、歸納、綜合的能力和空間想像能力教學重點:雜化軌道理論的要點教學難點:分子的立體結構,雜化軌道理論教學過程:碳的價電子構型是什麼樣的?甲烷的分子模型表明是空間正四面體,分子中的C—H鍵是等同的,鍵角是109°28′。
說明什麼?[結論]碳原子具有四個完全相同的軌道與四個氫原子的電子雲重疊成鍵。
師:碳原子的價電子構型2s22p2,是由一個2s軌道和三個2p軌道組成的,為什麼有這四個相同的軌道呢?為了解釋這個構型Pauling提出了雜化軌道理論。
板書:三、雜化軌道理論1、雜化的概念:在形成多原子分子的過程中,中心原子的若干能量相近的原子軌道重新組合,形成一組新的軌道,這個過程叫做軌道的雜化,產生的新軌道叫雜化軌道。
[思考與交流]甲烷分子的軌道是如何形成的呢?形成甲烷分子時,中心原子的2s和2p x,2p y,2p z等四條原子軌道發生雜化,形成一組新的軌道,即四條sp3雜化軌道,這些sp3雜化軌道不同於s軌道,也不同於p 軌道。
根據參與雜化的s軌道與p軌道的數目,除了有sp3雜化軌道外,還有sp2雜化和sp雜化,sp2雜化軌道表示由一個s軌道與兩個p軌道雜化形成的,sp雜化軌道表示由一個s軌道與一個p軌道雜化形成的。
[討論交流]:[總結評價]:引導學生分析、歸納、總結多原子分子立體結構的判斷規律,完成下[討論]:怎樣判斷有幾個軌道參與了雜化?(提示:原子個數)[結論]:中心原子的孤對電子對數與相連的其他原子數之和,就是雜化軌道數。
[討論總結]:三種雜化軌道的軌道形狀,SP雜化夾角為180°的直線型雜化軌道,SP2雜化軌道為120°的平面三角形,SP3雜化軌道為109°28′的正四面體構型。

分子的立体结构一、教材分析在第二节“分子的立体结构”中,首先按分子中所含的原子数直间给出了三原子、四原子和五原子分子的立体结构,并配有立体结构模型图。
为什么这些分子具有如此的立体结构呢?教科书在本节安排了“价层电子对互斥模型”和“杂化轨道理论”来判断简单分子和离子的立体结构。
在介绍这两个理论时要求比较低,文字叙述比较简洁并配有图示。
还设计了“思考与交流”、“科学探究”等内容让学生自主去理解和运用这两个理论。
第1课时一、三维目标1、知识与技能认识共价分子的多样性和复杂性;初步认识价层电子对互斥模型;能用VSEPR模型预测简单分子或离子的立体结构2、过程与方法复习化学键的概念,能用电子式表示常见物质的离子键或共价键的形成过程3、情感态度与价值观培养学生严谨认真的科学态度和空间想象能力二、教学重点分子的立体结构;利用价层电子对互斥模型预测分子的立体结构三、教学难点价层电子对互斥理论四、教学策略首先按分子中所含的原子数直间给出了三原子、四原子和五原子分子的立体结构,并配有立体结构模型图。
为什么这些分子具有如此的立体结构呢?教科书在本节安排了“价层电子对互斥模型”和“杂化轨道理论”来判断简单分子和离子的立体结构。
在介绍这两个理论时要求比较低,文字叙述比较简洁并配有图示。
还设计了“思考与交流”、“科学探究”等内容让学生自主去理解和运用这两个理论。
五、教学准备多媒体、黑板、教材、学案六、教学环节1、课堂导入[复习]共价键的三个参数。
[过渡]我们知道许多分子都具有一定的空间结构,如:……,是什么原因导致了分子的空间结构不同,与共价键的三个参数有什么关系?我们开始研究分子的立体结构。
2、课堂讲授[板书]第二节分子的立体结构一、形形色色的分子[讲]大多数分子是由两个以上原子构成的,于是就有了分子中的原子的空间关系问题,这就是所谓“分子的立体结构”。
例如,三原子分子的立体结构有直线形和V形两种。
如C02分子呈直线形,而H20分子呈V形,两个H—O键的键角为105°。

《选修三第二章第二节分子的立体结构》导学案(第2课时)高二_班第_组姓名 ________________ 组内评价 _________ 教师评价 ________【课标要求】1、认识杂化轨道理论的要点2、进一步了解有机化合物中碳的成键特征3、能根据杂化轨道理论判断简单分子或离子的构型 [f A 乳吾、]1、^据杂化轨道理论判断简单分子或离子的构型 【新课导学】 三、杂化轨道理论 1、杂化与杂化轨道① 杂化轨道理论是一种价键理论,是 ________ 为例解释分子 _______________ 提出的。
② 轨道的杂化:原子内部能量 ____ 的原子轨道重新组合形成一组新轨道的过程。
③ 杂化轨道:杂化后形成的新的能量 ______ 的一组原子轨道。
注意:杂化轨道用于容纳0键和孤对电子④ 分子构型与杂化类型的关系(1) sp 3杂化1个s 轨道和3个p 轨道发生混杂,得到 ________________ ,夹角力 ______ ,称为sp 3杂化轨道,空间结构: __________ ,代表分子: _______________ o(2) sp 2杂化1个s 轨道和2个p 轨道杂化得到的3个相同的轨道,夹角为 __________ ,空1X1错构: _______ ,代表分子: ________________ O(3) sp 杂化1个s 轨道和1个p 轨道杂化得到的 ________________ ,夹角为 _______ ,空间结构: __________ ’代表分子: ________________ o注意:杂化轨道只用于形成 ____________ 或者用來 ________________________________而sp 2和sp 两种未参与杂化的p 轨道,可用于形成 ___________ 。
⑤ 杂化轨道理论图解a.sp 3杂化b.sp 2杂化BF 3的空间构型力平面'三角形叫的空间构型为正四面体C : 2s 22p 22p:2哪2s (r )(So —⑥.>⑴sp迦①①①①2pACH 4的形成杂化类型spspsp.2s_pc PL ® gp)5o阅读教材,回答下列问题:① 写出碳原子的核外电子排布图 ___________② 碳原子2p 轨道有两个单电子,是否能够结合两个氢原子形成CH 2? ③ 碳原子核外电子数共有6个,能否结合6个氢原子,形成CH 6?④ CH4的空间构型是 _______ .四个碳氢键键长的关系是 __________ .键角 _________ . ⑤ C 原子为什么要进行"杂化〃? C 原子是如何进行"杂化"的?"杂化轨道"有哪些特点?形成甲烷分子时,中心原子的2s 和2p x , 2p y , 2p z 等叫条原子轨道发生杂化,形成一组 新的轨道,即四条sp 3杂化轨道,这些sp 3杂化轨道不同于s 轨道,也不同于p 轨道。
课题 第二节 分子的立体构型(第2课时)1. 理解价层电子对互斥模型,能用VSEPR 模型预测简单分子或离子的立体构型。
2. 通过对典型分子立体构型探究过程,学会运用观察、比较、分类及归纳等方法对信息进行加工,提高科学探究能力。
【教学重难点】价层电子对互斥理论【学法指导】利用课前预习了解价层电子对互斥理论。
利用小组讨论,进一步掌握利用价P 37-P 391、 价层电子对互斥模型认为,分子的立体构型是__________相互排斥的结果。
价层电子对是指分子中的中心原子上的电子对 ,包括_________和___________ 。
σ键电子对数可由___________确定。
2、 中心原子上的孤电子对数=1/2(a-xb)。
其中a 为_____________________;x 为______________;b 为_______________________________。
3、 几种分子或离子的中心原子上的孤电子对数。
【学点一】价层电子对数的确定【交流讨论】1、什么是“孤对电子”?【交流讨论】2、AB n 型分子中σ键的个数如何确定?________________________________________________________________________________________例如:NH 3中的中心原子为N,N 有___对σ键电子对。
【交流讨论】3、中心原子上的孤对电子数如何确定?阳离子和阴离子的中心原子上的孤对1、以S和P为例,说明如何根据主族元素在周期表中的位置确定它的价电子数。
2、VSEPR模型与分子立体构型之间的关系。
(阅读教材P38部分)1、下列分子或离子中,中心原子价层电子对的立体构型为四面体形,且分子或离子的立体构型为V形的是( )A.NH4+B.PH3C.H3O+D.OF2课后小结:。
《第二节分子的立体构型》教课方案一、教材剖析本节课是选修3的第二章第二节内容,是在必修2已介绍共价键的知识基础上,介绍分子的立体结构。
本节内容对空间想象能力要求较高,但不用解说太深,能依据价层电子对互斥理论对简单共价分子结构的多样性和复杂性进行解说即可。
二、学情剖析学生的空间想象思想较弱,有关知识的链接不够,在教课中需要仔细掌握。
但另一方面本节知识属于化学理论教课和已有知识关系度较少,经过设计指引能获得很好教课成效。
三、考大纲求:1、认识共价分子的多样性和复杂性2、初步认识价层电子对互斥模型;3、能用VSEPR模型展望简单分子或离子的立体结构四、教课目的知识与技术1、使学生正确理解价层电子对互斥理论2、学会剖析分子的立体构型能力培育1、经过价层电子对互斥理论的教课,提高学生化学理论修养。
2、经过研究分子的立体构型,培育学生空间想象能力,自学能力。
感情价值观的培育经过学习培育学生独立思虑、踊跃进步的精神,用数学的思想解决化学识题的能力。
亲身感悟化学学科的巧妙,体验研究中的疑惑、顿悟、愉悦;在怀疑、领会、反省中提高自己素质。
五、要点难点1、分子的立体构型2、价层电子对互斥理论六、教课方法研究式教课法,模型结构,学生自主学习,多媒体。
七、教课过程[复习回首]σ键成键方式“头碰头”,呈轴对称1.共价键的种类π键成键方式“肩并肩”,呈镜像对称判断规律共价单键是σ键,共价双键中一个是σ键,另一个是π键,共价三键中一个是σ键,另两个为π键键能权衡化学键稳固性键参数键长键角描绘分子的立体结构的重要要素[板书] 第二节分子的立体构型[发问]什么是分子的立体构型?[学生回答]分子的立体构型是指多原子分子组成的分子中原子的空间地点关系。
[追问]双原子分子存在立体结构吗?[过渡]多原子分子的立体结构是什么构型呢?[板书]一.林林总总的分子[学生活动]看大屏幕1、双原子分子:直线形O2 HCl2、三原子分子立体结构(直线形CO2和V形H2O)3、四原子分子立体结构(直线形CH、平面三角形CHO、三角锥形NH、正四周体P)2344、五原子分子立体结构(最常有的是正四周体CH4)5、其余[问题导入]1、同为三原子分子,CO和HO分子的空间结构却不一样,为何?2同为四原子分子,CH2O与NH3分子的空间结构也不一样,为何?2、立体结构是由什么决定的?分子的立体结构怎样测得?并请学生阅读课本P37-P38二。
第二節分子的立體構型軌道總數不變,卻得到4個相同的軌道,夾角109°28′,稱為sp3雜化軌道,表示這4個軌道是由1個s軌道和3個p軌道雜化形成的。
當碳原子跟4個氫原子結合時,碳原子以4個sp3雜化軌道分別與4個氫原子的ls軌道重疊,形成4個C--Hσ鍵,因此呈正四面體的分子構型。
[投影][講]雜化軌道理論認為:在形成分子時,通常存在激發、雜化、軌道重疊等過程。
但應注意,原子軌道的雜化,只有在形成分子的過程中才會發生,而孤立的原子是不可能發生雜化的。
同時只有能量相近的原子軌道才能發生雜化,而1s軌道與2p 軌道由於能量相差較大,它是不能發生雜化的。
[講]我們需要格外注意的是,雜化軌道只用於形成σ鍵或者用來容納孤對電子剩餘的p軌道可以形成π鍵[投影] sp3雜化軌道[板書]2、雜化軌道的類型:(1) sp3雜化:1個s軌道和3個p軌道會發生混雜,得到4個相同的軌道,夾角109°28′,稱為sp3雜化軌道。
[講]價層電子對互斥模型時我們知道,H20和NH3的VSEPR模型跟甲烷分子一樣,也是四面體形的,因此它們的中心原子也是採取sp3雜化的。
所不同的是,水分子的氧原子的sp3雜化軌道有2個是由孤對電子佔據的,而氨分子的氮原子的sp3雜化軌[講]應當注意的是,雜化過程中還有未參與雜化的p 軌道,可用於形成π鍵,而雜化軌道只用於形成σ鍵或者用來容納未參與成鍵的孤對電子。
而沒有填充電子的空軌道一般都不參與雜化。
[講]乙烯分子中的碳原子的原子軌道採用sp 2雜化。
其中兩個碳原子間各用一個sp 2雜化軌道形成σ鍵,用兩個sp 2雜化軌道與氫原子形成σ鍵,兩個碳原子各用一個未參加雜化的2p 原子軌道形成Π鍵。
[投影]C 2H 4(sp 2杂化)[講]苯環分子中的碳原子的原子軌道採用了sp 2雜化。
每個碳原子上的三個sp 2雜化軌道分別與兩個相鄰的碳原子和一個氫原子形成三個σ鍵並形成六碳環,每個碳原子上的未雜化2p 軌道採用“肩並肩”的方式重疊形成大Π鍵。
人教版选修三第二章第二节第二课时《杂化轨道理论》教学设计一、教材与学情分析1.教材分析新教材改革使结构化学成为独立的课本出现在高中化学中,本节内容选自高中化学人教版(新课标)选修3第二章分子与结构第二节第二课时。
杂化轨道理论位于共价键和价层电子对互斥理论之后,对价键理论进行了完善和丰富,很好地解释了多原子分子的空间构型,并且形象地解释了原子之间的成键方法、有关物质的空间结构及其稳定性。
还对后续配合物和晶胞的学习奠定了空间想象基础。
因此杂化轨道理论在高中化学中起着承上启下的作用。
2.学情分析:知识基础:已经学习了原子的结构与性质,价键理论和价层电子对互斥理论,学会了运用价层电子对互斥理论来判断简单分子的空间构型。
能力基础: 高二学生思维敏捷,好奇心强,动手能力强,但空间想象力弱,而且本节对学生空间想象力和抽象思维能力要求较高。
因此我将难点拆分,将其转化为问题抛给学生,再通过模型动画演示和小组合作学习的形式突破教学重难点。
可能遇到的障碍:如果对原子结构和价层电子对互斥理论掌握的不好,空间想象能力欠缺将会影响到对本部分内容的学习二、教学目标根据《普通高中化学课程标准(实验)》的要求,制定以下教学目标:1.知识与技能:认识共价分子结构的多样性和复杂性,能根据杂化轨道理论解释分子的空间构型。
2.过程与方法:培养分析、归纳能力和空间想象能力3.情感态度与价值感:通过杂化轨道理论的学习,激发学习兴趣,投身科学追求真理的积极情感;提高学生对探究物质结构的兴趣,感受物质结构与性质的奇妙。
三、教学重难点重点:杂化轨道理论的要点难点:对杂化轨道理论的理解;用杂化轨道理论来解释分子的构型四、教法学法教法:讲授法,问题驱动式教学法,对比归纳法,多媒体辅助教学法学法:自主学习,探究学习,合作学习五、教学流程[教师]为探究分子的立体构型,发展了许多结构理论,上节课我们已经学习了其中一种叫做价层电子对互斥理论,这节课我们来学习另一个非常重要的价键理论——杂化轨道理论。
《选修三第二章第二节 分子的立体构型》导学案(第2课时)
【课标要求】知识与技能要求:
1.认识杂化轨道理论的要点
2.进一步了解有机化合物中碳的成键特征
3.能根据杂化轨道理论判断简单分子或离子的构型
【回顾与思考】1.共价键类型:σ、π键,价层电子对互斥模型。
2. 我们已经知道,甲烷分子呈正四面体形结构,它的4个C--H
键的键长相同,H —C--H 的键角为109~28°。
按照我们已经学过的价键理论,甲烷的4个C--H 单键都应该是π键,然而,碳原子的4个价层原子轨道是3个相互垂直的2p 轨道和1个球形的2s 轨道,用它们跟4个氢原子的ls 原子轨道重叠,不可能得到四面体构型的甲烷分子。
为什么?
【阅读与归纳】阅读教材P39及图2-16
【小结】杂化轨道理论的简述
1.杂化轨道理论认为:在形成分子时,通常存在激发、杂化、轨道重叠等过程。
但应注意,原子轨道的杂化,只有在形成分子的过程中才会发生,而孤立的原子是不可能发生杂化的。
同时只有能量相近的原子轨道(如2s,2p 等)才能发生杂化,而1s 轨道与2p 轨道由于能量相差较大,它是不能发生杂化的。
2.杂化轨道成键时,要满足化学键间最小排斥原理,键与键间排斥力大小决定于键的方向,即决定于杂化轨道间的夹角。
由于键角越大化学键之间的排斥力越小,对sp 杂化来说,当键角为180°时,其排斥力最小,所以sp 杂化轨道成键时分子呈直线形;对sp 2杂化来说,当键角为120°时,其排斥力最小,所以sp 2杂化轨道成键时,分子呈平面三角形。
由于杂化轨道类型不同,杂化轨道夹角也不相同,其成键时键角也就不相同,故杂化轨道的类型与分子的空间构型有关。
3.杂化轨道的数目与组成杂化轨道的各原子轨道的数目相等。
四、AB m 型杂化类型的判断
1.公式: 电子对数n =12(中心原子的价电子数+配位原子的成键电子数±电荷数)
2.根据n 值判断杂化类型
一般有如下规律:
当n =2,sp 杂化;n =3,sp 2杂化;n =4, sp 3杂化。
例如:SO 2 n =12(6+0)=3 sp 2杂化 NO -3 n =12
(5+1)=3 sp 2杂化 NH 3 n =12(5+3)=4 sp 3杂化
注意①当上述公式中电荷数为正值时取“-”,电荷数为负值时取“+”。
②当配位原子为氧原子或硫原子时,成键电子数为零。
【典例解悟】
根据价层电子对互斥理论及原子的杂化理论判断NF3分子的空间构型和中心原子的杂化方式为()
A.直线形sp杂化B.三角形sp2杂化 C.三角锥形sp2杂化D.三角锥形sp3杂化
【对点练习】
1.用杂化轨道理论解释CH4分子的形成过程。
2.为了满足生成BF3和BeCl2的要求,B和Be原子的价电子排布应如何改变?用轨道式表示B、Be原子的价电子结构的改变。
3.指出下列化合物可能采取的杂化类型,并预测其分子的几何构型:
(1)BeH2;(2)BBr3;(3)SiH4;(4)PH3。
4.如下图,请用杂化轨道理论分析乙烯和乙炔分子的成键情况。
乙烯和乙炔的结构示意图
【课后作业】
1.下列分子中划横线的原子的杂化轨道类型属于sp杂化的是()
A.CH4B.C2H4C.C2H2D.NH3
2.有关苯分子说法不正确的是()
A.苯分子中C原子均以平面三角形方式成键,形成120°的三个平面三角形轨道,故为正六边形的碳环
B.每个碳原子还有1个未参与杂化的2p轨道,垂直碳环平面,相互交盖,形成共轭大π键
C.大π键中6个电子被6个C原子共用,故称为中心6电子大π键
D.苯分子中共有6个原子共面,6个碳碳键完全相同
3.下列物质分子中的氢原子不在同一平面上的有()
A.C2H2B.C2H4C.C2H6 D.C6H6
4.下列分子中,空间结构为平面三角形的是()
A.HgCl2B.BF3C.SiCl4D.SF6
5.OF2分子的中心原子采取的杂化轨道是()
A.sp2B.sp C.sp3D.无法确定6.下列分子中的中心原子的杂化方式为sp杂化,分子的空间结构为直线形且分子中没有形成π键的是() A.CH≡CH B.CO2 C.BeCl2D.BF3
7.原子轨道的杂化不但出现在分子中,原子团中同样存在原子的杂化。
在SO2-4中S原子的杂化方式为() A.sp B.sp2 C.sp3D.无法判断
8.为什么CH4、NH3、H2O分子中中心原子的杂化轨道的类型都为sp3杂化,但三者的空间构型却大不相同?
9.ClO-、ClO-2、ClO-3、ClO-4中,Cl都是按以sp3杂化轨道方式与O原子成键,则ClO-空间的构型是________;ClO-2空间的构型是________;ClO-3空间的构型是________;ClO-4空间的构型是________。
10.指出下列分子中,中心原子可能采用的杂化轨道类型,并预测分子的几何构型。
疑点反馈:
____________________________________________________________________ _
___________________________________________________________________ __
《选修三第二章第二节分子的立体构型》导学案(第2课时)
【典例解悟】
解析判断分子的杂化方式要根据中心原子的孤对电子数以及与中心原子相连的原子个数。
在NF3分子中N原子的孤对电子数为1,与其相连的原子数为3,所以根据理论可推知中心原子的杂化方式为sp3杂化,空间构型为三角锥形,类似于NH3。
答案 D
轨道杂化时,轨道的数目不变,轨道在空间的分布方向和分布情况发生改变。
对于判断分子
的杂化方式及空间构型,一般要求我们熟记教材上常见的分子就可以了。
【对点练习】
1.答案碳原子2s轨道中1个电子吸收能量跃迁到2p空轨道上,这个过程称为激发,但此时各个轨道的能量并不完全相同,于是1个2s轨道和3个2p轨道“混合”起来,形成能量相等、成分相同的4个sp3杂化轨道,然后4个sp3杂化轨道上的电子间相互排斥,使四个杂化轨道指向空间距离最远的正四面体的四个顶点,碳原子的4个sp3杂化轨道分别与4个H原子的1s轨道形成4个相同的σ键,从而形成CH4分子。
由于4个C—H键完全相同,所以形成的CH4分子为正四面体形,键角是109°28′。
2.答案B原子的电子层结构为1s22s22p1x,当硼与氟反应时,硼原子的一个2s
电子激发到一个空的2p轨道中,使硼原子的电子层结构为1s22s12p1x2p1y。
Be原子的电子结构是1s22s2,在激
发态下,Be的一个2s电子可以进入2p轨道,使Be原子的电子结构为1s22s12p1。
3.答案
4.答案(1)sp杂化直线形(2) sp2杂化平面三角形
(3) sp3杂化正四面体形(4) sp3杂化三角锥形
5.答案在乙烯分子中C原子由一个s轨道和两个p轨道进行杂化,组成三个等同的sp2杂化轨道,sp2轨道彼此成120°。
乙烯中两个碳原子各用一个sp2轨道重叠形成一个C—C σ键外,各又以两个sp2轨道和四个氢原子的1s轨道重叠,形成四个σ键,这样形成的五个σ键在同一平面上;每个C原子还剩下一个p y 轨道,它们垂直于这五个σ键所在平面,且互相平行,它们侧面重叠,形成一个π键。
在乙炔分子中碳原子由一个2s轨道和一个2p轨道组成两个sp杂化轨道,两个sp杂化轨道夹角为180°。
在乙炔分子中,两个碳原子各以一个sp轨道互相重叠,形成一个C—C σ键,每一个碳原子又各以一个sp轨道分别与一个氢原子形成σ键;此外每个碳原子还有两个互相垂直的未杂化的p轨道,它们与另一个碳的两个p轨道两两互相侧面重叠形成两个互相垂直的π键。
【课后作业】
1.答案 C 2.答案 D 3.答案 C 4.答案 B 5.答案 C 6.答案 C
7.答案 C 8.答案CH4分子中sp3,每个H原子占据四面体一个顶点,分子为正四面体形。
NH3分子中虽是sp3,三个H原子占据四面体三个顶点,一对孤对电子占据一个顶点,故N原子与三个氢原子构成三角锥形。
H2O分子中也是sp3,两个H 原子占据四面体两个顶点,另两个顶点被两个孤电子对占据,故O原子与两个氢原子呈V形,即H2O分子呈V形。
9.答案直线形V形三角锥形正四面体
10.答案。