氧化型型谷胱甘肽(Glutathione Oxidized,GSSG)含量测定试剂盒使用说明
- 格式:pdf
- 大小:100.77 KB
- 文档页数:3

氧化型谷胱甘肽测定方法引言:氧化型谷胱甘肽(oxidized glutathione, GSSG)是一种重要的抗氧化物质,它在细胞内起到清除自由基和保护细胞免受氧化损伤的作用。
因此,准确测定氧化型谷胱甘肽的含量对于了解细胞氧化状态和维持细胞正常功能具有重要意义。
本文将介绍几种常用的氧化型谷胱甘肽测定方法。
一、梅尔二硫代苯酚法梅尔二硫代苯酚法是一种常用的氧化型谷胱甘肽测定方法。
该方法利用氧化型谷胱甘肽与2,2'-二硫代苯酚反应生成深黄色化合物,通过比色法测定其吸光度来计算氧化型谷胱甘肽的浓度。
该方法简单、快速,且具有较高的灵敏度和准确性。
二、高效液相色谱法高效液相色谱法是一种常用的氧化型谷胱甘肽测定方法。
该方法利用高效液相色谱仪对氧化型谷胱甘肽进行分离和测定。
首先将样品中的氧化型谷胱甘肽与还原剂还原生成还原型谷胱甘肽,然后通过高效液相色谱仪进行分析。
该方法具有分离效果好、灵敏度高、准确性高的优点,但操作复杂,需要专门的仪器设备。
三、酶联免疫吸附测定法酶联免疫吸附测定法是一种基于酶标记技术的氧化型谷胱甘肽测定方法。
该方法利用特异性抗体与氧化型谷胱甘肽结合,然后通过酶标记的二抗与抗体结合,最后通过底物的酶促反应生成产物,通过测定产物的光吸光度来计算氧化型谷胱甘肽的浓度。
该方法具有高灵敏度、高特异性和较强的抗干扰能力,但需要较长的操作时间。
四、电化学法电化学法是一种常用的氧化型谷胱甘肽测定方法。
该方法利用电极对氧化型谷胱甘肽进行氧化还原反应,并通过测定电流的变化来计算氧化型谷胱甘肽的浓度。
该方法具有快速、准确、灵敏度高的优点,但需要专门的电化学仪器设备和操作技术。
结论:氧化型谷胱甘肽测定方法有多种选择,每种方法都有其特点和适用范围。
选择合适的测定方法需要根据实际需求和条件来决定。
无论采用哪种方法,都需要严格控制实验条件和操作步骤,以确保测定结果的准确性和可靠性。
希望本文介绍的几种常用的氧化型谷胱甘肽测定方法对读者有所帮助。

检测谷胱甘肽还原酶活性水平在乙型肝炎辅助诊断中的应用谷胱甘肽还原酶(glutathione reductase, GR)是一种重要的酶,属于还原酶家族,它在细胞内参与谷胱甘肽/氧化型谷胱甘肽(GSH/GSSG)系统的正常运转。
这一系统在维持细胞内氧化还原平衡中发挥着关键的作用,对于细胞的生存和代谢起着非常重要的作用。
GR在此过程中作为重要的辅助酶,能够还原氧化型的谷胱甘肽(GSSG)为还原型的谷胱甘肽(GSH),从而维持GSH/GSSG的平衡。
近年来,相关研究表明检测GR活性水平有望成为乙型肝炎辅助诊断的新方法。
乙型肝炎(HBV)是一种由乙型肝炎病毒引起的疾病,在我国致病率较高,给人们的生活和健康带来了很大危害。
目前临床上常用的诊断方法包括HBV标志物的检测、肝脏超声检查、肝组织活检等。
这些方法都存在一定的局限性,如HBV标志物检测的敏感性和特异性不高,肝脏超声检查容易受到操作者技术水平的影响,而肝组织活检则存在较为严重的创伤和风险。
寻找新的乙型肝炎辅助诊断方法显得尤为重要。
近年来,国内外的研究者对GR活性水平在乙型肝炎辅助诊断中的应用进行了深入的探讨。
一些研究者发现,HBV感染患者的血清中GR活性水平明显降低,这与正常人群相比存在显著的差异。
这一降低的趋势与HBV感染的程度呈现出一定的相关性,即随着肝炎病情的加重,GR活性水平的降低趋势也会逐渐加重。
GR活性水平的检测可以作为乙型肝炎患者肝脏炎症程度的一个指标,这对于临床上的诊断、鉴别诊断和治疗具有重要的指导意义。
一些研究者还发现,HBV感染对GR活性水平的影响不仅限于肝细胞,同时它还会对全身的氧化还原平衡产生一定的影响。
HBV感染引起的氧化还原平衡失衡不仅表现在肝脏内,同时也会直接对全身的氧化还原平衡产生影响,这也为利用GR活性水平进行乙型肝炎辅助诊断提供了可能。
尽管GR活性水平检测对于乙型肝炎辅助诊断具有潜在的应用前景,但是也需要注意到目前在治疗过程中的一些建议。

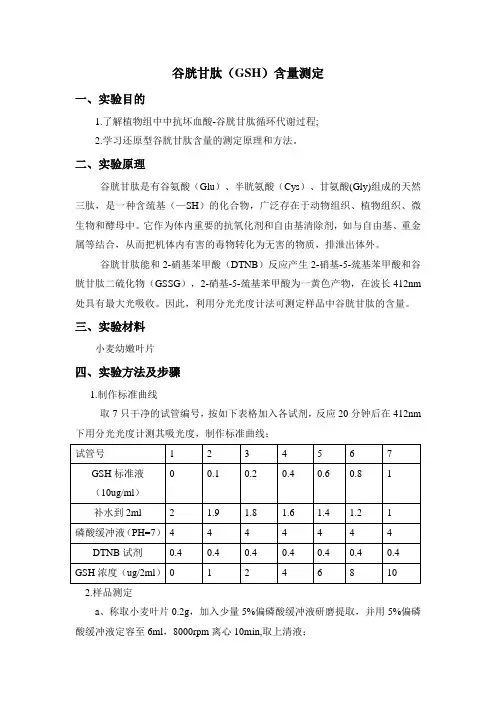
谷胱甘肽(GSH)含量测定一、实验目的1.了解植物组中中抗坏血酸-谷胱甘肽循环代谢过程;2.学习还原型谷胱甘肽含量的测定原理和方法。
二、实验原理谷胱甘肽是有谷氨酸(Glu)、半胱氨酸(Cys)、甘氨酸(Gly)组成的天然三肽,是一种含巯基(—SH)的化合物,广泛存在于动物组织、植物组织、微生物和酵母中。
它作为体内重要的抗氧化剂和自由基清除剂,如与自由基、重金属等结合,从而把机体内有害的毒物转化为无害的物质,排泄出体外。
谷胱甘肽能和2-硝基苯甲酸(DTNB)反应产生2-硝基-5-巯基苯甲酸和谷胱甘肽二硫化物(GSSG),2-硝基-5-巯基苯甲酸为一黄色产物,在波长412nm 处具有最大光吸收。
因此,利用分光光度计法可测定样品中谷胱甘肽的含量。
三、实验材料小麦幼嫩叶片四、实验方法及步骤1.制作标准曲线取7只干净的试管编号,按如下表格加入各试剂,反应20分钟后在412nm 下用分光光度计测其吸光度,制作标准曲线;2.样品测定a、称取小麦叶片0.2g,加入少量5%偏磷酸缓冲液研磨提取,并用5%偏磷酸缓冲液定容至6ml,8000rpm离心10min,取上清液;b、取上述上清液2ml显色,操作同标准曲线。
3.结果计算:GSH含量(ug/Gfw)= (Cx*Vt)/(Fw*Vs)注:Cx---2ml样品中GSH含量(ug),即每管中GSH的含量Vt---样品提取液总体积(ml);Vs----显色时所取样的体积(ml);FW---样品鲜重(g)。
五、实验结果1.标准曲线1.样品测定结果六、注意事项1.使用移液管吸取试剂时,视线要垂直于移液管且与液面凹面水平,不能斜视,以免量取试剂不准确。
2.在提取样品时,最好沉淀出去蛋白质,以防止蛋白质中所含巯基及相关酶对测定结果的影响。
3.在研磨叶片时,为方便研磨,刚开始时加入少量的提取液。

还原型谷胱甘肽(GSH)与氧化型谷胱甘肽(GSSG)的测定关键词:还原型谷胱甘肽GSH氧化型谷胱甘肽GSSG测定2009-04-24 00:00 来源:互联网点击次数:6147GSH和GSSG 参照Anderson等(1992)。
取0.5 g样品,加入3 mL冰冷的6%的偏磷酸(含1 mmol•L-1 EDTA ,pH 2.8),冰浴研磨,匀浆液以20,000 g,4 ℃离心15 min,取上清液来马上测定GSH和GSSG的含量或储存在-20 ℃下等待测定。
总的GSH和GSSG含量测定如下:200 μL提取液加 1.2 mL反应液包含400 μL反应液1(110 mmol•L-1 Na2HPO4•7H20,40 mmol•L-1NaH2PO4•H2O,15 mmol•L-1EDTA,0.3 mmol•L-15,5‘-dithiobis-(2-nitrobenzoic acid)DTNB,0.04% BSA)、320 μL反应液2 (1 mmol•L-1 EDTA,50 mmol•L-1 imidazole 咪唑solution and 0.02% BSA)、400 μL反应液3(5% Na2HPO4,pH 7.5的溶液稀释50倍)、80 μL 9.0 mmol•L-1 NADPH。
测定OD412下的吸收值。
GSSG 含量测定如下:200 μL提取液加入1 mL的2-2乙烯嘧啶(稀释50倍)在25°C下水浴1 h再测定OD412下的吸收值。
GSH的含量可以从总的GSH和GSSG含量中减去GSSG含量获得。
GSH测定方法:取样品0.5 g,加入预冷的5%磺基水杨酸2.5 ml和少许石英砂,充分冰预研磨,转入离心管中,于4℃下20,000×g离心20min,将上清液分装,液氮冷冻后于-20℃保存或直接进行抗氧化剂分析。
取50 μL上清液,用5% 磺基水杨酸定容至100 μL (即加入5% 磺基水杨酸50 μL),加入24 μL 1.84 mol•L-1三乙醇胺triethlene diamine以中和样液,加入50 μL 10% 乙烯吡啶Polyvinyl pyridine (用70% 乙醇配制),25℃水浴1 h,以除去GSH,到时加入706 mL 50 mmol•L-1磷酸缓冲液,pH 7.5,内含2.5 mmol•L-1 EDTA,加入20 μL 10 mmol•L-1 NADPH 和80 μL 12.5 mmol•L-1 DTNB(二硫硝基苯甲酸),混匀,25℃保温10 min,到时加入20μL 50 U•mL-1 GR,总体积为1 mL,立即混匀,读出3 min时的OD值。


还原型谷胱甘肽(reduced glutathione,GSH)含量测定试剂盒使用说明产品简介:GSH/GSSG是细胞内最重要的氧化还原对之一。
因此,测定细胞内GSH和GSSG含量以及GSH/GSSG比值,能够很好地反映细胞所处的氧化还原状态。
DTNB与GSH反应生成复合物,在412nm处有特征吸收峰;其吸光度变化与GSH含量成正比。
试验中所需的仪器和试剂:可见分光光度计、低温离心机、水浴锅、可调节移液器、1ml比色皿、双蒸水产品内容:试剂一×1支,充分溶解于100ml双蒸水,4℃保存试剂二×1支,充分溶解于50ml试剂一中,4℃保存试剂三×1支,充分溶解于10ml双蒸水中,4℃避光保存操作步骤:一、样品前处理:取组织约0.1g,加1ml试剂二,冰上充分研磨,8000rpm4℃离心10min,取上清。
(如上清不清澈,再离心3min)GSH测定操作:测定前将试剂一于25℃水浴20min按每100mg组织加入1000µL生理盐水的比例进行匀浆。
8000g4℃离心10分钟,取上清,置冰上待测。
对于非哺乳动物组织:按每100mg组织加入1000µL提取液的比例进行匀浆。
8000g 4℃离心10分钟,取上清,置冰上待测。
(2)血清(浆)样品:直接检测。
二、测定操作表:测定管空白管样本0.1ml/试剂一0.7ml0.7ml蒸馏水/0.1ml试剂三0.2ml0.2ml 迅速混匀,于412nm测吸光值,并记录第60s的OD值GSH含量计算:GSH标准曲线公式:y=0.0015x+0.0818(x为GSH浓度,y为吸光值)液体中GSH(µmol/L)=[(OD测定管-OD空白管)-0.0818]/0.0015×样品稀释倍数组织中GSH计算:①GSH(µmol/mg prot)=[(OD测定管-OD空白管)-0.0818]/0.0015×样品稀释倍数÷样品蛋白浓度(Cpr)②GSH(µmol/g mass)=[(OD测定管-OD空白管)-0.0818]/0.0015×样品稀释倍数÷样品质量(g)注意事项:(1)样品处理等过程均需要在冰上进行,且须在当日测定酶活力,以免影响其活力测定时,除试剂一外,其它试剂均需放置在冰上;(2)样本测定前先取1-2个样做预实验,如吸光值太高(超过标准曲线范围,即y >0.2时),应先用试剂二稀释到适当倍数,使得吸光值在标准曲线范围内。


谷胱甘肽-S-转硫酶法快速测定红细胞GSH和其氧化产物赵利娜;李生兵;郭睿;王佚;廖飞【期刊名称】《中国药理学通报》【年(卷),期】2006(22)7【摘要】红细胞谷胱甘肽(GSH)、氧化型谷胱甘肽(GSSG)及蛋白结合谷胱甘肽(PSSG)是反映氧化溶血的指标。
Ellman试剂测定GSH干扰多。
高效液相层析测定GSH及其衍生物受仪器和效率限制。
谷胱甘肽-S-转硫酶(GST)法测定GSH干扰少,但从未用于测定红细胞GSH或其衍生物。
本文尝试改进GST法并用于测定红细胞GSH及其衍生物。
【总页数】2页(P893-894)【作者】赵利娜;李生兵;郭睿;王佚;廖飞【作者单位】重庆医科大学,生物化学教研室,重庆,400016;重庆医科大学,生物化学教研室,重庆,400016;重庆医科大学,生物化学教研室,重庆,400016;重庆医科大学,附属儿科医院,重庆,400016;重庆医科大学,生物化学教研室,重庆,400016【正文语种】中文【中图分类】R331.122;R341.6;R345.46;R345.5;R977.3;R977.6【相关文献】1.分析谷胱甘肽-S-转硫酶的产物抑制反应过程测定还原型谷胱甘肽 [J], 赵利娜;陶佳;赵运胜;廖飞2.慢型克山病患者红细胞谷胱甘肽硫转移酶活力测定 [J], 李立;薛建斌3.测定谷胱甘肽-S-转硫酶动力学参数的变化表征其抑制剂 [J], 张灵;杨晓兰;白婧;廖娟;刘红博;廖飞4.联用酶反应过程分析法和初速度法测定谷胱甘肽-S-转硫酶活性 [J], 廖娟;赵利娜;龙高波;杨晓兰;蒲军;廖飞5.融合标签谷胱甘肽S-转硫酶高亲和配体的设计与筛选 [J], 杨宪峰;张灵;杨晓兰;龙高波;张奕;廖飞因版权原因,仅展示原文概要,查看原文内容请购买。
氧化型谷胱甘肽(GSSG)检测试剂盒(DTNB速率比色法) 简介:谷胱甘肽(glutathione,GSH)存在于几乎身体的每一个细胞,参与细胞许多功能活动,是一种氧自由基消除剂。
谷胱甘肽能帮助保持正常的免疫系统的功能,保护组织细胞免受氧化损伤,并具有抗氧化作用和整合解毒作用,半胱氨酸上的巯基为其活性基团,故常简写为G-SH或GSH,易与某些药物(如扑热息痛)、毒素(如自由基、碘乙酸、铅、汞、砷等)等结合,具有整合解毒作用。
谷胱甘肽具有广谱解毒作用,在延缓衰老、增强免疫力、抗肿瘤等功能性食品广泛应用。
谷胱甘肽是研究活性氧和自由基的重要指标,亦是机体氧化物牵累的重要指标。
还原型谷胱甘肽(GSH)是一种含γ-酰胺键和巯基的三肽,由谷氨酸、半胱氨酸及甘氨酸组成,能可逆的转变为氧化型谷胱甘肽(GSSG),其存在形式会随着细胞内代谢的情况而发生相互转变。
氧化型谷胱甘肽(GSSG)检测试剂盒(DTNB速率比色法)(GSSG Assay Kit)是一种简单易行的氧化型谷胱甘肽(GSSG)检测的试剂盒,其检测原理是先检测还原型谷胱甘肽(GSH)含量,再检测总谷胱甘肽(T-GSH)含量T-GSH减去GSH即得氧化型谷胱甘肽(GSSG):待测样品中的还原型谷胱甘肽(GSH)与发色底物DTNB反应,产生稳定黄色的TNB和GSSG;谷胱甘肽还原酶把氧化型谷胱甘肽(GSSG)还原成还原型谷胱甘肽(GSH),由GSSG还原成的GSH和样品本身含有的GSH都与发色底物DTNB反应,生成黄色的TNB和GSSG,前后两个反应合并起来,总谷胱甘肽(GSSG+GSH)就相当于一个呈色的限速反应,总谷胱甘肽(T-GSH)含量决定了黄色含量。
通过分光光度法(酶标仪)检测410nm处吸光度,与相应处理的GSH标准比较,分别获得还原型谷胱甘肽(GSH)和总谷胱甘肽(T-GSH),用T-GSH 减去GSH即得氧化型谷胱甘肽(GSSG)。
该试剂盒可用于检测血浆、血清、组织、细胞等样品中氧化型谷胱甘肽(GSSG)含量,亦可检测还原型谷胱甘肽(GSH)和总谷胱甘肽(T-GSH)含量。

谷胱甘肽氧化型和还原型1. 谷胱甘肽的基本概念大家好,今天咱们来聊聊一个在生物化学里可算是“明星”的家伙——谷胱甘肽(Glutathione),听起来是不是很高大上?实际上,它就是咱们身体里的小帮手,能保护细胞、清除自由基,简直是个小超人!谷胱甘肽有两种状态:氧化型和还原型,咱们今天就来聊聊它们之间的那些事儿。
1.1 什么是还原型谷胱甘肽?先说说还原型谷胱甘肽,也就是咱们常说的GSH。
这个小家伙就像是个“清道夫”,负责把身体里的毒素和废物处理掉。
你想想,生活中不也是需要有人来打理卫生吗?GSH就是那个给咱们的细胞打扫卫生的好帮手!它能和自由基“较量”,把它们中和掉,让咱们的身体保持“整洁”。
换句话说,有了它,咱们就不怕那些坏家伙来捣乱。
1.2 氧化型谷胱甘肽的角色然后咱们再看看氧化型谷胱甘肽,叫做GSSG。
哎,这个名字听起来就有点“高冷”的感觉。
它的作用主要是在GSH参与反应之后出现的,换句话说,就是GSH在忙完之后会变成GSSG。
你可以把它想象成一个“退休工人”,虽然不再是“第一线战斗员”,但依然在背后发挥着重要的作用。
它会和其他还原型谷胱甘肽结合,帮助恢复平衡,确保细胞里的环境稳定。
就像我们生活中,有些人虽然不出风头,但背后默默付出的精神,是不可或缺的。
2. 它们之间的关系2.1 氧化与还原的较量说到这儿,大家可能会问了:这两者之间到底是什么关系呢?其实,它们就像是阴阳两面,相辅相成。
GSH可以转变成GSSG,而当身体需要更多的抗氧化能力时,GSSG又可以被转化回GSH。
就像是一个循环,一直在运转。
这个过程就叫做“氧化还原反应”,听起来很复杂,其实就是“换工作”的过程而已。
2.2 生活中的重要性在我们的日常生活中,这个过程可重要了。
想象一下,如果你天天吃垃圾食品,身体里的自由基就像无头苍蝇一样到处飞。
这个时候,GSH就会加倍努力,拼命清理,但如果它用完了,GSSG又无法及时转变回GSH,身体就容易受到伤害。
还原型谷胱甘肽检测标准
谷胱甘肽(glutathione,GSH)是一种重要的细胞内抗氧化剂,它能够清除自由基,保护细胞免受氧化应激的损伤。
谷胱甘肽检测是衡量体内谷胱甘肽水平的一种方法,可以评估体内抗氧化能力和氧化应激状态。
还原型谷胱甘肽(reduced glutathione,GSH)是谷胱甘肽的活性形式,其浓度的改变反映了细胞内氧化还原平衡的变化。
还原型谷胱甘肽检测标准是指确定衡量还原型谷胱甘肽浓度的实验方法和结果解读的参考范围。
常见的还原型谷胱甘肽检测方法包括高效液相色谱法(HPLC)、光度法、流式细胞术和电化学法等。
在进行谷胱
甘肽检测时,可以根据实验方法的要求,采集样本、提取还原型谷胱甘肽、加入标准品进行定量测量,并根据标准品的浓度范围进行结果解读。
通常情况下,人体血液中还原型谷胱甘肽的标准浓度范围是
2-20 μM。
这个范围是通过大量的临床研究得出的,可以用作
评估人体抗氧化能力和氧化应激状态的参考。
需要注意的是,不同实验室可能会使用不同的标准浓度范围或检测方法进行谷胱甘肽检测。
因此,在具体的实验室中进行检测时,应该参考该实验室所使用的标准范围和方法进行结果解读。
同时,还应该综合考虑个体差异以及其他临床指标,来评估谷胱甘肽水平的意义和临床价值。
还原型谷胱甘肽(GSH)检测
谷胱甘肽(Glutathione,GSH)是由谷氨酸、半胱氨酸及甘氨酸组成,含有巯基的三肽,广泛存在于动、植物中,在生物体内有着重要的作用,如抗氧化作用、整合解毒作用。
谷胱甘肽在体内以还原型谷胱甘肽(GSH)和氧化型谷胱甘肽(GSSG)两种形式存在,其活性成分为还原型谷胱甘肽,可参与体内三羧酸循环,激活各种酶,对不稳定的眼晶状体蛋白质巯基有抑制作用,从而抑制白内障的发展,抑制角膜及视网膜病变,在角膜损害时能促进上皮组织的修复。
迪信泰检测平台采用高效液相色谱(HPLC)和液质联用(LC-MS)法,可高效、精准的检测还原型谷胱甘肽的含量变化。
此外,我们还提供其他氨基酸及其代谢物检测服务,以满足您的不同需求。
HPLC和LC-MS测定还原型谷胱甘肽样本要求:
1. 请确保样本量大于0.2g或者0.2mL。
周期:2~3周
项目结束后迪信泰检测平台将会提供详细中英文双语技术报告,报告包括:
1. 实验步骤(中英文)
2. 相关质谱参数(中英文)
3. 质谱图片
4. 原始数据
5. 还原型谷胱甘肽含量信息。
氧化型谷胱甘肽说明书
中文名称:氧化型谷胱甘肽
英文名称:Glutathione oxidized;GSSG
其他名称:N-(N-L-γ-谷胺酰基-L-半胱胺酰基)甘氨酸-2,2-二硫化物;L-谷胱甘肽(氧化型);氧化谷胱甘肽
CAS号:27025-41-8
C20H32N6O12S2=612.63
含量:≥98.0%
比旋光度:-96~-106º
鉴别:合格
重金属:≤20ppm
性状(以下信息仅供参考):白色或微黄色粉末。
溶于水,不溶于乙醇和乙醚。
本品1分子能结合约2分子的溶剂(水、乙醇和丙酮)。
在高真空、高温(大于100℃),能除去结合的溶剂,同时部分分解,冷冻不能除去结合的溶剂。
熔点182~185℃。
有刺激性
用途:本品仅供科研,不得用于其它用途。
(以下用途仅供参考)酶法测定NADP和NADPH的氢受体。
保存:RT。
GSH含量测定一、原理还原性谷胱甘肽(GSH)是植物细胞重要的抗氧化剂之一,是一个良好的表示氧化胁迫的指标。
GSH+TDBN在pH=7时生成黄色物质,其颜色深浅与GSH的浓度成线性关系。
即:在巯基化合物的存在下,无色的DTNB将被转变成黄色的5-巯基-2-硝基苯甲酸。
由于5-巯基-2-硝基苯甲酸在412 nm处具有最大吸收,DTNB的吸收光谱并不干扰巯基的测定。
二、材料、试剂、仪器1、材料:小麦叶片2、试剂(1)GSH标准溶液:称取10mg 分析纯GSH,溶于蒸馏水中,并定容于10ml,即为1mg/ml 之标准母液,用稀释10倍(0.1mg/ml GSH);(2)5%偏磷酸;(3)0.2mol/L 磷酸钾缓冲液,pH7.0;(4)TDNB试剂:称取39.6mg二硫代双-二硝基苯甲酸(TDNB),用0.2mol/L磷酸钾缓冲液溶解并定容于100ml;(5)1mol/L NaOH溶液。
2、仪器(1)可见分光光度计:4台;(2)离心机:1台(10000转/分);(3)1/千天平-2台;(4)离心管:3支×16(10ml)(5)刻度试管:4×16支;(10或15ml)(6)普通试管(刻度试管):7支×4(15*150 标准曲线)(7)刻度吸管:0.5ml-8支; 1ml-8支; 2ml-16支; 5ml-8支;(8)研钵:1×16个;(9)比色杯4套;(10)吸水纸适量;(11)剪刀8把;(12)玻棒8支;三、方法步骤:1、制作标准曲线:取7支刻度试管,编号,按表加入试剂:将上述溶液混合均匀,在室温下显色5min。
在412nm波长下测定吸光度。
以标准溶液中GSH浓度为X,吸光度为y,制作标准回归方程,(并求出GSH含量。
)2 、样品测定:称取植物鲜样0.204g加入少量5%偏磷酸研磨提取,并用5%偏磷酸定容到10ml。
10000rpm 离心10min。
离心后取上清液2 ml,同标准曲线操作。
草鱼氧化型谷胱甘肽(GSSG)酶联免疫分析试剂盒使用说明书本试剂盒仅供研究使用。
检测范围:96T0.2 nmol/mL - 12nmol/mL使用目的:本试剂盒用于测定草鱼组织样本中氧化型谷胱甘肽(GSSG)含量。
实验原理本试剂盒应用双抗体夹心法测定标本中草鱼氧化型谷胱甘肽(GSSG)水平。
用纯化的草鱼氧化型谷胱甘肽(GSSG)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入氧化型谷胱甘肽(GSSG),再与HRP标记的氧化型谷胱甘肽(GSSG)抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。
TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的氧化型谷胱甘肽(GSSG)呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),通过标准曲线计算样品中草鱼氧化型谷胱甘肽(GSSG)浓度。
1.标本采集后尽早进行提取,提取按相关文献进行,提取后应尽快进行实验。
若不能马上进行试验,可将标本放于-20℃保存,但应避免反复冻融2.不能检测含NaN3的样品,因NaN3抑制辣根过氧化物酶的(HRP)活性。
操作步骤1.标准品的稀释:本试剂盒提供原倍标准品一支,用户可按照下列图表在小试管中进行稀释。
2.加样:分别设空白孔(空白对照孔不加样品及酶标试剂,其余各步操作相同)、标准孔、待测样品孔。
在酶标包被板上标准品准确加样50μl,待测样品孔中先加样品稀释液40μl,然后再加待测样品10μl(样品最终稀释度为5倍)。
加样将样品加于酶标板孔底部,尽量不触及孔壁,轻轻晃动混匀。
3.温育:用封板膜封板后置37℃温育30分钟。
4.配液:将30倍浓缩洗涤液用蒸馏水30倍稀释后备用5.洗涤:小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30秒后弃去,如此重复5次,拍干。
6.加酶:每孔加入酶标试剂50μl,空白孔除外。
7.温育:操作同3。
8.洗涤:操作同5。
9.显色:每孔先加入显色剂A50μl,再加入显色剂B50μl,轻轻震荡混匀,37℃避光显色15分钟.10.终止:每孔加终止液50μl,终止反应(此时蓝色立转黄色)。
氧化型型谷胱甘肽(Glutathione Oxidized,GSSG)含量测定试剂盒使用说明货号:BC1180常量法50T/48S
一、试剂盒组成:
试剂Ⅰ液体1瓶50ml(4℃保存)
试剂Ⅱ液体1支170l(4℃保存)
试剂Ⅲ液体1瓶60ml(4℃保存)
试剂Ⅳ液体1瓶8ml(4℃避光保存)
试剂Ⅴ粉剂4℃保存,用前8ml蒸馏水溶解
试剂Ⅵ液体1支40l用前0.8ml蒸馏水稀释
标准品粉剂1mg(4℃避光保存)
说明书一份
二、实验原理
氧化型谷胱甘肽(GSSG)是谷胱甘肽(GSH)的氧化形式,又称为二硫代谷胱甘肽,是两分子的谷胱甘肽氧化而成。
GSSG会被谷胱甘肽还原酶还原成GSH,因此机体中大多数是以还原型方式存在。
测定细胞内GSH和GSSG含量以及GSH/GSSG比值,能够很好地反映细胞所处的氧化还原状态。
本试剂盒利用谷胱甘肽能和5,5’-二硫代-双-(2-硝基苯甲酸)(5,5’-dithiobis-2-nitrobenoic acid,DTNB)反应产生2-硝基-5-巯基苯甲酸,2-硝基-5-巯基苯甲酸在波长412nm处具有最大光吸收的特点,通过2-乙烯吡啶抑制样品中原有的还原型谷胱甘肽,然后利用谷胱甘肽还原酶将GSSG还原为GSH,借此测定氧化型谷胱甘肽的含量。
三、实验仪器
分析天平、微量匀浆器(规格2ml)、低温离心机、水浴锅、移液器、可见分光光度计、1ml比色皿。
四、操作步骤
1、样品的处理
组织处理
新鲜组织首先用PBS冲洗2次,然后称取动物组织或者植物组织0.1g。
加入用试剂Ⅰ润洗过的匀浆器中(匀浆器提前放冰上预冷);然后加入1ml试剂Ⅰ(组织/试剂Ⅰ比例保持不变即可),迅速冰上充分研磨(使用液氮研磨效果更好);10000rpm4℃离心10min;取上清液放置于4℃待测,若暂时不能完成测试可放于-80℃保存(可保存10天)。
血液处理
血浆:将收集的抗凝血于4℃,600g离心10分钟,吸取上层血浆到另一支试管中,加入等体积的试剂Ⅰ,4℃,8000g离心10分钟,将上清移入新的试管中放置于4℃待测,若暂时不能完成测试可放于-80℃保存(可保存10天)。
血细胞:将收集的抗凝血于4℃,600g离心10分钟,弃去上层血浆用3倍体积的PBS 清洗3次(用PBS重悬血细胞,600g离心10分钟),加入等体积试剂Ⅰ,混匀后4℃放置10分钟,8000g离心10分钟,吸取上清放于4℃待测,若暂时不能完成测试可放于-80℃保存(可保存10天)。
细胞处理
收集不少于108个细胞,首先用PBS清洗细胞2次(PBS重悬细胞,600g离心10分钟),加入3倍细胞沉淀体积的试剂Ⅰ重悬细胞,反复冻融2-3次(可在液氮中冻结,37℃水浴中溶解),8000g离心10分钟,收集上清于4℃待测,若暂时不能完成测试可放于-80℃保存(可保存10天)。
2、分光光度计预热30min以上,调节波长至412nm,蒸馏水调零。
3、试剂Ⅱ放置37℃(哺乳动物)或25℃(一般物种)水浴中保温30min。
4、标准品的稀释:将标准品用1ml蒸馏水溶解(4℃保存),浓度为1mg/ml。
取适当溶液配制浓度为25g/ml、20g/ml、12.5g/ml、6.25g/ml、3.125g/ml、0g/ml的标准品(试剂Ⅰ十倍稀释后进行稀释)。
5、取1.5ml离心管,加入100L稀释好的标准品或样品,加入2L试剂Ⅱ,混匀后37℃孵育30分钟。
6、制作标准曲线
孵育完成后标准管依次加入700μL试剂Ⅲ,100μL试剂Ⅳ,100μL试剂Ⅴ,10μL试剂Ⅵ,迅速混匀后,测定412nm处30s和150s光吸收A1和A2。
吸光度(A2-A1)为横坐标,浓度为纵坐标做标准曲线。
7、样品管依次加入700μL试剂Ⅲ,100μL试剂Ⅳ,100μL试剂Ⅴ,10μL试剂Ⅵ,迅速混匀后,测定412nm处30s和150s光吸收A1和A2。
五、GSSG含量计算
将样品△A(即A2减去A1)带入标准曲线公式,即可计算出每0.1g组织或相应血液、细胞样品中氧化型谷胱甘肽的含量。
六、注意事项
1、样品处理需匀浆完全,若当天不能完成测量,可放-80℃保存。
2、若不确定样品中GSSG含量的高低,可稀释几个梯度后再进行测量。
3、此方法利用酶促反应速率计算底物浓度,尽量准确在30秒和150秒处完成读数。
4、因为试剂Ⅰ中含有蛋白质沉淀剂,因此上清液不能用于蛋白浓度测定。
5、本试剂盒所配制的试剂除测定48个样品外,至少可做4次标准曲线。