【精品】初三化学的所有化学方程式
- 格式:pdf
- 大小:145.16 KB
- 文档页数:12

初三化学得所有化学方程式化合反应1、镁在空气中燃烧:2Mg + O2 点燃 2MgO2、铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O43、铝在空气中燃烧:4Al + 3O2 点燃 2Al2O34、氢气在空气中燃烧:2H2 + O2 点燃 2H2O5、红磷在空气中燃烧:4P + 5O2 点燃 2P2O56、硫粉在空气中燃烧: S + O2 点燃 SO27、碳在氧气中充分燃烧:C + O2 点燃 CO28、碳在氧气中不充分燃烧:2C + O2 点燃 2CO9、二氧化碳通过灼热碳层: C + CO2 高温 2CO10、一氧化碳在氧气中燃烧:2CO + O2 点燃 2CO211、二氧化碳与水反应(二氧化碳通入紫色石蕊试液):CO2 + H2O === H2CO312、生石灰溶于水:CaO + H2O === Ca(OH)213、无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4·5H2O14、钠在氯气中燃烧:2Na + Cl2点燃 2NaCl分解反应15、实验室用双氧水制氧气:2H2O2 MnO2 2H2O+ O2↑16、加热高锰酸钾:2KMnO4 加热K2MnO4 + MnO2 + O2↑17、水在直流电得作用下分解:2H2O 通电2H2↑+ O2 ↑18、碳酸不稳定而分解:H2CO3 === H2O + CO2↑19、高温煅烧石灰石(二氧化碳工业制法):CaCO3 高温CaO + CO2↑置换反应20、铁与硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu21、锌与稀硫酸反应(实验室制氢气):Zn + H2SO4 == ZnSO4 + H2↑22、镁与稀盐酸反应:Mg+ 2HCl === MgCl2 + H2↑23、氢气还原氧化铜:H2 + CuO 加热 Cu + H2O24、木炭还原氧化铜:C+ 2CuO 高温2Cu + CO2↑25、甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O26、水蒸气通过灼热碳层:H2O + C 高温 H2 + CO27、焦炭还原氧化铁:3C+ 2Fe2O3 高温4Fe + 3CO2↑其她28、氢氧化钠溶液与硫酸铜溶液反应:2NaOH + CuSO4 == Cu(OH)2↓ + Na2SO429、甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O30、酒精在空气中燃烧:C2H5OH + 3O2 点燃 2CO2 + 3H2O31、一氧化碳还原氧化铜:CO+ CuO 加热 Cu + CO232、一氧化碳还原氧化铁:3CO+ Fe2O3 高温 2Fe + 3CO233、二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH)2 + CO2 ==== CaCO3 ↓+ H2O34、氢氧化钠与二氧化碳反应(除去二氧化碳):2NaOH + CO2 ==== Na2CO3 + H2O35、石灰石(或大理石)与稀盐酸反应(二氧化碳得实验室制法):CaCO3 + 2HCl ===CaCl2 + H2O + CO2↑36、碳酸钠与浓盐酸反应(泡沫灭火器得原理): Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑一. 物质与氧气得反应:(1)单质与氧气得反应:1、镁在空气中燃烧:2Mg + O2 点燃 2MgO2、铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O43、铜在空气中受热:2Cu + O2 加热 2CuO4、铝在空气中燃烧:4Al + 3O2 点燃 2Al2O35、氢气中空气中燃烧:2H2 + O2 点燃 2H2O6、红磷在空气中燃烧:4P + 5O2 点燃 2P2O57、硫粉在空气中燃烧: S + O2 点燃 SO28、碳在氧气中充分燃烧:C + O2 点燃 CO29、碳在氧气中不充分燃烧:2C + O2 点燃 2CO(2)化合物与氧气得反应:10、一氧化碳在氧气中燃烧:2CO + O2 点燃 2CO211、甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O12、酒精在空气中燃烧:C2H5OH + 3O2 点燃 2CO2 + 3H2O二.几个分解反应:13、水在直流电得作用下分解:2H2O 通电2H2↑+ O2 ↑14、加热碱式碳酸铜:Cu2(OH)2CO3 加热2CuO + H2O + CO2↑15、加热氯酸钾(有少量得二氧化锰):2KClO3 ==== 2KCl + 3O2 ↑16、加热高锰酸钾:2KMnO4 加热K2MnO4 + MnO2 + O2↑17、碳酸不稳定而分解:H2CO3 === H2O + CO2↑18、高温煅烧石灰石:CaCO3 高温CaO + CO2↑三.几个氧化还原反应:19、氢气还原氧化铜:H2 + CuO 加热 Cu + H2O20、木炭还原氧化铜:C+ 2CuO 高温2Cu + CO2↑21、焦炭还原氧化铁:3C+ 2Fe2O3 高温4Fe + 3CO2↑22、焦炭还原四氧化三铁:2C+ Fe3O4 高温3Fe + 2CO2↑23、一氧化碳还原氧化铜:CO+ CuO 加热 Cu + CO224、一氧化碳还原氧化铁:3CO+ Fe2O3 高温 2Fe + 3CO225、一氧化碳还原四氧化三铁:4CO+ Fe3O4 高温 3Fe + 4CO2四.单质、氧化物、酸、碱、盐得相互关系(1)金属单质 + 酸 -------- 盐 + 氢气 (置换反应)26、锌与稀硫酸Zn + H2SO4 = ZnSO4 + H2↑27、铁与稀硫酸Fe + H2SO4 = FeSO4 + H2↑28、镁与稀硫酸Mg + H2SO4 = MgSO4 + H2↑29、铝与稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3H2↑30、锌与稀盐酸Zn + 2HCl === ZnCl2 + H2↑31、铁与稀盐酸Fe + 2HCl === FeCl2 + H2↑32、镁与稀盐酸Mg+ 2HCl === MgCl2 + H2↑33、铝与稀盐酸2Al + 6HCl == 2AlCl3 + 3H2↑(2)金属单质 + 盐(溶液) ------- 另一种金属 + 另一种盐34、铁与硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu35、锌与硫酸铜溶液反应:Zn + CuSO4 === ZnSO4 + Cu36、铜与硝酸汞溶液反应:Cu + Hg(NO3)2 === Cu(NO3)2 + Hg(3)碱性氧化物 +酸 -------- 盐 + 水37、氧化铁与稀盐酸反应:Fe2O3 + 6HCl === 2FeCl3 + 3H2O38、氧化铁与稀硫酸反应:Fe2O3 + 3H2SO4 === Fe2(SO4)3 + 3H2O39、氧化铜与稀盐酸反应:CuO + 2HCl ==== CuCl2 + H2O40、氧化铜与稀硫酸反应:CuO + H2SO4 ==== CuSO4 + H2O41、氧化镁与稀硫酸反应:MgO + H2SO4 ==== MgSO4 + H2O42、氧化钙与稀盐酸反应:CaO + 2HCl ==== CaCl2 + H2O(4)酸性氧化物 +碱 -------- 盐 + 水43.苛性钠暴露在空气中变质:2NaOH + CO2 ==== Na2CO3 + H2O44.苛性钠吸收二氧化硫气体:2NaOH + SO2 ==== Na2SO3 + H2O45.苛性钠吸收三氧化硫气体:2NaOH + SO3 ==== Na2SO4 + H2O46.消石灰放在空气中变质:Ca(OH)2 + CO2 ==== CaCO3 ↓+ H2O47、消石灰吸收二氧化硫:Ca(OH)2 + SO2 ==== CaSO3 ↓+ H2O(5)酸 + 碱 -------- 盐 + 水48.盐酸与烧碱起反应:HCl + NaOH ==== NaCl +H2O49、盐酸与氢氧化钾反应:HCl + KOH ==== KCl +H2O50.盐酸与氢氧化铜反应:2HCl + Cu(OH)2 ==== CuCl2 + 2H2O51、盐酸与氢氧化钙反应:2HCl + Ca(OH)2 ==== CaCl2 + 2H2O52、盐酸与氢氧化铁反应:3HCl + Fe(OH)3 ==== FeCl3 + 3H2O53、氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 ==== AlCl3 + 3H2O54、硫酸与烧碱反应:H2SO4 + 2NaOH ==== Na2SO4 + 2H2O55、硫酸与氢氧化钾反应:H2SO4 + 2KOH ==== K2SO4 + 2H2O56、硫酸与氢氧化铜反应:H2SO4 + Cu(OH)2 ==== CuSO4 + 2H2O57、硫酸与氢氧化铁反应:3H2SO4 + 2Fe(OH)3==== Fe2(SO4)3 + 6H2O58、硝酸与烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O(6)酸 + 盐 -------- 另一种酸 + 另一种盐59.大理石与稀盐酸反应:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑60.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑61.碳酸镁与稀盐酸反应: MgCO3 + 2HCl === MgCl2 + H2O + CO2↑62.盐酸与硝酸银溶液反应:HCl + AgNO3 === AgCl↓ + HNO363、硫酸与碳酸钠反应:Na2CO3 + H2SO4 === Na2SO4 + H2O + CO2↑64、硫酸与氯化钡溶液反应:H2SO4 + BaCl2 ==== BaSO4 ↓+ 2HCl (7)碱 + 盐 -------- 另一种碱 + 另一种盐65.氢氧化钠与硫酸铜:2NaOH + CuSO4 ==== Cu(OH)2↓ + Na2SO466.氢氧化钠与氯化铁:3NaOH + FeCl3 ==== Fe(OH)3↓ + 3NaCl67.氢氧化钠与氯化镁:2NaOH + MgCl2 ==== Mg(OH)2↓ + 2NaCl68、氢氧化钠与氯化铜:2NaOH + CuCl2 ==== Cu(OH)2↓ + 2NaCl69、氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 === CaCO3↓+ 2NaOH(8)盐 + 盐 ----- 两种新盐70.氯化钠溶液与硝酸银溶液:NaCl + AgNO3 ==== AgCl↓ + NaNO371.硫酸钠与氯化钡:Na2SO4 + BaCl2 ==== BaSO4↓ + 2NaCl五.其它反应:72.二氧化碳溶解于水:CO2 + H2O === H2CO373.生石灰溶于水:CaO + H2O === Ca(OH)274.氧化钠溶于水:Na2O + H2O ==== 2NaOH75.三氧化硫溶于水:SO3 + H2O ==== H2SO476.硫酸铜晶体受热分解:CuSO4·5H2O 加热 CuSO4 + 5H2O77.无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4·5H2化学方程式反应现象应用2Mg+O2点燃或Δ2MgO 剧烈燃烧、耀眼白光、生成白色固体、放热、产生大量白烟白色信号弹2Hg+O2点燃或Δ2HgO 银白液体、生成红色固体拉瓦锡实验2Cu+O2点燃或Δ2CuO 红色金属变为黑色固体4Al+3O2点燃或Δ2Al2O3 银白金属变为白色固体3Fe+2O2点燃Fe3O4 剧烈燃烧、火星四射、生成黑色固体、放热 4Fe + 3O2高温2Fe2O3C+O2 点燃CO2 剧烈燃烧、白光、放热、使石灰水变浑浊S+O2 点燃SO2 剧烈燃烧、放热、刺激味气体、空气中淡蓝色火焰、氧气中蓝紫色火焰2H2+O2 点燃2H2O 淡蓝火焰、放热、生成使无水CuSO4变蓝得液体(水) 高能燃料4P+5O2 点燃2P2O5 剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量CH4+2O2点燃2H2O+CO2 蓝色火焰、放热、生成使石灰水变浑浊气体与使无水CuSO4变蓝得液体(水) 甲烷与天然气得燃烧2C2H2+5O2点燃2H2O+4CO2 蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体与使无水CuSO4变蓝得液体(水) 氧炔焰、焊接切割金属2KClO3MnO2 Δ2KCl +3O2↑ 生成使带火星得木条复燃得气体实验室制备氧气2KMnO4Δ K2MnO4+MnO2+O2↑ 紫色变为黑色、生成使带火星木条复燃得气体实验室制备氧气2HgOΔ2Hg+O2↑ 红色变为银白、生成使带火星木条复燃得气体拉瓦锡实验2H2O通电2H2↑+O2↑ 水通电分解为氢气与氧气电解水Cu2(OH)2CO3Δ2CuO+H2O+CO2↑ 绿色变黑色、试管壁有液体、使石灰水变浑浊气体铜绿加热初三常见化学方程式集。

九年级化学方程式大全分解反应水在直流电的作用下分解:2H2O 通电2H2↑+ O2 ↑加热碱式碳酸铜:Cu2(OH)2CO3 加热2CuO + H2O + CO2↑加热氯酸钾(有少量的二氧化锰):2KClO3 ==== 2KCl + 3O2 ↑加热高锰酸钾:2KMnO4 加热K2MnO4 + MnO2 + O2↑碳酸不稳定而分解:H2CO3 === H2O + CO2↑高温煅烧石灰石:CaCO3高温CaO + CO2↑氧化还原反应:氢气还原氧化铜:H2 + CuO 加热 Cu + H2O木炭还原氧化铜:C+ 2CuO高温2Cu + CO2↑焦炭还原氧化铁:3C+ 2Fe2O3 高温4Fe + 3CO2↑焦炭还原四氧化三铁:2C+ Fe3O4 高温3Fe + 2CO2↑一氧化碳还原氧化铜:CO+ CuO 加热 Cu + CO2一氧化碳还原氧化铁:3CO+ Fe2O3 高温 2Fe + 3CO2一氧化碳还原四氧化三铁:4CO+ Fe3O4 高温 3Fe + 4CO2酸与金属氧化物氧化铁和稀盐酸反应:Fe2O3 + 6HCl ==2FeCl3 + 3H2O氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 == Fe2(SO4)3 + 3H2O氧化铜和稀盐酸反应:CuO + 2HCl ==CuCl2 + H2O氧化铜和稀硫酸反应:CuO + H2SO4 == CuSO4 + H2O金属单质与酸锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3 H2↑锌和稀盐酸Zn + 2HCl == ZnCl2 + H2↑铁和稀盐酸Fe + 2HCl == FeCl2 + H2↑镁和稀盐酸Mg+ 2HCl == MgCl2 + H2↑铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3 H2↑与氧有关的化学方程式2Mg+O2点燃2MgO 现象:燃烧、放出大量的热、同时放出耀眼的白光S+O2 点燃SO2 现象:空气中是淡蓝色的火焰;纯氧中是蓝紫色的火焰;同时生成有刺激性气味的气体。

九年级化学方程式大全【最全整理】物质与氧气的反应(1)单质与氧气的反应:1. 镁在空气中燃烧:2Mg + O2 点燃 2MgO2. 铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O43. 铜在空气中受热:2Cu + O2 加热 2CuO4. 铝在空气中燃烧:4Al + 3O2 点燃 2Al2O35. 氢气中空气中燃烧:2H2 + O2 点燃 2H2O6. 红磷在空气中燃烧:4P + 5O2 点燃 2P2O57. 硫粉在空气中燃烧: S + O2 点燃 SO28. 碳在氧气中充分燃烧:C + O2 点燃 CO29. 碳在氧气中不充分燃烧:2C + O2 点燃 2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO + O2 点燃 2CO211. 甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O12. 酒精在空气中燃烧:C2H5OH + 3O2 点燃 2CO2 + 3H2O 几个分解反应13. 水在直流电的作用下分解:2H2O 通电2H2↑+ O2 ↑14. 加热碱式碳酸铜:Cu2(OH)2CO3 加热2CuO + H2O + CO2↑15. 加热氯酸钾(有少量的二氧化锰作催化剂):2KClO3 ==== 2KCl + 3O2 ↑16. 加热高锰酸钾:2KMnO4 加热K2MnO4 + MnO2 + O2↑17. 碳酸不稳定而分解:H2CO3 === H2O + CO2↑18. 高温煅烧石灰石:CaCO3 高温CaO + CO2↑几个氧化还原反应19. 氢气还原氧化铜:H2 + CuO 加热 Cu + H2O20. 木炭还原氧化铜:C+ 2CuO 高温2Cu + CO2↑21. 焦炭还原氧化铁:3C+ 2Fe2O3 高温4Fe + 3CO2↑22. 焦炭还原四氧化三铁:2C+ Fe3O4 高温3Fe + 2CO2↑23. 一氧化碳还原氧化铜:CO+ CuO 加热 Cu + CO224. 一氧化碳还原氧化铁:3CO+ Fe2O3 高温 2Fe + 3CO225. 一氧化碳还原四氧化三铁:4CO+ Fe3O4 高温 3Fe + 4CO2 单质、氧化物、酸、碱、盐的相互关系金属单质 + 酸 -------- 盐 + 氢气 (置换反应)26. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑27. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑28. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑29. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3H2↑30. 锌和稀盐酸Zn + 2HCl === ZnCl2 + H2↑31. 铁和稀盐酸Fe + 2HCl === FeCl2 + H2↑32. 镁和稀盐酸Mg+ 2HCl === MgCl2 + H2↑33. 铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3H2↑。

初三化学方程式大全一.物质与氧气的反应:(1)单质与氧气的反应:L镁在空气中燃烧:2Mg+02点燃2Mg02.铁在氧气中燃烧:3Fe+202点燃Fe3O43.铜在空气中受热:2Cu+02加热2Cu04.铝在空气中燃烧:4AI+302点燃2AI2O35.氢气中空气中燃烧:2H2+02点燃2H2O6.红磷在空气中燃烧:4P+502点燃2P2O57硫粉在空气中燃烧:S+02点燃S028碳在氧气中充分燃烧:C+02点燃C029碳在氧气中不充分燃烧:2C+02点燃2C0(2)化合物与氧气的反应:10.—氧化碳在氧气中燃烧:2C0+02点燃2CO21L甲烷在空气中燃烧:CH4+202点燃C02+2H2O12酒精在空气中燃烧:C2H5OH+302点燃2CO2+3H2O二.几个分解反应:13.水在直流电的作用下分解:2H2O通电2H2T+02t国登&涅瞬自.Ill+o e u瞿 m o u o起临蕾瞿oo wo u + 02 R u m c o w 票喝WK-^W Z -I一"0 +"OUIAI+寸O U I A I ">I娠吕寸OU S M一肱避艘程蒸晨91一 §+G M R R m o D 湘二艘昔侦南令)旺盈愚莒.3一rxl co+ 0"H+ o n ufxl蒸吕m o u fxl Io m n u一"0¥ + aLL.m唳饱寸 om a LL.+O U寸一抠II IX 1谛S瓯照龄3诵—.捋§m +①LL.fxl卷m o 财LL.+0*-篓崛瓯眼普—.其fxl ou + n u蒸吕o n )+0U -x o ufxl +a LL.m唳饱s m o M - +U "-援川^w 巳限照瑕«质 0M +CULL.寸唳裾m ofxl cu LL."+*一抠¥)«晚照瑕遥.1"§u +n uCN明建O r o "+U 回葵诵晚照瑕长o fxl o"H + n u蒸目o n u+S .回葵诵晚照r w .61四.单质、氧化物、酸、碱、盐的相互关系(1)金属单质+酸------盐+氢气(置换反应) 26.锌和稀硫酸反应:Zn+H2SO4===ZnS04+H2T27.铁和稀硫酸反应:Fe+H2SO4===FeS04+H2T28.镁和稀硫酸反应:Mg+H2SO4===MgS04+H2T29.铝和稀硫酸反应:2AI+3H2SO4===AI2(SO4)3+3H2t30.锌和稀盐酸反应:Zn+2HCI===ZnCI2+H2t31.铁和稀盐酸反应:Fe+2HCI===FeCI2+H2t32.镁和稀盐酸反应:Mg+2HCI===MgCI2+H2T33.铝和稀盐酸反应:2AI+6HCI===2AICI3+3H2T(2)金属单质+盐(溶液)另一种金属+另一种盐ofxl Hm + 8^h h h_U H 9 + m o斜LL.-回底^甜曜曷援^«忘冬+锢--------s s s (m )6h+"(m o N)n uhh hCN (m o N )6H + n u -nu + S ^C Nh h h寸o s n u+C N -回底黑现回盈炬履挞.#n u + 寸 o s a LL.H H H 寸o s n u+ £ .冬+ 锢----®+(寸)ofxl H+ "o e uhh h hd h "+ o e u-ofxl H+ 寸O S 6SR R寸O S "H+06芝-Ofxl H+ 寸o s n uh h h h寸0S 2+ o n u-2 + 3n uh h h h o h" +o n u-02m + m (寸O S )财LL.hh h寸o s "H m+m o斜LL.-ofxl H+Tmoseuh h h h+"(H o )e u-焙^M n-tx lE ^JKZ寸ofxl H+T m o u e uh h h h§ +fxl (H 0)3 -ttg秘任r佃担常宾起粮• 9寸Ofxl H+ 寸0s "e Nh h h h+H o e N "一 长更焙^Ml I l n l e afc •Ln i zO fxl H+m o s z e Nh h h h+ H o e N "一 也r焙^崛门坚举坛坦面•寸寸02 + m o urxl eNh h h h§ +H o e N "一ttg秘任r佃担睡嘿坛坦面• m寸02m + m _%Ll_hh h h2H O OLL.+U H T 回底扳涅M M履离另rxiLn02" + 3e u R R"(Ho)eu+O H "-回底瓠g M M巨离铜.IsOfxl H" + 3n u R R "(H o )n u +U H "-垣景昔«耆铜•oLnCXI H+ sh h h hH 8 + _¥ -回底旺与M w履离铜.6寸2 + G r a zh h h hH o e N+ s一 国胃®誉霸铜• 8寸志 + 铜----®+®(Ln )029+ m (寸O S )财LL.RR 2H O 0LL."+ 寸 o s rxl Hm -回底扳M M M巨离焙以02CXI +寸o s n uh h h h"(H o )n u+ 寸 os fxl H-回监葵源«l w w 9Ln0£" +寸O s ah h h hH 8" +寸O S "H-回底肱M W M巨离焙校OZH"+h h h hH o e N "+1Z 0S 2一 国底詹襄巨离W寸Lno "H m + S 3h h h hm (H O )<+G H m -m o N H+ -_%< hh hm o N 6<+O H -回底揆现聪潮遥巨避铜•"9-"O u + orxl H+"G6IAIH U H D HCXI +O1OU6芝•19一rxl co + 0"H+G e Ncsl hh hD HCXI +m o u fxl eN• 09§u +O "H+ 3e uhh h g hcxi +m o u e u -• 6Ln锢暮—叱 +®ft:—咔----铜 +®( 9)02+m o N e NR RH o e N+8N H一昌®管密od LnD e N m+ -2H O OLL.hh h h+H o e N T抠^喊坍援^崛»・99寸 osfxl eN +一cxl (HO )n ) H H H H寸o s n u +H o e N "一 曜避炬JJ?MV)M M ・Ln 9锢暮—叱+詹拄—咔----铜+®( Z)G H " +-寸O S e sh h h h8^+寸os rxl H-回岛黑佃色节扇巨离W寸9-CN OU + o rxl H+寸0s "e NH H H 寸O S "H+mo u rxl eN -G e N " +-寸o s e mH H H H+ 寸 os CN eN一 M节扇口窝盈焙.IZ.m o N e N+一。

二、自然界中的水:16.水在直流电的作用下分解(研究水的组成实验):2H2O 通电2H2↑+ O2↑17.生石灰溶于水:CaO + H2O == Ca(OH)218.二氧化碳可溶于水:H2O + CO2==H2CO3三、质量守恒定律:19.镁在空气中燃烧:2Mg + O2点燃2MgO20.铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu21.氢气还原氧化铜:H2 + CuO 加热Cu + H2O22. 镁还原氧化铜:Mg + CuO 加热Cu + MgO四、碳和碳的氧化物:(1)碳的化学性质23. 碳在氧气中充分燃烧:C + O2点燃CO224.木炭还原氧化铜:C+ 2CuO 高温2Cu + CO2↑25.焦炭还原氧化铁:3C+ 2Fe2O3高温4Fe + 3CO2↑(2)煤炉中发生的三个反应:(几个化合反应)26.煤炉的底层:C + O2点燃CO227.煤炉的中层:CO2 + C 高温2CO28.煤炉的上部蓝色火焰的产生:2CO + O2点燃2CO2(3)二氧化碳的制法与性质:29.大理石与稀盐酸反应(实验室制二氧化碳):CaCO3 + 2HCl == CaCl2 + H2O + CO2↑30.碳酸不稳定而分解:H2CO3 == H2O + CO2↑31.二氧化碳可溶于水:H2O + CO2== H2CO332.高温煅烧石灰石(工业制二氧化碳):CaCO3高温CaO + CO2↑ 33.石灰水与二氧化碳反应(鉴别二氧化碳):Ca(OH)2 + CO2 === CaCO3↓+ H2O(4)一氧化碳的性质:34.一氧化碳还原氧化铜:CO+ CuO 加热Cu + CO235.一氧化碳的可燃性:2CO + O2点燃2CO2其它反应:36.碳酸钠与稀盐酸反应(灭火器的原理):Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑五、燃料及其利用:37.甲烷在空气中燃烧:CH4 + 2O2点燃CO2 + 2H2O38.酒精在空气中燃烧:C2H5OH + 3O2点燃2CO2 + 3H2O39.氢气中空气中燃烧:2H2 + O2点燃2H2O六、金属(1)金属与氧气反应:40.镁在空气中燃烧:2Mg + O2点燃2MgO41.铁在氧气中燃烧:3Fe + 2O2点燃Fe3O442. 铜在空气中受热:2Cu + O2加热2CuO43. 铝在空气中形成氧化膜:4Al + 3O2 = 2Al2O3(2)金属单质+ 酸-------- 盐+ 氢气(置换反应)44. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑45. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑46. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑47. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3 H2↑48. 锌和稀盐酸Zn + 2HCl == ZnCl2 + H2↑49. 铁和稀盐酸Fe + 2HCl == FeCl2 + H2↑50. 镁和稀盐酸Mg+ 2HCl == MgCl2 + H2↑51.铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3 H2↑(3)金属单质+ 盐(溶液)------- 新金属+ 新盐52. 铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu53. 锌和硫酸铜溶液反应:Zn + CuSO4 ==ZnSO4 + Cu54. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 == Cu(NO3)2 + Hg (3)金属铁的治炼原理:55.3CO+ 2Fe2O3高温4Fe + 3CO2↑七、酸、碱、盐1、酸的化学性质(1)酸+ 金属-------- 盐+ 氢气(见上)(2)酸+ 金属氧化物-------- 盐+ 水56. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl ==2FeCl3 + 3H2O57. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 == Fe2(SO4)3 + 3H2O58. 氧化铜和稀盐酸反应:CuO + 2HCl ==CuCl2 + H2O59. 氧化铜和稀硫酸反应:CuO + H2SO4 == CuSO4 + H2O(3)酸+ 碱-------- 盐+ 水(中和反应)60.盐酸和烧碱起反应:HCl + NaOH == NaCl +H2O61. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 == CaCl2 + 2H2O62. 氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 == AlCl3 + 3H2O63. 硫酸和烧碱反应:H2SO4 + 2NaOH == Na2SO4 + 2H2O(4)酸+ 盐-------- 另一种酸+ 另一种盐64.大理石与稀盐酸反应:CaCO3 + 2HCl == CaCl2 + H2O + CO2↑ 65.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑ 66.碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑ 67. 硫酸和氯化钡溶液反应:H2SO4 + BaCl2 == BaSO4↓+ 2HCl2、碱的化学性质(1)碱+ 非金属氧化物-------- 盐+ 水68.苛性钠暴露在空气中变质:2NaOH + CO2 == Na2CO3 + H2O 69.苛性钠吸收二氧化硫气体:2NaOH + SO2 == Na2SO3 + H2O 70.苛性钠吸收三氧化硫气体:2NaOH + SO3 == Na2SO4 + H2O 71.消石灰放在空气中变质:Ca(OH)2 + CO2 == CaCO3↓+ H2O 72. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 == CaSO3↓+ H2O(2)碱+ 酸-------- 盐+ 水(中和反应,方程式见上)(3)碱+ 盐-------- 另一种碱+ 另一种盐73. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH 3、盐的化学性质(1)盐(溶液)+ 金属单质------- 另一种金属+ 另一种盐74. 铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu(2)盐+ 酸-------- 另一种酸+ 另一种盐75.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑ 碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑ (3)盐+ 碱-------- 另一种碱+ 另一种盐76. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH (4)盐+ 盐----- 两种新盐77.氯化钠溶液和硝酸银溶液:NaCl + AgNO3== AgCl↓ + NaNO3 78.硫酸钠和氯化钡:Na2SO4 + BaCl2 == BaSO4↓ + 2NaCl。
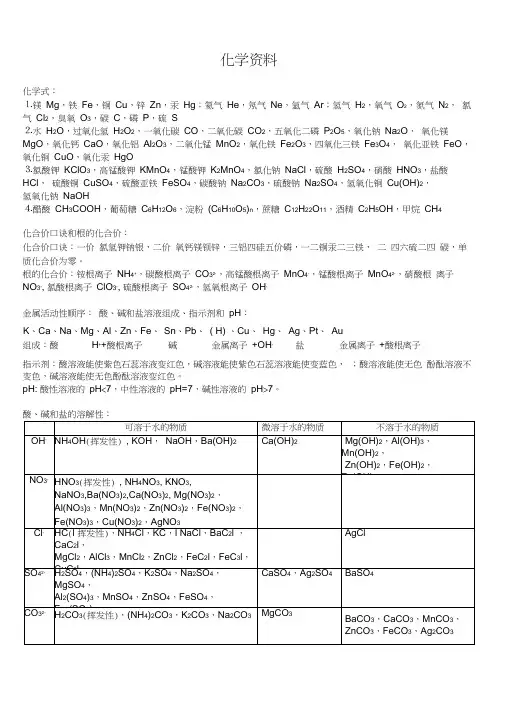
化学资料化学式:⒈镁Mg,铁Fe,铜Cu,锌Zn,汞Hg;氦气He,氖气Ne,氩气Ar;氢气H2,氧气O2,氮气N2,氯气Cl2,臭氧O3,碳C,磷P,硫S⒉水H2O,过氧化氢H2O2,一氧化碳CO,二氧化碳CO2,五氧化二磷P2O5,氧化钠Na2O,氧化镁MgO,氧化钙CaO,氧化铝Al2O3,二氧化锰MnO2,氧化铁Fe2O3,四氧化三铁Fe3O4,氧化亚铁FeO,氧化铜CuO,氧化汞HgO⒊氯酸钾KClO3,高锰酸钾KMnO4,锰酸钾K2MnO4,氯化钠NaCl,硫酸H2SO4,硝酸HNO3,盐酸HCl,硫酸铜CuSO4,硫酸亚铁FeSO4,碳酸钠Na2CO3,硫酸钠Na2SO4,氢氧化铜Cu(OH)2,氢氧化钠NaOH⒋醋酸CH3COOH,葡萄糖C6H12O6,淀粉(C6H10O5)n,蔗糖C12H22O11,酒精C2H5OH,甲烷CH4化合价口诀和根的化合价:化合价口诀:一价氯氢钾钠银,二价氧钙镁钡锌,三铝四硅五价磷,一二铜汞二三铁,二四六硫二四碳,单质化合价为零。
根的化合价:铵根离子NH4+,碳酸根离子CO32-,高锰酸根离子MnO4-,锰酸根离子MnO42-,硝酸根离子NO3-, 氯酸根离子ClO3-, 硫酸根离子SO42-,氢氧根离子OH-金属活动性顺序:酸、碱和盐溶液组成、指示剂和pH:K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、( H) 、Cu、Hg、Ag、Pt、Au组成:酸H++酸根离子碱金属离子+OH-盐金属离子+酸根离子指示剂:酸溶液能使紫色石蕊溶液变红色,碱溶液能使紫色石蕊溶液能使变蓝色,;酸溶液能使无色酚酞溶液不变色,碱溶液能使无色酚酞溶液变红色。
pH: 酸性溶液的pH<7,中性溶液的pH=7,碱性溶液的pH>7。
能发生复分解反应的集中类型:在水中不能共存的离子:H+和OH-,H+和CO32-,H+和HCO3-,NH4+和OH-,Ca2+和CO32-,Ba2+和SO42-、CO32-,Ag+和Cl-,Fe3+、Cu2+、Mg2+和OH-检验氨气的方法:氨气能使湿润的红色石蕊试纸变蓝色。

化学九年级方程式总结77个1、镁在空气中燃烧:2Mg + O2 = 2MgO。
2、铁在氧气中燃烧:3Fe + 2O2 = Fe3O4。
3、铜在空气中受热:2Cu + O2 = 2CuO。
4、铝在空气中燃烧:4Al + 3O2 = 2Al2O3。
5、氢气中空气中燃烧:2H2 + O2 = 2H2O。
6、红磷在空气中燃烧:4P + 5O2 = 2P2O5。
7、硫粉在空气中燃烧:S + O2 = SO2。
8、碳在氧气中充分燃烧:C + O2 = CO2。
9、碳在氧气中不充分燃烧:2C + O2 = 2CO。
10、一氧化碳在氧气中燃烧:2CO + O2 = 2CO2。
11、甲烷在空气中燃烧:CH4 + 2O2 = CO2 + 2H2O。
12、酒精在空气中燃烧:C2H5OH + 3O2 = 2CO2 + 3H2O。
13、水在直流电的作用下分解:2H2O = 2H2↑+ O2↑。
14、加热碱式碳酸铜:Cu2(OH)2CO3 = 2CuO + H2O + CO2↑。
15、加热氯酸钾(有少量的二氧化锰):2KClO3 = 2KCl + 3O2↑。
16、加热高锰酸钾:2KMnO4 = K2MnO4 + MnO2 + O2↑。
17、碳酸不稳定而分解:H2CO3 = H2O + CO2↑。
18、高温煅烧石灰石:CaCO3 = CaO + CO2↑。
19、氢气还原氧化铜:H2 + CuO = Cu + H2O。
20、木炭还原氧化铜:C+ 2CuO = 2Cu + CO2↑。
21、焦炭还原氧化铁:3C+ 2Fe2O3 = 4Fe + 3CO2↑。
22、焦炭还原四氧化三铁:2C+ Fe3O4 = 3Fe + 2CO2↑。
23、一氧化碳还原氧化铜:CO+ CuO = Cu + CO2。
24、一氧化碳还原氧化铁:3CO+ Fe2O3 = 2Fe + 3CO2。
25、一氧化碳还原四氧化三铁:4CO+ Fe3O4 = 3Fe + 4CO2。

初中化学方程式总汇一、氧气的性质:(1)单质与氧气的反应:(化合反应)1. 镁在空气中燃烧:2Mg + O =点燃= 2MgO 22. 铁在氧气中燃烧:3Fe + 2O=点燃= FeO 3243. 铜在空气中受热:2Cu + O=加热= 2CuO 24. 铝在空气中燃烧:4Al + 3O=点燃= 2AlO 32 25. 氢气中空气中燃烧:2H + O =点燃= 2HO2226. 红磷在空气中燃烧(研究空气组成的实验):4P + 5O =点燃= 2PO 5227. 硫粉在空气中燃烧: S + O =点燃= SO 22=点燃= CO 8. 碳在氧气中充分燃烧:C + O2 29. 碳在氧气中不充分燃烧:2C + O =点燃= 2CO 2(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO + O =点燃= 2CO 22=点燃=CO + 2O + 2HO 11. 甲烷在空气中燃烧:CH222412. 酒精在空气中燃烧:CHOH + 3O =点燃= 2CO + 3HO 22522(3)氧气的来源:13.玻义耳研究空气的成分实验 2HgO =加热= Hg+ O ↑214.加热高锰酸钾:2KMnO =加热= KMnO + MnO + O↑(实验室制氧气原理1)2422415.过氧化氢在二氧化锰作催化剂条件下分解反应:HO(MnO催化剂)=2HO+ O ↑(实验室制氧气原理2)22222二、自然界中的水:16.水在直流电的作用下分解(研究水的组成实验):2HO =通电= 2H↑+ O↑ 2 2217.生石灰溶于水:CaO + HO == Ca(OH) 2 2.18.二氧化碳可溶于水: HO + CO==HCO 3222三、质量守恒定律:19.镁在空气中燃烧:2Mg + O=点燃= 2MgO220.铁和硫酸铜溶液反应:Fe + CuSO=== FeSO+ Cu 4 421.氢气还原氧化铜:H + CuO =加热= Cu + HO 2222. 镁还原氧化铜:Mg + CuO =加热= Cu + MgO四、碳和碳的氧化物:(1)碳的化学性质23. 碳在氧气中充分燃烧:C + O =点燃= CO 2224.木炭还原氧化铜:C+ 2CuO =高温=2Cu + CO↑2=高温= 4Fe + 3CO3C+ 2FeO↑ 25.焦炭还原氧化铁:223(2)煤炉中发生的三个反应:(几个化合反应)26.煤炉的底层:C + O =点燃= CO 2227.煤炉的中层:CO + C =高温= 2CO228.煤炉的上部蓝色火焰的产生:2CO + O =点燃= 2CO 22(3)二氧化碳的制法与性质:29.大理石与稀盐酸反应(实验室制二氧化碳):CaCO + 2HCl == CaCl + HO + CO↑223230.碳酸不稳定而分解:HCO == HO + CO ↑223231.二氧化碳可溶于水: HO + CO== HCO 322232.高温煅烧石灰石(工业制二氧化碳):CaCO=高温= CaO + CO↑2333.石灰水与二氧化碳反应(鉴别二氧化碳):Ca(OH) + CO === CaCO ↓+ HO 2232(4)一氧化碳的性质:34.一氧化碳还原氧化铜:CO+ CuO =加热= Cu + CO 235.一氧化碳的可燃性:2CO + O=点燃= 2CO 22其它反应:36.碳酸钠与稀盐酸反应(灭火器的原理):NaCO + 2HCl == 2NaCl + HO + CO↑2322五、燃料及其利用:37.甲烷在空气中燃烧:CH + 2O =点燃= CO + 2HO 242238.酒精在空气中燃烧:CHOH + 3O =点燃= 2CO + 3HO 2222539.氢气中空气中燃烧:2H + O =点燃= 2HO222六、金属(1)金属与氧气反应:40.镁在空气中燃烧:2Mg + O2 =点燃= 2MgO41.铁在氧气中燃烧:3Fe + 2O =点燃= FeO 43242. 铜在空气中受热:2Cu + O =加热=2CuO 243. 铝在空气中形成氧化膜:4Al + 3O = 2Al2O 32(2)金属单质 + 酸 -------- 盐 + 氢气(置换反应)44. 锌和稀硫酸Zn + HSO = ZnSO + H↑244245. 铁和稀硫酸Fe + HSO = FeSO + H↑242446. 镁和稀硫酸Mg + HSO= MgSO + H↑224447. 铝和稀硫酸2Al +3HSO = Al(SO4)+3 H↑2243 248. 锌和稀盐酸Zn + 2HCl == ZnCl + H↑2249. 铁和稀盐酸Fe + 2HCl == FeCl + H↑2250. 镁和稀盐酸Mg+ 2HCl == MgCl + H↑2251.铝和稀盐酸2Al + 6HCl == 2AlCl + 3 H↑23(3)金属单质 + 盐(溶液) ------- 新金属 + 新盐52. 铁和硫酸铜溶液反应:Fe + CuSO == FeSO + Cu 4453. 锌和硫酸铜溶液反应:Zn + CuSO ==ZnSO+ Cu 4 454. 铜和硝酸汞溶液反应:Cu + Hg(NO3)== Cu(NO3)+ Hg 2 2)金属铁的治炼原理:4(.55.3CO+ 2FeO 高温 4Fe + 3CO↑232七、酸、碱、盐1、酸的化学性质(1)酸 + 金属 -------- 盐 + 氢气(见上)(2)酸 + 金属氧化物-------- 盐 + 水56. 氧化铁和稀盐酸反应:FeO + 6HCl ==2FeCl3 + 3HO 22357. 氧化铁和稀硫酸反应:FeO + 3H2SO == Fe(SO) + 3HO 234432258. 氧化铜和稀盐酸反应:CuO + 2HCl ==CuCl + HO 2259. 氧化铜和稀硫酸反应:CuO + HSO == CuSO + HO 2424(3)酸 + 碱 -------- 盐 + 水(中和反应)60.盐酸和烧碱起反应:HCl + NaOH == NaCl +HO261. 盐酸和氢氧化钙反应:2HCl + Ca(OH) == CaCl + 2HO 22262. 氢氧化铝药物治疗胃酸过多:3HCl + Al(OH) == AlCl + 3HO 23363. 硫酸和烧碱反应:HSO + 2NaOH == NaSO + 2HO 24422(4)酸 + 盐 -------- 另一种酸 + 另一种盐64.大理石与稀盐酸反应:CaCO + 2HCl == CaCl + HO + CO↑222365.碳酸钠与稀盐酸反应: NaCO + 2HCl == 2NaCl + HO + CO↑232266.碳酸氢钠与稀盐酸反应:NaHCO + HCl== NaCl + HO + CO↑22367. 硫酸和氯化钡溶液反应:HSO + BaCl == BaSO↓+ 2HCl 4 4222、碱的化学性质(1)碱 + 非金属氧化物 -------- 盐 + 水68.苛性钠暴露在空气中变质:2NaOH + CO == NaCO + HO 223269.苛性钠吸收二氧化硫气体:2NaOH + SO == NaSO+ HO 23 2270.苛性钠吸收三氧化硫气体:2NaOH + SO == NaSO + HO 223471.消石灰放在空气中变质:Ca(OH) + CO == CaCO ↓+ HO 222372. 消石灰吸收二氧化硫:Ca(OH) + SO == CaSO ↓+ HO2322.(2)碱 + 酸-------- 盐 + 水(中和反应,方程式见上)(3)碱 + 盐 -------- 另一种碱 + 另一种盐73. 氢氧化钙与碳酸钠:Ca(OH) + Na2CO == CaCO↓+ 2NaOH 3323、盐的化学性质(1)盐(溶液) + 金属单质------- 另一种金属 + 另一种盐74. 铁和硫酸铜溶液反应:Fe + CuSO == FeSO+ Cu 4 4(2)盐 + 酸-------- 另一种酸 + 另一种盐75.碳酸钠与稀盐酸反应: NaCO + 2HCl == 2NaCl + HO + CO↑2232碳酸氢钠与稀盐酸反应:NaHCO + HCl== NaCl + HO + CO↑223(3)盐 + 碱 -------- 另一种碱 + 另一种盐76. 氢氧化钙与碳酸钠:Ca(OH) + NaCO == CaCO↓+ 2NaOH 3232(4)盐 + 盐 ----- 两种新盐77.氯化钠溶液和硝酸银溶液:NaCl + AgNO == AgCl↓ + NaNO 3378.硫酸钠和氯化钡:NaSO+ BaCl == BaSO↓ + 2NaCl 44 22附:初中化学方程式大全化合反应2MgO 1、镁在空气中燃烧:2Mg+O2FeO 2、铁在氧气中燃烧:3Fe+2O4232AlO3、铝在空气中燃烧:4Al+3O 3222H+O2H4、氢气在空气中燃烧:O 2222P、红磷在空气中燃烧:54P+5OO 522.SO 、硫粉在空气中燃烧:S+O622CO 7、碳在氧气中充分燃烧:C+O222CO 8、碳在氧气中不充分燃烧:2C+O22CO C+CO、二氧化碳通过灼热碳层:9 22CO10、一氧化碳在氧气中燃烧:2CO+O 2211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO+HO==HCO 322212、生石灰溶于水:CaO+HO==Ca(OH) 2213、无水硫酸铜作干燥剂:CuSO+5HO==CuSO·5HO 24242Na+Cl2NaCl 14、钠在氯气中燃烧:2分解反应2HO+OO15、实验室用双氧水制氧气:2H↑2222K2MnO4+MnO2+O2↑16、加热高锰酸钾:2KMnO42H2O、水在直流电的作用下分解:17 2H2↑+O2↑18、碳酸不稳定而分解:H2CO3==H2O+CO2↑CaCO3 Ca:19、高温煅烧石灰石(二氧化碳工业制法)O+CO2↑置换反应20、铁和硫酸铜溶液反应:Fe+CuSO4==FeSO4+Cu21、锌和稀硫酸反应(实验室制氢气):Zn+H2SO4==ZnSO4+H2↑22、镁和稀盐酸反应:Mg+2HCl==MgCl2+H2↑H2+CuO 23、氢气还原氧化铜:Cu+H2O2Cu+CO2↑C+2CuO 24、木炭还原氧化铜:H2+CO 、水蒸气通过灼热碳层:H2O+C254Fe+3CO2↑26、焦炭还原氧化铁:3C+2Fe2O3其他27.氢氧化钠溶液与硫酸铜溶液反应:2NaOH+CuSO4==Cu(OH)2↓+Na2SO4CH4+2O2 28、甲烷在空气中燃烧:CO2+2H2O2CO2+3H2OC2H5OH+3O2、酒精在空气中燃烧:29.CO+CuO 、一氧化碳还原氧化铜:Cu+CO2302Fe+3CO23CO+Fe2O331、一氧化碳还原氧化铁:32、二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH)2+CO2==CaCO3↓+H2O33、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH+CO2==Na2CO3+H2O34、石灰石(或大理石)与稀盐酸反应(二氧化碳的实验室制法):CaCO3+2HCl==CaCl2+H2O+CO2↑35、碳酸钠与浓盐酸反应(泡沫灭火器的原理): Na2CO3+2HCl==2NaCl+H2O+CO2↑一.物质与氧气的反应:⑴单质与氧气的反应:2Mg+O2 1. 镁在空气中燃烧:2MgOFe3O4 铁在氧气中燃烧:3Fe+2O22.铜在空气中受热:3. 2CuO2Cu+O22Al2O3 4. 铝在空气中燃烧:4Al+3O22H2O 2H2+O2氢气中空气中燃烧:5.2P2O5 6. 红磷在空气中燃烧:4P+5O2SO2 S+O2硫粉在空气中燃烧:7.CO2 8. 碳在氧气中充分燃烧:C+O22CO碳在氧气中不充分燃烧:2C+O29.⑵化合物与氧气的反应:2CO2 10. 一氧化碳在氧气中燃烧:2CO+O2CO2+2H2O11. 甲烷在空气中燃烧:CH4+2O22CO2+3H2O酒精在空气中燃烧:12. C2H5OH+3O2 二.几个分解反应:2H2↑+O2↑13. 水在直流电的作用下分解:2H2OCu2(OH)2CO3加热碱式碳酸铜:2CuO+H2O+CO2↑14.2KClO3:加热氯酸钾(有少量的二氧化锰)15. 2KCl+3O2↑2KMnO4K2MnO4+MnO2+O2↑16. 加热高锰酸钾:17. 碳酸不稳定而分解:H2CO3==H2O+CO2↑CaCO3 高温煅烧石灰石:CaO+CO2↑18.三.几个氧化还原反应:Cu+H2O 19. 氢气还原氧化铜:H2+CuO2Cu+CO2↑C+2CuO 20. 木炭还原氧化铜:21. 焦炭还原氧化铁:4Fe+3CO2↑3C+2Fe2O322. 焦炭还原四氧化三铁:3Fe+2CO2↑2C+Fe3O4Cu+CO223. 一氧化碳还原氧化铜:CO+CuO2Fe+3CO23CO+Fe2O324. 一氧化碳还原氧化铁:3Fe+4CO225. 一氧化碳还原四氧化三铁:4CO+Fe3O4四.单质、氧化物、酸、碱、盐的相互关系⑴金属单质+ 酸--------盐+ 氢气(置换反应)26. 锌和稀硫酸Zn+H2SO4==ZnSO4+H2↑27. 铁和稀硫酸Fe+H2SO4==FeSO4+H2↑28. 镁和稀硫酸Mg+H2SO4==MgSO4+H2↑29. 铝和稀硫酸2Al+3H2SO4==Al2(SO4)3+3H2↑30. 锌和稀盐酸Zn+2HCl==ZnCl2+H2↑31. 铁和稀盐酸Fe+2HCl==FeCl2+H2↑32. 镁和稀盐酸Mg+2HCl==MgCl2+H2↑33. 铝和稀盐酸2Al+6HCl==2AlCl3+3H2↑⑵金属单质+ 盐(溶液)-------另一种金属+ 另一种盐34. 铁和硫酸铜溶液反应:Fe+CuSO4==FeSO4+Cu35. 锌和硫酸铜溶液反应:Zn+CuSO4==ZnSO4+Cu36. 铜和硝酸汞溶液反应:Cu+Hg(NO3)2==Cu(NO3)2+Hg⑶碱性氧化物+酸--------盐+ 水37. 氧化铁和稀盐酸反应:Fe2O3+6HCl==2FeCl3+3H2O38. 氧化铁和稀硫酸反应:Fe2O3+3H2SO4==Fe2(SO4)3+3H2O39. 氧化铜和稀盐酸反应:CuO+2HCl==CuCl2+H2O40. 氧化铜和稀硫酸反应:CuO+H2SO4==CuSO4+H2O41. 氧化镁和稀硫酸反应:MgO+H2SO4==MgSO4+H2O42. 氧化钙和稀盐酸反应:CaO+2HCl==CaCl2+H2O⑷酸性氧化物+碱--------盐+ 水43.苛性钠暴露在空气中变质:2NaOH+CO2==Na2CO3+H2O2NaOH+SO2==Na2SO3+H2O.苛性钠吸收二氧化硫气体:44.45.苛性钠吸收三氧化硫气体:2NaOH+SO3==Na2SO4+H2O 46.消石灰放在空气中变质:Ca(OH)2+CO2==CaCO3↓+H2O47. 消石灰吸收二氧化硫:Ca(OH)2+SO2==CaSO3↓+H2O⑸酸+ 碱--------盐+ 水48.盐酸和烧碱起反应:HCl+NaOH==NaCl+H2O49. 盐酸和氢氧化钾反应:HCl+KOH==KCl+H2O50.盐酸和氢氧化铜反应:2HCl+Cu(OH)2==CuCl2+2H2O51. 盐酸和氢氧化钙反应:2HCl+Ca(OH)2==CaCl2+2H2O52. 盐酸和氢氧化铁反应:3HCl+Fe(OH)3==FeCl3+3H2O53.氢氧化铝药物治疗胃酸过多:3HCl+Al(OH)3==AlCl3+3H2O54.硫酸和烧碱反应:H2SO4+2NaOH==Na2SO4+2H2O55.硫酸和氢氧化钾反应:H2SO4+2KOH==K2SO4+2H2O56.硫酸和氢氧化铜反应:H2SO4+Cu(OH)2==CuSO4+2H2O57.硫酸和氢氧化铁反应:3H2SO4+2Fe(OH)3==Fe2(SO4)3+ 6H2O58.硝酸和烧碱反应:HNO3+NaOH==NaNO3+H2O⑹酸+ 盐--------另一种酸+ 另一种盐59.大理石与稀盐酸反应:CaCO3+2HCl==CaCl2+H2O+CO2↑60.碳酸钠与稀盐酸反应: Na2CO3+2HCl==2NaCl+H2O+CO2↑61.碳酸镁与稀盐酸反应: MgCO3+2HCl==MgCl2+H2O+CO2↑62.盐酸和硝酸银溶液反应:HCl+AgNO3==AgCl↓+HNO363.硫酸和碳酸钠反应:Na2CO3+H2SO4==Na2SO4+H2O+CO2↑64.硫酸和氯化钡溶液反应:H2SO4+BaCl2==BaSO4↓+2HCl⑺碱+ 盐--------另一种碱+ 另一种盐65.氢氧化钠与硫酸铜:2NaOH+CuSO4==Cu(OH)2↓+Na2SO466.氢氧化钠与氯化铁:3NaOH+FeCl3==Fe(OH)3↓+3NaCl67.氢氧化钠与氯化镁:2NaOH+MgCl2==Mg(OH)2↓+2NaCl68. 氢氧化钠与氯化铜:2NaOH+CuCl2==Cu(OH)2↓+2NaCl69. 氢氧化钙与碳酸钠:Ca(OH)2+Na2CO3==CaCO3↓+2NaOH⑻盐+ 盐-----两种新盐70.氯化钠溶液和硝酸银溶液:NaCl+AgNO3==AgCl↓+NaNO371.硫酸钠和氯化钡:Na2SO4+BaCl2==BaSO4↓+2NaCl五.其它反应:72.二氧化碳溶解于水:CO2+H2O==H2CO373.生石灰溶于水:CaO+H2O==Ca(OH)274.氧化钠溶于水:Na2O+H2O==2NaOH75.三氧化硫溶于水:SO3+H2O==H2SO45H2OCuSO4+5H2O.硫酸铜晶体受热分解:CuSO4·7677.无水硫酸铜作干燥剂:CuSO4+5H2O==CuSO4·5H2O 化学方程式反应现象应用2Mg+O2 2MgO剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟白色信号弹拉瓦锡实验银白液体、生成红色固体2HgO2Hg+O2.2Cu+O2 2CuO红色金属变为黑色固体2Al2O3银白金属变为白色固体4Al+3O2Fe3O4剧烈燃烧、火星四射、生成黑色固体、放热3Fe+2O2CO2C+O2剧烈燃烧、白光、放热、使石灰水变浑浊SO2剧烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰S+O22H2O淡蓝火焰、放热、生成使无水CuSO42H2+O2变蓝的液体(水)高能燃料2P2O5 剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量4P+5O22H2O+CO2 CH4+2O2蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)甲烷和天然气的燃烧2C2H2+5O2 2H2O+4CO2 蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)氧炔焰、焊接切割金属2KClO3 2KCl+3O2↑生成使带火星的木条复燃的气体实验室制备氧气K2MnO4+MnO2+O2↑紫色变为黑色、生成使带火星木条复燃的气体2KMnO4实验室制备氧气红色变为银白、生成使带火星木条复燃的气体2HgO 拉瓦锡实验2Hg+O2↑2H2O 电解水2H2↑+O2↑水通电分解为氢气和氧气铜2CuO+H2O+CO2↑绿色变黑色、Cu2(OH)2CO3试管壁有液体、使石灰水变浑浊气体绿加热碳酸使石灰水变浑浊气体管壁有液体、↑+H2O+CO2↑NH4HCO3NH3白色固体消失、氢铵长期暴露空气中会消失Zn+H2SO4==ZnSO4+H2↑有大量气泡产生、锌粒逐渐溶解实验室制备氢气Fe+H2SO4==FeSO4+H2↑有大量气泡产生、金属颗粒逐渐溶解Mg+H2SO4==MgSO4+H2↑有大量气泡产生、金属颗粒逐渐溶解2Al+3H2SO4==Al2(SO4)3+3H2↑有大量气泡产生、金属颗粒逐渐溶解Fe2O3+3H2冶炼金属、利用氢气的红色逐渐变为银白色、试管壁有液体2Fe+3H2O还原性冶炼金属、利用氢气的黑色逐渐变为银白色、试管壁有液体3Fe+4H2O Fe3O4+4H2.还原性WO3+3H2 W+3H2O 冶炼金属钨、利用氢气的还原性Mo+3H2O 冶炼金属钼、利用氢气的还原性MoO3+3H22NaCl 剧烈燃烧、黄色火焰离子化合物的形成、2Na+Cl22HCl 苍白色火焰、瓶口白雾H2+Cl2 共价化合物的形成、制备盐酸CuSO4+2NaOH=Cu(OH)2↓+Na2SO4 蓝色沉淀生成、上部为澄清溶液质量守恒定律实验2C+O2 2CO煤炉中常见反应、空气污染物之一、煤气中毒原因2CO2蓝色火焰2CO+O2煤气燃烧2Cu+CO2↑黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体冶炼金属C+CuO4Fe+3CO2↑冶炼金属2Fe2O3+3C3Fe+2CO2↑Fe3O4+2C 冶炼金属C+CO22COCO2+H2O==H2CO3碳酸使石蕊变红证明碳酸的酸性H2CO3CO2↑+H2O石蕊红色褪去Ca(OH)2+CO2==CaCO3↓+H2O澄清石灰水变浑浊应用CO2检验和石灰浆粉刷墙壁CaCO3+H2O+CO2==Ca(HCO3)2白色沉淀逐渐溶解溶洞的形成,石头的风化Ca(HCO3)2 CaCO3↓+H2O+CO2↑白色沉淀、产生使澄清石灰水变浑浊的气体水垢形成.钟乳石的形成2NaHCO3 Na2CO3+H2O+CO2↑产生使澄清石灰水变浑浊的气体小苏打蒸馒头CaO+CO2↑工业制备二氧化碳和生石灰CaCO3CaCO3+2HCl==CaCl2+H2O+CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体实验室制备二氧化碳、除水垢Na2CO3+H2SO4==Na2SO4+H2O+CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体泡沫灭火器原理Na2CO3+2HCl==2NaCl+H2O+CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体泡沫灭火器原理MgCO3+2HCl==MgCl2+H2O+CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体冶炼金属黑色逐渐变红色,产生使澄清石灰水变浑浊的气体Cu+CO2CuO+CO.Fe2O3+3CO 2Fe+3CO2冶炼金属原理3Fe+4CO2冶炼金属原理Fe3O4+4COW+3CO2冶炼金属原理WO3+3COCH3COOH+NaOH=CH3COONa+H2O2CH3OH+3O2 2CO2+4H2O2CO2+3H2O 蓝色火焰、产生使石灰水变浑浊的气体、C2H5OH+3O2放热酒精的燃烧Fe+CuSO4==Cu+FeSO4银白色金属表面覆盖一层红色物质湿法炼铜、镀铜Mg+FeSO4==Fe+MgSO4溶液由浅绿色变为无色Cu+Hg(NO3)2==Hg+Cu(NO3)2Cu+2AgNO3==2Ag+Cu(NO3)2红色金属表面覆盖一层银白色物质镀银Zn+CuSO4==Cu+ZnSO4青白色金属表面覆盖一层红色物质镀铜Fe2O3+6HCl==2FeCl3+3H2O铁锈溶解、溶液呈黄色铁器除锈Al2O3+6HCl==2AlCl3+3H2O白色固体溶解Na2O+2HCl==2NaCl+H2O白色固体溶解CuO+2HCl==CuCl2+H2O黑色固体溶解、溶液呈蓝色ZnO+2HCl==ZnCl2+H2O白色固体溶解MgO+2HCl==MgCl2+H2O白色固体溶解CaO+2HCl==CaCl2+H2O白色固体溶解NaOH+HCl==NaCl+H2O白色固体溶解Cu(OH)2+2HCl==CuCl2+2H2O蓝色固体溶解Mg(OH)2+2HCl==MgCl2+2H2O白色固体溶解Al(OH)3+3HCl==AlCl3+3H2O白色固体溶解胃舒平治疗胃酸过多Fe(OH)3+3HCl==FeCl3+3H2O红褐色沉淀溶解、溶液呈黄色Ca(OH)2+2HCl==CaCl2+2H2OHCl+AgNO3==AgCl↓+HNO3 生成白色沉淀、不溶解于稀硝酸检验Cl—的原理Fe2O3+3H2SO4= Fe2(SO4)3+3H2O 铁锈溶解、溶液呈黄色铁器除锈Al2O3+3H2SO4==Al2(SO4)3+3H2O白色固体溶解CuO+H2SO4==CuSO4+H2O黑色固体溶解、溶液呈蓝色ZnO+H2SO4==ZnSO4+H2O白色固体溶解MgO+H2SO4==MgSO4+H2O白色固体溶解2NaOH+H2SO4==Na2SO4+2H2OCu(OH)2+H2SO4==CuSO4+2H2O蓝色固体溶解Ca(OH)2+H2SO4==CaSO4+2H2OMg(OH)2+H2SO4==MgSO4+2H2O白色固体溶解2Al(OH)3+3H2SO4==Al2(SO4)3+3H2O白色固体溶解2Fe(OH)3+3H2SO4==Fe2(SO4)3+3H2O红褐色沉淀溶解、溶液呈黄色Ba(OH)2+H2SO4==BaSO4↓+2H2O 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理BaCl2+H2SO4==BaSO4↓+2HCl生成白色沉淀、不溶解于稀硝酸检验SO42—的原理的原理—SO42检验生成白色沉淀、不溶解于稀硝酸Ba(NO3)2+H2SO4==BaSO4↓+2HNO3.Na2O+2HNO3==2NaNO3+H2O白色固体溶解CuO+2HNO3==Cu(NO3)2+H2O黑色固体溶解、溶液呈蓝色ZnO+2HNO3==Zn(NO3)2+H2O白色固体溶解MgO+2HNO3==Mg(NO3)2+H2O白色固体溶解CaO+2HNO3==Ca(NO3)2+H2O白色固体溶解NaOH+HNO3==NaNO3+H2OCu(OH)2+2HNO3==Cu(NO3)2+2H2O蓝色固体溶解Mg(OH)2+2HNO3==Mg(NO3)2+2H2O白色固体溶解Al(OH)3+3HNO3==Al(NO3)3+3H2O白色固体溶解Ca(OH)2+2HNO3==Ca(NO3)2+2H2OFe(OH)3+3HNO3==Fe(NO3)3+3H2O红褐色沉淀溶解、溶液呈黄色3NaOH+H3PO4==3H2O+Na3PO43NH3+H3PO4==(NH4)3PO42NaOH+CO2==Na2CO3+H2O 吸收CO、O2、H2中的CO22NaOH+SO2==Na2SO3+H2O 2NaOH+SO3==Na2SO4+H2O 处理硫酸工厂的尾气(SO2)FeCl3+3NaOH==Fe(OH)3↓+3NaCl 溶液黄色褪去、有红褐色沉淀生成AlCl3+3NaOH==Al(OH)3↓+3NaCl有白色沉淀生成MgCl2+2NaOH==Mg(OH)2↓+2NaClCuCl2+2NaOH==Cu(OH)2↓+2NaCl溶液蓝色褪去、有蓝色沉淀生成CaO+ H2O==Ca(OH)2白色块状固体变为粉末、生石灰制备石灰浆Ca(OH)2+SO2==CaSO3↓+H2O有白色沉淀生成初中一般不用Ca(OH)2+Na2CO3==CaCO3↓+2NaOH有白色沉淀生成工业制烧碱、实验室制少量烧碱Ba(OH)2+Na2CO3==BaCO3↓+2NaOH有白色沉淀生成Ca(OH)2+K2CO3==CaCO3↓+2KOH有白色沉淀生成CuSO4+5H2O==CuSO4·H2O蓝色晶体变为白色粉末CuSO4+H2O CuSO4+5H2O 白色粉末变为蓝色检验物质中是否含有水AgNO3+NaCl==AgCl↓+NaNO3白色不溶解于稀硝酸的沉淀(其他氯化物类似反应)应用于检验溶液中的氯离子BaCl2+Na2SO4==BaSO4↓+2NaCl白色不溶解于稀硝酸的沉淀(其他硫酸盐类似反应)应用于检验硫酸根离子CaCl2+Na2CO3==CaCO3↓+2NaCl有白色沉淀生成MgCl2+Ba(OH)2==BaCl2+Mg(OH)2↓有白色沉淀生成CaCO3+2HCl==CaCl2+H2O+CO2↑MgCO3+2HCl==MgCl2+H2O+ CO2↑NH4NO3+NaOH==NaNO3+NH3↑+H2O生成使湿润石蕊试纸变蓝色的气体应用于检验溶液中的铵根离子NH4Cl+KOH==KCl+NH3↑+H2O生成使湿润石蕊试纸变蓝色的气体。

初三化学方程式(全)与氧有关的化学方程式:2Mg + O2 → 2MgO:该反应产生燃烧、大量热量和耀眼的白光。
S + O2 → SO2:在空气中,火焰呈淡蓝色;在纯氧中,火焰呈蓝紫色;同时生成有刺激性气味的气体。
C + O2 → CO2:该反应产生让纯净石灰水变浑浊的气体。
2C + O2 → 2CO:除了燃烧现象外,其他现象不明显。
4P + 5O2 → 2P2O5:该反应产生白烟。
3Fe + 2O2 → Fe3O4:该反应产生剧烈燃烧、火星四射和黑色固体。
2H2 + O2 → 2H2O:该反应产生淡蓝色的火焰。
MnO2 + 2H2O2 → 2H2O + O2↑:该反应产生溶液里冒出大量气泡。
2HgO → 2Hg + O2↑:该反应产生银白色的液体金属。
MnO2 + 2KClO3 → 2KCl + 3O2↑:该反应产生能让带火星的木条复燃的气体。
2KMnO4 → K2MnO4 + MnO2 + O2↑:该反应同上。
与氢有关的化学方程式:2H2 + O2 → 2H2O:该反应产生淡蓝色的火焰。
Zn + H2SO4 → ZnSO4 + H2↑:该反应产生可燃气体。
Mg + H2SO4 → MgSO4 + H2↑:该反应同上。
Fe + H2SO4 → FeSO4 + H2↑:该反应产生浅绿色溶液和气体。
2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑:该反应产生气体。
Zn + 2HCl → ZnCl2 + H2↑:该反应产生气体。
Mg + 2HCl → MgCl2 + H2↑:该反应同上。
Fe + 2HCl → FeCl2 + H2↑:该反应产生浅绿色溶液和气体。
H2 + CuO → Cu + H2O:该反应由黑色固体变为红色,同时生成水珠。
高温2Fe2O3 + 3H2 → 2Fe + 3H2O:该反应产生气体。
化学反应现象与气体生成当碳与氧气反应时,会产生CO2气体,其化学方程式为C+O2→CO2.这种反应的现象是生成能使纯净的石灰水变浑浊的气体,并且固体的颜色会从红色变成银白色。

初三常见化学方程式初三常见化学方程式化合反应1.镁在空气中燃烧:2Mg + O2 → 2MgO2.铁在氧气中燃烧:3Fe + 2O2 → Fe3O43.铝在空气中燃烧:4Al + 3O2 → 2Al2O34.氢气在空气中燃烧:2H2 + O2 → 2H2O5.红磷在空气中燃烧:4P + 5O2 → 2P2O56.硫粉在空气中燃烧:S + O2 → SO27.碳在氧气中充分燃烧:C + O2 → CO28.碳在氧气中不充分燃烧:2C + O2 → 2CO9.二氧化碳通过灼热碳层:C + CO2 → 2CO10.一氧化碳在氧气中燃烧:2CO + O2 → 2CO211.二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 + H2O → H2CO312.生石灰溶于水:CaO + H2O → Ca(OH)213.无水硫酸铜作干燥剂:CuSO4 + 5H2O → CuSO4·5H2O14.钠在氯气中燃烧:2Na + Cl2 → 2NaCl分解反应15.实验室用双氧水制氧气:2H2O2 → 2H2O + O2↑16.加热高锰酸钾:2KMnO4 → K2MnO4 + MnO2 + O2↑17.水在直流电的作用下分解:2H2O → 2H2↑ + O2↑18.碳酸不稳定而分解:H2CO3 → H2O + CO2↑19.高温煅烧石灰石(二氧化碳工业制法):CaCO3 → CaO + CO2↑置换反应20.铁和硫酸铜溶液反应:Fe + CuSO4 → FeSO4 + Cu21.CaO + CO2↑22.锌和稀硫酸反应(实验室制氢气):Zn + H2SO4 → ZnSO4 + H2↑23.镁和稀盐酸反应:Mg + 2HCl → MgCl2+ H2↑24.氢气还原氧化铜:H2 + CuO → Cu + H2O25.木炭还原氧化铜:C + 2CuO → 2Cu + CO2↑26.水蒸气通过灼热碳层:H2O + C → H2 + CO27.焦炭还原氧化铁:3C + 2Fe2O3 → 4Fe + 3CO2↑其他28.氢氧化钠溶液与硫酸铜溶液反应:2NaOH + CuSO4 → Cu(OH)2↓ + Na2SO429.甲烷在空气中燃烧:CH4 + 2O2 → CO2 + 2H2O30.酒精在空气中燃烧:C2H5OH + 3O2 → 2CO2 + 3H2O31.一氧化碳还原氧化铜:CO + CuO → Cu + CO232.一氧化碳还原氧化铁:3CO + Fe2O3 → 2Fe + 3CO232、可以用澄清石灰水来检验二氧化碳:Ca(OH)2+CO2==CaCO3↓+H2O。

九年级所有化学方程式总汇全一、化学反应类型1. 置换反应金属置换反应:例如,铁与硫酸铜反应硫酸亚铁和铜。
Fe + CuSO₄ → FeSO₄ + Cu非金属置换反应:例如,氯气与溴化钠反应氯化钠和溴。
Cl₂ + 2NaBr → 2NaCl + Br₂2. 复分解反应中和反应:例如,氢氧化钠与盐酸反应氯化钠和水。
NaOH + HCl → NaCl + H₂O盐与盐的反应:例如,硫酸钠与氯化钡反应硫酸钡和氯化钠。
Na₂SO₄ + BaCl₂ → BaSO₄↓ + 2NaCl3. 分解反应热分解:例如,碳酸钙在高温下分解氧化钙和二氧化碳。
CaCO₃ → CaO + CO₂↑光解:例如,氯酸钾在光照下分解氯化钾和氧气。
2KClO₃ → 2KCl + 3O₂↑4. 合成反应燃烧反应:例如,碳与氧气反应二氧化碳。
C + O₂ → CO₂氢化反应:例如,氮气与氢气反应氨气。
N₂ + 3H₂ → 2NH₃二、化学方程式实例1. 氢气与氧气反应水2H₂ + O₂ → 2H₂O2. 铁与硫酸铜反应硫酸亚铁和铜Fe + CuSO₄ → FeSO₄ + Cu3. 氢氧化钠与盐酸反应氯化钠和水NaOH + HCl → NaCl + H₂O4. 碳酸钙在高温下分解氧化钙和二氧化碳 CaCO₃ → CaO + CO₂↑5. 氯酸钾在光照下分解氯化钾和氧气2KClO₃ → 2KCl + 3O₂↑6. 氮气与氢气反应氨气N₂ + 3H₂ → 2NH₃7. 碳与氧气反应二氧化碳C + O₂ → CO₂8. 氯气与溴化钠反应氯化钠和溴Cl₂ + 2NaBr → 2NaCl + Br₂9. 硫酸钠与氯化钡反应硫酸钡和氯化钠 Na₂SO₄ + BaCl₂ → BaSO₄↓ + 2NaCl 10. 氢气与氯气反应氯化氢H₂ + Cl₂ → 2HCl九年级所有化学方程式总汇全三、氧化还原反应1. 氧化反应例如,铁在氧气中燃烧四氧化三铁。
3Fe + 2O₂ → Fe₃O₄2. 还原反应例如,氧化铜在氢气中还原铜和水。
初三常用化学方程式1.氢气与氧气发生化合反应:2H2 + O2 → 2H2O2.镁与氧气发生化合反应:2Mg + O2 → 2MgO3.铁与氧气发生化合反应:3Fe + 2O2 → Fe3O44.碳与氧气发生化合反应:C + O2 → CO25.一氧化碳与氧气发生化合反应:2CO + O2 → 2CO26.甲烷在空气中燃烧:CH4 + 2O2 → CO2 + 2H2O7.乙醇在空气中燃烧:C2H5OH + 3O2 → 2CO2 + 3H2O8.氢氧化钠与稀硫酸发生中和反应:NaOH + H2SO4 → Na2SO4 +H2O9.氢氧化钙与稀盐酸发生中和反应:Ca(OH)2 + 2HCl → CaCl2 +2H2O10.二氧化碳与氢氧化钠反应:CO2 + 2NaOH → Na2CO3 + H2O11.氢氧化钠与二氧化碳反应:2NaOH + CO2 → Na2CO3 + H2O12.氢氧化钙与碳酸钠反应:Ca(OH)2 + Na2CO3 → CaCO3↓ +2NaOH13.碳酸钙高温分解:CaCO3 → CaO + CO2↑14.氧化钙与水反应:CaO + H2O → Ca(OH)215.硫酸铜与氢氧化钠反应:CuSO4 + 2NaOH → Cu(OH)2↓ +Na2SO416.氯化铁与氢氧化钠反应:FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl17.氯化钡与硫酸钠反应:BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl18.盐酸与硝酸银反应:HCl + AgNO3 → AgCl↓ + HNO319.硫酸与氯化钡反应:H2SO4 + BaCl2 → BaSO4↓ + 2HCl20.硫酸与氢氧化钠反应:H2SO4 + 2NaOH → Na2SO4 + 2H2O21.氧化铁与盐酸反应:Fe2O3 + 6HCl → 2FeCl3 + 3H2O22.氧化铜与硫酸反应:CuO + H2SO4 → CuSO4 + H2O23.氢氧化钠与稀硫酸反应:2NaOH + H2SO4 → Na2SO4 + 2H2O24.氢氧化钙与稀盐酸反应:Ca(OH)2 + 2HCl → CaCl2 + 2H2O25.氢氧化钠与二氧化碳反应:2NaOH + CO2 → Na2CO3 + H2O26.氢氧化钙与碳酸钠反应:Ca(OH)2 + Na2CO3 → CaCO3↓ +2NaOH27.氢氧化钠与氯化铁反应:3NaOH + FeCl3 → Fe(OH)3↓ + 3NaCl28.硫酸与氢氧化铁反应:3H2SO4 + 2Fe(OH)3 → Fe2(SO4)3 + 6H2O29.硝酸银与稀盐酸反应:AgNO3 + HCl → AgCl↓ + HNO330.硝酸银与稀氯化钠反应:AgNO3 + NaCl → AgCl↓ + NaNO331.锌与稀硫酸反应:Zn + H2SO4 → ZnSO4 + H2↑32.镁与稀盐酸反应:Mg + 2HCl → MgCl2 + H2↑33.铝与稀硫酸反应:2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑34.铁与稀盐酸反应:Fe + 2HCl → FeCl2 + H2↑35.铜与硝酸银反应:Cu + 2AgNO3 → Cu(NO3)2 + 2Ag36.铁与硫酸铜反应:Fe + CuSO4 → FeSO4 + Cu37.氧化钙与水反应:CaO + H2O → Ca(OH)238.二氧化碳与氢氧化钠反应:CO2 + 2NaOH → Na2CO3 + H2O39.二氧化碳与氢氧化钙反应:CO2 + Ca(OH)2 → CaCO3↓ + H2O40.二氧化碳与水反应:CO2 + H2O → H2CO341.氢气还原氧化铜:H2 + CuO → Cu + H2O42.碳还原氧化铜:C + 2CuO → 2Cu + CO2↑43.一氧化碳还原氧化铜:CO + CuO → Cu + CO244.碳还原氧化铁:3C + 2Fe2O3 → 4Fe + 3CO2↑45.一氧化碳还原氧化铁:3CO + Fe2O3 → 2Fe + 3CO246.碳酸钙与稀盐酸反应:CaCO3 + 2HCl → CaCl2 + H2O + CO2↑47.碳酸钠与稀盐酸反应:Na2CO3 + 2HCl → 2NaCl + H2O + CO2↑48.碳酸氢钠与稀盐酸反应:NaHCO3 + HCl → NaCl + H2O + CO2↑49.硫酸与碳酸钠反应:H2SO4 + Na2CO3 → Na2SO4 + H2O + CO2↑50.硫酸与碳酸氢钠反应:H2SO4 + NaHCO3 → Na2SO4 + H2O + CO2↑51.氨气与氯化氢反应:NH3 + HCl → NH4Cl52.氢氧化钠与稀硫酸反应:2NaOH + H2SO4 → Na2SO4 + 2H2O53.氢氧化钠与氯化铵反应:NaOH + NH4Cl → NaCl + NH3↑ + H2O54.碳酸氢钠受热分解:2NaHCO3 → Na2CO3 + CO2↑ + H2O55.碳酸氢铵受热分解:NH4HCO3 → NH3↑ + CO2↑ + H2O56.盐酸与硝酸银反应:HCl + AgNO3 → AgCl↓ + HNO357.硫酸与碳酸钠反应:H2SO4 + Na2CO3 → Na2SO4 + CO2↑ + H2O58.硫酸与碳酸氢钠反应:H2SO4 + NaHCO3 → Na2SO4 + CO2↑ +H2O59.硫酸与氢氧化铁反应:3H2SO4 + 2Fe(OH)3 → Fe2(SO4)3 + 6H2O60.硝酸与氢氧化铁反应:3HNO3 + Fe(OH)3 → Fe(NO3)3 + 3H2O61.氧化铁与氢气反应:Fe2O3 + 3H2 → 2Fe + 3H2O62.氧化铁与一氧化碳反应:Fe2O3 + 3CO → 2Fe + 3CO263.氧化铜与氢气反应:CuO + H2 → Cu + H2O64.氧化铜与一氧化碳反应:CuO + CO → Cu + CO265.氧化钙与水反应:CaO + H2O → Ca(OH)266.二氧化碳与氢氧化钙反应:CO2 + Ca(OH)2 → CaCO3↓ + H2O67.二氧化硫与水反应:SO2 + H2O → H2SO368.二氧化硫与氢氧化钠反应:SO2 + 2NaOH → Na2SO3 + H2O69.一氧化碳还原氧化铁:3CO + Fe2O3 → 2Fe + 3CO270.一氧化碳还原四氧化三铁:4CO + Fe3O4 → 3Fe + 4CO271.一氧化碳还原氧化铜:CO + CuO → Cu + CO272.甲烷在空气中燃烧:CH4 + 2O2 → CO2 + 2H2O73.水在直流电的作用下电解:2H2O → 2H2↑ + O2↑74.石灰石与稀盐酸反应:CaCO3 + 2HCl → CaCl2 + H2O + CO2↑75.小苏打受热分解:2NaHCO3 → Na2CO3 + CO2↑ + H2O76.碳酸钠与稀盐酸反应:Na2CO3 + 2HCl → 2NaCl + H2O + CO2↑77.双氧水在二氧化锰催化下分解:H2O2 → H2O + O2↑78.氯酸钾在二氧化锰催化下分解:KClO3 → KCl + O2↑79.硫酸铜与氢氧化钠反应:CuSO4 + 2NaOH → Cu(OH)2↓ +Na2SO480.氯化铁与氢氧化钠反应:FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl81.硝酸铵受热分解:NH4NO3 → N2O↑ + 2H2O82.硝酸钾受热分解:KNO3 → KNO2↑ + O2↑83.碳酸氢铵受热分解:NH4HCO3 → NH3↑ + CO2↑ + H2O84.氢氧化钠与稀硫酸反应:NaOH + H2SO4 → Na2SO4 + 2H2O85.硫酸与氢氧化铜反应:H2SO4 + Cu(OH)2 → CuSO4 + 2H2O86.硫酸与氢氧化铁反应:Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 3H2O87.盐酸与硝酸银反应:HCl + AgNO3 → AgCl↓ + HNO388.盐酸与碳酸钠反应:Na2CO3 + 2HCl → 2NaCl + H2O + CO2↑89.氯化钡与稀硫酸反应:BaCl2 + H2SO4 → BaSO4↓ + 2HCl90.硝酸与氢氧化钠反应:HNO3 + NaOH → NaNO3 + H2O91.氯化铵受热分解:NH4Cl → NH3↑ + HCl↑92.碳酸氢钠与稀盐酸反应:NaHCO3 + HCl → NaCl + H2O + CO2↑93.硫酸铜与氢氧化钠反应:CuSO4 + 2NaOH → Cu(OH)2↓ +Na2SO494.硝酸银与氯化钠反应:AgNO3 + NaCl → AgCl↓ + NaNO395.一氧化碳还原氧化亚铁:FeO + CO → Fe + CO296.一氧化碳还原氧化银:Ag2O + CO → 2Ag + CO297.二氧化碳与氢氧化钡反应:CO2 + Ba(OH)2 → BaCO3↓ + H2O98.二氧化硫与氢氧化钾反应:SO2 + 2KOH → K2SO3 + H2O99.一氧化氮与氧气反应:NO + O2 → NO2100.二氧化氮与水反应:NO2 + H2O → HNO3。
初三化学公式下面是我为您整理的初三化学公式大全(一共包含三个附注),希望能够对您有所帮助:1.氢气与氧气反应生成水:2H₂ + O₂ → 2H₂O2.碳酸钠和石灰水反应生成碳酸钙、水和二氧化碳:Na₂CO₃ + Ca(OH)₂ → CaCO₃ + 2NaOH3.氢气和氯气反应生成盐酸:H₂ + Cl₂ → 2HCl4.硫酸与氢氧化钠反应生成硫酸钠和水:H₂SO₄ + 2NaOH → Na₂SO₄ + 2H₂O5.氨和盐酸反应生成氯化铵:NH₃ + HCl → NH₄Cl6.碘和氢氧化钠反应生成碘化钠和水:2NaOH + I₂ → NaI + H₂O7.氧化铁与二氧化硫反应生成三氧化二铁:4Fe₂O₃ + SO₂ → 2Fe₃O₄ + SO₃8.溴水与亚硫酸钠反应生成硫酸钠和溴化钠:Br₂ + Na₂SO₃ → Na₂SO₄ + 2NaBr9.铜与硝酸反应生成硝酸铜和二氧化氮:3Cu + 8HNO₃ → 3Cu(NO₃)₂ + 2NO₂ + 4H₂O10.汞和盐酸反应生成氯化汞和氢气:Hg + 2HCl → HgCl₂ + H₂11.硫酸和钠碳酸反应生成二氧化碳、水和硫酸钠:H₂SO₄ + Na₂CO₃ → CO₂ + H₂O + Na₂SO₄12.镁与盐酸反应生成氯化镁和氢气:Mg + 2HCl → MgCl₂ + H₂13.碳酸钠和盐酸反应生成盐酸和二氧化碳:Na₂CO₃ + 2HCl → 2NaCl + CO₂ + H₂O14.钙与水反应生成氢气和氢氧化钙:Ca + 2H₂O → H₂ + Ca(OH)₂15.铝与硫酸反应生成硫酸铝和氢气:2Al + 3H₂SO₄ → Al₂(SO₄)₃ + 3H₂16.氢氧化钠和盐酸反应生成氯化钠和水:NaOH + HCl → NaCl + H₂O这些公式涉及了不同类型的化学反应,例如氧化还原反应、酸碱反应等。
请牢记,化学实验中应遵循正确的安全操作流程,并根据具体条件调整反应物的比例和浓度。
化学方程式化合反应1、镁在空气中燃烧:2Mg + O2 点燃 2MgO2、铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O43、铝在空气中燃烧:4Al + 3O2 点燃 2Al2O34、氢气在空气中燃烧:2H2 + O2 点燃 2H2O5、红磷在空气中燃烧:4P + 5O2 点燃 2P2O56、硫粉在空气中燃烧: S + O2 点燃 SO27、碳在氧气中充分燃烧:C + O2 点燃 CO28、碳在氧气中不充分燃烧:2C + O2 点燃 2CO9、二氧化碳通过灼热碳层: C + CO2 高温 2CO10、一氧化碳在氧气中燃烧:2CO + O2 点燃 2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 + H2O === H2CO312、生石灰溶于水:CaO + H2O === Ca(OH)213、无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4·5H2O14、钠在氯气中燃烧:2Na + Cl2点燃 2NaCl分解反应15、实验室用双氧水制氧气:2H2O2 MnO2 2H2O+ O2↑16、加热高锰酸钾:2KMnO4 加热K2MnO4 + MnO2 + O2↑17、水在直流电的作用下分解:2H2O 通电2H2↑+ O2 ↑18、碳酸不稳定而分解:H2CO3 === H2O + CO2↑19、高温煅烧石灰石(二氧化碳工业制法):CaCO3 高温CaO + CO2↑置换反应20、铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu21、锌和稀硫酸反应(实验室制氢气):Zn + H2SO4 == ZnSO4 + H2↑22、镁和稀盐酸反应:Mg+ 2HCl === MgCl2 + H2↑23、氢气还原氧化铜:H2 + CuO 加热 Cu + H2O24、木炭还原氧化铜:C+ 2CuO 高温2Cu + CO2↑25、甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O26、水蒸气通过灼热碳层:H2O + C 高温 H2 + CO27、焦炭还原氧化铁:3C+ 2Fe2O3 高温4Fe + 3CO2↑其他28、氢氧化钠溶液与硫酸铜溶液反应:2NaOH + CuSO4 == Cu(OH)2↓ + Na2SO429、甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O30、酒精在空气中燃烧:C2H5OH + 3O2 点燃 2CO2 + 3H2O31、一氧化碳还原氧化铜:CO+ CuO 加热 Cu + CO232、一氧化碳还原氧化铁:3CO+ Fe2O3 高温 2Fe + 3CO233、二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH)2 + CO2 ==== CaCO3 ↓+ H2O34、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH + CO2 ==== Na2CO3 + H2O35、石灰石(或大理石)与稀盐酸反应(二氧化碳的实验室制法):CaCO3 + 2HCl === CaCl2 + H2O + CO2↑36、碳酸钠与浓盐酸反应(泡沫灭火器的原理): Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑一.物质与氧气的反应:(1)单质与氧气的反应:1. 镁在空气中燃烧:2Mg + O2 点燃 2MgO2. 铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O43. 铜在空气中受热:2Cu + O2 加热 2CuO4. 铝在空气中燃烧:4Al + 3O2 点燃 2Al2O35. 氢气中空气中燃烧:2H2 + O2 点燃 2H2O6. 红磷在空气中燃烧:4P + 5O2 点燃 2P2O57. 硫粉在空气中燃烧: S + O2 点燃 SO28. 碳在氧气中充分燃烧:C + O2 点燃 CO29. 碳在氧气中不充分燃烧:2C + O2 点燃 2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO + O2 点燃 2CO211. 甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O12. 酒精在空气中燃烧:C2H5OH + 3O2 点燃 2CO2 + 3H2O二.几个分解反应:13. 水在直流电的作用下分解:2H2O 通电2H2↑+ O2 ↑14. 加热碱式碳酸铜:Cu2(OH)2CO3 加热2CuO + H2O + CO2↑15. 加热氯酸钾(有少量的二氧化锰):2KClO3 ==== 2KCl + 3O2 ↑16. 加热高锰酸钾:2KMnO4 加热K2MnO4 + MnO2 + O2↑17. 碳酸不稳定而分解:H2CO3 === H2O + CO2↑18. 高温煅烧石灰石:CaCO3 高温CaO + CO2↑三.几个氧化还原反应:19. 氢气还原氧化铜:H2 + CuO 加热 Cu + H2O20. 木炭还原氧化铜:C+ 2CuO 高温2Cu + CO2↑21. 焦炭还原氧化铁:3C+ 2Fe2O3 高温4Fe + 3CO2↑22. 焦炭还原四氧化三铁:2C+ Fe3O4 高温3Fe + 2CO2↑23. 一氧化碳还原氧化铜:CO+ CuO 加热 Cu + CO224. 一氧化碳还原氧化铁:3CO+ Fe2O3 高温 2Fe + 3CO225. 一氧化碳还原四氧化三铁:4CO+ Fe3O4 高温 3Fe + 4CO2 四.单质、氧化物、酸、碱、盐的相互关系(1)金属单质 + 酸 -------- 盐 + 氢气(置换反应)26. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑27. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑28. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑29. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3H2↑30. 锌和稀盐酸Zn + 2HCl === ZnCl2 + H2↑31. 铁和稀盐酸Fe + 2HCl === FeCl2 + H2↑32. 镁和稀盐酸Mg+ 2HCl === MgCl2 + H2↑33. 铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3H2↑(2)金属单质 + 盐(溶液) ------- 另一种金属 + 另一种盐34. 铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu35. 锌和硫酸铜溶液反应:Zn + CuSO4 === ZnSO4 + Cu36. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 === Cu(NO3)2 + Hg (3)碱性氧化物 +酸 -------- 盐 + 水37. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl === 2FeCl3 + 3H2O38. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 === Fe2(SO4)3 + 3H2O39. 氧化铜和稀盐酸反应:CuO + 2HCl ==== CuCl2 + H2O40. 氧化铜和稀硫酸反应:CuO + H2SO4 ==== CuSO4 + H2O41. 氧化镁和稀硫酸反应:MgO + H2SO4 ==== MgSO4 + H2O42. 氧化钙和稀盐酸反应:CaO + 2HCl ==== CaCl2 + H2O(4)酸性氧化物 +碱 -------- 盐 + 水43.苛性钠暴露在空气中变质:2NaOH + CO2 ==== Na2CO3 + H2O 44.苛性钠吸收二氧化硫气体:2NaOH + SO2 ==== Na2SO3 + H2O 45.苛性钠吸收三氧化硫气体:2NaOH + SO3 ==== Na2SO4 + H2O 46.消石灰放在空气中变质:Ca(OH)2 + CO2 ==== CaCO3 ↓+ H2O 47. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 ==== CaSO3 ↓+ H2O (5)酸 + 碱 -------- 盐 + 水48.盐酸和烧碱起反应:HCl + NaOH ==== NaCl +H2O49. 盐酸和氢氧化钾反应:HCl + KOH ==== KCl +H2O50.盐酸和氢氧化铜反应:2HCl + Cu(OH)2 ==== CuCl2 + 2H2O51. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 ==== CaCl2 + 2H2O52. 盐酸和氢氧化铁反应:3HCl + Fe(OH)3 ==== FeCl3 + 3H2O53.氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 ==== AlCl3 + 3H2O54.硫酸和烧碱反应:H2SO4 + 2NaOH ==== Na2SO4 + 2H2O55.硫酸和氢氧化钾反应:H2SO4 + 2KOH ==== K2SO4 + 2H2O56.硫酸和氢氧化铜反应:H2SO4 + Cu(OH)2 ==== CuSO4 + 2H2O57. 硫酸和氢氧化铁反应:3H2SO4 + 2Fe(OH)3==== Fe2(SO4)3 + 6H2O58. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O(6)酸 + 盐 -------- 另一种酸 + 另一种盐59.大理石与稀盐酸反应:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑60.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑61.碳酸镁与稀盐酸反应: MgCO3 + 2HCl === MgCl2 + H2O + CO2↑62.盐酸和硝酸银溶液反应:HCl + AgNO3 === AgCl↓ + HNO363.硫酸和碳酸钠反应:Na2CO3 + H2SO4 === Na2SO4 + H2O + CO2↑64.硫酸和氯化钡溶液反应:H2SO4 + BaCl2 ==== BaSO4 ↓+ 2HCl(7)碱 + 盐 -------- 另一种碱 + 另一种盐65.氢氧化钠与硫酸铜:2NaOH + CuSO4 ==== Cu(OH)2↓ + Na2SO466.氢氧化钠与氯化铁:3NaOH + FeCl3 ==== Fe(OH)3↓ + 3NaCl67.氢氧化钠与氯化镁:2NaOH + MgCl2 ==== Mg(OH)2↓ + 2NaCl68. 氢氧化钠与氯化铜:2NaOH + CuCl2 ==== Cu(OH)2↓ + 2NaCl69. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 === CaCO3↓+ 2NaOH(8)盐 + 盐 ----- 两种新盐70.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 ==== AgCl↓ + NaNO371.硫酸钠和氯化钡:Na2SO4 + BaCl2 ==== BaSO4↓ + 2NaCl五.其它反应:72.二氧化碳溶解于水:CO2 + H2O === H2CO373.生石灰溶于水:CaO + H2O === Ca(OH)274.氧化钠溶于水:Na2O + H2O ==== 2NaOH75.三氧化硫溶于水:SO3 + H2O ==== H2SO476.硫酸铜晶体受热分解:CuSO4·5H2O 加热 CuSO4 + 5H2O77.无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4·5H2化学方程式反应现象应用2Mg+O2点燃或Δ2MgO 剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟白色信号弹2Hg+O2点燃或Δ2HgO 银白液体、生成红色固体拉瓦锡实验2Cu+O2点燃或Δ2CuO 红色金属变为黑色固体4Al+3O2点燃或Δ2Al2O3 银白金属变为白色固体3Fe+2O2点燃Fe3O4 剧烈燃烧、火星四射、生成黑色固体、放热 4Fe + 3O2高温2Fe2O3C+O2 点燃CO2 剧烈燃烧、白光、放热、使石灰水变浑浊S+O2 点燃SO2 剧烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰2H2+O2 点燃2H2O 淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水)高能燃料4P+5O2 点燃2P2O5 剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量CH4+2O2点燃2H2O+CO2 蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)甲烷和天然气的燃烧2C2H2+5O2点燃2H2O+4CO2 蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)氧炔焰、焊接切割金属2KClO3MnO2 Δ2KCl +3O2↑ 生成使带火星的木条复燃的气体实验室制备氧气2KMnO4Δ K2MnO4+MnO2+O2↑ 紫色变为黑色、生成使带火星木条复燃的气体实验室制备氧气2HgOΔ2Hg+O2↑ 红色变为银白、生成使带火星木条复燃的气体拉瓦锡实验2H2O通电2H2↑+O2↑ 水通电分解为氢气和氧气电解水Cu2(OH)2CO3Δ2CuO+H2O+CO2↑ 绿色变黑色、试管壁有液体、使石灰水变浑浊气体铜绿加热初三常见化学方程式集。
九年化学方程式(一)化合反应1、木炭在氧气中燃烧:C + O 2 CO 22、碳不充分燃烧:2C + O 22CO 3、硫在氧气中燃烧:S + O 2 SO 24、镁在空气中燃烧:2Mg + O 2 2MgO 5、铁在氧气中燃烧:3Fe + 2O 2Fe 3O 46、磷在氧气中燃烧:4P + 5O 2 2P 2O 57、铜在空气中加热:2Cu + O 2 2CuO 8、氢气燃烧:2H 2 + O 22H 2O 9、二氧化碳与水反应:CO 2 + H 2O ===H 2CO 310、一氧化碳在空气中燃烧:2CO + O 2 2CO 211、二氧化碳通过灼热的碳层:CO 2 + C 2CO 12、生石灰和水化合:CaO + H 2O ===Ca(OH)213、汞与氧气反应:2Hg + O 22HgO 14、二氧化硫和水反应:SO 2 + H 2O === H 2SO 3 15、钠在氯气中燃烧:2Na + Cl 2 2NaCl 1616、铝与空气中的氧气反应:、铝与空气中的氧气反应:4Al + 3O 2=== 2Al 2O 3(二)分解反应:17、氯酸钾与二氧化锰共热(实验室制O 2):2KClO 32KCl + 3O 2↑ 18、加热高锰酸钾:2KMnO 4K 2MnO 4 + MnO 2 + O 2↑19、过氧化氢溶液和二氧化锰制取氧气:2H 2O 22 H 2O + O 2↑ 20、电解水:2H 2O2H 2↑ + O 2↑ 21、碳酸不稳定分解:H 2CO 3 === H 2O + CO2↑ 22、高温煅烧石灰石:CaCO 3CaO + CO 2↑ 23、氢氧化铜受热分解:Cu(OH)2CuO + H 2O 24、氧化汞分解: 2HgO 2Hg + O2↑ (三)置换反应(三)置换反应25、锌和稀硫酸反应(实验室制H 2):Zn + H2SO 4 === ZnSO 4 + H 2↑ 26、锌和盐酸的反应:Zn + 2HCl=== ZnCl 2 + H2↑ 27、铁和稀盐酸:Fe + 2HCl === FeCl 2 + H 2↑ 28、铁和稀硫酸:Fe + H2SO 4 === FeSO 4 + H 2↑ 29、镁和稀盐酸:Mg + 2HCl === MgCl 2 + H 2↑ 30、镁和稀硫酸:Mg + H2SO 4 === MgSO 4 + H 2↑ 31、氢气还原氧化铜:H 2 + CuO Cu + H 2O 32、木炭还原氧化铜:C + 2CuO2Cu + CO2↑ 33、焦碳还原氧化铁:3C + 2Fe2O 34Fe + 3CO 2↑ 34、铁和硫酸铜溶液:Fe + CuSO 4 === Cu + FeSO 435、铜和硝酸银溶液:Cu + 2 AgNO 3 === 2Ag + Cu(NO3)236、铝和硫酸铜溶液:2Al + 3CuSO 4=== Al 2(SO 4)3 + 3Cu 37、锌和硫酸铜溶液:Zn + CuSO 4 === Cu + ZnSO 438、铝和硝酸银溶液:Al + 3 AgNO 3 === 3Ag + Al(NO3)339、铁和氯化铜溶液:Fe + CuCl 2 === Cu + FeCl2 (四)复分解反应(四)复分解反应40、大理石和稀盐酸(实验室制CO 2):CaCO 3 + 2HCl === CaCl 2 + H 2O + CO 2↑ 41、氢氧化钠溶液和硫酸铜溶液:2NaOH + CuSO 4 === Cu(OH)2↓ + Na 2SO 4 42、碳酸钠溶液和盐酸(灭火器原理):Na 2CO 3 + 2HCl === 2NaCl + H 2O + CO 2↑ 43、碳酸氢钠溶液和盐酸:Na H CO 3 + HCl === NaCl + H 2O + CO 2↑ 44、盐酸和氢氧化钠溶液:HCl + NaOH === NaCl + H 2O 45、盐酸和氢氧化钾溶液:HCl + K OH === K Cl + H2O 46、盐酸和氢氧化镁:2HCl + Mg(OH)2 === MgCl 2 + 2 H 2O 47、盐酸和氢氧化铝:3HCl + Al(OH)3 === AlCl 3 + 3 H 2O 48、盐酸和氢氧化钙溶液:2HCl + Ca(OH)2 === CaCl 2 + 2 H 2O 49、盐酸除铁锈:Fe 2O 3 + 6HCl === 2FeCl 3 + 3H2O 50、硫酸和氢氧化钠溶液:H 2SO 4 + 2NaOH === Na 2SO 4 + 2H 2O 51、硫酸与氯化钡溶液:H 2SO 4 + BaCl 2=== BaSO 4↓ + 2HCl 52、硫酸与硝酸钡溶液:H 2SO 4 + Ba(NO3)2 === BaSO 4↓ + 2HNO 353、硫酸和氢氧化钙反应:H 2SO 4 + Ca(OH)2 === CaSO 4 + 2H2O 54、硫酸除铁锈:Fe 2O 3 +3 H 2SO 4 === Fe 2(SO 4)3 + 3H2O 55、碳酸钠溶液和硫酸:Na 2CO 3 + H2SO 4 === Na 2SO 4 + H 2O + CO 2↑ 56、碳酸钾溶液和硫酸:K 2CO 3 + H2SO 4 === K 2SO 4 + H 2O + CO 2↑ 57、碳酸钾溶液与硝酸钡溶液:K 2CO 3 + Ba(NO3)2 === Ba CO 3↓ + 2KNO 358、碳酸钠溶液和氯化钙溶液:Na 2CO 3 + CaCl 2 === CaCO 3↓ + 2NaCl 59、碳酸钠溶液和石灰水:Na 2CO 3 + Ca(OH)2=== CaCO 3↓ + 2NaOH 60、氧化铜和稀硫酸反应:CuO +2HCl === Cu Cl 2 + H 2O 61、氧化铜和稀盐酸反应:H 2SO 4 + CuO === CuSO 4 + H2O (五)其他:(五)其他:62、二氧化碳使澄清石灰水变浑浊:CO 2 + Ca(OH)2 === CaCO 3↓ + H2O 63、用氢氧化钠溶液吸收二氧化硫:SO 2 + 2NaOH === Na 2SO 3 + H2O 64、氢氧化钠溶液和三氧化硫反应:SO 3+ 2NaOH === Na 2SO 4 + H 2O 65、氢氧化钠溶液和二氧化碳反应:CO 2 + 2NaOH === Na 2CO 3 + H2O 66、一氧化碳还原氧化铜:CO + CuO Cu + CO267、一氧化碳还原氧化铁(炼铁原理):3CO + Fe2O 3 2Fe + 3CO 268、甲烷在空气中燃烧:CH 4 + 2O 2CO 2 + 2H 2O 69、乙醇在空气中燃烧:C 2H 5OH + 3O 22CO 2 + 3H 2O 70、葡萄糖在体内氧化:C 6H 12O 6 + 6O2 6CO 2 + 6H 2O常见物质的化学式:1、单质:H 2氢气氢气O 2氧气氧气 N 2氮气氮气 C 碳 P 磷 S 硫 Fe 铁 Cu 铜 Hg 汞2、化合物 (1)氧化物:H 2O 水 CO 2二氧化碳二氧化碳 CO 一氧化碳一氧化碳 SO 2二氧化硫二氧化硫 SO 3三氧化硫三氧化硫 P 2O 5五氧化二磷Fe 2O 3氧化铁(三氧化二铁)氧化铁(三氧化二铁)Fe 3O 4四氧化三铁四氧化三铁 CaO 氧化钙氧化钙 MgO 氧化镁氧化镁 CuO 氧化铜 ZnO 氧化锌氧化锌 FeO 氧化亚铁氧化亚铁 MnO 2二氧化锰二氧化锰 Na 2O 氧化钠氧化钠 Al 2O 3氧化铝(三氧化二铝) (2)酸:HCl 盐酸盐酸 H 2SO 4硫酸硫酸 HNO 3硝酸硝酸 CH 3COOH 醋酸醋酸 H 2CO 3碳酸碳酸 H 2SO 3亚硫酸亚硫酸 (3)碱:NaOH 氢氧化钠氢氧化钠 KOH 氢氧化钾氢氧化钾 Ca(OH)2氢氧化钙氢氧化钙 Ba(OH)2氢氧化钡氢氧化钡 Cu(OH)2氢氧化铜氢氧化铜 Fe(OH)3氢氧化铁氢氧化铁 Fe(OH)2氢氧化亚铁氢氧化亚铁 Al(OH)3氢氧化铝氢氧化铝 Mg(OH)2氢氧化镁氢氧化镁 (4)盐:NaCl 氯化钠Na 2CO 3碳酸钠ZnCl 2氯化锌CaCl 2氯化钙氯化钙KCl 氯化钾氯化钾 Na 2SO 4硫酸钠硫酸钠 CuSO 4硫酸铜硫酸铜AgCl 氯化银氯化银 FeCl 3氯化铁氯化铁 FeCl 2氯化亚铁氯化亚铁 AlCl 3氯化铝氯化铝 FeSO 4硫酸亚铁硫酸亚铁 Fe 2(SO 4)3硫酸铁硫酸铁ZnSO 4硫酸锌硫酸锌 CaCO 3碳酸钙碳酸钙 BaCl 2氯化钡氯化钡 BaSO 4硫酸钡硫酸钡 KClO 3氯酸钾 KMnO 4高锰酸钾高锰酸钾 K 2MnO 4锰酸钾锰酸钾 KNO 3硝酸钾硝酸钾 Cu(NO 3)2硝酸铜硝酸铜 Hg(NO 3)2硝酸汞硝酸汞 NH 4Cl 氯化铵氯化铵 NH 4NO 3硝酸铵硝酸铵 (NH 4)2SO 4硫酸铵硫酸铵 NH 4HCO 3碳酸氢铵碳酸氢铵 NaHCO 3碳酸氢钠碳酸氢钠 Cu 2(OH)2CO 3碱式碳酸铜碱式碳酸铜(5)有机物: CH 4甲烷甲烷 C 2H 5OH 乙醇(酒精)CH 3COOH 乙酸(醋酸)乙酸(醋酸) CO(NH 2)2尿素尿素 熟记一些物质的学名、俗名及对应的化学式Hg 汞(水银)汞(水银) CO 2二氧化碳(干冰)二氧化碳(干冰) CO 一氧化碳(煤气主要成分)一氧化碳(煤气主要成分) CaO 氧化钙(生石灰)氧化钙(生石灰) NaCl 氯化钠(食盐)氯化钠(食盐) C 2H 5OH 乙醇(酒精)乙醇(酒精)CH 3COOH 乙酸(醋酸)乙酸(醋酸) Na 2CO 3碳酸钠(纯碱、苏打)碳酸钠(纯碱、苏打) NaHCO 3碳酸氢钠(小苏打)碳酸氢钠(小苏打)CuSO 4·5H 2O 五水硫酸铜(胆矾、蓝矾)矾) K 2CO 3碳酸钾(草木灰主要成分)碳酸钾(草木灰主要成分) KAl(SO 4)2·12H 2O 十二水硫酸铝钾(明矾) CH 4甲烷(沼气、天然气主要成分)甲烷(沼气、天然气主要成分)Ca(OH)2氢氧化钙氢氧化钙(熟石灰、(熟石灰、(熟石灰、消石灰)消石灰) CaCO 3碳酸钙(石灰石、(石灰石、大理石主要成分)大理石主要成分) NaOH 氢氧化钠(火碱、烧碱、苛性钠)。
九年级全一册化学方程式整理九年级全一册化学方程式整理如下:
1. 镁在空气中燃烧:2Mg + O2点燃2MgO
2. 铁在氧气中燃烧:3Fe + 2O2点燃Fe3O4
3. 铜在空气中受热:2Cu + O2加热2CuO
4. 铝在空气中燃烧:4Al + 3O2点燃2Al2O3
5. 氢气中空气中燃烧:2H2 + O2点燃2H2O
6. 红磷在空气中燃烧:4P + 5O2点燃2P2O5
7. 硫粉在空气中燃烧:S + O2点燃SO2
8. 碳在氧气中充分燃烧:C + O2点燃CO2
9. 碳在氧气中不充分燃烧:2C + O2点燃2CO
10. 一氧化碳在氧气中燃烧:2CO + O2点燃2CO2
11. 一氧化碳还原氧化铜:CO+CuOCu+CO2
12. 二氧化碳通过炽热的炭层:CO2+C高温2CO
13. 一氧化碳还原氧化铁:3CO+Fe2O3高温2Fe+3CO2
14. 甲烷在空气中燃烧:CH4+2O2点燃CO2+2H2O
15. 水在直流电的作用下分解:2H2O通电2H2↑+O2↑
16. 生石灰溶于水:CaO+H2O=Ca(OH)2
17. 盐酸的检验:HCl+AgNO3=AgCl↓+HNO3
18. 硫酸根的检验:H2SO4+Ba(NO3)2=BaSO4↓+HNO3
19. 氯化铵与氢氧化钠反应:NH4Cl+NaOH加热NaCl+H2O+NH3↑以上是九年级全一册化学方程式整理,供您参考。