常用化学药品配制重点
- 格式:doc
- 大小:139.50 KB
- 文档页数:11

试剂配制1.乙醇制氢氧化钾试液可取用乙醇制氢氧化钾液(0.5mol/L)。
2.乙醇制氨试液取无水乙醇,加浓氨试液使100ml中含NH3 9~11g,即得。
本液应置橡皮塞瓶中保存。
3.乙醇制溴化汞试液取溴化汞2.5g,加乙醇50ml,微热使溶解,即得。
本液应置玻璃塞瓶内,在暗处保存。
4.二乙基二硫代氨基甲酸银试液取二乙基二硫代氨基甲酸银0.25g,加氯仿适量与三乙胺1.8ml,加氯仿至100ml,搅拌使溶解,放置过夜,用脱脂棉滤过,即得。
本液应置棕色玻璃瓶内,密塞,置阴凉处保存。
5.二硝基苯试液取间二硝基苯2g,加乙醇使溶解成100ml,即得。
6.二硝基苯甲酸试液取3,5-二硝基苯甲酸1g,加乙醇使溶解成100ml,即得。
二硝基苯肼乙醇试液取2,4-二硝基苯肼1g,加乙醇1000ml使溶解,再缓缓加入盐酸10ml,摇匀,即得。
7.二硝基苯肼试液取2,4-二硝基苯肼1.5g,加硫酸溶液(1→2)20ml,溶解后,加水使成100ml,滤过,即得。
8.三硝基苯酚试液(苦味酸?)本液为三硝基苯酚的饱和水溶液。
9.三氯化铁试液取三氯化铁9g,加水使溶解成100ml,即得。
10.三氯化铝试液取三氯化铝1g,加乙醇使溶解成100ml,即得。
11.三氯化锑试液本液为三氯化锑饱和的氯仿溶液。
12.水合氯醛试液取水合氯醛50g,加水15ml与甘油10ml使溶解,即得。
13.甘油醋酸试液取甘油、50%醋酸与水各等份,混合,即得。
14.甲醛试液可取用“甲醛溶液”。
15.四苯硼钠试液取四苯硼钠0.1g,加水使溶解成100ml,即得。
16.对二甲氨基苯甲醛试液取对二甲氨基苯甲醛0.125g,加无氮硫酸65ml与水35ml的冷混合液溶解后,加三氯化铁试液0.05ml,摇匀,即得。
本液配制后7日即不适用。
17.亚铁氰化钾试液取亚铁氰化钾1g,加水10ml使溶解,即得。
本液应临用新制。
18.亚硝基铁氰化钠试液取亚硝基铁氰化钠1g,加水使溶解成20ml,即得。

常见试剂配制一、标准溶液配制1、硫酸(H 2SO 4)溶液配制:1000mL 浓度c (1/2H 2SO 4)=0.1mol/L ,即c (H 2SO 4)=0.05mol/L 硫酸溶液配制: 取3mL 左右浓硫酸缓缓注入1000mL 水中,冷却,摇匀。
新配制硫酸需要标定,其标定方法以下:称取于270-300 ℃高温炉中灼烧至恒重工作基准试剂无水碳酸钠0.2g ,溶于50mL 水中,加10滴溴甲酚绿-甲基红指示液,用配制好硫酸溶液滴定至溶液由绿色变为暗红色,煮沸2min ,冷却后继续滴定至溶液再呈暗红色。
同时做空白试验(取50mL 水,加10滴溴甲酚绿-甲基红指示液,一样用硫酸溶液滴定至溶液由绿色变为暗红色,煮沸2min ,冷却后继续滴定至溶液再呈暗红色)。
计算公式为:()M V V m SO H c 2142100021-⨯=⎪⎭⎫ ⎝⎛ 式中:m :无水碳酸钠质量,g ;V 1:滴定时所用硫酸体积,mL ;V 2:空白滴定时所用硫酸体积,mL ;M :无水硫酸钠相对分子质量,g/mol ,[M (1/2Na 2CO 3)=52.994)]。
测定氨氮时,氨氮含量计算:()V M V V 10001401⨯⨯⨯-=氨氮式中:氨氮:氨氮含量,mg/L ;V 1:滴定水样时所用硫酸体积,mL ;V 2:空白滴定时所用硫酸体积,mL ;M :硫酸溶液浓度,mol/L ;V :水样体积, mL 。
2、重铬酸钾(K 2Cr 2O 7)溶液配制1000mL 浓度c (1/6K 2Cr 2O 7)=0.2500mol/L ,即c (K 2Cr 2O 7)=0.0417 mol/L 重铬酸钾溶液配制:称取12.258g 于120 ℃下干燥2h 重铬酸钾溶于水中,并移入容量瓶中,定容至1000mL ,摇匀,备用。
3、硫酸亚铁铵标准溶液配制:1000mL 0.1 mol/L 硫酸亚铁铵标准溶液配制:称取39.5g 硫酸亚铁铵溶于水中,边搅拌边缓慢加入20mL 浓硫酸,冷却后移入1000 mL 容量瓶中,加水稀释至刻度线,摇匀。

水质分析常用化学试剂配制方法1. 重铬酸钾标准溶液【C(1/6K2Cr2O7)=0.2500mol/L】:称取预先在120℃烘干2h的重铬酸钾12.258g溶解于纯水中,并定容到1000mL。
2. 试亚铁灵指示溶液:称取1.485g邻菲啰啉,0.695g硫酸亚铁溶解于纯水中,并稀释到100mL,储存于棕色瓶中。
3. 硫酸亚铁铵标准溶液(约为0.05mol/L):称取19.75g硫酸亚铁铵溶解于纯水中,边搅拌边加入20mL浓硫酸,冷却后定容到1000mL。
(不用时应于冰箱中保存,防止标定后的浓度变化)。
或称取39.5g 硫酸亚铁铵溶解于纯水中,边搅拌边加入40mL浓硫酸,冷却后定容到2000mL。
4. 1%硫酸-硫酸银溶液:在500mL浓硫酸(比重1.84)中加入5g硫酸银。
5. 1mol/L的盐酸溶液:用11体积的纯水稀释1体积的浓盐酸(密度1.19g/mL)即可。
取83mL的浓盐酸稀释到1000mL。
详细方法:在500mL的烧杯中加入约400mL蒸馏水,徐徐加入83mL(50+20+10+3)浓盐酸,用玻璃棒搅拌均匀后,转入1000mL容量瓶中,用蒸馏水冲洗烧杯至少三次,冲洗水转入容量瓶中,定容至1000mL即可。
6. 1mol/L的氢氧化钠溶液:将40g氢氧化钠溶于500mL水中,冷至室温,稀释至1000ml,盛放在聚乙烯瓶中。
7. 10%(m/V)抗坏血酸溶液:按上述方法溶解10g抗坏血酸于蒸馏水中,并稀释至100mL。
该溶液贮存在棕色玻璃细口瓶内,在4℃冰箱内保存,可稳定几周。
如颜色变黄,则重新配制。
8. (1+1)硫酸:取500mL烧杯一只,用量筒量取150mL蒸馏水加入到烧杯中,然后用量筒量取150mL 浓硫酸,多余的可以用玻璃棒蘸出至水槽中。
用玻璃棒将150mL浓硫酸缓缓加入到150mL蒸馏水中,加完后,用玻璃棒缓慢搅拌使之混合均匀,冷却至室温待用。
9. 1+9盐酸:在9份体积的蒸馏水中,徐徐加入浓盐酸(d=1.198g/mL)1份。
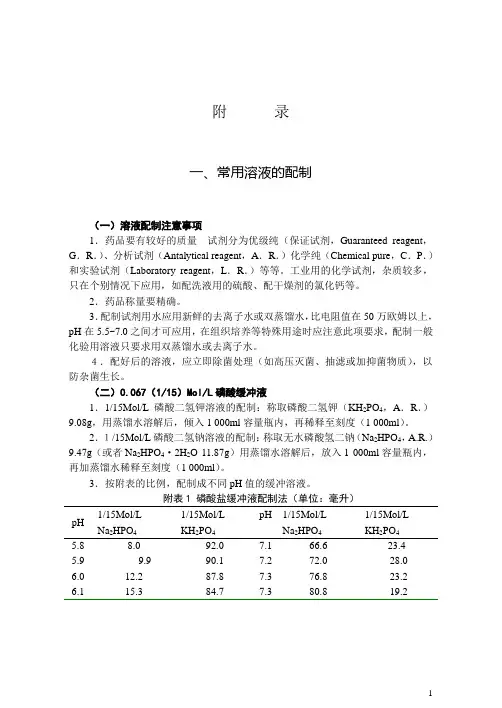
附录一、常用溶液的配制(一)溶液配制注意事项1.药品要有较好的质量试剂分为优级纯(保证试剂,Guaranteed reagent,G.R.)、分析试剂(Antalytical reagent,A.R.)化学纯(Chemical pure,C.P.)和实验试剂(Laboratory reagent,L.R.)等等。
工业用的化学试剂,杂质较多,只在个别情况下应用,如配洗液用的硫酸、配干燥剂的氯化钙等。
2.药品称量要精确。
3.配制试剂用水应用新鲜的去离子水或双蒸馏水,比电阻值在50万欧姆以上,pH在5.5~7.0之间才可应用,在组织培养等特殊用途时应注意此项要求,配制一般化验用溶液只要求用双蒸馏水或去离子水。
4.配好后的溶液,应立即除菌处理(如高压灭菌、抽滤或加抑菌物质),以防杂菌生长。
(二)0.067(1/15)Mol/L磷酸缓冲液1.1/15Mol/L磷酸二氢钾溶液的配制:称取磷酸二氢钾(KH2PO4,A.R.)9.08g,用蒸馏水溶解后,倾入1 000ml容量瓶内,再稀释至刻度(1 000ml)。
2.1/15Mol/L磷酸二氢钠溶液的配制:称取无水磷酸氢二钠(Na2HPO4,A.R.)9.47g(或者Na2HPO4·2H2O 11.87g)用蒸馏水溶解后,放入1 000ml容量瓶内,再加蒸馏水稀释至刻度(1 000ml)。
3.按附表的比例,配制成不同pH值的缓冲溶液。
附表1 磷酸盐缓冲液配制法(单位:毫升)pH 1/15Mol/LNa2HPO41/15Mol/LKH2PO4pH 1/15Mol/LNa2HPO41/15Mol/LKH2PO45.8 8.0 92.0 7.1 66.6 23.45.9 9.9 90.1 7.2 72.0 28.06.0 12.2 87.8 7.3 76.8 23.2 6.1 15.3 84.7 7.3 80.8 19.26.2 18.6 81.47.5 84.1 15.9 6.3 22.4 77.6 7.6 87.0 13.0 6.4 26.7 73.3 7.7 89.4 10.6 6.5 31.8 68.2 7.8 91.5 8.5 6.6 37.5 62.5 7.9 93.2 6.8 6.7 43.5 56.5 8.8 94.7 5.3 6.8 49.6 50.4 8.1 95.8 4.26.9 55.4 44.6 8.2 97.0 3.07.0 61.1 38.9 8.4 98.0 2.0(三)0.15Mol/L PB液附表2 0.15Mol/LPB液配制法pH 0.15Mol/L Na2HPO4(ml)0.15Mol/L NaH2PO4(ml)6.4 26.5 73.56.6 37.5 62.56.8 49.0 51.07.0 61.0 39.07.2 72.0 28.07.4 81.0 19.07.6 87.0 13.0Na2HPO4·2H2O分子量=175.05 0.15Mol/L溶液含26.7g/L。

试剂配制方法一、实验室常用储备液(1)0.5mol/L EDTA(乙二胺四乙酸)在700ml 超纯水中溶解186.1g Na2EDT A·2H2O,在磁力搅拌器上剧烈搅拌。
用10mol/L NaOH调至PH8.0(约用10mol/L NaOH 50ml),补加超纯水至1L。
分装后高压蒸汽灭菌。
室温贮存。
注意:EDTA二钠盐需加入NaOH将溶液的PH值调至接近8.0,才会溶解。
(2)1mol/L Tri s·Cl将121.1g Tris碱溶于800ml超纯水中,用浓盐酸将PH值调至设定值。
PH值HCl7.4 70ml7.6 60ml8.0 42ml应使溶液冷却至室温后,方可最后调定PH值。
加超纯水定容至1L,分装后高压蒸汽灭菌。
如果配制的溶液呈现黄色,应予丢弃。
并使用质量更好的Tris。
Tris溶液的PH值因温度而异,温度每升高1℃,PH值大约降低0.03个单位。
(3)10mol/L 乙酸铵(NH4C2H3O2)将771g乙酸铵溶于800ml蒸馏水中,磁力搅拌至完全溶解,用蒸馏水定容至1L,过滤除菌,室温贮存。
乙酸铵在热水中分解,含有乙酸铵的溶液不能高压蒸汽灭菌。
(4)甘油(10%,V/V)用9体积的灭菌纯水稀释1体积的分子生物学级的甘油。
用0.22μm过滤器过滤除菌。
分装成1ml每份,-20℃贮存。
(5) 10mg/ml溴化乙啶(EtBr)在20ml双蒸水中溶解0.2g溴化乙啶,磁力搅拌数小时,以确保其完全溶解。
然后用铝箔包裹容器或将溶液转移至棕色瓶中,于4℃避光保存。
注意:溴化乙啶是一种诱变剂,必须小心操作。
(6) 70%乙醇(C2H5OH)100ml70ml无水乙醇溶于30ml蒸馏水。
(7) 50×葡萄糖Glucose(150ml储备液)将54g D-葡萄糖溶于超纯水,磁力搅拌至完全溶解,并将体积调至150ml,过滤除菌,室温贮存。
(8) 10mol/L氢氧化钠(NaOH)将400g NaOH颗粒,加入到一个约含有0.9L蒸馏水的烧杯中,磁力搅拌至完全溶解。


常用试剂配制的具体操作1.HCL(1+1):在1000ml棕色瓶或白色瓶中,先倒入用500ml量杯量取的500ml纯净水,然后再缓慢加入盐酸,摇匀,密封备用。
(打开盐酸时,需要用纸,盖在瓶盖上再打开。
因为里面可能存在压力,若是直接打开,可能会因为压力过大,造成液体冲出,伤害到眼睛)也可以放置少量在白色滴瓶中待用。
2.抗坏血酸(5%):用一次性塑料杯,称取抗坏血酸1g,硫脲0.1g,加入20ml纯净水,在超声器中用玻璃棒搅匀,再倒入30ml小棕色瓶中保存。
(在实验前需要看颜色变化,如果颜色变深,则代表试剂过期)。
3.盐酸—硼酸混合酸:用一次性塑料杯称取硼酸25g,500ml量杯分2次量取900ml纯净水,清洗塑料杯,并倒入1000ml烧杯中,再加入HCL(1+1)70ml,放置在超声器中,用玻璃棒搅匀溶解,再倒入1000ml的棕色瓶中保存(也可以用500ml白色塑料瓶,插10ml刻度移液管)4.钼酸钠(6%):用一次性塑料杯称取钼酸钠30g,500ml量杯量取500ml纯净水,边清洗塑料杯边倒入500ml烧杯中,然后放置在超声器中,用玻璃棒搅匀,再倒入至500ml白色塑料瓶中,密封保存。
(插5ml刻度移液管)5.H₂O₂(1+20):全名为过氧化氢或者双氧水。
用1ml刻度移液管,吸取1ml过氧化氢至一次性塑料杯中,20ml量杯量取20ml纯净水,倒入塑料杯中,摇匀,再倒入至30ml的小棕色瓶中。
(容易失效,所以做溶液和检测时都需要速度快)6.三乙醇胺(TEA)(1+1):在1000ml棕色瓶中,先倒入用500ml量杯量取的500ml纯净水,然后再缓慢倒入500ml三乙醇胺,摇匀备用。
(也可以用白色塑料瓶,加黑色外袋保存,插5ml刻度移液管)7.H2SO4(1+1):带橡胶手套及口罩。
用500ml量杯先量取300ml纯净水,在1000ml烧杯内,先倒入300ml纯净水。
用脸盆装半脸盆自来水,将烧杯先放入脸盆中,再用500ml量杯量取300ml浓硫酸,缓缓倒入浓硫酸,并用玻璃棒不停搅拌。

热电厂化学专业常用药品简略配制方法5M 硫酸溶液的配制:于 720ml 高纯水中渐渐加入280ml 浓硫酸(优级纯)。
注意事项:1.切勿将水加入到浓硫酸中。
2.加入浓硫酸时应用玻璃棒不停搅拌,且将烧杯置于冷水盆中,防备硫酸溶液沸腾。
酸性钼酸铵的配制于 600ml 高纯水中迟缓加入 167ml 浓硫酸(剖析纯),冷却至室温,称取 20g 钼酸铵溶于硫酸溶液中,用高纯水稀释至 1L。
注意事项:因为钼酸铵在热水中易分解,务必待硫酸溶液冷却至室温才可加入钼酸铵。
5% 钼酸铵溶液的配制:正确称取 25g 钼酸铵溶于500ml 高纯水中。
1% 氯化亚锡甘油溶液的配制:称取 1.19g 氯化亚锡于烧杯中,加入 20ml 盐酸溶液( 1+1),加热后,再加入 80ml 丙三醇,搅匀后将溶液保留在塑料瓶中备用。
氨 -氯化铵缓冲溶液(用于测硬度)的配制:称取 27g 氯化铵,溶于 100ml 高纯水中,加入 175ml 浓氨水,在用高纯水稀释至 500ml 。
注意事项:1.因为氯化铵中有少量硬度,需加入必定剂量的EDTA 溶液除去氨-氯化铵缓冲溶液中的硬度。
取10ml 制备好的氨-氯化铵缓冲溶液与 100ml 除盐水于锥形瓶中,加入两滴酸性铬蓝 K,用 0.1mol 的 EDTA滴定至溶液呈蓝紫色,将耗费的 0.1molEDTA 溶液体积乘以 49 倍的0.1molEDTA 溶液加入到节余的 490ml 氨-氯化铵缓冲溶液中。
2.倾倒氨水时请在通风橱内进行。
酸性铬蓝 K 指示剂(测低硬度用)的配制:称取 4g 硼砂,加1g 氢氧化钠溶解于适当高纯水中稀释至 100ml ,既得硼砂缓冲溶液。
称取 0.5g 酸性铬蓝 K 与 4.5g 盐酸羟胺,加入 10ml 硼砂缓冲溶液,溶解于 40ml 高纯水中,用乙醇稀释至 100ml ,储存于棕色瓶中,使用期应不超出一个月。
酚酞指示剂的配制称取 1g 酚酞,加入100ml95% 乙醇溶解,再以氢氧化钠中和至稳固的微红色。

常用标准溶液的配制1、常用标准滴定溶液的制备氢氧化钠标准溶液的配制(1)配制浓度为c(NaOH)=1mol/L、c(NaOH)=0.5mol/L、c(NaOH)=0.1mol/L的氢氧化钠标准滴定溶液:称取100g氢氧化钠,溶于100mL水中,摇匀,注入聚乙烯容器中,密闭放置至溶液清亮,用塑料管虹吸下述规定体积的上层清液,注入1000mL无二氧化碳的水中,摇匀。
c(NaOH)(mol/L)氢氧化钠饱和溶液(mL)1 520.5 260.1 5(2)标定:称取下述规定量的于105~110℃烘至恒重的基准邻苯二甲酸氢钾,称准至0.0001g,溶于下述规定体积的无二氧化碳的水中,加2滴酚酞指示剂,用配制好的氢氧化钠溶液滴定至溶液呈粉红色,同时做空白实验。
c(NaOH) 邻苯二甲酸氢钾无二氧化碳的水1 6 800.5 3 800.1 0.6 50(3)计算:氢氧化钠标准溶液的浓度按下式计算:c(NaOH)=m/(V1-V0)×0.2042式中:c(NaOH)--氢氧化钠标准溶液之物质的量浓度m--邻苯二甲酸氢钾的质量V1--氢氧化钠溶液的用量V0--空白试验氢氧化钠溶液的用量0.2042--与1.00mL氢氧化钠标准溶液相当的以克表示的邻苯二甲酸氢钾的质量。
(4)比较法:量取30.00~35.00mL下述规定浓度的盐酸标准溶液,加50mL无二氧化碳的水及2滴酚酞指示剂,用配制好的氢氧化钠溶液滴定,近终点时加热至80℃,继续滴定至溶液呈粉红色。
c(NaOH) c(HCL)1 10.5 0.50.1 0.1氢氧化钠标准溶液的浓度按下式计算:c(NaOH)=V1c1/V式中:V1--盐酸标准溶液的用量c1--盐酸浓度V--氢氧化钠溶液的用量。
HCL标准溶液的配制(1)配制浓度为c(HCL)=1、0.5、0.1mol/L的盐酸标准滴定溶液:量取下述规定体积的盐酸,注入1000mL水中,摇匀。
c(HCL)/(mol/L)盐酸/mL1 900.5 450.1 9(2)标定:称取下述规定量的于270~300℃灼烧至恒重的基准无水碳酸钠,称准至0.0001g,溶于50mL水中,加10滴溴甲酚绿-甲基红混合指示剂,用配制好的盐酸溶液滴定至溶液由绿色变为暗红色,煮沸2min,冷却后继续滴定至溶液再呈暗红色,同时做空白试验。

化学试剂配制⽅法电⼚化学试剂配制1、硬度:⼀种测定硬度⼤于0.5me/L的⽔样;⼆种测定硬度在1-0.5ue/L的⽔样。
⑴、氨-氯化铵缓冲溶液:称取20g氯化铵溶于500⾼纯⽔中,加150ml浓氨⽔,⽤⾼纯⽔稀释⾄1000ml混匀;取50ml按第⼆⽅法测定其硬度,根据测定结果往其余950ml缓冲溶液加所需EDTA溶液抵消其硬度。
⑵、(⾼硬度)氨-氯化铵缓冲溶液:称取67.5克氯化铵,加570ml浓氨⽔,加1gEDTA⽤⾼纯⽔稀释⾄1000ml混匀;⑶、硼砂缓冲溶液:称取40g硼砂溶于80ml⾼纯⽔中,加⼊10g氢氧化钠,溶解后⽤⾼纯⽔稀释⾄1000ml,按上述⽅法抵消硬度。
⑷、0.5﹪铬⿊T指⽰剂(⼄醇溶液):称取0.5g铬⿊T 与4.5g盐酸羟胺在研钵中磨匀,混合后溶于100ml95﹪⼄醇中,转⼊棕⾊瓶中。
使⽤期限不超过1个⽉。
⑸、酸性铬蓝K指⽰剂(⼄醇溶液):称取0.5g酸性铬蓝K与4.5盐酸羟胺混合,加10ml氨-氯化铵缓冲溶液(硼砂也可)和40ml⾼纯⽔,溶解后⽤95﹪⼄醇稀释⾄100ml. 使⽤期限不超过1个⽉。
2、磷酸盐:⑴、磷酸盐储备液(1ml=1mgPO4),称取在105℃⼲燥过的优级纯磷酸⼆氢钾1.433g溶于少量除盐⽔中,并稀释⾄1000ml。
⑵、磷酸⼯作溶液:(1ml=0.1mgPO4),取上述储备液10ml稀释⾄100ml⑶、钼酸铵-偏钒酸铵-硫酸显⾊液(酸性钼酸铵):(A)称取50g钼酸铵和2.5g偏钒酸铵,溶于400ml除盐⽔中;(B)取195ml浓硫酸,在不断搅拌下徐徐加⼊到250ml除盐⽔中,并冷却⾄室温。
将(B)配置的溶液倒⼊(A)配置的溶液中,⽤除盐⽔稀释⾄1000ml。
3、⼆氧化硅:⑴、酸性钼酸铵溶液:A.称取50g钼酸铵溶于500ml⾼纯⽔中;B.取42ml浓硫酸,在不断搅拌下加⼊到300ml⾼纯⽔中,并冷却⾄室温。
C.将A加⼊到B中,然后⽤⾼纯⽔稀释⾄1000ml。

配制化学试剂的注意事项化学试剂在科学研究、医学诊断和各种实验室综合实践过程中起着至关重要的作用。
不同的化学试剂会在不同的环境下表现出不同的性质,因此如何正确地配制化学试剂是实验室工作者必须掌握的技能之一。
本文将就配制化学试剂的注意事项进行详细阐述。
一、寻找可靠的化学试剂首先,寻找可靠的化学试剂是配制化学试剂的先决条件之一。
选择优质、高纯度的化学试剂最为关键,否则可能会影响到实验结果的准确性和可重复性。
同时,如果在配制过程中使用了低质量的或者已经过期、失效的化学试剂不但无法得到所期望的效果,而且还可能导致不良后果,甚至危及人身安全。
如果无法确定化学试剂的质量或失效时间,建议不要使用该化学试剂。
二、选择合适的溶剂化学试剂的配制需要选择合适的溶剂。
不同的化学试剂对不同的溶剂有不同的选择要求,在选择溶剂时要根据试剂的性质和用途进行选择。
在选择溶剂时应该尽可能地选择对环境和身体无害的溶剂,比如水、甘油等。
同时还应注意不要使用可燃或易燃的溶剂,以避免发生意外事故。
在使用溶剂时,要按照要求精确称重,以确保正确的配比。
三、注意安全操作在配制化学试剂的过程中,一定要注意安全操作,以免发生化学品事故。
首先,在配制之前应该熟悉所使用化学品的性质、特性、挥发度和毒性等安全信息,了解各项安全操作规程;其次,在配制的过程中应该配戴防护用品,如实验室外套、手套、防护眼镜、防毒面具等;最后,在配制完成后应该将化学试剂以正确的方式保存,以避免造成安全隐患。
四、准确计算配比压缩气体多为剧毒易爆的气体,配制时应注意把压缩气体和化学药品分开储存,压缩气体储存的区域要有通风设备,而进行压缩气体的纯度检测时应使用专业检测仪器。
在配制化学试剂的过程中,需要准确计算配比。
配比不准确会导致实验效果不佳,或者对人体和环境造成危险。
因此,要根据配方精确计算每种化学试剂的质量或体积,严格按照规定用量和顺序进行搭配和混合的操作,并进行充分搅拌,以确保每种物质都能充分溶解和混合,从而得到所需的化学试剂。
高锰酸钾配制方法
高锰酸钾是一种常用的氧化剂和消毒剂,常用于医疗、农业、环境保护等领域。
高锰酸钾配制方法如下:
1. 准备药品
高锰酸钾是一种化学药品,需要准备足够的高锰酸钾溶液,一般建议准备浓度为0.1%至0.2%的高锰酸钾溶液。
同时,需要准备干净的容器和手套等个人防护装备。
2. 称量药品
将高锰酸钾放在称量台上,用称其重量的方法称量出高锰酸钾的重量。
通常情况下,高锰酸钾的重量为5克至10克。
3. 溶解药品
将高锰酸钾放在干净的容器中,加入适量的水,使其溶解。
一般情况下,水的用量为高锰酸钾的10至20倍,即5克高锰酸钾需要500至600毫升水。
4. 配置浓度
将溶液倒入干净的容器中,按照0.1%至0.2%的浓度进行配置。
配置时需要注意浓度过高或过低都不利于使用,因此需要根据具体情况进行调整。
5. 配制后处理
在高锰酸钾溶液配制完成后,需要进行处理。
将溶液倒入一个干净的容器中,避免污染。
然后将溶液倒入下水道或花园中进行排放。
高锰酸钾配制方法简单易行,适用于各种应用场景。
需要注意的是,在使用高锰酸钾时需要注意安全,遵守相关的操作规范,避免造成人身伤害或环境污染。
常⽤化学试剂配制常⽤化学试剂的配制1、2,4-⼆硝基苯肼溶液I.在15mL浓硫酸中,溶解3克2,4-⼆硝基苯肼。
另在70mL95%⼄醇⾥加20mL⽔,然后把硫酸苯肼倒⼊稀⼄醇溶液中,搅动混合均匀即成橙红⾊溶液(若有沉淀应过滤)。
Ⅱ.将1.2克2,4⼀⼆硝基苯肼溶于50mL30%⾼氯酸中,配好后储于棕⾊瓶中,不易变质。
I法配制的试剂,2,4-⼆硝基苯肼浓度较⼤,反应时沉淀多便于观察。
Ⅱ法配制的试剂由于⾼氯酸盐在⽔中溶解度很⼤,因此便于检验⽔中醛且较稳定,长期贮存不易变质。
2、卢卡斯(Lucas)试剂将34克⽆⽔氯化锌在蒸发⽫中强热熔融,稍冷后放在⼲燥器中冷⾄室温。
取出捣碎,溶于23mL浓盐酸中(⽐重1.187)。
配制时须加以搅动,并把容器放在冰⽔浴中冷却,以防氯化氢逸出。
此试剂—般是临⽤时配制。
3、托伦(Tollens)试剂I.取0.5mL10%硝酸银溶液于试管⾥,滴加氨⽔,开始出现⿊⾊沉淀,再继续滴加氨⽔,边滴边摇动试管,滴到沉淀刚好溶解为⽌,得澄清的硝酸银氨⽔溶液,即托伦试剂。
Ⅱ.取⼀⽀⼲净试管.加⼊1mL5%硝酸银,滴加5%氢氧化钠2滴,产⽣沉淀,然后滴加5%氨⽔,边摇边滴加,直到沉淀消失为⽌,此为托伦试剂。
⽆论I法或Ⅱ法,氨的量不宜多,否则合影响试剂的灵敏度。
I法配制的Tollens试剂较Ⅱ法的碱性弱,在进⾏糖类实验时,⽤I法配制的试剂较好。
4、谢⾥⽡诺夫(Seliwanoff)试剂将0.05g间苯⼆酚溶于50mL浓盐酸中,再⽤蒸馏⽔稀释⾄100mL。
5、希夫(Schiff)试剂在100mL热⽔中溶解0.2g品红盐酸盐,放置冷却后,加⼊2g亚硫酸氢钠和2mL浓盐酸,再⽤蒸馏⽔稀释⾄200mL。
或先配制l0mL⼆氧化硫的饱和⽔溶液,冷却后加⼊0.2g品红盐酸盐,溶解后放置数⼩时使溶液变成⽆⾊或淡黄⾊,⽤蒸馏⽔稀释⾄200mL。
此外,也可将0.5g品红盐酸盐溶于l00mL热⽔中,冷却后⽤⼆氧化硫⽓体饱和⾄粉红⾊消失,加⼊0.5g活性炭,振荡过滤,再⽤蒸馏⽔稀释⾄500mL。
化验室常用药品的配制和标定方法一、氢氧化钠标准溶液的配制和标定(依据国标GB/T5009.1-2003)C(NaOH)= 1mol/LC(NaOH)= 0.5mol/LC(NaOH)= 0.1mol/L(一)氢氧化钠标准溶液的配制:称取120gNaOH,溶于100mL无CO2的水中,摇匀,注入聚乙烯容器中,密闭放置至溶液清亮。
用塑料管吸取下列规定体积的上层清液,注入用无CO2的水稀释至1000mL,摇匀。
C(NaOH),mol/L NaOH饱和溶液,mL1 560.5 280.1 5.6(二)氢氧化钠标准溶液的标定:1.测定方法:称取下列规定量的、于105—110。
C电烘箱烘至恒重的工作基准试剂邻苯二甲酸氢钾,称准至0.0001 g,溶于下列规定体积的无CO2的水中,加2滴酚酞指示液(10 g/L),用配制好的NaOH溶液滴定至溶液呈粉红色并保持30S。
同时做空白试验。
C(NaOH),mol/L 基准邻苯二甲酸氢钾,g 无CO2水,mL1 6.0800.5 3.0800.1 0.6802.计算:氢氧化钠标准溶液浓度按下式计算:MC(NaOH)= ------------------------(V—V0)×0.2042式中:C(NaOH)——氢氧化钠标准溶液之物质的浓度,mol/L; V——消耗氢氧化钠的量,mL;V0——空白试验消耗氢氧化钠的量,mL;M——邻苯二甲酸氢钾的质量,g;0.2042——邻苯二甲酸氢钾的摩尔质量。
Kg/ mol。
二、盐酸标准溶液的配制和标定(依据国标GB/T5009.1-2003)C(HCl)= 1mol/LC(HCl)= 0.5mol/LC(HCl)= 0.1mol/L(一)盐酸标准溶液的配制:量取下列规定体积的盐酸,注入1000 mL水中,摇匀。
C(HCl) HCl,mL1900.5 450.19(二)盐酸标准溶液的标定:1.测定方法:称取下列规定量的、于270—300。
实验常用试剂、缓冲液的配制方法当溶液的浓度表示为物质的量浓度时,单位为摩尔每升(mol/L),量的符号为c[例如c (HNO3)=1mol/L];当溶液的浓度表示为质量浓度时,单位为克每升(g/L)、微克每毫升(μg/ml)等,量的符号为ρ[例如ρ(U)=10.0μg/ml ];如果溶液浓度以质量分数给出量的符号为ω[例如ω(NaCl)=10% ,表示100g 该溶液中含有10g 氯化钠,即10g氯化钠溶于90g 水中] ,单位无量纲;如果溶液浓度以体积分数给出,量的符号为ψ[例如ψ(HCl)=5% ,表示100mL 该溶液中含有浓盐酸5mL] ,单位无量纲。
1、1M Tris-HCl□组份浓度1 M Tris-HCl (pH7.4,7.6,8.0)□配制量1L□配置方法1. 称量121.1gTris置于1L烧杯中。
2. 加入约800mL的去离子水,充分搅拌溶解。
3. 按下表量加入浓盐酸调节所需要的pH值。
pH值浓HCl7.4 约70mL7.6 约60mL8.0 约42mL4. 将溶解定容至1L。
5. 高温高压灭菌后,室温保存。
注意:应使溶液冷却至室温后再调定pH值,因为Tris溶液的pH值随温度的变化差很大,温度每升高1℃,溶液的pH 值大约降低0.03个单位。
2、1.5 M Tris-HCl□组份浓度1.5 M Tris-HCl (pH8.8)□配制量1L□配置方法1.称取181.7gTris置于1L烧杯中。
2. 加入约800mL的去离子水,充分搅拌溶解。
3. 用浓盐酸调pH值至8.8。
4. 将溶液定容至1L。
5. 高温高压灭菌后,室温保存。
注意:应使溶液冷却至室温后再调定pH值,因为Tris溶液的pH值随温度的变化差异很大,温度每升高1℃,溶液的pH值大约降低0.03个单位。
3. 将溶液定至1L后,高温高压灭菌。
4. 室温保存。
4、3 M 醋酸钠□组份浓度3 M 醋酸钠(pH5.2)□配制量100mL□配置方法1. 称取40.8gNaOAc•3H2O置于100~200mL烧杯中,加入约40mL的去离子水搅拌溶解。