片剂质量监控点
- 格式:doc
- 大小:69.50 KB
- 文档页数:2

片剂质量控制要点1.质量标准的制定制定合理的质量标准是片剂质量控制的基础和前提。
质量标准应包括物理性质、化学性质、药效学性质、微生物学性质等指标。
在制定质量标准时,需要参考药典相关规定、国家法规、药品注册要求等,并结合生产工艺和产品特性进行适当调整和完善。
2.原材料的选择与检验选择合适的原材料对片剂的质量起到至关重要的作用。
原材料的选择应考虑其纯度、稳定性、可获得性以及与药物相互作用等因素。
在原材料进厂前应进行严格的进货验收,包括外观检查、质量合规证明文件检查以及物理、化学、微生物等方面的检验。
3.生产工艺的控制生产工艺的控制是片剂质量控制的核心环节。
应在生产过程中采取一系列严格的操作规程和记录,包括原料粉碎、混合、压片、包衣等环节的控制。
同时,应对关键步骤进行质量控制点的设置,确保每个关键环节的操作符合质量标准,并进行相应的监测和控制。
4.成品检验与评价成品的检验与评价是片剂质量控制不可或缺的一个环节。
检验包括外观检查、含量、析出物、释放度等指标的测定,以确保成品符合质量标准。
评价则是通过对成品效果的观察和测定来判断产品的质量和稳定性,包括药效学评价、稳定性研究以及缺陷和不良反应的监测等。
5.装运、包装与储存控制片剂在装运、包装和储存过程中容易受到湿气、温度、光照等外界条件的影响,影响其质量和稳定性。
所以在装运过程中要注意避免受潮、碰撞等,包装要符合规定的要求,并要设置合适的储存环境,包括温度、湿度、光照等的控制,以保证片剂的质量和稳定性。
总之,片剂质量控制的要点主要包括质量标准的制定、原材料的选择与检验、生产工艺的控制和成品的检验与评价,以及装运、包装与储存的控制等。
通过科学合理的质量控制措施,可以保证片剂药品的质量稳定和一致性,为患者提供安全有效的药品。

片剂的质量控制与评价一、引言片剂是一种常见的固体制剂形式,广泛应用于医药领域。
为了确保片剂的质量和疗效,需要进行严格的质量控制和评价。
本文将详细介绍片剂的质量控制与评价的相关内容。
二、质量控制1. 原料药的选择和质量要求在片剂的制备过程中,原料药的选择至关重要。
需要选择符合药典标准的原料药,并确保其质量符合要求。
原料药的质量要求包括外观、纯度、含量、溶解度等指标。
2. 制剂工艺的优化片剂的制备过程中,制剂工艺的优化对质量的控制至关重要。
需要根据药物的性质和制剂的特点,合理选择制剂工艺参数,如颗粒大小、压片力度、压片速度等。
同时,需要确保制剂工艺的稳定性和可重复性。
3. 质量控制方法的建立针对片剂的质量控制,需要建立适合的质量控制方法。
常用的方法包括外观检查、含量测定、溶解度测试、释放度测试等。
这些方法需要符合药典标准,并具有准确性、可重复性和可靠性。
4. 质量控制记录的管理在片剂的生产过程中,需要做好质量控制记录的管理。
包括原料药的批号记录、制剂工艺参数的记录、质量控制方法的执行记录等。
这些记录有助于追溯质量问题的原因,并进行及时的纠正和改进。
三、质量评价1. 外观评价片剂的外观评价是判断片剂质量的重要指标之一。
需要评估片剂的外观特征,如颜色、形状、表面光滑度等。
外观评价可以通过目测或者使用仪器进行。
2. 含量评价片剂的含量评价是判断片剂质量的关键指标之一。
需要通过含量测定方法,确定片剂中活性成份的含量是否符合要求。
常用的含量评价方法包括高效液相色谱法、紫外分光光度法等。
3. 溶解度评价片剂的溶解度评价是判断片剂质量的重要指标之一。
需要通过溶解度测试,确定片剂在一定时间内的溶解度是否符合要求。
常用的溶解度评价方法包括体外溶出度测试、离子强度法等。
4. 释放度评价片剂的释放度评价是判断片剂质量的重要指标之一。
需要通过释放度测试,确定片剂中活性成份的释放度是否符合要求。
常用的释放度评价方法包括体外溶出度测试、离子强度法等。

片剂的质量控制与评价一、引言片剂是一种常见的药物制剂形式,广泛应用于临床治疗中。
为了确保片剂的质量和疗效,需要进行严格的质量控制和评价。
本文将介绍片剂的质量控制和评价的标准格式文本。
二、质量控制1. 原料药的质量控制(1)原料药的纯度检测:使用适当的分析方法,如高效液相色谱法(HPLC)或气相色谱法(GC),对原料药的纯度进行检测。
(2)原料药的含量测定:采用合适的定量方法,如紫外分光光度法(UV)或荧光分光光度法(FL)等,对原料药的含量进行测定。
(3)原料药的微生物检测:使用适当的微生物检测方法,如菌落计数法或培养法,对原料药进行微生物检测。
2. 辅料的质量控制(1)辅料的纯度检测:对辅料进行纯度检测,确保其符合药典规定的标准。
(2)辅料的重金属检测:使用适当的重金属检测方法,如原子吸收光谱法(AAS)或电感耦合等离子体质谱法(ICP-MS),对辅料进行重金属检测。
(3)辅料的溶解度测定:采用适当的方法,如离子色谱法(IC)或滴定法,对辅料的溶解度进行测定。
3. 生产工艺的质量控制(1)片剂的制备工艺:确保片剂的制备工艺符合药典规定的标准,如药物的配方、混合时间、压片力度等。
(2)片剂的质量控制点:在制备过程中设定质量控制点,如原料药的添加量、混合时间等,以确保片剂的质量稳定性和一致性。
(3)片剂的质量测试:对制备好的片剂进行质量测试,如外观检查、均匀度测试、硬度测定、溶解度测定等。
三、质量评价1. 片剂的外观评价(1)颜色和形状:对片剂的颜色和形状进行评价,确保符合药典规定的标准。
(2)表面光滑度:使用适当的仪器,如表面光滑度仪,对片剂的表面光滑度进行评价。
(3)杂质和破碎:对片剂中的杂质和破碎情况进行评价,确保符合药典规定的标准。
2. 片剂的物理性质评价(1)均匀度:使用适当的方法,如药物释放度仪,对片剂的均匀度进行评价。
(2)硬度:采用合适的硬度测试仪器,对片剂的硬度进行评价。
(3)溶解度:使用适当的方法,如离子色谱法或滴定法,对片剂的溶解度进行评价。

固体制剂车间QA现场监控要点一、公用部分:1.劳保穿戴是否规范2.洗手消毒、随手关门是否到位3.清场工作是否符合要求4.记录填写是否及时、规范5.产尘大的岗位是否定期清洗除尘袋,并填写相关记录6.各岗位若有地漏、回风口是否按规定定期清洗,并填写相关记录7.生产设备是否有明显的状态标志8.生产设备是否按要求保养、润滑设备并有使用、维修保养记录9.生产过程中所产生的各种废弃物是否及时清理10.生产过程中是否存在污染物料、混批的情况11.生产过程中各岗位所领物料是否符合要求(批号、规格、品种)12.设备运行情况是否正常,若有异常是否及时通知机修人员或车间管理人员13.各岗位人员生产过程中若出现异常情况,是否及时通知车间管理人员14.各岗位人员是否擅自离岗、睡岗、串岗15.各岗位人员是否已掌握本岗位SOP所规定的内容二、细则:1.备料:⑴每日所领各物料的品名、规格、批号或编号、数量是否与配料指令单相一致若有不同,是否及时处理⑵每日所发各物料是否双人复核、并按先进先出的原则⑶每日所发各物料台帐记录是否与所发物料相一致⑷原、辅料是否按品种、规格、批号分开存放2.粉碎:⑴所粉碎各物料是否与配制指令单相一致⑵粉好物料与未粉好物料是否分开放置,是否标有物料标识⑶到备料间领取待处理各物料时是否复核过物料品名、数量、批号⑷送至配料岗位各物料是否有填写完整的物料标识是否经配料岗位人员复核无误⑸可利用物料经处理后是否及时填写相关记录3.配料:⑴每日所配各物料品名、规格、数量、批次是否与配制指令单相一致⑵送至制粒岗位各物料是否有物料标识,填写是否完整⑶称量是否有复核4.制粒:⑴生产前,查看本批所用的原辅料是否合格,上工序传递的原料标示卡上是否有QA签发的合格标志设备是否运转正常⑵生产过程中,若发现所制湿颗粒粗细不均匀(或太粗),是否及时采取措施来改善5.干燥:⑴在设备正常情况下,所得干燥颗粒水分是否满足工艺要求⑵在整粒过程中若发现所整湿颗粒粗细不均匀(或太粗)是否及时告知制粒岗位,配合其采取相应措施6.总混:⑴总混后颗粒中辅料与主药是否有明显的差异⑵总混后颗粒是否发生结块现象是否为人为造成⑶与中间站岗位人员交接物料时是否与发(收)料人复核过物料品名、规格、数量⑷到备料间领取物料时,是否与备料岗位人员复核物料的品名、批号、数量⑸生产结束后,是否及时清场所生产的物料是否及时封存并放于中间站待检7、压片:⑴生产前,查看设备是否运转正常,对于关键部位要仔细检查(比如上下冲、中模、刮料器是否安装妥当,上下冲的磨损程度,以生产1000kg素片更换一次冲头为度),混料时,是否按照颗粒的粒度来调整加入酒精的比例⑵设备正常运转时,是否按要求定期称取片重及测试素片硬度等参数⑶生产结束后,是否及时清场所生产的物料是否及时封存并放于中间站待检8包衣:⑴生产前,查看本批所用的原辅料是否合格,上工序传递的原料标示卡上是否有QA签发的合格标志⑵生产过程中:上隔离层时,如发现素片有质量问题(出现松片、散片,素片边沿过高等情况)是否及时通知QA⑶生产结束后,是否及时清场,是否将本次生产的中间产品放于糖衣片干燥室干燥处理9胶囊填充:⑴生产前,检查上工序交接的物料标示卡上是否有QA签发的合格标志所领的包装材料是否合格⑵查看设备是否运转正常,料盘、填充模具等是否安装妥当⑶生产现场温湿度是否符合要求如不符合要求,是否及时通知QA及维修人员处理⑷生产过程中是否不定期的抽检胶囊装量和胶囊的脆碎度是否及时清理操作台面掉落的颗粒是否不定期的查看现场的温湿度情况⑸生产结束后,是否及时清场所生产的物料是否及时封存并放于中间站待检10泡罩:⑴生产前,检查上工序交接的物料标示卡上是否有QA签发的合格标志所领的包装材料是否合格⑵在泡罩胶囊前,检查生产现场温湿度是否符合要求机器设备是否运转正常⑶试机时,检查本批生产品种的生产批号、生产日期及有效期是否符合生产指令单的要求⑷生产过程中,是否按照岗位SOP进行生产检查⑸生产结束后,是否及时清场11颗粒、散剂分装:⑴生产前,检查上工序交接的物料标示卡上是否有QA签发的合格标志所领的包装材料是否合格⑵查看设备是否运转正常,料盘、填充模具等是否安装妥当⑶试机时,检查本批生产品种的生产批号、生产日期及有效期是否符合生产指令单的要求⑷生产过程中,是否及时检查装量差异⑸生产结束后,是否及时清场12片瓶分装:⑴生产前,检查上工序交接的物料标示卡上是否有QA签发的合格标志所领的包装材料是否合格⑵查看设备是否运转正常热封效果是否达到标准要求⑶生产过程中,是否按照岗位SOP进行生产检查⑷生产结束后,是否及时清场物料是否及时通知QA检查13外包:⑴生产前,检查上工序交接的物料标示卡上是否有QA签发的合格标志所领的包装材料是否合格⑵包装材料上的三期(批号,生产日期、有效期)是否与生产指令单相符生产结束后,是否彻底清场,说明书等包装材料应及时退库;。

片剂的质量控制与评价1.外观性状片剂外观应完整光洁,色泽均匀。
2.重量差异(weight variation)一般来说,片剂的平均重量<0.30g,片剂的差异限度为+7.5%;=0.30g,差异限度为+5.0%。
糖衣片应在包衣前检查片芯的重量差异,符合规定后方可包衣;包衣后不再检查片重差异。
薄膜衣片应在包薄膜后检查重量差异。
另外,凡检查含量均匀度的片剂,一般不再进行重量差异检查。
3.硬度与脆碎度(hardness and friability)要求有适宜的硬度和耐磨性,以免包装、运输过程中发生磨损或破碎。
除另有规定外,非包衣片应符合片剂脆碎度检查法(通则0923),一般来讲脆碎度应小于1%。
普通片剂的硬度在50N 以上,抗张强度在1.5~3.0MPa 为好。
4.崩解时限(disintegration)凡药典规定检查溶出度、释放度或分散均匀性的片剂,口含片、咀嚼片等,不再进行前解时限检查。
一般限度要求如下:普通片剂15分钟,薄膜衣片30分钟,中药薄膜衣片1小时,糖衣片1小时。
5.溶出度或释放度药典规定,根据原料药物和制剂的特性,除来源于动植物多组分且难以建立测定方法的片剂除外,溶出度(dissolution)、释放度均应符合要求。
对于难溶性药物而言,虽然片剂的崩解时限合格却不一定能够保证药物的溶出合格,因此,溶出度检查更能体现片剂的内在质量。
测定溶出度的品种无须再检查崩解时限。
6.含量均匀度(content uniformity)含量均匀度系指小剂量制剂符合标示量的程度,按照《中国药典》2015年版通则0941含量均匀度检查法检查。
每片的标示量<25mg或每片主药含量<25%时,军应检查含量均匀度。

固体制剂车间QA现场监控要点一、公用部分:1.劳保穿戴是否规范?2。
洗手消毒、随手关门是否到位?3。
清场工作是否符合要求?4。
记录填写是否及时、规范?5.产尘大的岗位是否定期清洗除尘袋,并填写相关记录?6。
各岗位若有地漏、回风口是否按规定定期清洗,并填写相关记录? 7。
生产设备是否有明显的状态标志?8.生产设备是否按要求保养、润滑设备并有使用、维修保养记录?9.生产过程中所产生的各种废弃物是否及时清理?10.生产过程中是否存在污染物料、混批的情况?11.生产过程中各岗位所领物料是否符合要求(批号、规格、品种)?12。
设备运行情况是否正常,若有异常是否及时通知机修人员或车间管理人员?13.各岗位人员生产过程中若出现异常情况,是否及时通知车间管理人员?14.各岗位人员是否擅自离岗、睡岗、串岗?15。
各岗位人员是否已掌握本岗位SOP所规定的内容?二、细则:1.备料:⑴每日所领各物料的品名、规格、批号或编号、数量是否与配料指令单相一致?若有不同,是否及时处理?⑵每日所发各物料是否双人复核、并按先进先出的原则?⑶每日所发各物料台帐记录是否与所发物料相一致?⑷原、辅料是否按品种、规格、批号分开存放?2。
粉碎:⑴所粉碎各物料是否与配制指令单相一致?⑵粉好物料与未粉好物料是否分开放置,是否标有物料标识?⑶到备料间领取待处理各物料时是否复核过物料品名、数量、批号?⑷送至配料岗位各物料是否有填写完整的物料标识?是否经配料岗位人员复核无误?⑸可利用物料经处理后是否及时填写相关记录?3。
配料:⑴每日所配各物料品名、规格、数量、批次是否与配制指令单相一致?⑵送至制粒岗位各物料是否有物料标识,填写是否完整?⑶称量是否有复核?4.制粒:⑴生产前,查看本批所用的原辅料是否合格,上工序传递的原料标示卡上是否有QA签发的合格标志?设备是否运转正常?⑵生产过程中,若发现所制湿颗粒粗细不均匀(或太粗),是否及时采取措施来改善?5。
干燥:⑴在设备正常情况下,所得干燥颗粒水分是否满足工艺要求?⑵在整粒过程中若发现所整湿颗粒粗细不均匀(或太粗)是否及时告知制粒岗位,配合其采取相应措施?6.总混:⑴总混后颗粒中辅料与主药是否有明显的差异?⑵总混后颗粒是否发生结块现象?是否为人为造成?⑶与中间站岗位人员交接物料时是否与发(收)料人复核过物料品名、规格、数量?⑷到备料间领取物料时,是否与备料岗位人员复核物料的品名、批号、数量?⑸生产结束后,是否及时清场?所生产的物料是否及时封存并放于中间站待检?7、压片:⑴生产前,查看设备是否运转正常,对于关键部位要仔细检查(比如上下冲、中模、刮料器是否安装妥当,上下冲的磨损程度,以生产1000kg素片更换一次冲头为度),混料时,是否按照颗粒的粒度来调整加入酒精的比例?⑵设备正常运转时,是否按要求定期称取片重及测试素片硬度等参数?⑶生产结束后,是否及时清场?所生产的物料是否及时封存并放于中间站待检?8包衣:⑴生产前,查看本批所用的原辅料是否合格,上工序传递的原料标示卡上是否有QA签发的合格标志?⑵生产过程中:上隔离层时,如发现素片有质量问题(出现松片、散片,素片边沿过高等情况)是否及时通知QA?⑶生产结束后,是否及时清场,是否将本次生产的中间产品放于糖衣片干燥室干燥处理?9胶囊填充:⑴生产前,检查上工序交接的物料标示卡上是否有QA签发的合格标志?所领的包装材料是否合格?⑵查看设备是否运转正常,料盘、填充模具等是否安装妥当?⑶生产现场温湿度是否符合要求?如不符合要求,是否及时通知QA 及维修人员处理?⑷生产过程中是否不定期的抽检胶囊装量和胶囊的脆碎度?是否及时清理操作台面掉落的颗粒?是否不定期的查看现场的温湿度情况?⑸生产结束后,是否及时清场?所生产的物料是否及时封存并放于中间站待检?10泡罩:⑴生产前,检查上工序交接的物料标示卡上是否有QA签发的合格标志?所领的包装材料是否合格?⑵在泡罩胶囊前,检查生产现场温湿度是否符合要求?机器设备是否运转正常?⑶试机时,检查本批生产品种的生产批号、生产日期及有效期是否符合生产指令单的要求?⑷生产过程中,是否按照岗位SOP进行生产检查?⑸生产结束后,是否及时清场?11颗粒、散剂分装:⑴生产前,检查上工序交接的物料标示卡上是否有QA签发的合格标志?所领的包装材料是否合格?⑵查看设备是否运转正常,料盘、填充模具等是否安装妥当?⑶试机时,检查本批生产品种的生产批号、生产日期及有效期是否符合生产指令单的要求?⑷生产过程中,是否及时检查装量差异?⑸生产结束后,是否及时清场?12片瓶分装:⑴生产前,检查上工序交接的物料标示卡上是否有QA签发的合格标志?所领的包装材料是否合格?⑵查看设备是否运转正常?热封效果是否达到标准要求?⑶生产过程中,是否按照岗位SOP进行生产检查?⑷生产结束后,是否及时清场?物料是否及时通知QA检查?13外包:⑴生产前,检查上工序交接的物料标示卡上是否有QA签发的合格标志?所领的包装材料是否合格?⑵包装材料上的三期(批号,生产日期、有效期)是否与生产指令单相符?生产结束后,是否彻底清场,说明书等包装材料应及时退库;。


片剂质量监控标准操作规程1.目的:建立片剂质量监控规程,保证产品质量。
2.范围:适用于片剂生产的监控.3. 责任:车间QA监控员,岗位操作人员对此规程的实施负责。
4. 内容:4.1 监控依据:产品工艺规程、岗位操作规程。
4.2环境监控:4.2.1 沉降菌:4。
2.1.1 每月监控一次。
4.2.1.2 监控标准:4.2.2悬浮粒子4.2.2.1悬浮粒子每三个月监控一次.4.2.2.2监控标准:4.2.3温湿度:4.2.3.1 QA监控员每天随机监控二次。
4。
2。
3.2 监控标准:洁净室(区)的温度和湿度应与其生产及工艺要求相适应(温度控制在18℃~26℃,相对湿度控制在45%~65%).4.2.4压差:4.2.4.1QA监控员每天随机监控二次.4.2.4.2监控标准:空气洁净度不同的洁净室(区)之间的压差应≥10Pa,空气洁净度要求高的洁净室(区)对相邻的空气洁净度级别低的洁净室(区)一般要求呈相对正压,产尘间保持相对负压。
4.2.5纯化水:4.2.5.1QA监控员随时对纯化水进水口、出水口、总回水口进行酸碱度、电导率、氨、氯化物项目的检查,应符合标准要求。
4.2.5.2监控标准4。
2。
5.2。
1 酸碱度:取本品10ml,加甲基红指示液2滴,不得显红色;另取10ml,加溴麝香草酚蓝指示液5滴,不得显蓝色。
4.2.5.2.2氯化物:取本品50ml,加硝酸5滴与硝酸银试液1ml,不得发生混浊。
4.2.5.2.3氨:取本品50ml,加碱性碘化汞钾试液2ml,放置15分钟;如显色,与氯化铵溶液1.5ml,加无氨水48ml与碱性碘化汞钾试液2ml制成的对照液比较,不得更深(含量≤0。
00003%).4。
2。
5.2。
4 电导率:取本品适量,照“电导率检查标准操作规程”测定,应≤2.0m/s.4.3生产前监控:4.3。
1.1 上批次或品种结束,是否进行清洁、清场。
是否有“清场合格证"。
4.3.1.2 生产区设备是否有完好的状态标志及已清洁状态标志.4。

片剂质量控制要点摘要:影响药品质量的因素有很多,必须对药品生产过程的各环节进行监督管理和控制。
在片剂生产过程由于种种因素会产生药品质量问题,掌握片剂生产过程中控制要点对药品的质量控制能起到重要的作用。
本文介绍一些可能会影响片剂质量的原因以及在生产过程中如何解决这些问题。
关键词:片剂质量控制要点片剂生产车间应严格执行《药品管理法》、《药品流通监督管理规范》、GMP 及GSP等有关法规规定。
控制药品质量,首先要对原辅料严格执行验收、检验,一旦发现假劣原辅料,应立即采取停用停购等措施,把好药品质量关。
其次对片剂药品生产原料投放、软材制取、颗粒混匀、压片等全过程加强监控管理,完善生产工艺,从而保证片剂质量的稳定性。
一、原辅料控制药品生产企业要做好原辅料供应商的审计工作,把好原辅料进货渠道关,认真从源头上把好药品质量关,杜绝从非法渠道采购原辅料。
企业选择供应商时,首先要严格对其资质证明文件进行审核,查看其资质证明文件是否真实可靠,有时仅凭几份加盖公章的复印件是分辩不了真假的。
有的不法企业为了谋取利益,很可能采用不良手段,在复印前更改一些内容,因此,药品生产企业在选择供应商时必须慎重对待,认真复核其许可证、营业执照、法人及经营范围是否相符,是否在有效期内使用等等。
必要时应前去供应商厂家进行现场考察,对供应商厂家的生产管理和质量管理状况进行现场调研,特别是对本企业需购其原料的生产和质量控制等方面进行调研。
二、生产工艺控制1.粘冲与吊冲压片时片剂表面细粉被冲头和冲模黏附,致使片面不光、不平有凹痕,刻字冲头更容易发生粘冲现象。
吊冲边的边缘粗糙有纹路,原因及解决方法:(1)颗粒含水量过多、含有引湿性易受潮的药物、操作室温度与湿度过高易产生粘冲。
应注意适当干燥、降低操作室温度、湿度, 避免引湿性药物受潮等。
(2)润滑剂用量过少或混合不匀、细粉过多。
应适当增加润滑剂用量或充分混合,解决粘冲问题。
(3)冲头表面不干净,有防锈油或润滑油、新冲模表面粗糙或刻字太深有棱角。

片剂的质量控制与评价一、引言片剂是一种常见的固体制剂形式,广泛应用于药物治疗中。
为了确保片剂的质量和疗效,需要进行严格的质量控制和评价。
本文将详细介绍片剂的质量控制和评价方法。
二、质量控制1. 原料药的选择和质量要求片剂的原料药是保证片剂质量的基础。
应选择符合药典标准的原料药,并确保其质量符合要求。
原料药的质量要求包括外观、纯度、溶解度、稳定性等指标。
2. 制剂工艺的控制制剂工艺对片剂的质量具有重要影响。
应确保制剂工艺符合药典标准,并进行严格的操作控制。
制剂工艺包括原料药的混合、压片、包衣等工艺步骤,每个步骤都需要控制好关键参数,如混合时间、压片压力、包衣液的喷雾速度等。
3. 质量控制的检测方法为了确保片剂的质量,需要使用合适的检测方法进行质量控制。
常用的片剂质量控制检测方法包括外观检查、含量测定、溶解度测定、均匀度检查等。
这些检测方法可以通过仪器分析或化学分析来进行。
4. 质量控制的记录和文件管理质量控制的记录和文件管理是片剂质量控制的重要环节。
应建立健全的记录和文件管理制度,确保质量控制数据的准确性和可追溯性。
记录和文件应包括原始记录、检测报告、质量控制标准等。
三、质量评价1. 外观评价外观是片剂质量的重要指标之一。
应对片剂的外观进行评价,包括颜色、形状、表面光滑度等。
外观评价可以通过目视观察和仪器测量来进行。
2. 片剂硬度评价片剂的硬度是指片剂在一定条件下抗压破裂的能力。
硬度评价可以通过硬度计进行,常用的方法有三点法和单点法。
硬度评价结果可以反映片剂的机械强度。
3. 含量评价含量是片剂质量的核心指标之一。
应使用合适的方法对片剂的含量进行评价,如高效液相色谱法、紫外分光光度法等。
含量评价结果应与药典标准进行比较,确保片剂的含量符合要求。
4. 溶解度评价溶解度是片剂的重要性能之一,对药物的吸收和疗效具有重要影响。
应使用适当的方法对片剂的溶解度进行评价,如体外释放度法、溶出度法等。
溶解度评价结果应与药典标准进行比较,确保片剂的溶解度符合要求。
片剂的质量控制与评价一、引言片剂是一种常见的药物剂型,广泛应用于临床治疗。
为确保片剂的质量和疗效,需要进行严格的质量控制和评价。
本文将详细介绍片剂的质量控制与评价的标准格式。
二、质量控制1. 原辅材料的选择和质量要求片剂的原辅材料包括活性成分、辅料和包衣材料。
活性成分应符合药典规定的纯度标准,并通过质量控制方法进行检验。
辅料和包衣材料应符合药典规定的质量标准,如颗粒度、溶解度、稳定性等。
2. 生产工艺的控制片剂的生产工艺应符合药典规定的要求,包括制粒、混合、压片、包衣等步骤。
每个步骤都需要严格控制操作条件,如温度、湿度、压力等,以确保片剂的质量稳定。
3. 药物释放度的测试片剂的药物释放度是评价其质量和疗效的重要指标。
通过体外溶出试验,可以测定片剂中活性成分的释放速率。
药典中有详细的测试方法和标准,包括使用溶出器进行试验,并根据曲线图计算释放度。
4. 片剂的物理性质测试片剂的物理性质测试包括外观、尺寸、硬度、断裂性等指标的测定。
外观应符合药典规定的要求,尺寸和硬度应在一定范围内,断裂性应符合制剂的要求。
5. 包装材料的质量控制片剂的包装材料应符合药典规定的质量标准,如密封性、防潮性、防光性等。
包装材料的质量控制可以通过物理测试和化学测试来进行。
三、质量评价1. 药物含量的测定片剂的药物含量是评价其质量的重要指标。
通过药典规定的方法,可以测定片剂中活性成分的含量。
常用的方法包括高效液相色谱法、紫外分光光度法等。
2. 不溶性物质的测定片剂中的不溶性物质会影响其溶解度和药物释放度。
药典中规定了不溶性物质的限度,并提供了相应的测定方法。
常用的方法包括过滤、洗涤、干燥等步骤。
3. 包衣膜的质量评价片剂的包衣膜质量评价包括外观、厚度、溶解性、稳定性等指标的测定。
外观应符合药典规定的要求,厚度应在一定范围内,溶解性和稳定性可以通过药典规定的方法进行测定。
4. 药剂稳定性的评价片剂的药剂稳定性评价是为了保证其质量在有效期内不发生变化。
片剂的质量控制与评价一、引言片剂是一种常见的固体制剂形式,广泛应用于药物治疗领域。
为了确保片剂的质量和疗效,需要进行严格的质量控制和评价。
本文将详细介绍片剂质量控制和评价的标准格式。
二、质量控制1. 原料药的质量控制(1) 原料药的纯度检验:采用高效液相色谱法(HPLC)或者气相色谱法(GC)等方法,检测原料药的纯度。
(2) 溶解度测定:通过测定原料药在不同溶剂中的溶解度,判断其适合性。
(3) 含量测定:采用滴定法、分光光度法等方法,测定原料药中活性成份的含量。
(4) 残留溶剂检测:使用气相色谱-质谱联用仪(GC-MS)等技术,检测原料药中的残留溶剂。
2. 辅料的质量控制(1) 辅料的纯度检验:采用红外光谱法(FT-IR)、紫外光谱法(UV)等方法,检测辅料的纯度。
(2) 含量测定:采用滴定法、分量法等方法,测定辅料中的活性成份含量。
(3) 残留溶剂检测:使用气相色谱法(GC)等技术,检测辅料中的残留溶剂。
3. 生产工艺的质量控制(1) 制剂工艺参数的控制:包括颗粒大小、颗粒形状、压片力度等参数的控制,确保制剂质量的稳定性。
(2) 制剂工艺流程的验证:通过制剂工艺的验证,确保制剂过程的可控性和一致性。
三、质量评价1. 片剂外观评价(1) 外观检查:检查片剂的外观,包括颜色、形状、表面光滑度等方面。
(2) 尺寸测定:测量片剂的直径、厚度等尺寸参数。
2. 片剂物理性质评价(1) 分量一致性:随机抽取一定数量的片剂,称重并计算平均分量,判断片剂的分量一致性。
(2) 硬度测定:采用硬度测试仪,测定片剂的硬度。
(3) 耐磨性测试:通过摹拟使用环境,测试片剂在磨擦力下的耐磨性。
(4) 分散性测试:将片剂置于水中,观察其分散性能。
3. 片剂药物释放度评价(1) 体外释放度测试:采用离体释放度测试仪,摹拟人体消化液环境,测定片剂中药物的释放度。
(2) 体内释放度测试:通过动物实验,测定片剂在体内的药物释放度。
4. 片剂稳定性评价(1) 加速稳定性测试:将片剂置于高温高湿条件下,观察其药物含量的变化。
片剂的质量控制与评价一、引言片剂是一种常见的药物剂型,具有固定剂量、易于服用和储存等优点。
为确保片剂的质量,需要进行严格的质量控制与评价。
本文将详细介绍片剂质量控制与评价的标准格式。
二、质量控制1. 原材料选择片剂的质量受原材料的影响较大,因此需要选择优质的原材料。
原材料应符合药典规定的质量要求,并进行合格供应商的认证。
2. 制备工艺片剂的制备工艺应符合药典规定的要求,并进行验证。
包括原料的称量、混合、压片、包衣等工艺步骤,每一个步骤都需要严格控制操作条件和时间。
3. 质量控制指标片剂的质量控制指标应包括外观、质量、含量、释放度等方面。
外观应符合药典规定的要求,质量应符合药典规定的分量、厚度、硬度等要求,含量应符合药典规定的标准,释放度应符合药典规定的要求。
4. 质量控制方法片剂的质量控制方法应包括外观检查、质量测定、含量测定、释放度测定等方法。
这些方法应符合药典规定的方法,并进行验证,确保准确可靠。
5. 质量记录与报告片剂的质量控制过程中,应及时记录各项质量控制指标的检测结果,并编制质量报告。
这些记录和报告应保存一定的时间,并定期进行审核和归档。
三、质量评价1. 片剂的质量评价应包括质量控制指标的合格率、稳定性等方面。
质量控制指标的合格率是评价片剂质量的重要指标,应达到药典规定的要求。
稳定性是评价片剂质量稳定性的指标,应进行长期稳定性试验。
2. 质量评价报告片剂的质量评价应编制质量评价报告,详细记录质量评价的结果。
报告应包括质量控制指标的合格率、稳定性试验结果等内容,并进行分析和评价。
3. 质量改进措施片剂的质量评价结果可以为质量改进提供依据。
根据评价结果,制定相应的质量改进措施,包括原材料的选择、制备工艺的优化等方面,以提高片剂的质量。
四、结论片剂的质量控制与评价是确保片剂质量的重要环节。
通过选择优质的原材料、严格控制制备工艺、制定合理的质量控制指标和方法,以及进行全面的质量评价,可以保证片剂的质量稳定和可靠性。
片剂质量控制要点摘要:影响药品质量的因素有很多,必须对药品生产过程的各环节进行监督管理和控制。
在片剂生产过程由于种种因素会产生药品质量问题,掌握片剂生产过程中控制要点对药品的质量控制能起到重要的作用。
本文介绍一些可能会影响片剂质量的原因以及在生产过程中如何解决这些问题。
关键i司:片剂质量控制要点片剂生产车间应严格执行《药品管理法》、《药品流通监督管理规范》、GMP 及GSP 等有关法规规定。
控制药品质量,首先要对原辅料严格执行验收、检验,一旦发现假劣原辅料,应立即采取停用停购等措施,把好药品质量关。
其次对片剂药品生产原料投放、软材制取、颗粒混匀、压片等全过程加强监控管理,完善生产工艺,从而保证片剂质量的稳定性。
一、原辅料控制药品生产企业要做好原辅料供应商的审讣工作,把好原辅料进货渠道关,认真从源头上把好药品质量关,杜绝从非法渠道采购原辅料。
企业选择供应商时,首先要严格对其资质证明文件进行审核,查看其资质证明文件是否真实可靠,有时仅凭儿份加盖公章的复印件是分辩不了真假的。
有的不法企业为了谋取利益,很可能采用不良手段,在复印前更改一些内容,因此,药品生产企业在选择供应商时必须慎重对待,认真复核其许可证、营业执照、法人及经营范圉是否相符,是否在有效期内使用等等。
必要时应前去供应商厂家进行现场考察,对供应商厂家的生产管理和质量管理状况进行现场调研,特别是对本企业需购其原料的生产和质量控制等方面进行调研。
二、生产工艺控制1.粘冲与吊冲压片时片剂表面细粉被冲头和冲模黏附,致使片面不光、不平有凹痕,刻字冲头更容易发生粘冲现象。
吊冲边的边缘粗糙有纹路,原因及解决方法:(1)颗粒含水量过多、含有引湿性易受潮的药物、操作室温度与湿度过高易产生粘冲。
应注意适当干燥、降低操作室温度、湿度,避免引湿性药物受潮等。
(2)润滑剂用量过少或混合不匀、细粉过多。
应适当增加润滑剂用量或充分混合,解决粘冲问题。
(3)冲头表面不干净,有防锈油或润滑油、新冲模表面粗糙或刻字太深有棱角。
片剂的质量控制与评价一、引言片剂是一种常见的口服固体制剂,广泛应用于临床治疗中。
为了确保片剂的质量和疗效,需要进行严格的质量控制和评价。
本文将详细介绍片剂的质量控制和评价的标准格式。
二、质量控制1. 药材选用片剂的质量控制首先从药材选用开始。
药材应符合国家药典或者相关标准的要求,包括药材的种类、产地、质量等。
2. 药材质量评价对于选用的药材,需要进行质量评价。
常用的评价指标包括外观、颜色、气味、含水量、杂质等。
评价结果应符合国家药典或者相关标准的要求。
3. 药材处理选用的药材需要进行处理,包括清洗、研磨、筛选等。
处理过程应符合相关标准,并记录处理过程的相关信息。
4. 配方设计片剂的配方设计是质量控制的重要环节。
配方应根据药物的特性和治疗要求进行合理设计,确保药物的稳定性和疗效。
5. 制剂工艺片剂的制剂工艺应符合相关标准,包括混合、压片、包衣等步骤。
制剂工艺的每一个步骤都需要进行严格控制和记录。
6. 药品包装制成的片剂需要进行包装,以保护药物的质量和稳定性。
包装材料应符合相关标准,包装过程应进行严格控制和记录。
三、质量评价1. 外观检查对于制成的片剂,首先进行外观检查。
外观应符合国家药典或者相关标准的要求,包括颜色、形状、表面光滑度等。
2. 尺寸测定片剂的尺寸测定是评价片剂质量的重要指标之一。
测定片剂的直径、厚度等尺寸,并与相关标准进行比较。
3. 药物含量测定片剂的药物含量测定是评价片剂质量的关键指标之一。
采用适当的分析方法,测定片剂中活性成份的含量,并与相关标准进行比较。
4. 可分性检查片剂的可分性是指片剂在口服后能否迅速分解和释放药物。
进行可分性检查,观察片剂在摹拟消化液中的分解情况。
5. 溶出度测定片剂的溶出度测定是评价片剂质量的重要指标之一。
采用适当的分析方法,测定片剂中活性成份的溶出度,并与相关标准进行比较。
6. 稳定性研究片剂的稳定性研究是评价片剂质量的关键环节之一。
进行稳定性研究,包括湿热试验、光照试验等,评估片剂在不同条件下的稳定性。
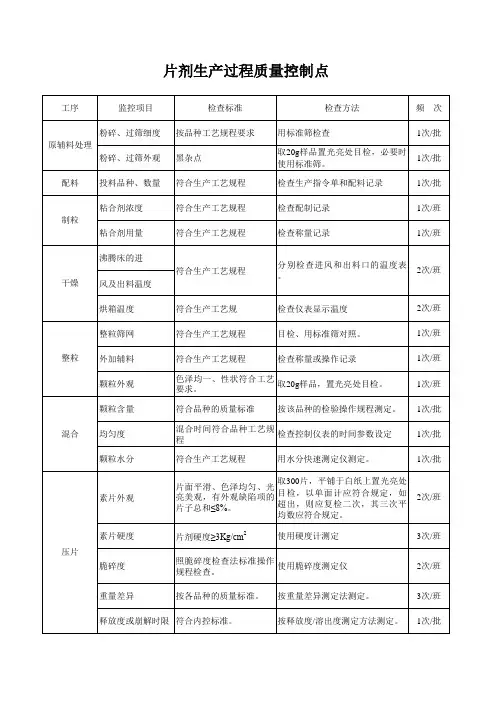
片剂生产过程质量监控管理规程片剂生产现场质量监控管理规程1.主题内容与适用范围1.1本标准规定了片剂生产现场质量监控管理的内容与要求。
1.2本标准适用于片剂生产现场质量监控的管理。
2.职责:2.1片剂车间QA、QC对本标准的执行负责。
2.2质量保证部经理负责检查本标准的执行情况与监督管理。
3.管理内容与要求3.1 生产前检查3.1.1生产前检查项目、检查标准及检查频次3.1.2在监控过程中,应及时填写监控记录。
3.2 生产过程监控3.2.1 车间QA生产过程监控3.2.1.2 检查方法3.2.1.2.1脱外包物料清洁度:目检物料应脱除外包装,内包装应清洁。
物料状态标识:目检内包装上应有物料标签,标签上应有品名、规格、批号、检验单号、生产商、数量、操作者签名。
3.2.1.2.2物料暂存物料贮存状态:物料应处于密闭或密封状态。
物料状态标识:目检内包装上应有物料标签,标签上应有品名、规格、批号、检验单号、生产商、数量、操作者签名。
3.2.1.2.3粉筛筛网目数:检查粉碎机和震荡网筛网型号是否符合工艺要求,并检查操作工是否进行了检查并复核。
物料状态标识:检查己粉筛物料应有物料状态标识。
3.2.1.2.4称量称量操作:现场检查或检查操作记录,检查使用的天平或磅秤是否有校验合格证、零点是否准确。
称量时严格执行双人复核制。
称料数量:现场检查或检查操作记录,检查物料的称料量应与配制指令相符。
3.2.1.2.5配料配料数量:现场检查或检查操作记录,每种物料的投料量应与配制指令相符。
配料顺序:检查配料顺序应符合工艺要求3.2.1.2.6制浆制浆配方、浓度:现场检查或检查操作记录,制浆配方、浓度应符合工艺要求。
3.2.1.2.7软材加浆温度:现场检查或检查操作记录,加浆温度应符合工艺要求。
混合时间、速度:现场检查或检查操作记录,混合时间和混合速度应符合工艺要求。
性状:软材应能手握成团轻压即散。
3.2.1.2.8 制粒切割时间、速度:现场检查或检查操作记录,切割时间和切割速度应符合工艺要求。