实验讲义- 库伦、极谱分析
- 格式:doc
- 大小:64.50 KB
- 文档页数:8





实验讲义-库伦、极谱分析控制电流库仑分析实验⼗三控制电流库仑滴定测定未知酸的含量⼀、实验⽬的:学习和掌握库仑滴定法的原理及实验技术。
⼆、基本原理:库仑滴定法是在电解分析的基础上发展起来的。
它是在电解过程中,测量被分析物质直接在电极上反应所消耗的电量或者测量被分析物质间接与电极电解产物进⾏定量反应所消耗的电量来进⾏定量分析的⽅法。
随着精密电⼦仪器的发展,库仑滴定发展更为迅速,不断涌现新的⽅法和多种类型微库仑计。
在⽯油、化⼯、环境监测和有机⽣化等领域得到⼴泛应⽤。
库仑滴定既适⽤于微量亦适⽤于常量物质的测定,是⽬前常量分析⽅法中最准确的⽅法之⼀。
库仑分析的基础是法拉第定律,其关系式为:W = QM/nF =ItM/nF式中W为活性物质在电极上反应的克数,I为电解电流,t为电解时间,Q 为电量(以库仑C为单位),M为反应物的摩尔质量,n 为电⼦转移数,F为法拉第常数(在电极上析出1/nmol物质所需的电量),其值为96487库。
库仑分析⽆需作校正曲线,⽽且测定准确度和精密度都在ppm级,和经典的化学分析法相同。
库仑滴定测量的是电量,因此电极反应的电流效率必须为100﹪,即通过溶液的电量应全部⽤于电解被分析物质,⽽⽆其它副反应发⽣。
库仑滴定法测定未知酸的原理是:H+ 在电极上还原为H2,以酚酞作指⽰剂,当溶液从⽆⾊变为粉红⾊时即到达滴定终点,记录下电解过程中消耗的电量。
通过法拉第公式是可求出未知酸的浓度。
C酸= m酸/ V样= (W酸/ M酸)·1/ V样= (It / nF)·1/ V样式中m酸为未知酸的摩尔数,V样为未知酸的体积。
M酸为未知酸的摩尔质量,I为电解电流,t为电解时间。
三、仪器和试剂:仪器LK2005型电化学⼯作站(天津市兰⼒科化学电⼦⾼技术有限公司);铂电极⼆⽀;盐桥⼀⽀;试剂盐酸溶液(浓度任意);磷酸盐缓冲溶液:称取7.8gNaH2PO4·2H2O(AR)和1gNaOH(AR)溶于250mL⽔中,保存在试剂瓶中;0.5%酚酞溶液。
控制电流库仑分析实验十三控制电流库仑滴定测定未知酸的含量一、实验目的:学习和掌握库仑滴定法的原理及实验技术。
二、基本原理:库仑滴定法是在电解分析的基础上发展起来的。
它是在电解过程中,测量被分析物质直接在电极上反应所消耗的电量或者测量被分析物质间接与电极电解产物进行定量反应所消耗的电量来进行定量分析的方法。
随着精密电子仪器的发展,库仑滴定发展更为迅速,不断涌现新的方法和多种类型微库仑计。
在石油、化工、环境监测和有机生化等领域得到广泛应用。
库仑滴定既适用于微量亦适用于常量物质的测定,是目前常量分析方法中最准确的方法之一。
库仑分析的基础是法拉第定律,其关系式为:W = QM/nF =ItM/nF式中W为活性物质在电极上反应的克数,I为电解电流,t为电解时间,Q 为电量(以库仑C为单位),M为反应物的摩尔质量,n为电子转移数,F为法拉第常数(在电极上析出1/nmol物质所需的电量),其值为96487库。
库仑分析无需作校正曲线,而且测定准确度和精密度都在ppm级,和经典的化学分析法相同。
库仑滴定测量的是电量,因此电极反应的电流效率必须为100﹪,即通过溶液的电量应全部用于电解被分析物质,而无其它副反应发生。
库仑滴定法测定未知酸的原理是:H+ 在电极上还原为H2,以酚酞作指示剂,当溶液从无色变为粉红色时即到达滴定终点,记录下电解过程中消耗的电量。
通过法拉第公式是可求出未知酸的浓度。
C酸= m酸/ V样= (W酸/ M酸)·1/ V样= (It / nF)·1/ V样式中m酸为未知酸的摩尔数,V样为未知酸的体积。
M酸为未知酸的摩尔质量,I为电解电流,t为电解时间。
三、仪器和试剂:仪器LK2005型电化学工作站(天津市兰力科化学电子高技术有限公司);铂电极二支;盐桥一支;试剂盐酸溶液(浓度任意);磷酸盐缓冲溶液:称取7.8gNaH2PO4·2H2O(AR)和1gNaOH(AR)溶于250mL水中,保存在试剂瓶中;0.5%酚酞溶液。
四、实验步骤:1、方法选择:恒电流技术——恒电流电解。
2、参数设置:起始电流:0mA;电解电流:-5mA(视需要设定);电解时间:视需要设定。
3、在两室中分别放入磷酸盐缓冲溶液。
中间用盐桥连接,工作电极放入阴极室,辅助电极放入阳极室。
将阴极室放电磁搅拌器上,放入搅拌子。
4、开动搅拌器启动实验,电解开始,注意观察阴极室。
当溶液刚一出现粉红色(不仅仅是电极周围),终止电解实验。
5、平行取未知酸样品三次,将测量数据填入表1。
表1 测量结果五、讨论:1、试分析本实验滴定中可能的误差来源及预防措施。
2、本实验是用酚酞作指示剂。
还有其它指示终点的方法吗?叙述其原理。
实验十四恒电流库仑滴定法测定砷一、实验目的1、通过本实验,学习掌握库仑滴定法的基本原理。
2、掌握恒电流库仑滴定法测定痕量砷的实验方法。
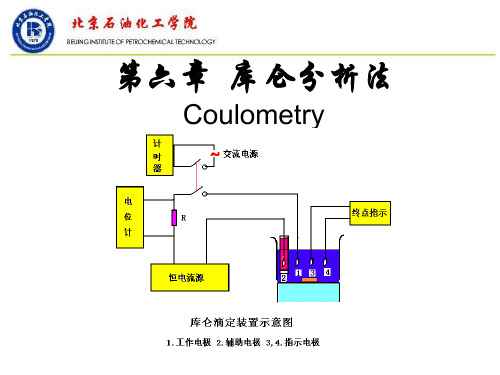
二、方法原理库仑滴定是通过电解产生的物质作为―滴定剂‖来滴定被测物质的一种分析方法。
在分析时,以100%的电流效率产生一种物质(滴定剂),能与被分析物质进行定量的化学反应,反应的终点可借助指示剂、电位法、电流法等进行确定。
这种滴定方法所需的滴定剂不是由滴定管加入的,而是藉助于电解方法产生出来的,滴定剂的量与电解所消耗的电量(库仑数)成比,所以称为―库仑滴定‖。
本实验是采用恒电流电解碘化钾的缓冲溶液(用碳酸氢钠控制溶液的pH值)产生的碘来测定砷的含量。
在铂电极上碘离子被氧化为碘,然后与试剂中的砷(Ⅲ)反应,当砷(Ⅲ)全部被氧化为砷(V)后,过量的微量碘将淀粉溶液变为微红紫色,即达到终点。
根据电解所消耗的电量(iτ),按法拉第定律计算溶液中砷(Ⅲ)的含量。
三、仪器和试剂仪器LK20006A电化学工作站(天津兰力科);铂片电极(作工作电极);螺旋铂丝电极;两室电解池;盐桥。
试剂亚砷酸溶液:约10-4mol/L(用硫酸微酸化以使之稳定);碘化钾缓冲溶液:溶解60g碘化钾,10g碳酸氢钠,然后稀释至1L,加入亚砷酸溶液2~3mL,以防止被空气氧化;新配制淀粉试液:0.5%;硝酸(体积比1:1),1mol/L硫酸钠溶液。
四、实验步骤1、将铂电极浸入1:1硝酸溶液中,数分钟后,取出用蒸馏水吹洗,滤纸沾掉水珠。
2、量取碘化钾缓冲溶液50mL及淀粉溶液约3mL,置于电解池中,放入搅拌磁子,将电解池放在仪器内置磁力搅拌器上。
在阴极室中注入硫酸钠溶液,至管的2/3部位,插入螺旋铂丝电极。
将铂片电极装在阳极室内(注意铂片要完全浸入试液中)。
铂片电极接―阳极‖,螺旋铂丝电极接―阴极‖。
启动搅拌器,设置电解电流为1.0mA。
仔细观察电解溶液,当微红紫色出现时,停止电解。
慢慢滴加亚砷酸溶液,直至微红紫色褪去再多加1~2滴,再次继续电解至微红紫色出现,停止电解。
为能熟练掌握终点的颜色判断,可如此反复练习几次。
3、准确移取亚砷酸10.0mL,置于上述电解池中,开始实验,电解至溶液出现与定量加亚砷酸前一样微红紫色时,立即停止电解,记下电解时间(s)。
再加入10.0mL亚砷酸溶液,同样步骤测定。
重复实验3~4次。
4、测量完毕,关闭LK2006A电化学工作站电源,洗净电极并将电极浸在去离子水中。
五、数据处理1、根据几次测量结果,求出平均电解时间与标准偏差。
2、根据平均电解时间,用法拉第定律计算出未知溶液中亚砷酸的含量(以mol/L 计)。
六、思考题1、写出滴定过程的电极反应和化学应式。
2、碳酸氢钠在电解溶液中起什么作用?极谱分析原理实验十五天然水中钼的极谱催化波测定一、实验目的学习利用极谱催化波方法测定微量钼的原理与实验方法。
二、基本原理在硫酸-氯酸钾-酒石钾钠(Kna-Tar, Tar表示酒石酸)底液中,Mo(Ⅵ)在一定电位下发生下列电极反应:Mo(Ⅵ)-Tar + e → Mo(Ⅴ)-Tar由于氯酸钾在酸性介质中为一强氧化剂,能将上述电极反应的还原产物Mo(Ⅴ)-Tar立即氧化:6Mo(Ⅴ) –Tar+ClO3-+6H+→ 6Mo(Ⅵ)-Tar+3H2O+Cl-产生的Mo(Ⅵ)-Tar又可在滴汞电极上被还原,在电极表面附近形成电极反应-化学反应-电极反应的往复循环,使极谱电流大为增强,该极谱电流受化学反应速度所控制。
而在实验的电位范围内,KClO3不会发生电极反应。
在这一循环过程中,钼的浓度在反应前后几乎未起变化,实际消耗的是KClO3,所以可把钼看作催化剂。
由于催化反应而增加的电流称为催化电流,在一定的催化剂浓度范围内,催化电流与催化剂浓度成正比,因此可作为定量分析的基础。
催化电流的强度远比单纯的扩散电流强,故测定的灵敏度大为提高。
在无吸附现象时,极谱催化波的波形与经典极谱波相同,本实验中钼-酒石酸络阴离子吸附于汞电极表面,因而所得的极谱催化波成对称峰形,通过测量峰高,即可测定钼的含量。
三、仪器与试剂仪器LK2005A型电化学工作站(天津兰力科化学电子高技术有限公司);三电极系统;Ag/AgCl为参比电极,滴汞电极为工作电极,铂电极为对电极;容量瓶250 mL ,100 mL ,25 mL;吸量管10 mL, 5 mL试剂(1)Mo(Ⅵ)标准贮备溶液准确称取分析纯Na2MoO4·2H2O 0.252g,用水溶解幷定容成100mL,溶液含Mo(Ⅵ)1.00mg/mL。
(2)Mo(Ⅵ) 标准工作溶液将Mo(Ⅵ)标准贮备溶液先稀释成Mo(Ⅵ)4.00μg/mL,再稀释为含Mo(Ⅵ)0.200μg/mL(使用前临时配制)(3)0.35mol.·L-1KClO3溶液准确称取分析纯KClO310.723g溶解于水中,容成250mL。
(4)0.20mol·L-1酒石酸钾钠溶液准确称取分析纯NaKC4H4O6·4H2O5.644g,溶解于水,幷定容成100mL。
(5)0.7mol·L-1H2SO4:量取分析纯浓H2SO4(相对密度1.84)4.0mL,小心加入已盛有水的烧杯中,稀释后定容100mL。
(6)纯N2 99.9% N2四、操作步骤1、于7只25mL容量瓶中,按下表所列体积(mL)加入各种溶液,然后定容成25mL。
2、依次将1-7号溶液倒入电解池中,通入N2气5min除氧,设置起始电位和终止电位分别为+0.1和-0.8V,以适当的扫描速度记录极谱图。
3、于25mL容量瓶中,按上表1号溶液的用量加入H2SO4,KNa-Tar 和KClO3溶液,再加入含钼的水样2.50mL,定容成25mL后,测其极谱图。
五、数据及处理1、可根据仪器打印的每个标准溶液和未知溶液的极谱电流自行绘制工作曲线,查出未知溶液的钼含量。
也可在测定时选用工作曲线法,输入标准溶液的体积,仪器根据其测得的波高,可自动绘制标准工作曲线(三个标准即可),再根据未知试液的波高自动给出结果,具体操作参见仪器说明书。
2、钼含量以每毫升原始试液含钼的微克数表示。
3、将6号溶液与3号溶液的极谱图比较,可以得出什么结论?4、将7号溶液与5号溶液的极谱图比较,可以得出什么结论?实验十六单扫描极谱法同时测定铅和镉一、实验目的1、熟悉单扫描极谱法的基本原理和特点。
2、测定水样中铅和镉的含量。
二、方法原理单扫描极谱法是在一个汞滴长成的后期,当汞滴的面积基本保持恒定时,把滴汞电极的电位从一个数值线性改变到另一个数值,同时观察电流随电位的变化,电流随电位变化的i—E曲线直接从显示器上显示出来。
对于可逆电极反应过程,可用峰电流方程式来表示:i p=Kn3/2q m2/3t2/3D1/2v1/2c式中v为扫描速率,即电压变化率(V·s-1);t为出现电流峰的时间(s);i p为峰电流(μA);K为常数。
其他与尤考维奇方程式相同。
在一定的实验条件下,峰电流i p与被测物质的浓度c呈正比,即i p=kc三、仪器和试剂仪器LK2005型电化学工作站(天津兰力科化学电子有限公司)。
试剂 1.00×10-3 mol·L-1Cd2+标准溶液,1.00×10-3 mol·L-1Pb2+标准溶液,4mol·L-1盐酸,5 g·L-1明胶溶液。
四、实验步骤1、准确吸取用滤纸过滤的含Cd2+、Pb2+水样25mL于50mL容量瓶中,加入15mL4mol·L-1HCl溶液,1.00mL5g·L-1明胶溶液。
用蒸馏水稀释至刻度,备用。
2、吸取上述溶液10.00mL于10mL电解池中,选择线性扫描伏安法,并选中极谱模式,起始电位-0.1V,终止电位-0.9V,扫速0.05V/s,测量镉和铅的还原峰,读取其峰高值。
3、在上述测量溶液中,分别加入 1.00×10-3mol·L-1的镉和铅的标准溶液各0.30mL,搅匀后同操作2,测量镉、铅的峰值,以标准加入法计算水样中镉、铅的量。