大学物理热力学基础1
- 格式:pptx
- 大小:1.40 MB
- 文档页数:61


大学物理热力学基础热力学是物理学的一个分支,它研究热现象中的物理规律,包括物质的热性质、热运动和热转化。
在大学物理课程中,热力学基础是物理学、化学、材料科学、工程学等学科的基础课程之一。
热力学基础主要涉及以下几个方面的内容:1、热力学第一定律热力学第一定律,也称为能量守恒定律,是指在一个封闭系统中,能量不能被创造或消除,只能从一种形式转化为另一种形式。
这个定律说明,能量在传递和转化过程中是守恒的,不会发生质的损失。
2、热力学第二定律热力学第二定律是指热量只能从高温物体传递到低温物体,而不能反过来。
这个定律说明,热量传递的方向是单向的,不可逆的。
这个定律对于理解能源转换和利用具有重要意义。
3、热力学第三定律热力学第三定律是指绝对零度下,物质的熵(表示物质混乱度的量)为零。
这个定律说明,在绝对零度下,所有物质的分子和原子都处于静止状态,没有热运动,因此熵为零。
这个定律对于理解物质在低温下的性质和行为具有重要意义。
4、理想气体状态方程理想气体状态方程是指一定质量的气体在恒温条件下,其压力、体积和密度之间的关系。
这个方程对于理解气体在平衡状态下的性质和行为具有重要意义。
5、热容和焓热容和焓是描述物质在加热和冷却过程中性质变化的物理量。
热容表示物质吸收或释放热量的能力,焓表示物质在恒温条件下加热或冷却时所吸收或释放的热量。
这两个物理量对于理解和分析热现象具有重要意义。
大学物理热力学基础是物理学的重要分支之一,它为我们提供了理解和分析热现象的基本理论工具。
通过学习热力学基础,我们可以更好地理解能源转换和利用的原理,为未来的学习和职业生涯打下坚实的基础。
在无机化学的领域中,化学热力学基础是理解物质性质、反应过程和能量转换的重要工具。
本篇文章将探讨化学热力学的基础概念、热力学第一定律、热力学第二定律以及热力学第三定律。
一、化学热力学的基础概念化学热力学是研究化学反应和相变过程中能量转换的科学。
它主要涉及物质的能量、压力、温度和体积等物理量之间的关系。

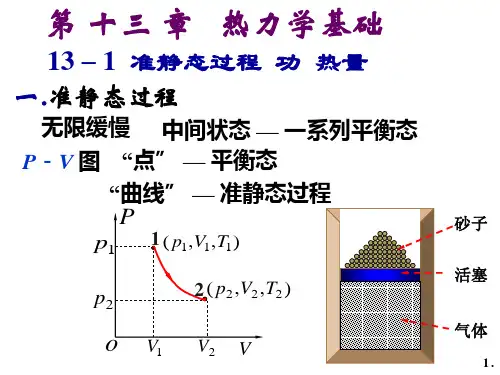
第十三章热力学基础一、简答题:1、什么是准静态过程?答案:一热力学系统开始时处于某一平衡态,经过一系列状态变化后到达另一平衡态,若中间过程进行是无限缓慢的,每一个中间态都可近似看作是平衡态,那么系统的这个状态变化的过程称为准静态过程。
2、什么是可逆过程与不可逆过程答案:可逆过程:在系统状态变化过程中,如果逆过程能重复正过程的每一状态,而且不引起其它变化;不可逆过程:在系统状态变化过程中,如果逆过程能不重复正过程的每一状态,或者重复正过程时必然引起其它变化。
3、一系统能否吸收热量,仅使其内能变化? 一系统能否吸收热量,而不使其内能变化?答:可以吸热仅使其内能变化,只要不对外做功。
比如加热固体,吸收的热量全部转换为内能升高温度;4、简述热力学第二定律的两种表述。
答案:开尔文表述:不可能制成一种循环工作的热机,它只从单一热源吸收热量,并使其全部变为有用功而不引起其他变化。
克劳修斯表述:热量不可能自动地由低温物体传向高温物体而不引起其他变化。
5、什么是熵增加原理?答:一切不可逆绝热过程中的熵总是增加的,可逆绝热过程中的熵是不变的。
把这两种情况合并在一起就得到一个利用熵来判别过程是可逆还是不可逆的判据——熵增加原理。
6、什么是卡诺循环? 简述卡诺定理?答案:卡诺循环有4个准静态过程组成,其中两个是等温线,两个是绝热线。
卡诺提出在稳度为T1的热源和稳度为T2的热源之间工作的机器,遵守两条一下结论:(1)在相同的高温热源和低温热源之间工作的任意工作物质的可逆机,都具有相同的效率。
(2)工作在相同的高温热源和低温热源之间的一切不可逆机的效率都不可能大于可逆机的效率。
7、可逆过程必须同时满足哪些条件?答:系统的状态变化是无限缓慢进行的准静态过程,而且在过程进行中没有能量耗散效应。
二、选择题1、对于理想气体的内能,下列说法中正确的是( B ):( A ) 理想气体的内能可以直接测量的。
(B) 理想气体处于一定的状态,就有一定的内能。


⼤学物理上册(第五版)重点总结归纳及试题详解第五章热⼒学基础第五章热⼒学基础⼀、基本要求1.掌握功、热量、内能的概念,理解准静态过程。
2.掌握热⼒学第⼀定律,能分析、计算理想⽓体等值过程和绝热过程中功、热量、内能的改变量。
3.掌握循环过程和卡诺循环等简单循环效率的计算。
4.了解可逆过程和不可逆过程。
5.理解热⼒学第⼆定律及其统计意义,了解熵的玻⽿兹曼表达式及其微观意义。
⼆、基本内容1. 准静态过程过程进⾏中的每⼀时刻,系统的状态都⽆限接近于平衡态。
准静态过程可以⽤状态图上的曲线表⽰。
2. 体积功pdV dA = ?=21V V pdV A功是过程量。
3. 热量系统和外界之间或两个物体之间由于温度不同⽽交换的热运动能量。
热量也是过程量。
4. 理想⽓体的内能2iE RT ν=式中ν为⽓体物质的量,R 为摩尔⽓体常量。
内能是状态量,与热⼒学过程⽆关。
5. 热容定体摩尔热容 R i dT dQ C V m V 2)(,== 定压摩尔热容 R i dT dQ C p mp 22)(,+== 迈耶公式 R C C m V m p +=,, ⽐热容⽐ ,,2p m V mC i C iγ+==6.热⼒学第⼀定律A E Q +?=dA dE dQ +=(微分形式)7.理想⽓体热⼒学过程主要公式(1)等体过程体积不变的过程,其特征是体积V =常量。
过程⽅程: =-1PT 常量系统对外做功: 0V A =系统吸收的热量:()(),21212V V m iQ vC T T v R T T =-=-系统内能的增量:()212V iE Q v R T T ?==-(2)等压过程压强不变的过程,其特征是压强P =常量。
过程⽅程: =-1VT 常量系统对外做功:()()212121V P V A PdV P V V vR T T ==-=-?系统吸收的热量: (),2112P P m i Q vC T v R T T ??=?=+-系统内能的增量: ()212iE v R T T ?=-(3)等温过程温度不变的过程,其特征是温度T =常量。





大学物理热力学基础教案一、引言1.1 热力学的概念解释热力学是研究物质系统在温度、压力等条件变化时,其宏观性质如何变化的科学。
强调热力学在工程、物理等领域的应用重要性。
1.2 热力学的研究方法描述热力学通过实验和理论分析来研究物质系统的宏观性质。
介绍热力学的基本定律和理论模型。
二、热力学第一定律2.1 能量守恒定律解释能量守恒定律的内容,即在一个封闭系统中,能量不会凭空产生或消失,只能从一种形式转化为另一种形式。
通过示例或实验现象展示能量守恒定律的应用。
2.2 内能定义内能的概念,即系统内部所有分子和原子的动能和势能之和。
解释内能与系统温度、体积等参数的关系。
三、热力学第二定律3.1 熵的概念介绍熵的概念,即系统混乱程度的度量,熵值越大,系统越混乱。
解释熵与系统温度、分子运动等的关系。
3.2 热力学第二定律的表述表述热力学第二定律的不同形式,如熵增原理、卡诺定理等。
通过实际例子或图示展示熵增原理的应用。
四、热力学第三定律4.1 绝对零度的概念解释绝对零度是理论上最低可能的温度,即物质的熵为零的状态。
介绍开尔文温标与摄氏温标的关系。
4.2 熵与绝对零度解释熵与绝对零度之间的关系,即随着温度的降低,熵逐渐减小并趋近于零。
强调熵与绝对零度在热力学研究中的重要性。
五、热力学应用5.1 热机介绍热机的概念,即利用热能转换为机械能的装置。
解释热机的效率和热力学第二定律的关系。
5.2 热传递描述热传递的基本方式,包括导热、对流和辐射。
解释热传递的规律,如傅里叶定律、牛顿热传递定律等。
六、热力学状态方程6.1 理想气体状态方程推导理想气体状态方程PV=nRT,其中P 为压强,V 为体积,n 为物质的量,R 为理想气体常数,T 为温度。
解释理想气体状态方程在一定条件下的适用性。
6.2 物态方程介绍物态方程的概念,它是描述在不同温度和压力下,物质的状态(如固体、液体、气体)如何变化的方程。
举例说明物态方程在实际应用中的重要性。
大学热学物理知识点总结1.热力学基本定律热力学基本定律是热学物理的基础,它包括三个基本定律,分别是热力学第一定律、热力学第二定律和热力学第三定律。
(1)热力学第一定律热力学第一定律是能量守恒定律的热学表述,它规定了热力学系统能量的守恒性质。
简单地说,热力学第一定律表明了热力学系统能量的增减只与系统对外界做功和与外界热交换有关。
热力学第一定律的数学表达式为ΔU=Q-W,其中ΔU表示系统内能的增量,Q表示系统吸热的大小,W表示系统对外界所作的功。
由此可以看出,系统的内能变化量等于吸收热量减去做的功。
(2)热力学第二定律热力学第二定律是热力学系统不可逆性的表述,它规定了热力学系统内部的熵增原理,即系统的熵不会减小,而只会增加或保持不变。
简单地说,热力学第二定律表明了热力学系统内部的任何一种热力学过程都是不可逆的。
这意味着热力学系统永远无法使热量全部转化为功,总会有一部分热量被转化为无效热。
热力学第二定律还表明了热力学过程的方向性,即热量只能从高温物体传递到低温物体,而不能反向传递。
(3)热力学第三定律热力学第三定律规定了当温度趋于绝对零度时,任何物质的熵都将趋于一个有限值,这个有限值通常被定义为零。
简单地说,热力学第三定律表明了在绝对零度时,任何系统的熵都将趋于零。
热力学第三定律的提出对于热学物理的研究具有非常重要的意义,它为我们理解热学系统的性质提供了重要的基础。
2.热力学过程热力学过程是指热力学系统内部发生的一系列变化,包括各种状态参数的变化和热力学系统对外界的能量交换。
常见的热力学过程有等温过程、绝热过程、等容过程和等压过程等。
这些过程在日常生活以及工业生产中都有着广泛的应用。
(1)等温过程等温过程是指在恒定温度下进行的热力学过程。
在等温过程中,系统对外界做的功和吸收的热量之比是一个常数。
这意味着等温过程的压强和体积成反比,在P-V图上表现为一条双曲线。
常见的等温过程有等温膨胀和等温压缩等。
(2)绝热过程绝热过程是指在无热交换的情况下进行的热力学过程。